文章信息
- 吴香玉, 李宁, 唐惠儒
- WU Xiang-yu, LI Ning, TANG Hui-ru
- 绿豆(Vigna Radiata)代谢物组成的核磁共振定量分析
- Quantitative Analysis of Metabolites in Mungbean (Vigna Radiata) Extracts using NMR Techniques
- 波谱学杂志, 2014, 31(4): 548-563
- Chinese Journal of Magnetic Resonance, 2014, 31(4): 548-563
-
文章历史
收稿日期: 2014-01-08
收修改稿日期: 2014-11-06


2. 中国科学院大学,北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
绿豆(Vigna radiata)属于豆目(Fabales)豆科(Fabaceae)菜豆族(Phaseoleae)豇豆属(Vigna)经济作物[1].它含有22条染色体,基因组大小为579 MB[1].绿豆生长周期短(3~4个月),而且适应高温和干旱天气,在东南亚地区广泛种植[2].绿豆在中国有两千多年的栽培历史[3],是传统的出口产品.绿豆营养丰富,可培育成绿豆芽,也可制作成绿豆汤、凉粉与粉丝等绿豆淀粉胶或各类糕点食用.绿豆的营养价值主要体现其含有的蛋白质、碳水化合物、脂肪酸、矿物质以及氨基酸和糖类代谢物等方面.一般而言,绿豆含有25~28%蛋白质、60~65%碳水化合物、3.5~4.5%纤维、1.0~1.5%脂肪及4.5~5.5%矿物质,而且它的营养成分可与谷物相互补充[1, 2].有文献[1]表明绿豆富含维生素A、钾、铁、磷和钙,但缺乏钠;富含赖氨酸,但缺乏甲硫氨酸和胱氨酸.绿豆具有一定的抗氧化[4, 5]、抗炎[6]和抗菌[7]作用.绿豆还是一种可用于研究植物种子萌发、植物发育以及共生相互作用的模式植物,这些生命过程均与其代谢密切相关.尽管经典文献中已有用液相色谱[8]和气相色谱[9, 10]技术检测分析绿豆里氨基酸[1, 9]、多酚[8, 11, 12]和糖类[9, 10, 13]等相关代谢物的报道,但绿豆种子代谢物组成的相关信息仍不够全面,需要进一步研究和完善.核磁共振波谱技术在分子结构解析[14]及其定量[15]分析方面都有着明显优势,已成为生物代谢物组成定量分析的重要工具.
为系统地定量分析绿豆种子的代谢物组成,本研究以鄂绿4号(Elü No.4,品种审定编号为鄂审杂2009001[16])绿豆为材料,利用1H NMR,J-RES,1H-1H化学位移相关谱(包括COSY和TOCSY)、1H-13C化学位移相关谱(包括HSQC,HMBC)和二维扩散排序谱(DOSY)对绿豆种子亲水提取物组成成分进行了系统研究和归属,并利用全弛豫谱对大部分代谢物进行了定量分析.
1 实验部分 1.1 仪器及试剂提取溶剂由体积比为1:1的甲醇和双蒸水配制而成.磷酸盐缓冲液由体积比为4:1的0.1 mol/L K2HPO4•3H2O和NaH2PO4•2H2O溶液配制而成(pH 7.4),并含有20%重水(99.9% D,用作锁场信号源)和0.15 mmol/L 2, 2, 3, 3-氘代三甲基硅烷丙酸钠(TSP,用作化学位移定标).重水、TSP、棉籽糖、水苏糖、毛蕊花糖和蔗糖标准品购自Sigma-Aldrich有限公司.分析纯甲醇、K2HPO4•3H2O、NaH2PO4•2H2O和NaClO购自上海国药试剂有限公司.双蒸水取自Elix Advantage system(Millipore, Merck, Germany).
1.2 样品提取首先,用双蒸水清洗已被0.1% NaClO溶液消毒15 min的绿豆种子7次;然后称取约50 mg在液氮中研磨成粉的绿豆,实验共包含10个平行样,含水量测定参照国际种子水分检验规程[17]进行.提取实验采用已发表的优化方法[18].简而言之,向样品中加入500 μL提取溶剂(50%甲醇),利用涡旋混合仪(WH-2,上海沪西分析仪器厂有限公司)混匀10 s后,冰浴静置10 min;利用组织破碎仪(QIAGEN, Hilden, Germany)以20 Hz频率匀浆破碎3 min(每次90 s,两次匀浆之间间隔90 s),在超声破碎仪(DL180,上海之信)中以200 W功率、45 kHz频率冰浴超声30 min(超声1 min-静置1 min,共15个循环);将匀浆液离心(4℃,16 000 x g) 10 min后,收集上清;重复上述提取操作两次;将所得3次上清混合均匀,而后用真空离心蒸发浓缩仪(SAVANT SC110A, Thermo, Germany)除去甲醇,再冷冻干燥(SCANVAC coolsafeTM, LabGene, Denmark) 48 h得到提取物冻干粉.
1.3 NMR检测分析称量约4 mg上述所得冷冻干燥的粉末溶于600 μL磷酸盐缓冲液,离心(4℃, 16 000 × g) 10 min后,转移540 μL上清至外径为5 mm的NMR管中.1D 1H NMR图谱在Bruker AVIII 600型核磁共振谱仪(Bruker BioSpin)上采集,采用标准NOESYGPPR1D序列,温度为298 K.谱宽设定为δH20 (12 kHz),采样点数设定为64 k.两次扫描间循环延迟时间为22.5 s,其中最后2 s用于水峰抑制脉冲发射.混合时间和90°脉宽分别设定为0.1 s和10 μs,累加扫描64次.利用全弛豫谱计算代谢物绝对浓度时,谱峰面积经由MestReNova (V 8.1, Mestrelab Research, Spain)去卷积处理后得到.
T1弛豫时间测定谱采用反转恢复脉冲序列在同一台核磁谱仪上采集.谱宽设定为δH 20 (12 kHz),90°脉宽设定为10 μs,采样点数设定为64 k,累加扫描64次.循环延迟时间(22.5 s)的最后2 s用于水峰抑制脉冲发射.18个弛豫等待时间分别设定为0.05,0.1,0.14,0.19,0.27,0.37,0.52,0.72,1,1.39,1.93,2.68,5.18,10,22,25,28和32 s.T1弛豫时间由TOPSPIN软件(V 2.1,Bruker BioSpin)拟合计算得到.
6个二维谱图(J-RES,1H-1H COSY,1H-1H TOCSY,HSQC,HMBC和DOSY)在同一台核磁谱仪上采集,均采用标准脉冲序列.J-RES的F2和F1维谱宽分别设定为6 313.13和60.00 Hz,采样数据点阵t2×t1=2 048×48,每条FID累加扫描32次.1H-1H COSY的F2 (1H)和F1 (1H)维谱宽均为6 313.13 Hz,采样数据点阵t2×t1=2 048×80,每条FID累加扫描64次.1H-1H TOCSY的F2 (1H)和F1 (1H)维谱宽均为6 313.13 Hz,采样数据点阵t2×t1=2 048×80,每条FID累加扫描96次,采用MLEV-17自旋锁定脉冲序列,混合时间设定为0.1 s.HSQC的F2 (1H)和F1 (13C)维谱宽分别为6 313.13和26 410.10 Hz,采样数据点阵t2×t1=2 048×90,每条FID累加扫描320次,在采样期间使用组合脉冲(GARP)去耦.HMBC的F2 (1H)和F1(13C)维谱宽分别为6 313.13和33 201.93 Hz,采样数据点阵t2×t1=2 048×90,每条FID累加扫描400次.上述二维谱在傅里叶变换时使用线性预测使填充后数据为2 k×2 k.DOSY每条FID累加扫描32次,梯度脉冲宽度、扩散时间和梯度恢复时间分别设定为2,200和0.15 ms,共使用16个脉冲梯度.
2 结果与讨论 2.1 绿豆种子提取物鉴定 2.1.1 棉籽糖家族寡糖和蔗糖的归属首先,根据1H NMR和J-RES核磁谱图,我们确认绿豆提取物1H NMR谱(图 1)δH 5.47~4.10间包含8个信号较强且分辨率较高的峰:δH 5.44(双峰)、5.42(双峰)、5.01(双峰)、5.00(双峰)、4.23(双峰)、4.22(双峰)、4.21(多重峰)和4.16(多重峰).
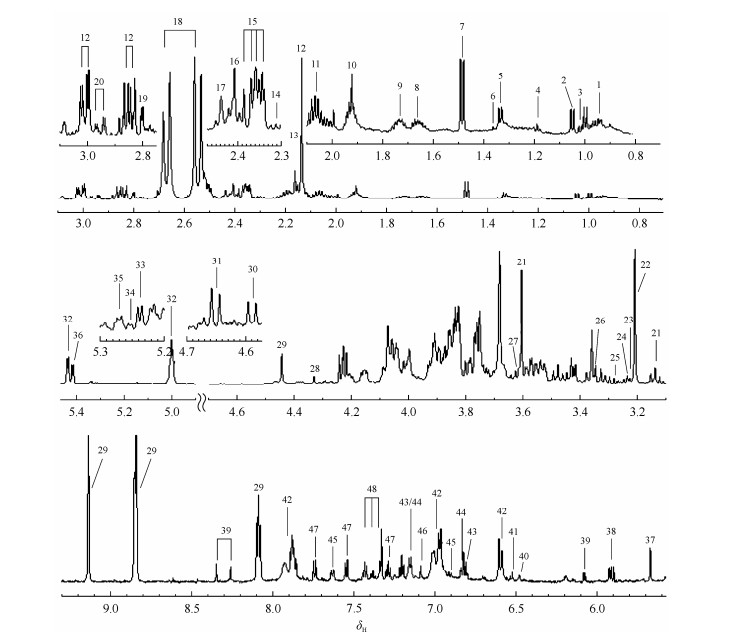
|
| 图 1 绿豆50%甲醇提取物的1H NMR谱图(δH 0.7~3.1和5.5~9.3均纵向放大32倍,代谢物归属见表 2) Fig. 1 1H NMR spectra of mungbean extracts from 50% aqueous methanol (δH 0.7~3.1 and 5.5~9.3 were vertically expanded 32 times, metabolite keys are listed in Table 2) |
然后根据COSY和TOCSY谱图,我们得到了6个质子耦合体系:δH 5.44~5.01 (d)-5.00(d)-3.58 (m)-4.07 (m)-4.03 (m)-3.86 (m)-3.78 (m)-3.68 (m)、δH 5.42~3.51 (m)-3.58 (m)-3.82 (m)、δH4.23~4.08 (m)-3.84(m)、4.22~3.83 (m)、δH 4.21~4.03 (m)-3.89 (m)和δH 4.16~4.06 (m)-3.94 (m)-3.82 (m)-3.71 (m),m表示多重峰.由于δH 3.20至4.15间谱峰严重重叠,因此仅从1H-1H化学位移相关谱,有可能得不到准确数目的质子组.根据HSQC和HMBC谱图,我们确定了上述δH 5.47~4.10间8组质子对应的13C化学位移依次为δC92.0,95.2,97.9,98.2,76.2,79.4,68.3和68.7,δH 3.20~4.15间质子对应的13C化学位移在δC60~80之间.虽然严重重叠的谱峰限制了在绿豆提取物里观测的质子耦合体系的分辨率(一个多重峰里可能包含几组质子),但是根据化学位移和质子间相关关系,我们推测这几组谱峰均属于糖类代谢物.
根据文献调研,我们发现绿豆富含棉籽糖家族寡糖和蔗糖.棉籽糖家族寡糖包括棉籽糖(三糖)、水苏糖(四糖)和毛蕊花糖(五糖).棉籽糖是蔗糖靠近葡萄糖一侧以α-1, 6糖苷键连接一个半乳糖,水苏糖是棉籽糖靠近半乳糖一侧以α-1, 6糖苷键连接一个半乳糖,而毛蕊花糖则是水苏糖末端半乳糖再以α-1, 6糖苷键连接一个半乳糖.它们的质子和13C化学位移都极其相近,在生物样品中与单糖及其衍生物谱峰严重重叠,即使利用二维化学位移相关谱亦可能不能准确确认.有文献报道用气相色谱[9]或液相色谱[10, 13]将各个糖分离后再作鉴定,这会耗费大较多时间,而且有可能会受到代谢物混合体系中其它糖类代谢物的干扰.
为鉴定绿豆提取物里蔗糖和棉籽糖家族寡糖,我们分别采集了蔗糖、棉籽糖、水苏糖、毛蕊花糖标准品和绿豆提取物的二维扩散排序谱,以及4种糖标准品的1D 1H NMR与化学位移相关谱.Stokes-Einstein公式[19]表明,化合物的自扩散系数D与其水合分子半径呈反比,同一代谢物的不同基团具有相同的自扩散系数.因此,自扩散系数可以作为归属蔗糖和棉籽糖家族寡糖的重要依据之一.这些寡糖的自扩散系数结果(表 1)表明寡糖的分子量越大,自扩散系数越小.其次,绿豆提取物中δH 5.42及4.22扩散系数与蔗糖相近,而δH 5.44,5.01,4.23,4.21和4.16扩散系数与毛蕊花糖接近.为进一步确认棉籽糖家族寡糖的构成,我们将微量的3种标准品分别滴加至绿豆提取物中,并得到了棉籽糖家族寡糖原位准确的1H和13C化学位移信息(表 2).与文献报道[10]不同的是,本研究发现绿豆种子里含有大量的棉籽糖家族寡糖,主要来自于毛蕊花糖,仅少量来自棉籽糖和水苏糖.
| 提取物 | δH | ||||||
| 4.16 | 4.21 | 4.22 | 4.23 | 5.01 | 5.42 | 5.44 | |
| 蔗糖(sucrose) | - | - | 5.62±0.01 | - | - | 5.61±0.02 | - |
| 棉籽糖(raffinose) | - | - | - | 4.93±0.01 | 4.71±0.02 | - | 4.81±0.01 |
| 水苏糖(stachyose) | 4.31±0.01 | - | - | 4.51±0.01 | 4.51±0.01 | - | 4.61±0.02 |
| 毛蕊花糖(verbascose) | 3.91±0.03 | 3.91±0.02 | - | 3.91±0.02 | 3.81±0.01 | - | 3.84±0.01 |
| 绿豆提取物(mungbean extract) | 3.81±0.01 | 3.82±0.01 | 5.52±0.01 | 3.91±0.01 | 3.82±0.01 | 5.49±0.01 | 3.83±0.01 |
| -:标准品在该化学位移处没有信号. | |||||||
| 编号 | 代谢物 | 基团 | δH | δC | 归属依据 |
| 1 | 亮氨酸 Leu |
δ-CH3 δ′-CH3 γ-CH β-CH2 α-CH COOH |
0.940 (d, 6.03) 0.960 (d, 6.03) 1.69 (m) 1.72 (m) 3.69 (t) |
23.91 23.91 26.70 26.70 68.22 178.6 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 2 | 缬氨酸 Val |
γ-CH3 γ′-CH3 β-CH α-CH COOH |
0.990 (d, 7.05) 1.04 (d, 7.05) 2.26 (m) 3.58 |
20.32 19.70 31.71 63.44 176.7 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 3 | 异亮氨酸 Ile |
δ-CH3 γ′-CH3 γ-CH2 γ-CH2 β-CH α-CH COOH |
0.941 (t) 1.01 (d, 7.07) 1.25 (m) 1.48 (m) 1.96 (m) 3.60 |
13.11 17.20 27.33 27.33 38.41 69.92 176.1 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 4 | 乙醇 ethanol |
CH3 CH2 |
1.19 (t, 7.08) 3.66 (q) |
19.41 60.10 | 1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 5 | 乳酸 lactate |
CH3 CH COOH |
1.33 (d, 6.94) 4.12 |
22.81 71.42 185.3 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 6 | 2-羟基异丁酸2-HIBA | β/β′-CH3 | 1.36 (s) | 25.20 | 1H, J-RES, HSQC, HMBC |
| 7 | 丙氨酸 Ala |
CH3 CH COOH |
1.47 (d, 7.20) 3.78 (m) |
18.71 53.33 178.8 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 8 | 瓜氨酸 citrulline |
γ-CH2 β-CH2 δ-CH2 α-CH COOH CO |
1.66 (m) 1.88 (m) 3.24 (m) 3.71 (m) |
26.82 31.22 43.31 57.90 160.1 178.6 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 9 | 赖氨酸 Lys |
d-CH2 γ-CH2 β-CH2 e-CH2 α-CH COOH |
1.45 (m) 1.68 (m) 1.70 (m) 1.90 (m) 3.02 (m) |
19.32 26.51 26.51 30.92 42.02 179.7 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 10 | 乙酸 acetate |
CH3 COOH |
1.92 (s) | 25.93 176.3 | 1H, J-RES, HSQC, HMBC |
| 11 | 谷氨酸 Glu |
β-CH2 γ-CH2 α-CH 1-COOH 5-COOH |
2.08 2.36 3.74 |
29.70 36.01 57.42 177.0 184.1 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 12 | 2-氨基-4-氧戊酸 AOPA |
CH3 CH2 CH2 CH NH2 1-COOH 4-COOH |
2.14 (s) 2.86 (dd, 8.70, 14.2) 3.01 (dd, 4.40, 14.2) 4.39 (m) 8.18 (s) |
19.71 38.72 38.72 57.40 177.3 180.0 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 13 | 甲硫氨酸 Met |
S-CH3 β-CH2 S-CH2 α-CH COOH |
2.17 (s) 2.19 (m) 2.52 3.80 |
17.11 30.02 34.32 57.21 177.2 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 14 | γ-氨基丁酸 GABA |
Β-CH2 α-CH2 γ-CH2 COOH |
1.88 (m) 2.30 (t, 7.42) 3.02 (t, 6.63) |
26.32 37.30 42.31 184.1 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 15 | 苹果酸malate | CH2 CH2 CH 1-COOH 4-COOH |
2.38 (dd, 9.70, 15.78) 2.69 (dd, 15.38, 3.21) 4.32 (dd, 3.07, 10.03) |
45.20 45.20 72.81 183.1 183.3 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 16 | 琥珀酸 succinate |
CH2 COOH |
2.41 (s) | 36.41 183.4 |
1H, J-RES, HSQC, HMBC |
| 17 | α-酮戊二酸 α-KG |
α-CH2 β-CH2 5-COOH 1-COOH 2-CO |
2.45 (t, 6.76) 3.02 (t, 6.96) |
34.11 38.62 184.1 180.8 207.9 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 18 | 柠檬酸 citrate |
CH2 CH2 OH-C 1/5-COOH 3'-COOH |
2.55 (dd, 15.69) 2.68 (dd, 15.69) |
48.42 48.42 78.21 181.7 184.4 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 19 | 天冬氨酸 Asp |
CH2 CH2 CH |
2.68 (dd) 2.82 (dd, 3.91, 16.14) 3.91 |
37.11 37.11 52.90 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 20 | 酪氨酸 Tyr |
CH2 CH2 CH-NH2 3/5-CH 2/6-CH OH-C COOH |
2.86 (dd, 8.61, 16.72) 2.96 (dd, 4.11, 16.53) 4.02 6.88 (d, 8.59) 7.18 (d, 8.61) |
38.71 38.71 54.32 133.8 129.8 157.0 177.2 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 21 | O-甲基鲨肌醇 OMSI |
1-CH 4-CH 3/5-CH 2/6-CH CH3 |
3.14 (t, 9.55) 3.34 (t, 9.45) 3.36 (dd, 9.45, 9.55) 3.43 (dd, 9.18, 9.45) 3.61 (s) |
76.21 85.52 76.11 75.92 62.41 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 22 | 胆碱 choline |
CH3 N-CH2 OH-CH2 |
3.20 (s) 3.52 (m) 4.06 (m) |
56.82 70.31 76.92 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 23 | 磷酸胆碱 PC |
N(CH3)3 N-CH2 OH-CH2 |
3.22 (s) 3.60 (m) 4.17 (m) |
56.90 77.61 61.04 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 24 | 甘油磷酸胆碱 GPC |
N(CH3)3 N-CH2 OH-CH2 |
3.24 (s) 3.69 (m) 4.33 (m) |
56.90 69.10 62.53 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 25 | 甜菜碱 betaine |
CH3 CH2 |
3.27 (s) 3.88 (s) |
53.22 69.21 |
1H, J-RES, HSQC, HMBC |
| 26 | 鲨肌醇SI | CH | 3.35 (s) | 76.32 | 1H, J-RES, HSQC, HMBC |
| 27 | 肌醇 inositol |
1-CH 3/5-CH 2/6-CH 4-CH |
3.30 (t, 9.36) 3.55 (dd, 2.93, 9.96) 3.64 (t, 9.54) 4.08 (t, 2.99) |
76.42 73.41 75.41 74.93 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 28 | 酒石酸 tartarate |
CHBR COOH | 4.34 (s) | 76.90 182.1 |
1H, J-RES, HSQC, HMBC |
| 29 | N1-甲基烟酸 NMNA |
N-CH3 3-CH 2-CH 4-CH 6-CH COOH-C COOH |
4.44 (s) 8.08 (dd, 6.78, 8.32) 8.83 (d, 6.14) 8.85 (d, 8.05) 9.13 (s) |
51.32 130.3 139.5 148.0 148.1 148.7 171.0 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 30 | β-半乳糖 β-Gal |
1-CH 4-CH 3-CH 2-CH 5-CH 6-CH2 |
4.59 (d, 7.94) 3.95 3.66 3.50 3.71 3.74 |
98.82 nd nd nd nd nd |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 31 | β-葡萄糖 β-Glc |
1-CH 4-CH 6-CH2 5-CH 3-CH 2-CH |
4.65 (d, 8.12) 3.90 3.75 3.69 3.49 3.26 |
98.91 nd nd nd nd nd |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 32 | 棉籽糖家族寡糖 -棉籽糖a raffinose |
Glc-4-CH Glc-2-CH Fru-1-CH2 Glc-6-CH2 Gal-6-CH2 Glc-3-CH Fru-6-CH2 Gal-2-CH Fru-6-CH2 Gal-3-CH Fru-5-CH Gal-5-CH Gal-4-CH Glc-6-CH2 Glc-5-CH Fru-4-CH Fru-3-CH Gal-1-CH Glc-1-CH |
3.55 (t, 9.31) 3.58 (dd, 3.88, 9.62) 3.68 (s) 3.69 (m) 3.75 (d, 6.34) 3.76 (dd, 8.21, 10.45) 3.78 (dd, 7.78, 11.96) 3.83 (dd, 3.75, 10.45) 3.84 (dd, 3.24, 13.47) 3.90 (m) 3.90 (m) 3.96 (m) 4.01 (m) 4.04 (m) 4.05 (m) 4.07 (m) 4.23 (d, 8.82) 5.00 (d, 4.01) 5.44 (d, 3.88) |
69.22 70.90 61.31 65.82 61.11 73.02 62.51 68.42 62.51 69.44 81.34 71.02 69.11 65.62 71.41 74.42 76.22 98.51 91.92 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC, DOSY, 标 准品 |
| 32 | 棉籽糖家族寡糖 -水苏糖a stachyose |
Glc-4-CH Glc-2-CH Fru-1-CH2 Glc-6-CH2 Gal2-6-CH2 Glc-3-CH Fru-6-CH2 Gal2-2-CH Gal2-5-CH Gal1-3-CH Gal1-6-CH2 Fru-5-CH Gal2-3-CH Gal1-2-CH |
3.54 (t, 9.58) 3.58 (dd, 3.85, 10.03) 3.68 (s) 3.68 (m) 3.73 (dd, 4.68, 10.69) 3.75 (d, 6.33) 3.76 (t, 9.37) 3.78 (dd, 7.96, 13.27) 3.82 (dd, 3.43, 10.46) 3.84 (dd, 1.64, 12.02) 3.86 (dd, 2.89, 10.23) 3.88 (m) 3.90 (m) 3.91 (dd, 2.89, 10.54) |
69.40 70.91 61.41 65.92 66.40 61.11 72.72 62.41 62.41 68.32 69.51 66.40 81.34 69.33 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC, DOSY, 标 准品 |
| 32 | 棉籽糖家族寡糖 -水苏糖a stachyose |
Glc-5-CH Gal1-4-CH Glc-6-CH2 Gal2-4-CH Fru-4-CH Gal1-5-CH Fru-3-CH Gal2-1-CH Gal1-1-CH Glc-1-CH |
3.99 (m) 4.01 (m) 4.04 (m) 4.05 (m) 4.06 (m) 4.07 (t, 8.46) 4.16 (m) 4.23 (d, 8.87) 5.00 (m) 5.44 (d, 3.83) |
69.21 70.92 69.20 65.73 71.34 74.01 68.72 76.33 98.20 92.01 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC, DOSY, 标 准品 |
| 32 | 棉籽糖家族寡糖 -毛蕊花糖a verbascose |
Glc-2-CH Gal1-6-CH2 Fru-1-CH2 Gal1-2-CH Glc-6-CH2 Gal3-6-CH2 Gal2-6-CH2 Glc-3-CH Fru-6-CH2 Glc-5-CH Gal-3-CH Gal3-2-CH Fru-5-CH Gal1-4-CH Gal2-2-CH Gal1-5-CH Gal2-3-CH Gal3-3-CH Gal2-4-CH Glc-4-CH Fru-4-CH Gal3-4-CH Gal2-5-CH Gal3-5-CH Fru-3-CH Gal3-1-CH Gal2-1-CH Gal1-1-CH Glc-1-CH |
3.54 (t, 9.56) 3.58 (dd, 3.92, 10.05) 3.68 (s) 3.69 (m) 3.73 (dd, 4.48, 11.08) 3.76 (d, 6.48) 3.76 (t, 10.38) 3.79 (dd, 7.43, 12.26) 3.83 (dd, 3.54, 10.49) 3.85 (dd, 3.77, 11.20) 3.87 (dd, 3.31, 10.26) 3.88 (m) 3.90 (m) 3.91 (dd, 7.90, 10.49) 3.92 (dd, 3.18, 10.26) 3.99 (m) 4.02 (m) 4.03 (m) 4.04 (m) 4.06 (m) 4.07 (t, 8.62) 4.09 (m) 4.16 (m) 4.21 (m) 4.23 (d, 8.86) 4.99 (d) 5.00 (d, 3.80) 5.01 (d, 3.65) 5.44 (d, 3.96) |
69.40 71.01 61.52 66.11 66.51 61.02 72.72 62.20 68.03 70.03 66.42 69.61 66.11 69.72 69.53 69.04 70.91 69.22 65.72 74.43 71.53 71.74 68.73 68.32 76.20 98.01 98.22 97.93 91.92 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC, DOSY, 标准品 |
| 33 | α-葡萄糖 α-Glc |
1-CH 5-CH 3-CH 2-CH 4-CH 6-CH2 |
5.25 (d, 3.81) 3.84 3.73 3.57 3.43 3.73 |
95.22 nd 75.21 nd nd nd |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 34 | α-阿拉伯糖 α-Ara |
1-CH 5-CH 4-CH 3-CH 2-CH |
5.26 (d, 3.81) 4.02 3.90 3.82 3.68 |
95.23 nd nd nd nd |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 35 | α-半乳糖 α-Gal |
1-CH 5-CH 4-CH 3-CH 2-CH 6-CH2 |
5.27 (d, 3.78) 4.07 4.00 3.83 3.80 3.74 |
95.20 nd nd nd nd nd |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 36 | 蔗糖a sucrose |
Glc-1-CH Fru-3-CH Fru-4-CH Fru-5-CH Glc-5-CH Glc-6-CH2 Fru-6-CH2 Glc-3-CH Fru-1-CH2 Glc-2-CH Glc-4-CH |
5.42 (d, 3.85) 4.22 (d, 8.86) 3.89 (m) 3.84 (m) 3.83 (m) 3.82 (m) 3.81 (m) 3.76 (dd, 9.17, 10.57) 3.69 (s) 3.56 (dd, 3.87, 10.08) 3.47 (dd, 9.49, 10.46) |
95.21 79.40 81.42 72.43 81.44 62.03 60.11 72.64 64.33 70.92 69.11 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC, DOSY, 标 准品 |
| 37 | 尿苷二磷酸葡萄糖胺UDPG | Glc-1-CH | 5.61 (dd, 4.31, 8.17) 4.18 4.03 |
141.3 nd nd |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 38 | 尿苷 uridine |
CH2-OH 4-CH 3-CH 2-CH 1-CH 5-CH 6-CH 2-CO 4-CO |
3.81 4.12 4.23 4.34 5.92 (d, 4.46) 5.91 (d, 8.21) 7.88 (d, 8.04) |
nd nd nd 76.90 92.31 105.5 144.5 154.9 168.9 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 39 | 肌苷 inosine |
1-CH 8-CH 2-CH |
6.06 (d, 6.27) 8.26 (s) 8.35 (s) |
90.90 148.9 142.7 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 40 | 顺乌头酸CA | CH | 6.48 | 126.6 | 1H, J-RES, HSQC, HMBC |
| 41 | 延胡索酸fumarate | CH COOH |
6.53 (s) | 138.2 177.2 |
1H, J-RES,
HSQC, HMBC |
| 42 | 糖苷配基 aglycone |
6-CH2 8-CH2 3-CH 5-CH 2-CH 6-CH |
6.20 (br) 6.58 (br) 7.01 (d, 8.87) 7.03 (d, 8.11) 7.92 (d, 8.78) 7.94 (d, 8.78) |
105.4 105.4 119.1 119.1 131.6 131.6 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 43 | 4-羟基苯乙酸 4-HPPA |
CH2 CH2 3/5-CH 2/6-CH 1-C OH-C COOH |
2.83 (d, 13.78) 2.96 (d, 13.78) 6.83 (d, 8.44) 7.15 (d, 8.32) |
46.33 46.33 131.8 134.9 117.6 156.8 183.7 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 44 | 4-羟基苯丙酮酸 4-HPPyrA |
CH2 CH2 3/5-CH 2/6-CH |
2.50 (d, 15.2) 2.79 (d, 16.04) 6.85 (d, 6.32) 7.13 (d, 8.66) |
48.22 48.22 nd 117.7 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 45 | 4-羟基苯甲酸 4-HBA |
3/5-CH 2/6-CH |
6.96 (d, 9.03) 7.64 (d, 9.03) |
117.6 133.9 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 46 | 组氨酸 His |
CH2 CH2 CH-NH2 2-CH 4-CH COOH |
3.08 (m) 3.19 (m) 3.94 (m) 7.03 (s) 7.74 (s) |
31.22 31.22 57.71 119.9 139.3 177.7 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 47 | 色氨酸 Trp |
CH2 CH2 CH-NH2 8-CH 7-CH 2-CH 6-CH 9-CH C=C NH-C COOH |
3.30 (dd, 4.92, 14.33) 3.47 (dd, 9.06, 15.01) 4.05 (dd, 4.94, 8.44) 7.19 (t, 7.32) 7.28 (t, 7.26) 7.33 (s) 7.53 (d, 8.01) 7.72 (d, 7.94) |
29.20 29.20 57.73 122.5 125.3 128.6 114.9 121.3 130.3 139.7 177.5 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| 48 | 苯丙氨酸 Phe |
CH2 CH2 NH2-CH 3/5-CH 4-CH 2/6-CH 1-C COOH |
3.12 (dd, 7.95, 14.88) 3.29 (dd, 5.26, 14.39) 4.00 (m) 7.32 (m) 7.36 (m) 7.42 (m) |
39.40 39.40 59.21 132.4 130.7 132.1 138.0 176.9 |
1H, J-RES, COSY, TOCSY, HSQC, HMBC |
| s(单峰);d(双峰);t(三重峰);m(多重峰);br(宽峰); nd(没有检测).a. Glc(葡萄糖)、Fru(果糖)、Gal(半乳糖),在水苏糖和毛蕊花糖归属中,Galn中n越小,表示半乳糖越靠近葡萄糖.2-HIBA:2-hydroxyisobutyrate;AOPA:2-amino-4-oxopentanate;OMSI:O-methyl scyllo-inositol;PC:phosphorylcholine;GPC:glycerophosphorylcholine;SI: scyllo-inositol;CA: cis-aconitic acid;4-HPPA: 4-hydroxyphenylacetate;4-HPPyrA: 4-hydroxyphenylpyruvate;4-HBA:4-hydroxybenzoate | |||||
在绿豆提取物中,根据二维谱和文献[10, 20-24],我们共归属了48种代谢物(图 1与表 2).它们包括15种氨基酸(亮氨酸、缬氨酸、异亮氨酸、丙氨酸、赖氨酸、瓜氨酸、谷氨酸、2-氨基-4-氧戊酸、γ-氨基丁酸、甲硫氨酸、天冬氨酸、酪氨酸、组氨酸、色氨酸和苯丙氨酸)、15种有机酸或醇(乙醇、乳酸、2-羟基异丁酸、乙酸、苹果酸、琥珀酸、α-酮戊二酸、柠檬酸、酒石酸、顺乌头酸、延胡索酸、糖苷配基、4-羟基苯乙酸、4-羟基苯丙酮酸和4-羟基苯甲酸)、11种糖及其衍生物(O-甲基鲨肌醇、鲨肌醇、β-半乳糖、β-葡萄糖、棉籽糖家族寡糖、α-葡萄糖、α-阿拉伯糖、α-半乳糖、蔗糖、尿苷二磷酸葡萄糖胺和肌醇)、4种胆碱代谢物(胆碱、磷酸胆碱、甘油磷酸胆碱和甜菜碱)、2种核苷(尿苷和肌苷)以及1种维生素(N1-甲基烟酸).
2.2 绿豆提取物代谢物定量分析T1值拟合计算结果(表 3)表明:绿豆种子提取物质子的T1弛豫时间均低于5 s.本研究1D 1H NMR谱图采集时,总循环等待时间设定为25.23 s(循环等待时间22.50 s+采样时间2.73 s),显然已经超过5倍T1时间,因此可以使用全弛豫谱进行NMR定量分析[25].
| 代谢物 | δH | T1±SDa | 浓度±SDb | 代谢物 | δH | T1±SDa | 浓度±SDb |
| 亮氨酸(Leu) | 0.960 | 0.788±0.090 | 0.05±0.01 | 缬氨酸(Val) | 0.990 | 0.960±0.060 | 0.11±0.01 |
| 异亮氨酸(Ile) | 1.01 | 0.788±0.100 | 0.03±0.00 | 乙醇(ethanol) | 1.18 | 2.167±0.122 | 0.02±0.01 |
| 乳酸(lactate) | 1.33 | 1.254±0.031 | 0.07±0.02 | 丙氨酸(Ala) | 1.47 | 1.301±0.047 | 0.19±0.03 |
| 乙酸(acetate) | 1.92 | 3.796±0.031 | 0.06±0.01 | 谷氨酸(Glu) | 2.08 | 0.986±0.045 | 0.70±0.06 |
| 2-氨基-4-氧戊酸 (AOPA) |
2.14 | 2.305±0.019 | 1.29±0.10 | 甲硫氨酸(Met) | 2.17 | 2.435±0.036 | 0.37±0.04 |
| γ-氨基丁酸 (GABA) |
2.30 | 1.146±0.040 | 0.04±0.01 | 苹果酸(malate) | 2.38 | 1.257±0.038 | 0.72±0.09 |
| 琥珀酸(succinate) | 2.41 | 1.468±0.028 | 0.13±0.01 | α-酮戊二酸(α-KG) | 2.45 | 1.059±0.032 | 0.23±0.02 |
| 柠檬酸(citrate) | 2.55 | 0.407±0.008 | 8.92±0.30 | 天冬氨酸(Asp) | 2.80 | 1.126±0.072 | 0.65±0.06 |
| 酪氨酸(Tyr) | 2.94 | 0.982±0.118 | 0.73±0.05 | O-甲基鲨肌(OMSI) | 3.61 | 1.283±0.016 | 3.74±0.31 |
| 胆碱(choline) | 3.20 | 2.181±0.003 | 1.43±0.00 | 磷酸胆碱(PC) | 3.22 | 1.037±0.015 | 0.10±0.01 |
| 甘油磷酸胆碱 (GPC) |
3.24 | 0.896±0.050 | 0.07±0.01 | 甜菜碱(betaine) | 3.27 | 1.854±0.011 | 0.05±0.00 |
| 鲨肌醇(SI) | 3.35 | 1.941±0.035 | 0.04±0.03 | 酒石酸(tartarate) | 4.34 | 4.431±0.017 | 0.51±0.05 |
| N1-甲基烟酸 (NMNA) |
4.44 | 2.288±0.048 | 1.34±0.07 | β-半乳糖(β-Gal) | 4.59 | 1.685±0.013 | 0.10±0.05 |
| α-葡萄糖(α-Glc) | 5.25 | 2.249±0.345 | 0.12±0.05 | β-葡萄糖(β-Glc) | 4.65 | 1.639±0.032 | 0.17±0.08 |
| α-半乳糖(α-Gal) | 5.27 | 2.972±0.011 | 0.03±0.02 | α-阿拉伯糖(α-Ara) | 5.26 | 2.241±0.014 | 0.03±0.03 |
| 棉籽糖家族寡糖 (RFOS) |
5.44 | 1.196±0.005 | 37.44±3.45 | 蔗糖(sucrose) | 5.42 | 1.018±0.031 | 9.42±1.07 |
| 尿苷二磷酸葡糖 胺(UDPG) |
5.61 | 3.120±0.396 | 1.14±0.07 | 尿苷(uridine)c | - | 0.22±0.03 | |
| 肌苷(inosine) | 8.35 | 1.858±0.149 | 0.10±0.02 | 顺乌头酸(CA) | 6.48 | 1.101±0.284 | 0.14±0.12 |
| 4-羟基苯丙酮 (4-HPPyrA) |
7.13 | 1.764±0.006 | 0.01±0.01 | 糖苷配基(aglycone) | 7.00 | 1.131±0.236 | 0.40±0.34 |
| 4-羟基苯乙酸 (4-HPPA) |
7.15 | 1.881±0.008 | 0.02±0.02 | 羟基苯甲酸(4-HBA) | 7.64 | 1.791±0.006 | 0.12±0.02 |
| 色氨酸(Trp) | 7.72 | 1.814±0.222 | 0.28±0.02 | 组氨酸(His) | 7.08 | 2.447±0.154 | 0.18±0.03 |
| 苯丙氨酸(Phe) | 7.43 | 2.417±0.090 | 0.19±0.03 | 延胡索酸(fumarate) | 6.53 | 4.434±0.349 | 0.02±0.00 |
| a.T1单位为s,T1误差为拟合误差;b. mg代谢物/每克绿豆, SD值来自十个平行样;c.没有测得T1值;RFOS(raffinose family oligosaccharides) | |||||||
使用上述提取方法,代谢物提取率约为18%(干绿豆种子含水量约为11.6%).在绿豆提取物中,我们共定量了44种代谢物(表 3).其余4种代谢物由于谱峰重叠严重(包括赖氨酸、瓜氨酸和肌醇),或者信号强度过小(2-羟基异丁酸)而不能进行去卷积得到准确的积分面积,因此没有进行NMR定量分析.结果表明,绿豆种子代谢物含量在0.01~37.44 mg/g干重,其中高含量代谢物( > 1 mg/g)包括棉籽糖家族寡糖(37.44 mg/g)、蔗糖(9.42 mg/g)、柠檬酸(8.92 mg/g)、O-甲基鲨肌醇(3.74 mg/g)、胆碱(1.43 mg/g)、N1-甲基烟酸(1.34 mg/g)、2-氨基-4-氧戊酸(1.29 mg/g)和尿苷二磷酸葡萄糖胺(1.14 mg/g).
3 结论本研究利用J-RES,COSY,TOCSY,HSQC,HMBC和1H NMR谱图,在绿豆的50%甲醇提取物中归属了48种代谢物,并利用2D DOSY谱图鉴定了绿豆提取物里棉籽糖家族寡糖的组成成分.在此基础上,利用全弛豫谱对其中44种代谢物进行了定量分析.这些结果为绿豆代谢组学及营养学研究提供了基础数据.
| [1] | Lambrides C J, Godwin I D . Pulses, Sugar and Tuber Crops[M]. Germany: Springer, 2007 . |
| [2] | Myers R L . Alternative Crop Guide[M]. USA: Thomas Jefferson Institute Columbia, 2000 . |
| [3] | Li Li(李莉), Wan Zheng-huang(万正煌), Huang Yi-qin(黄益勤) et al . Identification of local germplasm resources and evaluation of main characteristics of mung bean in Huibei province(湖北绿豆地方种质资源鉴定和主要农艺性状评价)[J]. Mod Agric Sci(现代农业科学) , 2009, 16 (1) : 30-33 |
| [4] | Anwar F, Latif S, Przybylski R et al . Chemical composition and antioxidant activity of seeds of different cultivars of mungbean[J]. J Food Sci , 2007, 72 (7) : S503-S510 DOI:10.1111/jfds.2007.72.issue-7 |
| [5] | Duh P D, Du P C, Yen G C . Action of methanolic extract of mung bean hulls as inhibitors of lipid peroxidation and non-lipid oxidative damage[J]. Food Chem Toxicol , 1999, 37 (11) : 1 055-1 061 DOI:10.1016/S0278-6915(99)00096-4 |
| [6] | Lee S J, Lee J, Lee H H et al . Effect of mung bean ethanol extract on pro-inflammtory cytokines in LPS stimulated macrophages[J]. Food Sci Biotechnol , 2011, 20 (2) : 519-524 DOI:10.1007/s10068-011-0072-z |
| [7] | Yao Y, Cheng X Z, Ren G X . Contents of D-chiro-inositol, vitexin, and isovitexin in various varieties of mung bean and its products[J]. Agric Sci China , 2011, 10 (11) : 1 710-1 715 DOI:10.1016/S1671-2927(11)60169-7 |
| [8] | Zhang X W, Shang P P, Qin F et al . Chemical composition and antioxidative and anti-inflammatory properties of ten commercial mung bean samples[J]. Lwt-Food Sci Technol , 2013, 54 (1) : 171-178 DOI:10.1016/j.lwt.2013.05.034 |
| [9] | Jom K N, Frank T, Engel K H . A metabolite profiling approach to follow the sprouting process of mung beans (Vigna radiata)[J]. Metabolomics , 2011, 7 (1) : 102-117 DOI:10.1007/s11306-010-0236-5 |
| [10] | Aman P . Carbohydrates in raw and germinated seeds from mung bean and chick pea[J]. J Sci Food Agr , 1979, 30 (9) : 869-875 DOI:10.1002/(ISSN)1097-0010 |
| [11] | Kim J K, Kim E H, Lee O K et al . Variation and correlation analysis of phenolic compounds in mungbean (Vigna radiata L[J]. Food Chem , 2013, 141 (3) : 2988-2997 DOI:10.1016/j.foodchem.2013.05.060 |
| [12] | Tang D Y, Dong Y M, Guo N et al . Metabolomic analysis of the polyphenols in germinating mung beans (Vigna radiata) seeds and sprouts[J]. J Sci Food Agric , 2013 DOI:10.1002/jsfa.6471 |
| [13] | Kuo T M, Vanmiddlesworth J F, Wolf W J . Content of raffinose oligosaccharides and sucrose in various plant seeds[J]. J Agr Food Chem , 1988, 36 (1) : 32-36 DOI:10.1021/jf00079a008 |
| [14] | Xiao Chao-ni(肖超妮), Liu Hong-bing(刘红兵), Dai Hui(戴惠) et al . Efficient identification and structural elucidation of metabolites using HPLC-DAD-SPE-CryoNMR-MS method(基于HPLC-DAD-SPE-CryoNMR-MS技术的代谢物快速定性和结构确定)[J]. Chinese J Magn Reson(波谱学杂志) , 2009, 26 (1) : 1-16 |
| [15] | Jiang Li-miao(江李苗), Tang Hui-ru(唐恵儒) . An NMR method for determining concentrations of calcium and magnesium ions in mammalian urines(哺乳动物尿液中钙镁离子浓度的1H NMR测定方法)[J]. Chinese J Magn Reson(波谱学杂志) , 2013, 30 (1) : 80-85 |
| [16] | Crop variety approval committee of Hubei province (湖北省农作物品种审定委员会) . Mungbean varieties of Elü No(绿豆品种鄂绿4号)[J]. Huibei Agric Sci(湖北农业科学) , 2010, 7 : 1689-1689 |
| [17] | International Seed Testing Association edit (国际种子检验协会主编), Yan Q C(颜起传), Bi X H translate(毕辛华译) . International Rules for Seed Testing(国际种子检验规程)[M]. Beijing(北京): Agriculture Publishing House(农业出版社), 1996 . |
| [18] | Wu X Y, Li N, Li H D et al . An optimized method for NMR-based plant seed metabolomic analysis with maximized polar metabolite extraction efficiency, signal-to-noise ratio, and chemical shift consistency[J]. Analyst , 2014 DOI:10.1039/c3an02100a |
| [19] | Miller C C . The Stokes Einstein law for diffusion in solution[J]. Proc R Soc Lond A , 1924, 106 (740) : 724-749 DOI:10.1098/rspa.1924.0100 |
| [20] | Fan T W M . Metabolite profiling by one-and two-dimensional NMR analysis of complex mixtures[J]. Prog Nucl Magn Reson Spectrosc , 1996, 28 (2) : 161-219 DOI:10.1016/0079-6565(95)01017-3 |
| [21] | Harbaum B, Hubbermann E M, Wolff C et al . Identification of flavonoids and hydroxycinnamic acids in pak choi varieties (Brassica campestris L[J]. J Agr Food Chem , 2007, 55 (20) : 8251-8260 DOI:10.1021/jf071314+ |
| [22] | Fan T W M, Lane A N . Structure-based profiling of metabolites and isotopomers by NMR[J]. Prog Nucl Magn Reson Spectrosc , 2008, 52 (2) : 69-117 |
| [23] | Sikorska M, Matlawska I . Polyphenolic compounds from Abutilon grandiflorum leaves[J]. Acta Pol Pharm , 2008, 65 (4) : 467-471 |
| [24] | Tian Yuan(田园), Tang Hui-ru(唐恵儒) . Identification and structural determination of saccharides in rat feces(大鼠粪样中几种糖类物质的结构确定)[J]. Chinese J Magn Reson(波谱学杂志) , 2012, 29 (3) : 361-371 |
| [25] | Mao Xi-an(毛希安) . Practical Technology and Application of Modern Nuclear Magnetic Resonance(现代核磁共振实用技术及应用)[M]. Beijing(北京): Scientific and Technical Documents Publishing House(科学技术文献出版社), 2000 . |
 2014, Vol. 31
2014, Vol. 31



