文章信息
- 刘敏, 邱雯绮, 孙惠军, 陈忠
- LIU Min, QIU Wen-qi, SUN Hui-jun, CHEN Zhong
- 便携式核磁共振谱仪的研究进展
- Progress in the Portable NMR Spectrometer
- 波谱学杂志, 2014, 31(4): 504-514
- Chinese Journal of Magnetic Resonance, 2014, 31(4): 504-514
-
文章历史
收稿日期: 2014-04-16
收修改稿日期: 2014-10-29


当前食品安全、环境污染、防疫、质检、安检及科考等领域的应用需求使得快速、实时、准确的现场检测越来越重要.核磁共振(Nuclear Magnetic Resonance, NMR)因为具有无损检测等特性,成为便携式现场检测的主要手段之一.现代中高场NMR仪器大多采用超导磁体,这类NMR谱仪能够获取高灵敏度和高分辨的磁共振信号,广泛应用于化学和生物医学方面的检测分析.然而超导磁体体积大、重量重,安装于相对固定的实验环境中,无法满足即时现场检测的要求.便携式小型化NMR波谱仪一直是磁共振领域的研究热点之一,从低场的地磁场NMR谱仪[1]和石油勘探的移动式NMR[2, 3],到Inside-out NMR和便携式通用表面探测仪(NMR-MOUSE)[1],再到目前利用微机电系统(Micro-Electro-Mechanical System, MEMS)的微型化片上NMR系统(μNMR)[4-7],国内外研究机构一直长期致力于小型化NMR仪器关键技术及应用的研究.便携式NMR仪器一般采用永磁体,磁场强度不高,不均匀性大,且磁场漂移具有较高的温度敏感性,这些因素导致便携式NMR仪器获取的信号分辨率和灵敏度不高,从而制约了便携式磁共振仪器的应用.提高磁场稳定性均匀性、获取高质量的磁共振信号以及NMR仪器的小型化是当前便携式NMR仪器研究面临的主要问题.近年来,国内外研究机构围绕着上述问题主要开展了以下方向的研究:(1)研究新型小型化磁体改善磁体的稳定性和均匀性;(2)研究微小型化探头提高信号信噪比,实现微量样品检测;(3)设计研制一体化控制台和无线移动式系统软件,进一步实现灵活便携操控;(4)研究谱学新方法新技术,获取高分辨核磁共振谱图.本文将从小型化磁体、高灵敏度探头、一体化控制台和移动式软件、实验新方法和实际应用等方面对便携式NMR谱仪的进展进行阐述.
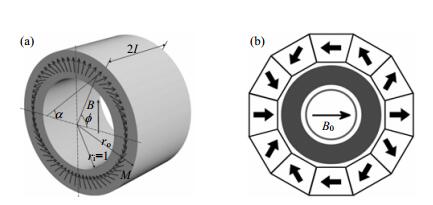
1 小型化永磁体尽管存在磁场强度较低、均匀性不佳、温度稳定性差等不足,永磁体却始终是便携式NMR波谱仪磁体的最佳选择.近年来,Halbach阵列结构永磁体(魔环磁体)的发展为小型永磁体实现较高磁场强度提供了新方法.波兰的Turek和Liszkowski从理论上对魔环磁体进行了详细分析[8].如图 1(a)所示,由于环状磁体各部分磁化方向的连续变化,魔环磁体形成了相对集中的封闭磁路,产生了高于同等尺寸常规永磁体的磁场B.然而,如图 1(b)所示,实际的魔环磁体是由M块大小相同、相邻之间的磁化方向以4π/M角度步进的扇形磁块构成,产生的磁场强度为[8-10]:
| $ {B_0} = {B_r}\frac{{\sin (2\pi /M)}}{{2\pi /M}}\ln ({r_o}/{r_i}) $ | (1) |
(1)式中Br是单个磁块的磁场强度,ri和ro是圆环的内外半径.为此,通过优化磁块组合和降低磁体内外半径之比,就可以提高目标磁场强度,从而实现较高磁场强度的小型化永磁体.
然而,实际磁块之间难以实现完全对称,也无法做到无缝拼接,这样魔环磁体依旧存在不均匀性问题,从而影响NMR谱图的分辨率[8, 11, 12].为了克服这一问题,研究人员从磁体设计和匀场线圈方面相继提出了一些新方法.德国Blümich小组采用固定梯形磁块之间嵌入可调矩形磁块的结构,开发出适用于5 mm标准样品管的0.7 T魔环磁体[11].该磁体重量仅0.5 kg,通过对矩形磁块的精细调整,可实现1H谱0.15 ppm的分辨率.北京工业大学张一鸣小组和中国科学院电工研究所陈继忠等提出了月牙形结构的理论方案[10, 12].他们通过分析和仿真,认为这类磁体结构的磁场均匀性比基本扇形结构有较大的改善,而且越靠近内部的边缘,磁场的均匀性提升越明显.北京大学俎栋林小组通过理论模型分析,研制出可使用5 mm标准样品管的8组魔环磁体匀场线圈[13].
为了改善永磁体温度稳定性,除了在钕铁硼(NdFeB)磁体中掺杂钴等稀土元素外,还可采用相对于NdFeB拥有更好温度稳定性的钐钴(SmCo)磁体[11].北京航空航天大学蒋成保小组通过表面修饰的方式进一步提高了SmCo磁体的温度稳定性[14].在实际应用中,一些小型化NMR谱仪商业公司为永磁体配备了较高精度的温控装置.这些装置独立于NMR系统,采用电控加热形式实现升温,再配合自然冷却来维持磁体的温度稳定性.因此,这类磁体只能在具备控温的环境中以高于室温的条件下运行.此外,美国哈佛医学院Lee小组在所研发的μNMR-3微型谱仪中使用了扫频跟踪技术来矫正激发频率,以避免磁场温漂导致共振频率失偏的问题[4].
2 高灵敏度探头探头作为NMR谱仪的信号收发的最前端部件,其性能直接影响着NMR谱仪的检测能力.为此,新型探头的设计和研究一直是便携式NMR仪器的研究热门.在NMR谱仪中,灵敏度通常用信噪比(SNR)来表示,受多种因素影响[15, 16]:
| $ SNR = \eta \frac{{\omega _0^2Q{V_s}}}{{\sqrt {4kT{R_c}\Delta f} }} $ | (2) |
(2)式中η是比例常数;ω0是拉莫频率;Q是射频线圈的品质因子;Vs是样品体积;k是玻尔兹曼常数;T是样品及周边线圈的热力学温度;Rc是线圈电阻;Δf是接收带宽. 对于中低磁场的小型化NMR谱仪要实现和维持稳定的低温探头在技术和工艺上较复杂,因此提高探头的品质因子Q值以及通过优化探头结构提高样品填充因子就成为提高便携式NMR谱仪信噪比更为可行的方式.
除了不断研究设计检测常规样品量的新型探头外,近年来适用于微量样品检测的微探头已成为便携式NMR仪器探头研究的发展方向之一.微量样品的NMR信号较弱,但是采用微型探头可提高NMR的灵敏度.哈佛医学院Lee小组利用微线圈、微流控和MEMS技术将线圈和样品腔制成一体化部件[5, 6],这样样品受磁场不均匀性的影响明显减弱,且填充因子得到提高,其灵敏度是台式Bruker MQ-60 NMR谱仪的60倍.此外,通过优化线圈参数来提高探头的Q值也是一种较通用的方法.如美国加州大学Herberg小组经过理论和工艺上的优化,研制出具有比以往更高灵敏度的螺线管型微线圈,在2 T磁场条件下Q值达到了22[17].
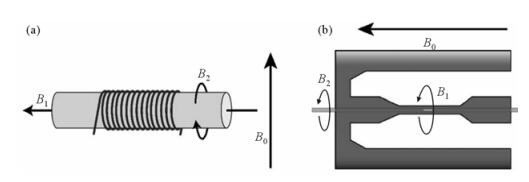
美国加州大学Jones和Larive对微型NMR系统灵敏度进行了理论分析[15].相对于常规的鞍型线圈,他们认为螺线管线圈具有更好的射频场均匀性、更高的灵敏度.然而,图 2(a)所示的螺线管线圈会在线圈两端形成环形射频磁场B2,其所在平面与主磁场B0平行,会干扰主磁场均匀性,进而影响获得谱图的分辨率.另外,Jones和Larive设计了一种微槽结构的新型微线圈.如图 2(b)所示,该微槽结构线圈所产生的射频磁场B1和B2与主磁场B0垂直,对磁场的均匀性几乎没有影响,理论上能够得到较高的谱图分辨率.
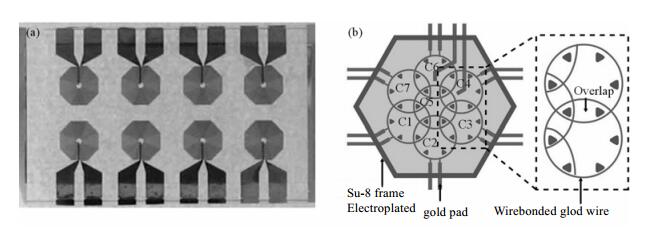
如图 3(a)所示的微线圈阵列利用多个线圈可以同时检测多份样品,有效提高大规模样品检测效率[5, 15, 17].此外,现代磁共振成像常采用阵列线圈在相同实验时间下提高信噪比.德国Gruschke小组设计了如图 3(b)所示的相控阵列微线圈,其是由7个直径为2 mm的线圈构成,信噪比相对于原有5 mm线圈提高了40%[18].因此将多阵列线圈技术引入便携式NMR谱仪探头的设计中也是有意义的研究方向.
轻巧简洁的一体化控制台和无线移动式系统软件是便携式NMR仪器的又一发展方向.为了满足实时便携的现场检测需求,便携式NMR谱仪控制台的一体化已成为发展趋势.即将脉冲序列发生器、射频发射和接收、射频功放、前置放大器、频率源等功能单元有机集成在一起.数字化仪器技术不仅能够提高仪器的控制精度和稳定性,提升仪器整体性能,而且还可以有效整合相关功能单元,实现仪器的一体化.同时,软件无线电(Software Defined Radio, SDR)技术的应用,使数字信号处理和数字控制功能的配置和升级更加灵活可变、更具适用性.另外,专用磁共振芯片的出现和MEMS技术的引入,使电路系统更加靠近探头,有利于提高谱仪探测信号质量、简化信号链路的结构.而移动终端平台使得系统软件能够无线操控NMR实验,从而进一步提高便捷化和灵活性.
近年来,国内外研究机构和厂商通过不断的努力推出了一些新型一体化控制台.日本京都大学Takeda博士采用SDR架构研制了NMR波谱仪原型控制台OPENCORE NMR.该控制台仅用FPGA芯片实现了包含脉冲序列发生器、直接数字频率合成器、数字接收机和通信接口在内的NMR波谱仪全部数字电路功能[19].在国内,北京大学王为民小组也开发出基于SDR架构的单板式NMR控制台(如图 4所示)[20].与OPENCORE NMR控制台相比,它单独采用一块DSP芯片来实现脉冲序列发生器以及与主控机通信功能,使得脉冲序列代码的转换更便捷且自动化程度更高.而且,该控制台还具有涡流补偿的梯度波形发生器,能够适用于扩散和空间选择NMR实验的研究.与此同时,利用SDR可重复配置的优势,OPENCORE NMR控制台和单板式NMR控制台可以以软件更新的形式,重新规划控制台的功能,从而优化控制性能.另外,华东师范大学李鲠颖小组提出的基于USB总线的一体化控制台,将射频收发系统、脉冲序列发射器、控制和通讯模块都集中在单张板卡上,实现了外部计算机控制和独立自主控制两种模式,使整个控制台具有更良好的适用性[21].
此外,与微小磁共振仪器共同发展的片上NMR系统成为一体化控制台的另一种新技术.如图 5所示,美国哈佛医学院Lee小组研制的掌上微磁共振系统(Palm NMR)和片上微磁共振系统(Chip NMR),将脉冲序列发生器、时钟源控制器、混频器、门控开关和功率放大器等射频部分电路集成在毫米见方的芯片上,再配合通用的数据传输、采样及控制电路就可实现弛豫时间分析,使得整个控制台的模拟部分更为精巧便携[6].
为了与便携式NMR谱仪相适应,并契合未来远程实验及操作的需求,开发基于移动终端(平板电脑、智能手机等)的配套软件就成为了NMR软件研究的新趋势.例如,Thermo Fisher公司在picoSpin系列NMR波谱仪的软件系统上采用了仪器控制与数据处理分离的方案[22].实验时,使用者通过网页访问仪器内建Web服务器,对仪器的实验参数进行设定,实验后将Web服务器中的实验数据导入Mnova NMR软件进行谱图数据处理即可.另外,美国哈佛医学院Lee小组在研制μNMR微型谱仪的同时,也开发出适用于智能手机平台的系统软件[4].通过该软件,使用者可以便捷地实现仪器设定、实验参数设置以及弛豫信号分析等一些基本的实验操作.
由本研究组开发的Touch NMR(软件著作权,2013SR028942)拥有较为完整的功能和良好的适用性[23].通过Dropbox等云存储方式,Touch NMR还实现了实验数据与云端的自动同步,能够快速便捷地进行数据交流与维护.这对于远程异地的数据共享和分析来说,是一种灵活高效的工作形式.此外,Touch NMR系列软件可将仪器控制功能嵌入其中,实现集仪器控制与数据处理全功能的移动NMR软件.
虽然微小型化控制台和移动式系统软件的研制有不少的报道,但是在系统完整性、实验功能全面性以及灵活性等方面值得进行更深入的研究.
4 不均匀场下获得高分辨谱方法相对于高场磁场强度,中低磁场谱仪的不同化学位移谱线之间的频率差别变小.即使采用匀场和温控等技术来补偿磁场的不均匀性和温度漂移,谱图分辨率仍然有限.同时,在现有便携式NMR实验检测技术中,实验功能通常较为有限,多采用常规质子密度和弛豫信号分析法对样品进行检测和识别[5, 6],而不同的应用需求需要有新的实验方法和技术,获取独特的信息,或通过对参数测量结果的综合分析,得到感兴趣的内容[1]. 因此采用一些谱学新方法和新的脉冲序列来提高分辨率也已成为便携式NMR仪器技术的发展方向之一.
(1) 分子间多量子相干(intermolecular Multiple-Quantum Coherence, iMQC)法.由于iMQC信号包含相干自旋的进动频率差的信息,具有对不均匀不稳定场的不敏感特性,能够保留化学位移、谱峰的分裂模式、偶合常数和相对峰面积等重要信息,因此利用iMQC方法可以获得分辨率较高的信息[24-26].厦门大学陈忠小组利用分子间零量子相干(intermolecular Zero-Quantum Coherence, iZQC)方法,可在不均匀场下(谱线的半高宽大约2 kHz的情况下)取得了在均匀磁场下效果相近的2D J谱和1D谱[25].在均匀场下与不均匀场(约3.6 ppm)下,该方法在化学位移维(F1维)获得的溶剂平均线宽分别为31.6 Hz和33.2 Hz、信噪比分别达到292和125.然而,由于iMQC信号较弱,该方法需要与样品预处理、超极化等提高信号强度方法相结合方可应用于低场便携式NMR谱仪.
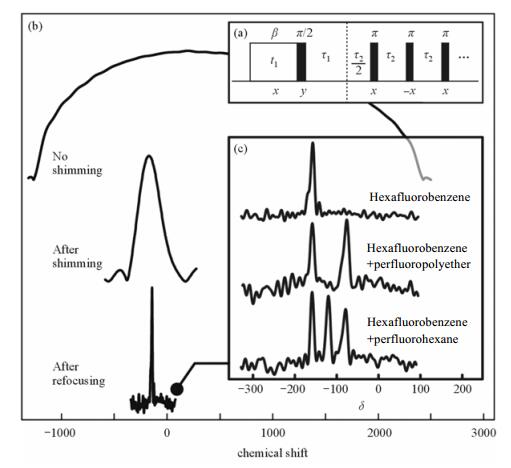
(2) 射频(RF)脉冲补偿技术.该技术通过设计与主磁场空间不均匀相匹配的平行变化的射频磁场,实现对不均匀主磁场的补偿[27].德国亚琛工业大学Blümich小组利用该方法测量了如图 6所示的氟化烃19F谱[28].他们通过一系列长度逐渐提高的基于空间变化的脉冲和多个自旋回波,将谱线的线宽由2 500 Hz降至65 Hz,耗费时间为3 mins,谱宽为δ8.此外,根据脉冲的特点及应用需要,将射频脉冲与空间编码技术相结合[29-31],并通过选择选择适合的空间编码方式,能够进一步提高谱图质量.
|
| 图 6 (a)补偿空间不均匀的射频脉冲序列,通过一些列π脉冲提高信噪比;(b)优化内部磁体位置和采用重聚序列后C6F6的谱图;(c)不同样品的化学位移解析谱[28] Fig. 6 (a) RF pulse sequences to compensate spatially inhomogeneous. A train of π pulses improves the signal to noise ratio, (b) spectra of C6F6 before and after optimized the position of the inner magnet and after used the refocusing sequence, (c) chemical shift-resolved spectra for different samples[28] |
(3) 反卷积技术.该技术利用样品管周边附加一个线圈,通过检测由主磁场的不均匀不稳定引起的感应电动势,并将感应电动势转化为磁场函数表达式.最后,将推出的磁场函数表达式对FID信号进行反卷积,得到相位校正后的FID信号[24].日本Iijima小组对KBr样品中79Br信号和感应电动势进行检测,通过该方法进行数据处理后得到了高分辨谱[32].然而,由于附加的信号监测通道需要增加线圈,因此探头需要更加优化的设计和精细的加工以便适用于便携式NMR谱仪.
(4) 自旋回波相干谱(SECSY)方法.自旋回波序列具有重聚不均匀磁场作用,能够减小谱线增宽[31].如果将自旋回波序列与上述3种方法结合,就能更好地抑制磁场不均匀性的影响[25].
此外,随着磁场强度降低,塞曼分裂现象愈发不明显,但分子内的标量偶合相互作用并不受影响.当磁场极低时,化学位移现象将被看作扰动,标量偶合将起主导作用,这时测得谱图的谱峰代表J耦合作用[33-36].此外,样品经过预极化后,可以扩大不同核自旋数目的差异,提高检测灵敏度,因而有望应用于便携式NMR谱仪.在没有附近干扰磁场作用下,利用地磁场(50~60 μT),分辨率可以达到10 mHz[34].
5 应用前景与展望在化学、生物学及医学领域中,结合微流控、微探头和MEMS技术研制的微型核磁共振(micro-NMR)仪器不仅可以很好地避免高昂的仪器运行成本、而且能够大幅减少样品的使用量,解决样品难以获取或价格昂贵问题.例如,德国Badilita小组利用micro-NMR的微流控技术,精确地操控少量样品进行NMR实验[7].美国哈佛医学院Lee小组利用μNMR平台,结合细胞的特异性免疫磁性纳米颗粒(MNPs)标记,实现了较为快速准确的循环肿瘤细胞(Circulating Tumor Cells, CTC)检测[4].
在食品质量检测方面,中低场NMR仪器基于食品中水、蛋白质、脂类等物质的含量与弛豫时间的关系可以快速无损各类食品的质量[1, 37-41].例如,对食物中水和蛋白质含量的分析,不仅可以快速检测乳制品的质量[37],衡量马铃薯干物的含量[38];而且可以推测猪肉的种类和口感[39],判断鱼类是野生的还是人工养殖的[40].另外,对脂类含量的分析,还可以测定冰淇淋的固体脂肪比例,辅助控制食品中的脂肪含量[41].
此外,对岩石的NMR检测和分析,不仅可以得到岩石层结构和其中流体及气体信息,辅助勘探石油和水源等[2, 42],而且能够直接应用于石油勘探领域的多项质量指标的检测等[3].通过检测弛豫时间分析可以判断水泥的老化程度,监测房屋的安全性[43].利用便携式单边NMR仪器可以无损检测古木制品和棺椁[44],详细分析古城墙和壁画[45]等.在植物研究方面,通过NMR弛豫时间和扩散系数的测量,可以无损分析植物的含水量和水的输运过程,推断植物生长和木质等信息,促进农林业生产等[46].
对低成本、可移动的NMR实时检测的需求,促使了便携式NMR谱仪的发展.提高永磁体磁场强度、改善磁体均匀性和温度稳定性、研制高性能探头、实现一体化控制台、开发移动式软件和发展获得高分辨率谱图的实验方法,一直是便携式NMR谱仪的研究重点.另一方面,当前便携式NMR谱仪的实验功能通常较为简单,具有一定的专用性,无法满足更深层次的物质结构和化学成分分析得需求.因此,发展功能全面的便携式NMR谱仪、提高检测分析能力,更加符合日益提高的现场检测和科学研究需求,也是便携式NMR谱仪的重要发展目标.同时,便携式NMR谱仪功能的完善和性能的提升,也将促使有关检测和研究能够以更低的成本获得更为丰富的信息,能够拓展出更广泛的应用前景.
| [1] | Mitchell J, Gladden L F, Chandrasekera T C et al . Low-field permanent magnets for industrial process and quality control[J]. Prog Nucl Magn Reson Spectrosc , 2014, 76 : 1-60 DOI:10.1016/j.pnmrs.2013.09.001 |
| [2] | Xiao L Z, Liu H B, Deng F et al . Probing internal gradients dependence in sandstones with multi-dimensional NMR[J]. Micropor Mesopor Mat , 2013, 178 : 90-93 DOI:10.1016/j.micromeso.2013.04.003 |
| [3] | Honorato H D A, Silva R C, Piumbini C K et al . 1H low-and high-field NMR study of the effects of plasma treatment on the oil and water fractions in crude heavy oil[J]. Fuel , 2012, 92 (1) : 62-68 DOI:10.1016/j.fuel.2011.08.009 |
| [4] | Castro C M, Ghazani A A, Chung J et al . Miniaturized nuclear magnetic resonance platform for detection and profiling of circulating tumor cells[J]. Lab Chip , 2014, 14 (1) : 14-23 DOI:10.1039/C3LC50621E |
| [5] | Lee H, Sun E, Ham D . Chip-NMR biosensor for detection and molecular analysis cells[J]. Nat Med , 2008, 14 (8) : 869-874 DOI:10.1038/nm.1711 |
| [6] | Sun N, Yoon T J, Lee H et al . Plam NMR and 1-chip NMR[J]. IEEE J Solid-St Circ , 2011, 46 (1) : 342-352 DOI:10.1109/JSSC.2010.2074630 |
| [7] | Badilita V, Meier R C, Spengler N et al . Microscale nuclear magnetic resonance: a tool for soft matter research[J]. Royal Soc Chem , 2012, 8 (41) : 10583-10597 |
| [8] | Turek K, Liszkowski P . Magnetic field homogeneity perturbations in finite Halbach dipole magnets[J]. J Magn Reson , 2014, 238 : 52-62 DOI:10.1016/j.jmr.2013.10.026 |
| [9] | Halbach K . Design of permanent multipole magnets with oriented rare earth cobalt materials[J]. Nucl Instrum Meth , 1980, 169 (1) : 1-10 DOI:10.1016/0029-554X(80)90094-4 |
| [10] | Zhang Yi-ming(张一鸣), Qiao De-zhi(乔德治), Gao Jun-xia(高俊侠) . Current research on and applications of Halbach permanent magnet array(Halbach阵列永磁体的研究现状与应用)[J]. Anal Instrum(分析仪器) , 2010, 2 : 5-10 |
| [11] | Danieli E, Perlo J, Blümich B et al . Small magnets for portable NMR spectrometers[J]. Angew Chem Int Edit , 2010, 49 (24) : 4133-4135 DOI:10.1002/anie.201000221 |
| [12] | Chen J Z, Xu C Y . An improved discrete configuration of a cylinder magnet for portable nuclear magnetic resonance instruments[J]. J Appl Phys , 2007, 101 (12) : 123926 DOI:10.1063/1.2743904 |
| [13] | Liu W, Casanova F, Blümich B et al . An efficacious target-field approach to design shim coils for Halbach magnet of mobile NMR sensors[J]. Appl Magn Reson , 2012, 42 (1) : 101-112 DOI:10.1007/s00723-011-0260-2 |
| [14] | Wang Q Y, Zheng L, An S Z et al . Thermal stability of surface modified Sm2Co17-type high temperature magnets[J]. J Magn Magn Mater , 2013, 331 : 245-249 DOI:10.1016/j.jmmm.2012.11.013 |
| [15] | Jones C J, Larive C K . Could smaller really be better? Current and future trends in high-resolution microcoil NMR spectroscopy[J]. Anal Bioanal Chem , 2012, 402 (1) : 61-68 DOI:10.1007/s00216-011-5330-7 |
| [16] | Watzlaw J, Müntjes J, Mokwa W et al . Multilayer micro coils for thin film analysis with mobile NMR arrays[J]. Procedia Eng , 2011, 25 : 395-398 DOI:10.1016/j.proeng.2011.12.098 |
| [17] | Demas V, Herberg J L, Malba V et al . Portable, low-cost NMR with laser-lathe lithography produced microcoils[J]. J Magn Reson , 2007, 189 (1) : 121-129 DOI:10.1016/j.jmr.2007.08.011 |
| [18] | Gruschke O G, Baxan N, Clad L et al . Lab on a chip phased-array MR multi-platform analysis system[J]. Lab Chip , 2012, 12 (3) : 495-502 DOI:10.1039/C2LC20585H |
| [19] | Takeda K . OPENCORE NMR: Open-source core modules for implementing an integrated FPGA-based NMR spectrometer[J]. J Magn Reson , 2008, 192 (2) : 218-229 DOI:10.1016/j.jmr.2008.02.019 |
| [20] | Tang W N, Wang W M . A single-board NMR spectrometer based on a software defined radio architecture[J]. Meas Sci Technol , 2011, 22 (1) : 015902 DOI:10.1088/0957-0233/22/1/015902 |
| [21] | Liu Ying(刘颖), Shen Jie(沈杰), Li Geng-ying(李鲠颖) . Integrated nuclear magnetic resonance spectrometer based on USB connection(基于USB总线的一体化核磁共振谱仪控制台)[J]. Chinese J Magn Reson(波谱学杂志) , 2007, 24 (1) : 35-41 |
| [22] | Thermo Fisher Scientific. PicoSpin-80[EB/OL]. http://picospin.com/products/picospin-80/. |
| [23] | Li QY. Touch NMR[EB/OL]. https://itunes.apple.com/app/touch-nmr/id564986048?mt=8. |
| [24] | Wu Rui(吴瑞), Zhang Zhi-yong(张志勇), Chen Hao(陈浩) et al . Progress of ultrafast spatially encoded high-resolution nuclear magnetic resonance spectroscopy in inhomogeneous fields(不均匀场下空间编码超快速高分辨NMR研究进展)[J]. Chinese J Magn Reson(波谱学杂志) , 2013, 30 (3) : 430-446 |
| [25] | Lin Y L, Zhang Z Y, Cai S H et al . High-resolution 2D J-resolved spectroscopy in inhomogeneous fields with two scans[J]. J Am Chem Soc , 2011, 133 (20) : 7632-7635 DOI:10.1021/ja1113479 |
| [26] | Huang Y Q, Cai S H, Chen X et al . Intermolecular single-quantum coherence sequences for high-resolution NMR spectra in inhomogeneous fields[J]. J Magn Reson , 2010, 203 (1) : 100-107 DOI:10.1016/j.jmr.2009.12.007 |
| [27] | Franck J M, Demas V, Martin R W et al . Shimmed matching pulses: Simultaneous control of RF and static gradients for inhomogeneity correction[J]. J Chem Phys , 2009, 131 (23) : 234506 DOI:10.1063/1.3243850 |
| [28] | Perlo J, Demas V, Casanova F et al . High-resolution NMR spectroscopy with a portable single-sided sensor[J]. Science , 2005, 308 (5726) : 1279 DOI:10.1126/science.1108944 |
| [29] | Shapira B, Frydman L . Spatially encoded pulse sequences for the acquisition of high resolution NMR spectra in inhomogeneous fields[J]. J Magn Reson , 2006, 182 (1) : 12-21 DOI:10.1016/j.jmr.2006.04.012 |
| [30] | Zhang Z Y, Chen H, Wu C et al . Spatially encoded ultrafast high-resolution 2D homonuclear correlation spectroscopy in inhomogeneous fields[J]. J Magn Reson , 2013, 227 : 39-45 DOI:10.1016/j.jmr.2012.11.020 |
| [31] | Shapira B, Frydman L . Spatial encoding and the acquisition of high-resolution NMR spectra in inhomogeneous magnetic fields[J]. J Am Chem Soc , 2004, 126 (23) : 7184-7185 DOI:10.1021/ja048859u |
| [32] | Iijima T, Takegoshi K, Hashi K et al . High-resolution NMR with resistive and hybrid magnets: Deconvolution using a field-fluctuation signal[J]. J Magn Reson , 2007, 184 (2) : 258-262 DOI:10.1016/j.jmr.2006.10.010 |
| [33] | Theis T, Blanchard J W, Butler M C et al . Chemical analysis using J-coupling multiplets in zero-field NMR[J]. Chem Phys Lett , 2013, 580 : 160-165 DOI:10.1016/j.cplett.2013.06.042 |
| [34] | Blümich B, Casanova F, Appelt S . NMR at low magnetic fields[J]. Chem Phys Lett , 2009, 477 (4) : 231-240 |
| [35] | Katz I, Shtirberg L, Shakour G et al . Earth field NMR with chemical shift spectral resolution: Theory and proof of concept[J]. J Magn Reson , 2012, 219 : 13-24 DOI:10.1016/j.jmr.2012.04.011 |
| [36] | Ledbetter M P, Theis T, Blanchard J W et al . Near-zero-field nuclear magnetic resonance[J]. Phys Rev Lett , 2011, 107 (10) : 107601 DOI:10.1103/PhysRevLett.107.107601 |
| [37] | Andersen C M, Frøst M B, Viereck N . Spectroscopic characterization of low-and non-fat cream cheeses[J]. Int Dairy J , 2010, 20 (1) : 32-39 DOI:10.1016/j.idairyj.2009.07.006 |
| [38] | Hansen C L, Thybo A K, Bertram H C et al . Determination of dry matter content in potato tubers by low-field nuclear magnetic resonance(LF-NMR)[J]. J Agr Food Chem , 2010, 58 (19) : 10300-10304 DOI:10.1021/jf101319q |
| [39] | Pearce K L, Rosenvold K, Andersen H J et al . Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the impacts on fresh meat quality attributes-a review[J]. Meat Sci , 2011, 89 (2) : 111-124 DOI:10.1016/j.meatsci.2011.04.007 |
| [40] | Erikson U, Standal I B, Aursand I G et al . Use of NMR in fish processing optimization:a review of recent progress[J]. Magn Reson Chem , 2012, 50 (7) : 471-480 DOI:10.1002/mrc.v50.7 |
| [41] | Lucas T, Wagener M, Barey P et al . NMR assessment of mix and ice cream. Effect of formulation on liquid water and ice[J]. Int Dairy J , 2005, 15 (10) : 1064-1073 DOI:10.1016/j.idairyj.2004.06.011 |
| [42] | Meng Xiao-hai(孟小海), Jiang Zhi-min(姜志敏), Shi Jing-sheng(史京生) et al . Two-dimensional NMR spectroscopy for observing rock wettability(二维核磁共振观测岩石润湿性)[J]. Chinese J Magn Reson(波谱学杂志) , 2012, 2 (29) : 190-200 |
| [43] | Simina M, Molnar L, Manea D et al . Monitoring the air influence on cement-lime mortar hydration using low-field nuclear magnetic resonance relaxometry[J]. Appl Magn Reson , 2012, 43 (3) : 443-450 DOI:10.1007/s00723-012-0389-7 |
| [44] | Proietti N, Presciutti F, Di Tullio V et al . Unilateral NMR, 13C CPMAS NMR spectroscopy and micro-analytical techniques for studying the materials and state of conservation of an ancient Egyptian wooden sarcophagus[J]. Anal Bioanal Chem , 2011, 399 (9) : 3117-3131 DOI:10.1007/s00216-010-4229-z |
| [45] | Blümich B, Haber A, Casanova F et al . Noninvasive depth profiling of walls by portable nuclear magnetic resonance[J]. Anal Bioanal Chem , 2010, 397 (7) : 3117-3125 DOI:10.1007/s00216-010-3880-8 |
| [46] | Capitani D, Brilli F, Mannina L et al . In situ investigation of leaf water status by portable unilateral nuclear magnetic resonance[J]. Plant Physiol , 2009, 149 (4) : 1638-1647 DOI:10.1104/pp.108.128884 |
 2014, Vol. 31
2014, Vol. 31