文章信息
- 孙麒, 杨庆昆, 龚珊珊, 马茶
- SUN Qi, YANG Qing-kun, GONG Shan-shan, MA Cha
- 磷氨米酮及其β-端位异构体的NMR研究
- An NMR Study of Phosphoramidon and Its β-Anomer
- 波谱学杂志, 2014, 31(3): 426-436
- Chinese Journal of Magnetic Resonance, 2014, 31(3): 426-436
-
文章历史
收稿日期: 2013-09-18
收修改稿日期: 2014-07-17


磷氨米酮(Phosphoramidon,1)是1972年日本科学家Umezawa等人首次从链霉菌(Streptomyces tanashiensis)培养液中分离得到的一种特殊含磷天然产物[1].如图 1所示,其分子结构中α-L-鼠李糖端位羟基通过磷酰胺结构与L-亮-L-色二肽连接.基于磷酰基与金属离子的配位作用,磷氨米酮有着极强的嗜热菌蛋白酶(Thermolysin)抑制作用,被广泛地应用于蛋白质序列分析、蛋白质纯化、组织解离和甜味剂工业合成等生物科学前沿领域[2, 3].此外,生物学家和医学家还利用磷氨米酮对内皮素转化酶的抑制作用,对其在内皮素-1活化与致病机理方面进行了深入研究,使之成为了治疗心脑血管疾病的新靶点[4, 5].同时,磷氨米酮作为重要的参照还被用来为新化合物的活性评价提供基准.

|
| 图 1 磷氨米酮(1)及其b-端位异构体(2)的结构式 Fig. 1 The skeletal formulas of phosphoramidon (1) and its b-anomer (2) |
虽然磷氨米酮的分子结构貌似并不十分复杂,但是在糖基端位立体选择性地构建磷酰二肽结构却是一项极具挑战性的工作.目前,有关磷氨米酮及其类似物合成方法的报道非常有限,且产率普遍较低,有关其1H NMR波谱的全归属还未见报道,已知的1H NMR数据仅对甲基和糖基端位的质子信号进行过简单的部分归属[1, 6].磷氨米酮13C NMR数据还未见报道.本课题组在前期合成方面的研究中,通过新型的糖基氢亚磷酸二酯法控制糖基端位亚磷酰化的反应条件,选择性地得到了保护的磷氨米酮及其β-异构前体,并最终通过“一锅”脱除保护高效地得到了高纯度的磷氨米酮1及其β-端位异构体2[7].本研究采集了磷氨米酮及其β-端位异构体的1H,13C和31P NMR等1D NMR波谱,利用1H-1H COSY,HSQC等2D NMR波谱方法对1和2的1H和13C NMR波谱进行了全归属,并通过NOESY和1JC, H对磷氨米酮及其β-端位异构体的端位构型进行了确认.本文的研究结果填补了关于天然磷酰糖肽类化合物核磁波谱在全归属方面的空白,为后续的相关研究提供了重要参考.
1 实验部分 1.1 仪器及试剂本研究全部NMR数据的采集均使用Bruker AV-400型NMR波谱仪.样品以D2O为溶剂,1H,13C和31P NMR的工作频率分别为400 MHz,100 MHz和162 MHz,谱宽分别为8 278.15 Hz,26 178.01 Hz和64 935.07 Hz.二维谱包括2D梯度场1H-1H COSY,HSQC及NOESY谱,均采用标准脉冲程序. 1H-1H COSY的F2 (1H)和F1 (1H)维的谱宽均为4 006.41 Hz,采样数据点阵t2 x t1=1 024x100;HSQC的F2 (1H)和F1 (13C)维的谱宽分别为4 006.41 Hz和19 996.40 Hz,采样数据点阵t2 x t1=1 024x325;NOESY的F2 (1H)和F1 (1H)维的谱宽均为4 006.41 Hz,采样数据点阵t2 x t1=1 024x241.
所有溶剂与化学试剂均为分析纯,干燥溶剂均采用实验室常规方法纯化.
1.2 化合物1和2的制备磷氨米酮1及其β-端位异构体2通过本课题报道的糖基氢亚磷酸二酯方法合成得到[6].该方法以α-L-三乙酰鼠李糖为原料,通过控制亚磷酰化反应条件得到不同端位构型比例的亚磷酰胺中间体,经水解得到鼠李糖基-1-氢亚磷酸二酯,利用四氯化碳/三乙胺氧化偶联体系将其与苄酯保护的亮色二肽苄酯氮端连接得到前体,并利用常规硅胶柱层析对α-和β-异构体进行有效分离.最后,“一锅”催化氢化和去乙酰化脱除全部保护基,经葡聚糖凝胶层析纯化分别得到磷氨米酮1和β-端位异构体2. HPLC分析测定的化合物1和2的纯度分别为98.5%和98%,符合结构鉴定的要求.
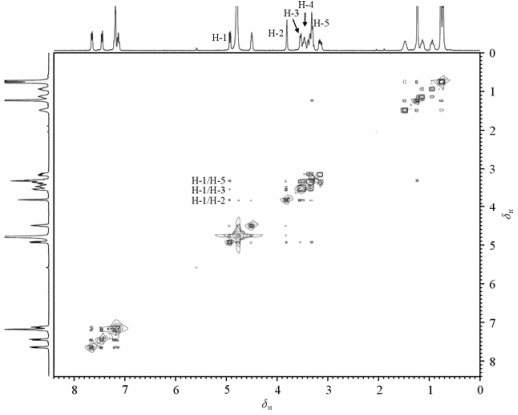
2 结果与讨论 2.1 化合物1的结构指认1H NMR和1H-1H COSY:在化合物1的1H NMR谱中,高场δ 0.80~1.52为烷基氢的信号. δ 0.80 (3H,d,J=7.9 Hz)和δ 0.83 (3H,d,J=6.2 Hz)归属为H-13和H-14的甲基信号,与H-12耦合为二重峰. H-12叔氢出现在较低场,与H-13,H-14和H-11耦合为多重峰,故δ 1.52 (1H,m)为H-12.受空间因素影响,H-11的两个氢化学环境存在明显差异,分别出现在δ 0.92 (1H,dd,J1=9.8 Hz,J2=4.5 Hz),1.14 (1H,dd,J1=9.7 Hz,J2=3.6 Hz),受到H-12和H-7耦合裂分为dd峰.此外,1H-1H COSY谱中有交叉峰δ 1.52/0.92,δ 1.52/1.14,为H-11/H-12的相关信号. δ 1.26 (3H,d,J=6.0 Hz)为H-6的甲基特征信号. δ 3.15~5.25区间共有9个氢,分别是5个糖环氢、2个氨基酸α-氢和2个色氨酸β-氢.由于H-6只与H-5相关,1H-1H COSY谱中的δ 1.26/3.79~3.81交叉信号说明δ 3.79~3.81 (1H,m)为H-5.由于H-5还与H-4相关,由1H-1H COSY谱中δ 3.79~3.81/3.35交叉峰可推知δ 3.35 (1H,dd,J1=9.8 Hz,J2=9.8 Hz)为H-4.基于1H-1H COSY谱中δ 3.35/3.77的交叉峰,可进一步推知δ 3.77 (1H,dd,J1=9.8 Hz,J2=3.3 Hz)为H-3.由于H-1与2个O原子相邻,其化学位移在最低场,受到H-2和P的影响,裂分为dd峰,d5.25 (1H,dd,J1=8.0 Hz,J2=1.4 Hz)归属为H-1.根据1H-1H COSY谱中δ 5.25/3.83的交叉峰,可判断δ 3.83 (1H,dd,J1=3.3 Hz, J2=1.4 Hz)为H-2.由于受邻位氮原子和酰胺基的影响,H-7的信号相对于H-9出现在较高场,并且在1H-1H COSY谱中有与H-11的δ 0.92/3.43~3.45和δ 1.14/3.43~3.45的交叉峰,故δ 3.43~3.45 (1H,m)为H-7.由于与氮原子和羧基相邻,H-9出现在较低场,同时受H-10的影响裂分为三重峰.因此,δ 4.53 (1H,t,J=6.2 Hz)为H-9. H-10与H-9相互耦合,由1H-1H COSY谱中交叉峰δ 4.53/3.15~3.20和δ 4.53/3.36~3.40可判断δ 3.15~3.20 (1H,m),δ 3.36~3.40 (1H,m)分别为H-10的2个氢. δ 7.17~7.67的信号是3-吲哚基的5个芳香氢.由于H-16是孤立的,所以δ 7.19 (1H,s)的单峰为H-16. H-18和H-21分别只受邻位一个氢的影响,裂分为d峰.根据Shoolery经验公式和相关文献报道可知H-18的信号应出现在较低场[8].因此,δ 7.67 (1H,d,J=7.6 Hz)为H-18,δ 7.48 (1H,d,J=8.0 Hz)为H-21.由1H-1H COSY谱中δ 7.67/7.17的交叉峰可推断δ 7.17 (1H,dd,J1=7.6 Hz,J2=7.3 Hz)为H-19.同理,δ 7.22 (1H,dd,J1=8.0 Hz,J2=7.3 Hz)为H-20.具体的1H NMR和1H-1H COSY数据及归属见表 1,1H-1H COSY谱见图 2.本研究得到并归属的1H NMR波谱数据与以往报道的化合物1的波谱数据相比较[1, 6],在化学位移和耦合常数等方面非常接近.
| 碳原子序号 | δC | δH (J/Hz) | HSQC | 质子数 | 1H-1H COSY |
| 1 | 95.41 | 5.25(dd, 1.4, 8.0) | + | 1 | H-2 |
| 2 | 71.15 | 3.83(dd, 1.4, 3.3) | + | 1 | H-1, H-3 |
| 3 | 69.90 | 3.77(dd, 3.3, 9.8) | + | 1 | H-2, H-4 |
| 4 | 72.37 | 3.35(dd, 9.8, 9.8) | + | 1 | H-3, H-5 |
| 5 | 69.51 | 3.79~3.81(m) | + | 1 | H-4, H-6 |
| 6 | 17.01 | 1.26(d, 6.0) | + | 3 | H-5 |
| 7 | 54.92 | 3.43~3.45(m) | + | 1 | H-11 |
| 8 | 177.0 | / | / | / | / |
| 9 | 55.80 | 4.53(t, 6.2) | + | 1 | H-10 |
| 10 | 27.85 | 3.15~3.20(m), 3.36~3.40(m) | + | 2 | H-9 |
| 11 | 43.24 | 0.92(dd, 9.8, 4.5), 1.14(dd, 9.7, 3.6) | + | 2 | H-7, H-12 |
| 12 | 24.02 | 1.52(m) | + | 1 | H-11, H-13, H-14 |
| 13 | 21.11 | 0.80(d, 7.9) | + | 3 | H-12 |
| 14 | 22.62 | 0.83(d, 6.2) | + | 3 | H-12 |
| 15 | 178.4 | / | / | / | / |
| 16 | 124.4 | 7.19(s) | + | 1 | / |
| 17 | 110.3 | / | / | / | / |
| 18 | 119.0 | 7.67(d, 7.6) | + | 1 | H-19 |
| 19 | 119.2 | 7.17(dd, 7.6, 7.3) | + | 1 | H-18, H-20 |
| 20 | 121.8 | 7.22(dd, 8.0, 7.3) | + | 1 | H-19, H-21 |
| 21 | 111.9 | 7.48(d, 8.0) | + | 1 | H-20 |
| 22 | 136.2 | / | / | / | / |
| 23 | 127.7 | / | / | / | / |

|
| 图 2 化合物1的1H-1H COSY谱 Fig. 2 1H-1H COSY spectrum of compound 1 |
13C NMR和HSQC:根据碳谱化学位移范围,δ 17.01~43.24为烷基碳的特征信号区域,根据HSQC谱可以归属δ 17.01,21.11,22.62,24.02,27.85,43.24,分别为C-6,C-13,C-14,C-12,C-10,C-11. δ 54.92和55.80分别为氨基酸α位C-7和C-9. δ 69.51~95.41的5个信号为糖环碳的特征位移.结合HSQC谱可知,δ 69.51,69.90,71.15,72.37,95.41分别归属为C-5,C-3,C-2,C-4,C-1.与寡糖结构中存在的α-L-鼠李糖片段C-1信号相比,α-L-鼠李糖-1-磷酰胺结构中C-1信号明显出现在更高场[9]. δ 110.3~136.2为3-吲哚基的芳环碳特征峰信号区间,根据HSQC谱可以判断δ 111.9,119.0,119.2,121.8,124.4分别为C-21,C-18,C-19,C-20,C-16.由于C-22受邻近氮原子的吸电作用,碳谱信号应在较低场,故δ 136.2为C-22;与之相反,C-17受氮原子的供电作用,电子云密度较高,所以δ 110.3为C-17;剩余δ 127.7的信号为C-23. δ 177.0,178.4为羰基碳信号,由于C-8为酰胺碳,C-15为羧基碳,C-15略在更低场,可初步判断δ 177.0为C-8,δ 178.4为C-15.此外,在化合物1的13C NMR谱中可以明显观察到δ 177.0处信号受三键磷碳耦合作用裂分为二重峰(3JC, P=7.7 Hz).同时,在磷酰胺另一侧对称的糖环C-2也出现了同样的裂分(3JC, P=3.1 Hz).因此,可以进一步确认δ 177.0为C-8.具体HSQC谱见图 3,13C NMR数据见表 1.

|
| 图 3 化合物1的HSQC谱 Fig. 3 HSQC spectrum of compound 1 |
31P NMR:根据磷谱中典型的磷酰胺结构(-5~+5)的化学位移范围,δ 4.06单峰为化合物1磷酰胺的信号.
综上分析,化合物1的结构确定为N-[(O-α-L-鼠李糖-1-)磷酰]-L-亮-L-色二肽二钠盐,其1H,13C和31P NMR等1D NMR波谱信号得到了全归属.
2.2 化合物2的结构指认1H NMR和1H-1H COSY:比较化合物2和化合物1的1H NMR数据(表 2),可以发现两种化合物在L-亮-L-色二肽片段信号基本一致,但是在糖基信号上存在明显差别.根据1H NMR和1H-1H COSY谱可以判断δ 5.00 (1H,dd,J1=2.6 Hz,J2=8.3 Hz),δ 3.88 (1H,dd,J1=J2=2.6 Hz),δ 3.59 (1H,dd,J1=2.6 Hz,J2=10.0 Hz),δ 3.53 (1H,dd,J1=J2=10.0 Hz),δ 3.41~3.45 (1H,m)分别是糖基上H-1,H-2,H-3,H-4,H-5.与化合物1相比,化合物2的H-2和H-4的位移变化不大,但是H-1,H-3,H-5的位移明显都向高场偏移,其中H-1和H-5差别较大.该结果说明磷酰胺结构处于平伏位置时,其对糖基上氢的吸电作用较弱,所以化合物2的H-1,H-3,H-5的电子云密度比化合物1中处于直立位置时高.具体1H-1H COSY谱见图 4.
| 碳原子序号 | δC | δH (J/Hz) | HSQC | 质子数 | 1H-1H COSY |
| 1 | 94.96 | 5.00 (dd, 2.6, 8.3) | + | 1 | H-2 |
| 2 | 71.50 | 3.88 (dd, 2.6, 2.6) | + | 1 | H-1, H-3 |
| 3 | 72.03 | 3.59 (dd, 2.6, 10.0) | + | 1 | H-2, H-4 |
| 4 | 72.59 | 3.53 (dd, 10.0, 10.0) | + | 1 | H-3, H-5 |
| 5 | 72.68 | 3.41~3.45 (m) | + | 1 | H-4, H-6 |
| 6 | 17.01 | 1.30 (d, 5.1) | + | 3 | H-5 |
| 7 | 54.82 | 3.45~3.53 (m) | + | 1 | H-11 |
| 8 | 176.9 | / | / | / | / |
| 9 | 55.84 | 4.56 (s) | + | 1 | H-10 |
| 10 | 27.86 | 3.18~3.24 (m), 3.41~3.45 (m) | + | 2 | H-9 |
| 11 | 43.35 | 1.00 (s), 1.20 (s) | + | 2 | H-7, H-12 |
| 12 | 23.94 | 1.54 (s) | + | 1 | H-11, H-13, H-14 |
| 13 | 21.54 | 0.79 (d, 5.7) | + | 3 | H-12 |
| 14 | 22.53 | 0.83 (d, 5.4) | + | 3 | H-12 |
| 15 | 178.5 | / | / | / | / |
| 16 | 124.5 | 7.25 (s) | + | 1 | / |
| 17 | 110.4 | / | / | / | / |
| 18 | 119.0 | 7.72 (d, 7.0) | + | 1 | H-19 |
| 19 | 119.3 | 7.19 (dd, 7.0, 7.0) | + | 1 | H-18, H-20 |
| 20 | 121.9 | 7.28 (dd, 7.6, 7.0) | + | 1 | H-19, H-21 |
| 21 | 111.9 | 7.52 (d, 7.6) | + | 1 | H-20 |
| 22 | 136.3 | / | / | / | / |
| 23 | 127.7 | / | / | / | / |

|
| 图 4 化合物2的1H-1H COSY谱 Fig. 4 1H-1H COSY spectrum of the compound 2 |
13C NMR和HSQC:与1H NMR数据类似,化合物2的13C NMR和化合物1的相比,二肽片段出现的信号基本一致,但是糖基碳有明显差别.根据HSQC谱可以指认δ 94.96,71.50,72.03,72.59,72.68分别为C-1,C-2,C-3,C-4,C-5.与化合物1相比,C-2和C-4出现的位置很类似,但是C-1,C-3,C-5的位置向高场偏移,与1H NMR中分析得到结果一致.化合物2的HSQC谱见图 5,NMR数据见表 2.
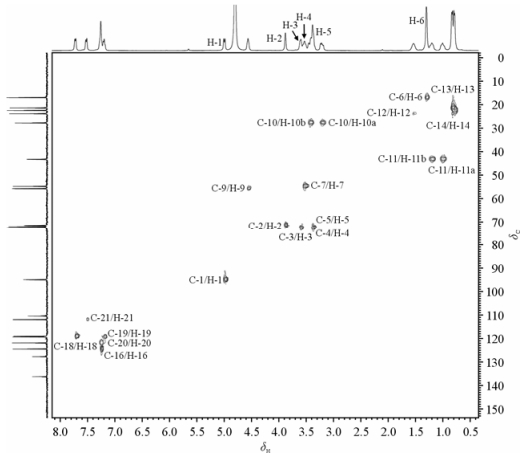
|
| 图 5 化合物2的HSQC谱 Fig. 5 HSQC spectrum of compound 2 |
31P NMR:根据磷谱中典型的磷酰胺结构(-5~+5)的化学位移范围,δ 4.90单峰为化合物2磷酰胺的信号,但与化合物1相比β-端位异构体2的磷谱化学位移明显偏向更低场.
综上分析,化合物2的结构确定为N-[(O-β-L-鼠李糖-1-)磷酰]-L-亮-L-色二肽二钠盐,其1H,13C和31P NMR等1D NMR波谱信号得到了全归属.
2.3 化合物1和2的端位构型研究对化合物1和2的1H NMR谱进行分析,计算得3JH-1, H-2都只有2 Hz左右,这是由于无论H-1处于直立键还是平伏键,H-1与H-2都是呈60°角.因此,以往文献报道[1, 6, 10, 11]中使用3JH-1, H-2判断糖基端位构型,确认化合物1的α构型不够精确.在糖化学研究中利用1JC-1, H-1的大小可以准确判断糖基端位构型(1JC-1, H-1=170 Hz为α构型,1JC-1, H-1=160 Hz则为β构型)[12-14].如图 6所示,根据非去偶碳谱计算得的化合物1的1JC-1, H-1=170 Hz,说明鼠李糖端位确为α构型.而化合物2的1JC-1, H-1=159 Hz,说明其鼠李糖端位是β构型,证明了上文中对化合物1和2糖基端位构型判断的正确性.此外,化合物1中糖基C-1受到了P的影响产生了明显裂分(2JC-1, P=4.0 Hz),而化合物2中糖基C-1由于端位构型的差异没有产生裂分(2JC-1, P=0 Hz).

|
| 图 6 化合物1和2的1JC-1, H-1 (a)和2JC-1, P (b) Fig. 6 1JC-1, H-1 (a) and 2JC-1, P (b) of compounds 1 and 2 |
此外,我们还采集了化合物1和2的NOESY谱,对两种化合物中原子的空间排布进行了研究.如图 7和8所示,化合物1的H-1只与H-2相关,而化合物2中的H-1同时与H-2,H-3,H-5相关. NOE相关信号说明化合物1中H-1处于平伏位置,与H-3和H-5处于糖环的异面,无空间相关;相反,化合物2中H-1为直立键,与H-3和H-5处于糖环同一侧,空间相近.该结果与通过1JC-1, H-1值判断化合物1和2的糖基端位构型的结果是相一致的,进一步确认了对化合物1和2端位构型判断的正确性.

|
| 图 7 化合物1的NOESY谱 Fig. 7 NOESY spectrum of compound 1 |
|
| 图 8 化合物2的NOESY谱 Fig. 8 NOESY spectrum of compound 2 |
通过对化合物1的NOESY谱进行分析,可以发现H-10与H-16和H-18都相关,故可以判断δ 7.67归属为H-18,根据1H-1H COSY可指认δ 7.17为H-19.同理,δ 7.48,7.22分别为H-21和H-20的信号,与上文中得到的指认结果完全相符.另外,化合物2 NOESY谱的分析结果与化合物1的结果非常类似.
3 结论本研究利用化学方法合成得到了高纯度的磷氨米酮及其β-端位异构体,并通过1D和2D NMR技术对两种化合物的1H,13C和31P NMR谱进行了全归属,为今后磷酰糖肽类化合物的结构确认提供了重要信息和参考.
| [1] | Umezawa S, Tatsuta K, Izawa O et al . A new microbial metabolite phosphoramidon(isolation and structure)[J]. Tetrahedron Lett , 1972, 1 : 97-100 |
| [2] | Weaver L H, Kester W R, Matthews B W . A crystallographic study of the complex of phosphoramidon with thermolysin. A model for the presumed catalytic transition state and for the binding of extended substrates[J]. J Mol Biol , 21977, 114 : 119-132 |
| [3] | Kitagishi K, Hiromi K . Binding between thermolysin and its specific inhibitor, phosphoramidon[J]. J Biochem , 1984, 95 : 529-534 |
| [4] | Kukkola P J, Savage P, Sakane Y J et al . Differential structure-activity relationships of phosphoramidon analogs for inhibition of 3 metalloproteases: Endothelin-converting enzyme, neutral endopeptidase, and angiotensin-converting enzyme[J]. Cardiovasc Pharmacol , 1995, 26 : S65-68 DOI:10.1097/00005344-199506263-00021 |
| [5] | Turner A J . Neuropeptides and Their Peptidases[M]. Chichester, Sussex: Ellis Horwood, 1987 : 183 -201. |
| [6] | De Nanteuil G, Benoist A, Remond G et al . Synthesis of the endothelin coverting enzyme inhihitor phosphoramidon[J]. Tetrahedron Lett , 1995, 36 : 1435-1438 DOI:10.1016/0040-4039(95)00024-7 |
| [7] | Sun Q, Yang Q, Gong S et al . Synthesis and enzymatic evaluation of phosphoramidon and its β anomer: Anomerzation of α-L-rhamnose triacetate upon phosphitylation[J]. Bioorg Med Chem , 2013, 21 : 6778-6787 DOI:10.1016/j.bmc.2013.07.052 |
| [8] | Kang Li-ping(康利平), Wang Yong-ze(王永泽), Feng Bing(冯冰) et al . An NMR study on two glucosylated steroidal saponins of Tb(皂苷Tb 2个糖基化产物的NMR研究)[J]. Chinese J Magn Reson(波谱学杂志) , 2012, 29 (1) : 101-111 |
| [9] | Yang Er-bing(杨二冰), Ma Li-bo(马利波), Wang Jin-hui(王金辉) et al . NMR signal assignment and solvent effects of N-substituted indoles(吲哚衍生物NMR数据归属及其溶剂研究)[J]. Chinese J Magn Reson(波谱学杂志) , 2013, 30 (2) : 256-263 |
| [10] | Sun Q, Xiao Q, Ju Y et al . Convenient and efficient synthesis of L-rhamnopyranosyl phosphoramidates via H-phosphonate[J]. Chinese Chem Lett , 2003, 14 : 685-688 |
| [11] | Donahue M G, Johnston J N . Preparation of a protected phosphoramidon precusor via an H-phosphonate coupling strategy[J]. Bioorg Med Chem Lett , 2006, 16 : 5602-5604 DOI:10.1016/j.bmcl.2006.08.024 |
| [12] | Duus J O, Gotfredsen C H, Bock K . Carbohydrate structural determination by NMR spectroscopy: modern methods and limitations[J]. Chem Rev , 2000, 100 : 4589-4614 DOI:10.1021/cr990302n |
| [13] | Uhrinova S, Uhrin D, Liptaj T et al . NMR of carbohydrates 1D homo nuclear selective methods[J]. Magn Reson Chem , 1991, 29 : 912-922 DOI:10.1002/(ISSN)1097-458X |
| [14] | Pedersen A T, Anderson O M, Aksnes D W et al . Anomeric sugar configuration of anthocyanin O-pyranosides determinded from heteronuclear one-bond coupling contants[J]. Phytochem Analysis , 1995, 6 : 313-316 DOI:10.1002/(ISSN)1099-1565 |
 2014, Vol. 31
2014, Vol. 31

