文章信息
- 陈璐, 宋侃, 王玉兰
- CHEN Lu, SONG Kan, WANG Yu-lan
- 感染减毒鼠伤寒沙门氏菌对小鼠粪样代谢组的影响--WIPM和Bruker 500 MHz核磁共振波谱仪检测结果的比较
- Effects of Attenuated Salmonella Typhimurium Infection on Fecal Metabonome in Mice--comparison between WIPM and Bruker 500 MHz NMR spectrometers
- 波谱学杂志, 2014, 31(3): 349-363
- Chinese Journal of Magnetic Resonance, 2014, 31(3): 349-363
-
文章历史
收稿日期: 2014-01-14
收修改稿日期: 2014-07-21


2. 长江航务管理局 疾病预防控制中心,湖北 武汉 430019;
3. 中国科学院大学,北京 100049
2. Center for Disease Prevention and Control of Changjiang River Administration of Navigational Affairs, Wuhan 430019, China;;
3. University of Chinese Academy of Sciences, Beijing 100049, China
鼠伤寒沙门氏菌(Salmonella typhimurium)是目前分离率极高的一种沙门氏菌(Salmonella)菌型,同时也是重要的人兽共患病原菌,其不仅能够引起人与畜禽的自限性肠炎,还可以导致小鼠出现人伤寒样的系统性感染以及人类的食物中毒等多种症状[1].有效疫苗的研制在沙门氏菌病的防控过程中扮演着极为重要的角色,越来越多的研究证明,减毒沙门氏菌活疫苗具有比亚单位疫苗或死疫苗更安全、更有效的免疫效果[2].所谓减毒沙门氏菌是指通过物理、化学或基因工程等手段,使沙门氏菌某些特定的基因发生不可逆的突变,进而使其毒性大大降低.减毒后的鼠伤寒沙门氏菌安全性大大提高,并在降低致病力的同时仍保持良好的侵袭力和免疫原性.减毒鼠伤寒沙门氏菌通过口服途径感染宿主后,能够产生持续且有效的细胞、体液以及局部黏膜免疫效应,目前已作为疫苗及DNA疫苗载体被广泛用于细菌[3, 4]、病毒[5, 6]及寄生虫[7-9]疫苗的研制.
近几十年来,随着鼠伤寒沙门氏菌基因组学、蛋白质组学和代谢组学等组学研究的开展,人类开始从分子水平对鼠伤寒沙门氏菌的多种特性进行研究.其中代谢组学出现的时间相对较晚,但它在短短十几年里的发展及其在系统生物学研究中的重要性却不可小觑.代谢组学能够揭示生物体最终确实已经发生了的变化,并协助研究者以下游代谢产物为出发点,进一步研究生命过程的本质及特性[10],其常用的检测方法有:NMR、色谱(高效液相色谱法,HPLC;气相色谱,GC)、质谱(MS)以及多种技术的联用[11].目前,多数研究都是以沙门氏菌培养基为对象进行的代谢组学研究,通过研究结果间接反映出菌体自身所发生的代谢变化[12].后来有研究者通过傅立叶变换离子回旋共振(DI-FT-ICR) MS来分析鼠伤寒沙门氏菌对小鼠肝脏和粪样代谢轮廓的影响,研究结果显示鼠伤寒沙门氏菌扰乱了宿主体内的多条代谢途径,其中激素类物质(类花生酸、类固醇等)发生的变化最为明显[13].然而,在这些工作中与NMR相关的报道极少,NMR检测技术仅被用于鼠伤寒沙门氏菌及其减毒菌株中某些特定物质(蛋白、酶类及脂质A等)的结构分析,迄今还没有研究利用NMR技术来分析减毒菌株感染对宿主代谢组产生的影响.
本研究的对象为减毒鼠伤寒沙门氏菌YS14510 (purI-,msbB-),其绝大部分特性与VNP20009 (purI-,msbB-,xylose-)这种常见减毒菌株相似,VNP20009的相关研究表明,该种减毒菌株具有极佳的安全性,并且在体内、外经过多次传代( > 140)仍能保持遗传性状的稳定性.此外,VNP20009在小鼠体内的清除率非常快,在感染后24 h便无法在尿液和粪便中检测到菌体的存在;在组织中则优先聚集在肝脏和脾脏当中,菌体数目随着时间的推移而明显减少,最终于3个月后被全部清除[14, 15].然而这些研究仅仅关注了减毒菌的使用安全性,却忽略了减毒鼠伤寒沙门氏菌在排出宿主体外以后,尤其是从粪便中排出后,其对宿主代谢应答产生的潜在效应.
基于NMR的代谢组研究能够充分利用NMR技术的无选择、无偏向、无损伤、灵活以及高通量等特性,对生物代谢物质进行定性定量分析[16].在全球的分析仪器生产商中,德国Bruker-Biospin公司一直占据着该领域的领先地位.为了将中国科学院武汉物理与数学研究所(WIPM)自主研发的NMR波谱仪与Bruker NMR波谱仪的检测性能进行比较,同时开展基于自主研发NMR波谱仪的代谢组学研究,本文同时使用WIPM和Bruker 500 MHz NMR波谱仪对同一批减毒鼠伤寒沙门氏菌感染小鼠的粪样进行检测,并结合多变量数据分析方法来研究减毒鼠伤寒沙门氏菌对小鼠粪样代谢组的影响,旨在为减毒鼠伤寒沙门氏菌的研究工作提供基础的粪样代谢组学信息,同时为WIPM NMR波谱仪的产业化提供可靠的科研依据.
1 实验部分 1.1 菌株及实验动物减毒鼠伤寒沙门氏菌YS14510由美国亚利桑那州立大学生命科学院施一燊教授惠赠.该菌株通过基因工程手段,敲除了野生型鼠伤寒沙门菌(ATCC 14028)的msbB和purI基因而获得.24只无特定病原体(Specific Pathogen Free,SPF)级6周龄雌性BALB/c小鼠(20±2 g),购于湖南斯莱克景达实验动物有限公司,实验动物合格证编号:HNASLKJ20120137.
1.2 化学试剂重水(D2O,99.9%氘代)购于美国Sigma-Aldrich贸易有限公司;胰蛋白胨、酵母提取物和琼脂粉购于英国OXOID公司,用于配制Luria-Bertani(LB)培养基;2, 2, 3, 3-氘代三甲基硅烷丙酸钠(TSP,98%氘代)购于美国Cambridge Isotope Laboratories公司;分析纯叠氮钠(NaN3)购于天津福晨化学试剂厂;分析纯氯化钠(NaCl)、氯化钾(KCl)、磷酸氢二钾(K2HPO4·3H2O)和磷酸二氢钠(NaH2PO4·2H2O)购于上海国药集团试剂有限公司.
1.3 实验方法 1.3.1 磷酸盐缓冲溶液(Phosphate Buffered Saline,PBS)的配制缓冲液A (K2HPO4/ NaH2PO4,0.01 mol/L,pH=7.4)由双蒸水(ddH2O)配制,其中含有0.8% NaCl (w/v)和0.02% KCl (w/v),经121 ℃高温高压灭菌20 min后4 ℃保存,用于菌悬液的制备.粪样提取使用的缓冲液B (K2HPO4/ NaH2PO4,0.1 mol/L,pH=7.4)由50% D2O配制,其中含有0.002% TSP (w/v)和0.1% NaN3 (w/v)分别作为化学位移内标物和防腐剂.
1.3.2 细菌的培养及菌悬液的制备取出-80 ℃冻存的YS14510菌株,在室温下融解后,接种1-2环菌液于LB平板上连续划线培养.37 ℃活化培养24 h后,挑取单菌落转接于5 mL LB液体培养基中,37 ℃振荡培养过夜,次日分别取200 μL培养液接种于两块LB平板,涂布均匀后在37 ℃下培养.24 h后刮取菌落(不可刮入培养基),混悬于PBS中制备成YS14510菌悬液,并将菌悬液浓度调至1×109菌落形成单位(Colony-Forming Units,CFU)/mL.
1.3.3 动物实验方案及样品的收集适应性饲养2周后,将24只SPF级BALB/c小鼠随机分为减毒鼠伤寒沙门氏菌组和对照组,每组各12只.减毒鼠伤寒沙门氏菌组每只小鼠灌服YS14510菌悬液0.3 mL (1×109 CFU/ mL),每隔2周一次,连续3次.对照组以0.3 mL无菌PBS代替,每隔2周灌服一次,连续3次.所有动物行灌胃处理前禁食禁水4 h,末次灌喂2周后收集所有小鼠粪样.粪样一经收集立即以液氮速冻,然后置于-80 ℃保存待NMR检测.
1.3.4 粪样的提取及制备称取50 mg左右小鼠粪样置于2 mL离心管中,加入0.5 mL粪样提取缓冲液B,液氮反复冻融3次(于25℃水浴中解冻,解冻完成后涡旋混匀),再用组织研磨仪(Tissuelyser,QIAGEN,德国)进行匀浆(20 Hz,90 s),然后对匀浆液进行离心(10 000 g, 4 ℃, 10 min)取上清.对剩余沉淀用相同方法再重提2次,最后将3次上清液混合后再离心(16 000 g, 4 ℃, 10 min),取上清550 μL转移至5 mm NMR样品管中待NMR检测[17].
1.3.5 样品的NMR检测本实验同时应用WIPM-I 500型NMR波谱仪(中国科学院武汉物理与数学研究所自主研发,质子共振频率为499.77 MHz)和Bruker AVII 500型NMR波谱仪(德国Bruker-Biospin公司,质子共振频率为500.13 MHz)对同一批小鼠粪样采集1H NMR谱图,实验温度为298 K.1D 1H NMR实验所用的脉冲序列为Noesygppr1d [RD-G1-90°-t1-90°-tm-G2-90°-ACQ],具体的采样参数设置如下:循环等待时间(RD)为2 s,混合时间(tm)为100 ms,脉冲延迟时间(t1)为4 μs,谱宽为10 000 Hz,采样时间为1.64 s,采样点数为32 k,累加次数为64.
为了进一步对1D谱中的信号进行归属,还需要选取具有代表性的样品采集一系列的2D NMR谱,即1H-1H COSY,1H-1H TOCSY,1H-1H J-RES,1H-13C HSQC和1H-13C HMBC五种谱图.所有2D NMR实验在Bruker AVIII 600型NMR波谱仪上进行,该谱仪配有TXI超低温探头,其质子共振频率为600.13 MHz.1H-1H J-RES的F2(1H)维的谱宽为6 313.13 Hz,采样数据点阵t2×t1=4 096×64;在1H-1H COSY与1H-1H TOCSY实验中F2 (1H)和F1 (1H)维的谱宽均为6 313.13 Hz,采样数据点阵t2×t1=2 048×128;1H-13C HSQC的F2 (1H)和F1 (13C)维的谱宽分别为6 313.13 Hz和26 409.97 Hz,采样数据点阵t2×t1=2 048×90;1H-13C HMBC的F2 (1H)和F1 (13C)维的谱宽分别为6 313.13 Hz和33 201.94 Hz,采样数据点阵t2×t1=2 048×100.
1.3.6 NMR谱图处理及多变量数据分析WIPM 500型NMR波谱仪上采集到的1D 1H NMR谱图通过SpinStudio软件(中国科学院物理与数学研究所自主研发)进行处理,Bruker 500型NMR波谱仪上采得的1D谱图则通过Topspin3.0软件(德国Bruker-Biospin公司研发)进行处理:所有自由感应衰减信号(FID)均乘以增宽因子为1 Hz的指数窗函数,经傅立叶变换(FT)后对谱图进行手动相位和基线的校正,然后用内标TSP的单峰定标(δ0.00).再使用AMIX软件(V3.9.5,德国Bruker-Biospin公司)对1H NMR谱在δ0.50~9.00的区域进行分段积分,积分区间宽为0.004.为了消除残余水峰信号的影响,去除NMR谱中的δ4.50~4.92(水信号)区间.
对积分后的数据进行总面积归一化处理,然后导入SIMCA-P+软件包(12.0,瑞典Umetrics公司)进行多变量分析.首先主成分分析(PCA)采用中心化处理(Ctr)的标准化处理方式,得到样品整体的分布趋势,同时可以观察到组内有无异常点,分析结果用得分图(Scores plots)来表示[18].然后使用偏最小二乘法判别分析(PLS-DA)发现NMR数据(X变量)和分组变量(Y变量)之间的相关关系,用舍一法对模型的质量进行交叉验证(Cross-validation,CV),得到R2X(代表模型可解释的变量)和Q2(代表模型的可预测度),然后通过排列实验(Permutation test)和CV-ANOVA[19]验证模型的有效度.最后以正交偏最小二乘法判别分析(OPLS-DA)最大化地凸显组别之间的差异,并利用MATLAB 7.1软件(美国Mathworks公司)结合研究组自编程序作出相关系数负载图(Coefficient Plot),结果显示为灰度图,即用黑白渐进色来表征代谢物对组间区分的贡献大小.根据两组中较小的样本数,查阅皮尔森相关系数(Pearson Correlation Coefficient)临界值表,得到相应的阈值rcutoff.当某一代谢物信号的相关系数绝对值|r|≥rcutoff时,则认为该代谢物的变化对模型的区分有意义,颜色越黑,代表|r|越大,其对组间区分上的贡献也越大[20].
2 结果与讨论 2.1 小鼠粪样提取物的1H NMR谱图分析图 1是在Bruker和WIPM 500 MHz NMR波谱仪上采集的具有代表性的减毒鼠伤寒沙门氏菌组和对照组小鼠粪样提取物的1H noesygppr1d NMR谱图,从1D NMR谱图中可以获取样品中不同物质的化学位移、偶合常数、裂分情况以及谱峰面积比例等相关信息,其中根据化学位移可以初步判断质子所处的化学基团种类.同时,依据一系列2D NMR实验和相关文献[21],并结合各种公共数据库对样品中的代谢物质进行谱峰的归属和物质的确认,详细的归属信息见表 1.
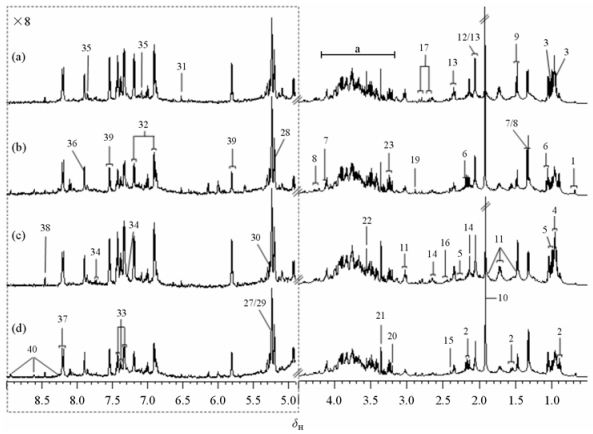
|
| 图 1 有代表性的小鼠粪样提取物的1H NMR谱图.其中相对于δ0.50~4.50区间,δ4.92~9.00区间纵向放大了8倍.(a)减毒鼠伤寒沙门氏菌组-Bruker;(b)对照组-Bruker;(c)减毒鼠伤寒沙门氏菌组-WIPM;(d)对照组-WIPM a:糖类和氨基酸αCH的共振信号.代谢物信号的归属编号详见表 1 Fig. 1 Typical 1H NMR spectra for the fecal extracts. The region of δ4.92~9.00 in the spectra was vertically expanded 8 times compared with the region of δ0.50~4.50. (a) Attenuated Salmonella typhimurium-Bruker, (b) Control-Bruker, (c) Attenuated Salmonella typhimurium-WIPM, (d) Control-WIPM a: saccharides and amino acids αCH resonances. Metabolites keys are shown in Table 1 |
| No. | Metabolites | Moieties | dH and multiplicity | dC |
| 1 | bile acids | CH3 | 0.68(bs) | 14.32 |
| CH3 | 0.70(bs) | 14.40 | ||
| CH3 | 0.73(bs) | # | ||
| 2 | n-butyrate | γCH3 | 0.90(t) | 16.10 |
| βCH2 | 1.56(m) | 22.25 | ||
| αCH2 | 2.16(t) | 42.39 | ||
| 3 | isoleucine | δCH3 | 0.94(t) | 13.97 |
| γ'CH3 | 1.01(d) | 17.57 | ||
| Half γCH2 | 1.27(m) | 27.26 | ||
| Half γCH2 | 1.47(m) | 27.26 | ||
| βCH | 1.98(m) | 38.65 | ||
| αCH | 3.68(d) | 62.48 | ||
| 4 | leucine | δCH3 | 0.96(d) | 23.62 |
| δ'CH3 | 0.97(d) | 24.74 | ||
| βCH2 | 1.69(m) | 42.62 | ||
| γCH | 1.73(m) | 29.27 | ||
| αCH | 3.74(t) | 56.46 | ||
| 5 | valine | γCH3 | 0.99(d) | 19.47 |
| γ'CH3 | 1.05(d) | 20.80 | ||
| βCH | 2.28(m) | 31.97 | ||
| αCH | 3.62(d) | 63.36 | ||
| 6 | propionate | βCH3 | 1.06(t) | 13.08 |
| αCH2 | 2.19(q) | 33.06 | ||
| 7 | lactate | βCH3 | 1.33(d) | 22.34 |
| αCH | 4.12(q) | 72.04 | ||
| 8 | threonine | γCH3 | 1.33(d) | 22.34 |
| αCH | 3.59(d) | 63.38 | ||
| βCH | 4.26(m) | 68.91 | ||
| 9 | alanine | βCH3 | 1.48(d) | 19.07 |
| αCH | 3.79(q) | 53.07 | ||
| 10 | acetate | CH3 | 1.92(s) | 26.14 |
| 11 | lysine | γCH2 | 1.48(m) | 24.29 |
| δCH2 | 1.73(m) | 29.31 | ||
| βCH2 | 1.92(m) | 32.79 | ||
| εCH2 | 3.03(t) | 41.98 | ||
| αCH | 3.77(t) | 57.05 | ||
| 12 | N-acetyl-glycoprotein | CH3 | 2.04~2.07(s) | 24.97 |
| 13 | glutamate | βCH2 | 2.06(m) | 29.89 |
| γCH2 | 2.35(m) | 36.31 | ||
| αCH | 3.76(m) | 57.01 | ||
| 14 | methionine | δCH3 | 2.14(s) | 16.83 |
| βCH2 | 2.17(m) | 33.08 | ||
| γCH2 | 2.65(t) | 31.68 | ||
| αCH | 3.87(t) | 56.76 | ||
| 15 | succinate | CH2 | 2.41(s) | 36.96 |
| 16 | glutamine | βCH2 | 2.14(m) | 29.29 |
| γCH2 | 2.46(m) | 33.69 | ||
| αCH | 3.78(m) | 56.78 | ||
| 17 | aspartate | half βCH2 | 2.68(dd) | 39.45 |
| half βCH2 | 2.82(dd) | 39.45 | ||
| αCH | 3.90(m) | 55.08 | ||
| 18 | asparagine | half βCH2 | 2.87(dd) | 37.53 |
| half βCH2 | 2.96(dd) | 37.53 | ||
| αCH | 4.00(m) | 53.85 | ||
| 19 | trimethylamine(TMA) | CH3 | 2.89(s) | 47.24 |
| 20 | choline | N(CH3)3 | 3.21(s) | 56.72 |
| 21 | methanol | CH3 | 3.36(s) | 51.91 |
| 22 | glycine | CH2 | 3.56(s) | 44.37 |
| 23 | β-glucose | 2-CH | 3.25(t) | 77.06 |
| 4-CH | 3.41(dd) | 72.47 | ||
| 5-CH | 3.47(m) | 78.72 | ||
| 3-CH | 3.50(t) | 78.60 | ||
| half 6-CH2 | 3.75(dd) | 63.75 | ||
| half 6-CH2 | 3.90(dd) | 63.57 | ||
| 1-CH | 4.65(d) | 98.72 | ||
| 24 | β-arabinose | 2-CH | 3.51(dd) | 74.47 |
| 1-CH | 4.52(d) | 99.67 | ||
| 25 | β-xylose | 2-CH | 3.23(dd) | # |
| 1-CH | 4.57(d) | 99.22 | ||
| 26 | β-galactose | 2-CH | 3.49(dd) | # |
| 1-CH | 4.59(d) | 99.35 | ||
| 27 | α-glucose | 4-CH | 3.41(dd) | 72.53 |
| 2-CH | 3.54(dd) | 74.44 | ||
| 3-CH | 3.72(t) | 75.59 | ||
| half 6-CH2 | 3.78(dd) | 63.81 | ||
| half 6-CH2 | 3.84(dd) | 63.81 | ||
| 5-CH | 3.85(m) | 74.37 | ||
| 1-CH | 5.24(d) | 94.92 | ||
| 28 | α-xylose | 2-CH | 3.53(dd) | 75.19 |
| 1-CH | 5.20(d) | 94.91 | ||
| 29 | α-arabinose | 2-CH | 3.85(dd) | 74.75 |
| 1-CH | 5.25(d) | 94.93 | ||
| 30 | α-galactose | 2-CH | 3.81(dd) | 72.61 |
| 1-CH | 5.27(d) | 95.05 | ||
| 31 | fumarate | CH | 6.52(s) | 138.1 |
| 32 | tyrosine | 3, 5-CH | 6.90(d) | 118.6 |
| 2, 6-CH | 7.19(d) | 133.6 | ||
| 33 | phenylalanine | 2, 6-CH | 7.33(dd) | 132.1 |
| 4-CH | 7.38(m) | 130.7 | ||
| 3, 5-CH | 7.43(t) | 131.9 | ||
| 34 | tryptophan | 5-CH | 7.21(t) | 122.4 |
| 6-CH | 7.28(t) | 124.7 | ||
| 7-CH | 7.54(d) | 114.8 | ||
| 4-CH | 7.74(d) | 121.2 | ||
| 35 | histidine | 4-CH | 7.10(s) | 119.9 |
| 2-CH | 7. 90(s) | 138.9 | ||
| 36 | xanthine | CH | 7.90(s) | 143.7 |
| 37 | hypoxanthine | 2-CH | 8.20(s) | 148.4 |
| 8-CH | 8.22(s) | 144.6 | ||
| 38 | formate | CH | 8.46(s) | 174.2 |
| 39 | uracil | CH | 5.81(d) | 103.8 |
| CH | 7.54(d) | 146.5 | ||
| 40 | nicotinate | 5-CH | 7.53(ddd) | 126.8 |
| 4-CH | 8.26(dd) | 140.4 | ||
| 6-CH | 8.62(dd) | 153.0 | ||
| 2-CH | 8.95(d) | 151.7 | ||
| *:谱峰的裂分模式:s,单峰;bs,宽单峰;d,双峰;t,三重峰;q,四重峰;m,多重峰;dd,二重双峰;ddd,三重双峰.#.未观测到13C的化学位移 *: Multiplicity for 1H resonances: s, singlet; bs, broad singlet; d, doublet; t, triplet; q, quartet; m, multiplet; dd, doublet of doublets; ddd, doublet of doublets of doublets. #:Signals were not determined | ||||
从图 1中观察到Bruker和WIPM 500 MHz NMR波谱仪上采集的1D 1H NMR谱图相似度极高,二者检测出的代谢物及峰强度大小均非常吻合.从谱图中得到小鼠粪便提取物中主要由氨基酸(异亮氨酸、亮氨酸、缬氨酸、苏氨酸、丙氨酸、赖氨酸、谷氨酸、蛋氨酸、谷氨酰胺、天冬氨酸、天冬酰胺、甘氨酸、酪氨酸、苯丙氨酸、色氨酸、组氨酸等)、短链脂肪酸(甲酸、乙酸、丙酸、正丁酸等)、糖类(葡萄糖、阿拉伯糖、木糖、半乳糖等)、核苷酸(如:黄嘌呤、次黄嘌呤、尿嘧啶等)以及胆汁酸等代谢物组成.由肉眼观察上述谱图可见减毒鼠伤寒沙门氏菌组和对照组小鼠粪样提取物的代谢物组成存在一定的差异,如:减毒鼠伤寒沙门氏菌组小鼠粪便中异亮氨酸、亮氨酸、缬氨酸以及苯丙氨酸等氨基酸类物质含量相对较多,而对照组中含有较高水平的乳酸.
然而肉眼观察谱图获取的信息十分有限,为了获取更多关于减毒鼠伤寒沙门氏菌引发小鼠粪样代谢物质变化的信息,本文进一步采用了多变量数据分析方法对NMR数据进行深入的分析.
2.2 粪样提取物1H NMR谱图的多变量分析为了观察动物模型中样本的聚类情况以及是否存在离群点,本研究先分别对在Bruker和WIPM 500 MHz NMR波谱仪上采集的小鼠粪样提取物的NMR数据进行PCA分析.二者的PCA得分图[图 2(a)和图 2(d)]中均显示对照组和减毒鼠伤寒沙门氏菌组小鼠粪样提取物的代谢物组成存在较明显的分离趋势.其中发现减毒鼠伤寒沙门氏菌组粪样提取物中有一个样品(编号:b9)为明显的离群点,通过观察原始谱图发现其所有代谢物的含量均明显高于同组其它样品,考虑为严重的个体差异所致,为了更准确地对数据进行解释,后续的数据分析过程中将该样品去除.

|
| 图 2 对照组(■)和减毒鼠伤寒沙门氏菌组(*)小鼠粪样提取物1H NMR谱图的PCA得分图、PLS-DA得分图及PLS-DA模型的排列实验结果.(a) PCA得分图-Bruker;(b) PLS-DA得分图-Bruker;(c)排列实验-Bruker;(d) PCA得分图-WIPM;(e) PLS-DA得分图-WIPM;(f)排列实验-WIPM Fig. 2 PCA scores plots, PLS-DA scores plots and permutation test for control mice (■) and attenuated Salmonella typhimurium infected mice (*) derived from the 1H NMR spectra of fecal extracts. (a) PCA scores plots-Bruker, (b) PLS-DA scores plots-Bruker, (c) permutation test-Bruker, (d) PCA scores plots-WIPM, (e) PLS-DA scores plots-WIPM, (f) permutation test-WIPM |
在PCA的基础上,接着进行PLS-DA分析,Bruker和WIPM NMR数据的PLS-DA模型验证的排列实验结果如图 2(c)和图 2(f)所示,实验结果均表明,减毒鼠伤寒沙门氏菌组和对照组建立的粪样提取物的数据模型成立,即两组小鼠在粪样提取物中的代谢物存在显著的差异.
进一步对以上数据做OPLS-DA分析,并绘制OPLS-DA模型对应的相关系数负载图,从图 3中可以发现Bruker和WIPM NMR波谱仪所测数据的OPLS-DA分析结果高度相似.该两个OPLS-DA模型均具有较高的模型质量参数(R2X和Q2,见表 2),并且通过CV-ANOVA分析所得的p值均小于0.05(图 3),同时也验证了排列实验的结果.在小鼠粪样OPLS-DA模型中,相关系数|r|的阈值为0.576 (n=11,p≤0.05),其对应相关系数负载图(图 3,右)上标出了对两组间区分有显著性贡献的代谢物,其中颜色越黑的物质对组间区分的贡献越大,这些代谢物对应的相关系数值列在了表 2中.

|
| 图 3 对照组(■)和减毒鼠伤寒沙门氏菌组(*)小鼠粪样提取物NMR谱图OPLS-DA模型的得分图(左)和相关系数负载图(右).(a) Bruker (p=9.93×10-5),(b) WIPM (p=4.50×10-5).代谢物信号的归属编号详见表 2 Fig. 3 Cross-validated OPLS-DA scores plots (left) and coefficient plots (right) derived from 1H NMR spectra of fecal extracts indicating the discrimination between control mice (■) and attenuated Salmonella typhimurium infected mice (*). These models were evaluated with CV-ANOVA for (a) Bruker (p=9.93×10-5), (b) WIPM (p=4.50×10-5) |
| Metabolites (No.) | Bruker 500 MHz | WIPM 500 MHz |
| R2X=0.238 Q2=0.713 | R2X=0.251 Q2=0.738 | |
| |r|≥0.576 | |r|≥0.576 | |
| bile acids (1) | −0.808 | −0.767 |
| Isoleucine (3) | +0.804 | +0.775 |
| leucine (4) | +0.788 | +0.781 |
| valine (5) | +0.818 | +0.803 |
| propionate (6) | −0.715 | −0.672 |
| lactate (7) | −0.755 | −0.808 |
| lysine (11) | +0.774 | +0.749 |
| glutamate (13) | +0.719 | +0.753 |
| methionine (14) | +0.767 | +0.819 |
| glycine (22) | +0.787 | +0.708 |
| tyrosine (32) | +0.791 | +0.847 |
| phenylalanine (33) | +0.845 | +0.889 |
| uracil (39) | +0.726 | +0.749 |
| †: +和−分别表示与对照组相比减毒鼠伤寒沙门氏菌组代谢物相对含量的增加和减少 †: The + and−signs indicate metabolite concentration increase and decrease respectively for attenuated Salmonella typhimurium infected mice compared with control mice | ||
由图 3和表 2可见,与对照组相比,减毒鼠伤寒沙门氏菌组小鼠粪样提取物中多种氨基酸(异亮氨酸、亮氨酸、缬氨酸、赖氨酸、谷氨酸、蛋氨酸、甘氨酸、酪氨酸、苯丙氨酸)和尿嘧啶的含量显著增加,并伴有胆汁酸、乳酸和丙酸含量的下降.
众所周知,小肠是食物消化和营养物质(如:氨基酸)吸收的主要场所,而肠道的消化和吸收能力又受到寄生其中的微生物的很大影响[22].已有研究报道在炎症性肠病病人的粪便样品中氨基酸水平显著上升,是由于肠道的炎症导致其对氨基酸的吸收能力降低[23].由此推测,本实验中减毒鼠伤寒沙门氏菌组小鼠粪样氨基酸代谢物含量的上升,可能是因为小鼠感染减毒伤寒沙门氏菌后,引起了体内的炎症反应使其肠道微生物发生紊乱,最终导致小肠的吸收不良,并伴随粪样中氨基酸含量的升高.此外,本研究还观察到粪样中尿嘧啶含量增加,提示感染减毒鼠伤寒沙门氏菌所造成的早期炎症反应可能会导致小鼠组织细胞对DNA和RNA生物合成所需的嘧啶核苷酸需求增加,并使得与尿嘧啶降解速度密切相关的二氢嘧啶脱氢酶(DPD)活性下调[24],最终导致尿嘧啶分解速率减慢.
在正常生理状态下,90%的胆汁酸在肠道中通过肝肠循环被重吸收,而肠道菌群在胆汁酸的代谢过程中扮演着重要的角色,因此胆汁酸含量的变化同样也可以反应宿主-肠道微生物的相互作用[25].实验结果发现减毒鼠伤寒沙门氏菌组动物的粪样中胆汁酸含量显著下降,这表明减毒鼠伤寒沙门氏菌感染可能使肠道微生物代谢功能发生了紊乱,从而影响了胆汁酸的正常代谢.
短链脂肪酸(SCFAs)主要是由食物中半纤维素和抗性淀粉(Resistant starch)经肠道厌氧菌发酵生成的产物.它们不仅是动物体内的主要能量来源之一,还可以维护肠道上皮细胞的完整性,对粘膜免疫细胞有维护作用,并保护肠道不受炎症的侵害[26].哺乳动物由于缺乏相应的酶类,所以必须依赖肠道菌群来参与代谢食物中这类不消化的碳水化合物[27].前人还发现肠道菌群可将乳酸转化为短链脂肪酸,这也是盲肠内容物中短链脂肪酸的来源之一[28].本研究中观察到减毒鼠伤寒沙门氏菌组小鼠粪样中乳酸和丙酸含量显著降低,代表在减毒鼠伤寒沙门氏菌感染后,小鼠肠道微生物对糖类物质的发酵功能受到了影响,进而使相应发酵产物--短链脂肪酸的含量降低.
由此可见,减毒鼠伤寒沙门氏菌能够引起宿主肠道菌群的代谢紊乱,本研究通过对小鼠粪样代谢组的研究能够更直观地得到宿主和菌群本身的代谢信息以及二者相互作用的共代谢信息.但是,粪样代谢组研究作为代谢组学研究中的一部分,其所能提供的代谢信息仍相对有限,未来还可以进一步开展减毒鼠伤寒沙门氏菌感染对小鼠不同脏器及各种体液代谢组的影响等方面的研究,以获取更多与减毒鼠伤寒沙门氏菌感染相关的宿主代谢信息.
3 结论本研究同时使用WIPM和Bruker 500 MHz NMR波谱仪对同一批减毒鼠伤寒沙门氏菌感染小鼠的粪样进行检测,多变量数据分析结果均发现减毒鼠伤寒沙门氏菌感染能够引起小鼠粪样代谢物中多种氨基酸和尿嘧啶含量的上升以及胆汁酸、乳酸和丙酸含量的下降.这些变化的物质均说明减毒鼠伤寒沙门氏菌感染对小鼠宿主和肠道微生物的共代谢产生了一定的影响.以上研究为减毒鼠伤寒沙门氏菌的研究工作补充了基础的粪样代谢组信息.此外,本文首次开展了基于自主研发NMR波谱仪的代谢组学研究,该研究结果与利用极具权威的Bruker NMR波谱仪检测所得到的结果高度一致.这点在某种程度上表明,WIPM NMR波谱仪不仅能够满足科研人员对生物样品的NMR检测需求,同时还能够确保检测数据在后续分析中的准确可信.该部分工作为基于自主研发NMR波谱仪的代谢组学技术相关应用的开发奠定了基础,同时也为WIPM NMR波谱仪的产业化提供可靠的科研依据.
致谢: 感谢美国亚利桑那州立大学施一燊教授和武汉大学郭林教授对本实验所用减毒鼠伤寒沙门氏菌菌株的惠赠,同时感谢科技部谱仪项目(2011YQ12003503)的支持.| [1] | Everest P, Ketley J, Hardy S et al . Evaluation of salmonella typhimurium mutants in a model of experimental gastroenteritis[J]. Infect Immun , 1999, 67 (6) : 2815-2821 |
| [2] | Hur J, Lee J H . Immune responses to new vaccine candidates constructed by a live attenuated salmonella typhimurium delivery system expressing escherichia coli f4, f5, f6, f41 and intimin adhesin antigens in a murine model[J]. J Vet Med Sci , 2011, 73 (10) : 1265-1273 DOI:10.1292/jvms.11-0087 |
| [3] | Xin W, Li Y, Mo H et al . Pspa family fusion proteins delivered by attenuated salmonella enterica serovar typhimurium extend and enhance protection against streptococcus pneumoniae[J]. Infect Immun , 2009, 77 (10) : 4518-4528 DOI:10.1128/IAI.00486-09 |
| [4] | Yang X L, Liu W C, Yang W W et al . Oral immunization of mice with vaccine of attenuated salmonella typhimurium expressing helicobacter pylori urease b subunit[J]. Biomed Environ Sci , 2005, 18 (6) : 411-418 |
| [5] | Rahman M M, Uyangaa E, Han Y W et al . Oral administration of live attenuated salmonella enterica serovar typhimurium expressing chicken interferon-alpha alleviates clinical signs caused by respiratory infection with avian influenza virus h9n2[J]. Vet Microbiol , 2011, 154 (1-2) : 140-151 DOI:10.1016/j.vetmic.2011.06.034 |
| [6] | Cheng Ming(程明), He Jin-sheng(何金生), Fu Yuan-hui(付远辉) et al . Antibody responses induced by mucosal DNA vaccine encoding the codon-optimized F protein of human respiratory syncytial virus (RSV) delivered with attenuated salmonella typhimurium(以减毒鼠伤寒沙门菌为载体的人呼吸道合胞病毒F蛋白DNA疫苗滴鼻免疫抗体分析)[J]. Acta Microbiologica Sinica(微生物学报) , 2011, 51 (7) : 965-971 |
| [7] | Chen G, Dai Y, Chen J et al . Oral delivery of the sj23lhd-gst antigen by salmonella typhimurium type iii secretion system protects against schistosoma japonicum infection in mice[J]. PLoS Negl Trop Dis , 2011, 5 (9) : e1313 DOI:10.1371/journal.pntd.0001313 |
| [8] | Yang Y, Zhang Z, Yang J et al . Oral vaccination with ts87 DNA vaccine delivered by attenuated salmonella typhimurium elicits a protective immune response against trichinella spiralis larval challenge[J]. Vaccine , 2010, 28 (15) : 2735-2742 DOI:10.1016/j.vaccine.2010.01.026 |
| [9] | Qu D, Yu H, Wang S et al . Induction of protective immunity by multiantigenic DNA vaccine delivered in attenuated salmonella typhimurium against toxoplasma gondii infection in mice[J]. Vet Parasitol , 2009, 166 (3-4) : 220-227 DOI:10.1016/j.vetpar.2009.08.016 |
| [10] | Tang H, Wang Y . Metabonomics:A revolution in progress[J]. Prog Biochem Biophys , 2006, 33 (5) : 401-417 |
| [11] | Chen Lu(陈璐), Wang Yu-lan(王玉兰) . Metabolite composition of planarian analyzed by nuclear magnetic resonance spectroscopy(涡虫代谢物组成的核磁共振分析)[J]. Chinese J Magn Reson(波谱学杂志) , 2013, 30 (4) : 516-527 |
| [12] | Cevallos-Cevallos J M, Danyluk M D, Reyes-De-Corcuera J I . Gc-ms based metabolomics for rapid simultaneous detection of escherichia coli o157:H7, salmonella typhimurium, salmonella muenchen, and salmonella hartford in ground beef and chicken[J]. J Food Sci , 2011, 76 (4) : M238-M246 DOI:10.1111/jfds.2011.76.issue-4 |
| [13] | Antunes L C M, Arena E T, Menendez A et al . Impact of salmonella infection on host hormone metabolism revealed by metabolomics[J]. Infect Immun , 2011, 79 (4) : 1759-1769 DOI:10.1128/IAI.01373-10 |
| [14] | Clairmont C, Lee K C, Pike J et al . Biodistribution and genetic stability of the novel antitumor agent vnp20009, a genetically modified strain of salmonella typhimurium[J]. J Infect Dis , 2000, 181 (6) : 1996-2002 DOI:10.1086/jid.2000.181.issue-6 |
| [15] | Clairmont C, Bermudes D, Ittensohn M et al . Genetically modified salmonella typhimurium, vnp20009, a novel anticancer agent: Bio-distribution, genetic stability, selective tumor accumulation, and antitumor efficacy[J]. Cancer Gene Ther , 1999, 6 (6) : S11-S12 |
| [16] | Nicholson J K, Connelly J, Lindon J C et al . Metabonomics: A platform for studying drug toxicity and gene function[J]. Nat Rev Drug Discov , 2002, 1 (2) : 153-161 DOI:10.1038/nrd728 |
| [17] | Tian Yuan(田园), Tang Hui-ru(唐惠儒) . Identification and structural determination of saccharides in rat feces(大鼠粪样中几种糖类物质的结构确定)[J]. Chinese J Magn Reson(波谱学杂志) , 2012, 29 (3) : 361-371 |
| [18] | Jolliffe I. Principal Component Analysis[M]. Wiley Online Library: 2005. |
| [19] | Eriksson L, Trygg J, Wold S . CV-ANOVA for significance testing of pls and opls® models[J]. J Chemometr , 2008, 22 (11-12) : 594-600 DOI:10.1002/cem.v22:11/12 |
| [20] | Jiang L, Huang J, Wang Y et al . Metabonomic analysis reveals the ccl4-induced systems alterations for multiple rat organs[J]. J Proteome Res , 2012, 11 (7) : 3848-3859 DOI:10.1021/pr3003529 |
| [21] | Fan T W M, Lane A N . Structure-based profiling of metabolites and isotopomers by NMR[J]. Prog Nucl Mag Res Sp , 2008, 52 (2-3) : 69-117 DOI:10.1016/j.pnmrs.2007.03.002 |
| [22] | Wang Y, Tang H, Holmes E et al . Biochemical characterization of rat intestine development using high-resolution magic-angle-spinning 1h nmr spectroscopy and multivariate data analysis[J]. J Proteome Res , 2005, 4 (4) : 1324-1329 DOI:10.1021/pr050032r |
| [23] | Marchesi J R, Holmes E, Khan F et al . Rapid and noninvasive metabonomic characterization of inflammatory bowel disease[J]. J Proteome Res , 2007, 6 (2) : 546-551 DOI:10.1021/pr060470d |
| [24] | Johnston S J, Ridge S A, Cassidy J et al . Regulation of dihydropyrimidine dehydrogenase in colorectal cancer[J]. Clin Cancer Res , 1999, 5 (9) : 2566-2570 |
| [25] | Jones B V, Begley M, Hill C et al . Functional and comparative metagenomic analysis of bile salt hydrolase activity in the human gut microbiome[J]. Proc Natl Acad Sci USA , 2008, 105 (36) : 13580-13585 DOI:10.1073/pnas.0804437105 |
| [26] | Grubb B R . Avian cecum: Role of glucose and volatile fatty acids in transepithelial ion transport[J]. Am J Physiol-Gastr L , 1991, 260 (5) : G703-G710 |
| [27] | Gill S R, Pop M, DeBoy R T et al . Metagenomic analysis of the human distal gut microbiome[J]. Science , 2006, 312 (5778) : 1355-1359 DOI:10.1126/science.1124234 |
| [28] | Bourriaud C, Robins R, Martin L et al . Lactate is mainly fermented to butyrate by human intestinal microfloras but inter-individual variation is evident[J]. J Appl Microbiol , 2005, 99 (1) : 201-212 DOI:10.1111/jam.2005.99.issue-1 |
 2014, Vol. 31
2014, Vol. 31



