文章信息
- 李博解, 徐君, 王强, 王秀梅, 齐国栋, 邓风
- LI Bo-jie, XU Jun, WANG Qiang, WANG Xiu-mei, QI Guo-dong, DENG Feng
- 铜丝光沸石上甲醇羰基化反应的固体核磁共振研究
- Carbonylation of Methanol on Cu-H-MOR Zeolites: Insights from Solid-State NMR Spectroscopy
- 波谱学杂志, 2014, 31(3): 331-340
- Chinese Journal of Magnetic Resonance, 2014, 31(3): 331-340
-
文章历史
收稿日期: 2013-11-28
收修改稿日期: 2014-07-17


乙酸甲酯(CH3COOCH3)是一种重要的工业生产原料.主要应用在树脂、涂料、油墨、油漆、胶粘剂、皮革生产过程所需的有机溶剂、聚氨酯泡沫发泡剂、制备天那水等.目前世界上工业乙酸乙酯主要制备方法有乙酸酯化法、乙醛缩合法、乙烯加成法和乙醇脱氢法等.研究发现分子筛可以催化CH3OH与CO羰基化反应生成乙酸甲酯和乙酸(CH3COOH).分子筛作为一种价格低廉、环境友好、物理化学性质稳定、催化活性良好的固体酸催化剂,在乙酸甲酯工业生产上有很好的应用前景[1-5].对于CH3OH与CO羰基化反应制备乙酸甲酯,丝光(MOR)沸石分子筛的催化活性和选择性是最好的[6].但是由于CH3OH与CO羰基化反应过程中容易产生大量的水分,因此会大大降低反应的活性和选择性.对此,有研究者将金属离子引入分子筛体系,以提高分子筛的反应性能.
Haw等人在对于研究金属(Cu,Ir以及Al)掺杂分子筛的工作中[7-9]发现:金属元素的引入可以大大促进催化剂对于活泼小分子(CO,CH4以及CH3OH)的吸附作用,为它们进一步的反应提供条件.而且金属离子在体系中还会产生一定的氧化还原性,对于反应有一定的促进作用.Corma小组发现将Cu引入到氢型丝光(H-MOR)分子筛上后,CH3OH与CO的羰基化反应速率得到很大提高,而且反应对于乙酸甲酯的选择性达到了90%以上[10].
Iglesia小组利用红外以及核磁共振(NMR)等手段,在CH3OH与CO羰基化反应机理方面做了大量研究[4, 11-16].他们指出:CH3OH与CO在氢型分子筛上羰基化反应,首先是CH3OH与分子筛上的Brønsted酸位反应生成表面甲氧基.生成的表面甲氧基会被体系中的CO进攻,从而形成表面乙酰基,这一步是决定反应速率的关键步骤.表面乙酰基具有很高的反应活性,它很容易与CH3OH及它的生成物[二甲醚(DME)或者甲氧基]反应生成产物乙酸和乙酸甲酯.相对于氢型分子筛来说,金属改性分子筛催化,CH3OH与CO的羰基化反应的机理仍不明确,对于反应活性提高的原因还有待研究.
本文的主要内容是利用固体核磁共振手段研究了CH3OH与CO在Cu-H-MOR上的羰基化反应进程,重点研究了反应过程中Cu-H-MOR上产生的吸附物种并对其进行了归属.并根据获得的吸附物种的信息,推测了Cu-H-MOR上CH3OH与CO的羰基化反应机理.
1 实验部分 1.1 样品制备使用浓度为2 mol/L浓度的NH4NO3溶液对Na-MOR分子筛(Si/Al为10.3)在80 ℃下进行12 h×4的离子交换,然后使用过量的去离子水洗涤,得到NH4MOR分子筛.样品在80 ℃烘干12 h.然后将样品在干燥空气中升至500 ℃焙烧3 h,得到H-MOR分子筛.
Cu-H-MOR分子筛样品的制备分3步进行:第一步,9.85 g H-MOR与1.507 g的三水合硝酸铜(Cu(NO3)2·3H2O)在100 mL的去离子水中80 ℃条件下搅拌加热2 h.过滤样品,在100 ℃条件下干燥12 h.第二步,将干燥后的样品与0.78 g Cu(NO3)2·3H2O和87 mL去离子水混合,在80 ℃条件下搅拌加热2 h.然后过滤样品,在100 ℃条件下干燥12 h.第三步,将样品在500 ℃条件下,焙烧2 h.
所有样品制备后,都要进行脱水步骤才能够吸附指定气体,进行相关实验.实验的脱水部分是在一个特制的玻璃真空系统中进行的.样品在真空条件下以1 ℃/min的速度升至100 ℃,保持3 h,然后继续以1 ℃/min的速度升至450 ℃,气压低于10-3Pa条件下保持12 h.
气体的吸附也是在玻璃真空系统中进行的,按照Al:CH3OH:CO=1:1:1.2的物质量的比例吸附.样品吸附后,将分子筛与反应物使用煤气喷枪火焰密封在玻璃管中.在玻璃管中的样品加热至180 ℃,保持0.5 h.反应后用液氮冷却,使反应立即停止.室温下对冷却后的样品进行真空处理,在10-3 Pa条件下保持0.5 h.然后在手套箱中将样品转移到NMR样品管中,进行NMR实验.
1.2 NMR实验所有的固体NMR实验都是在固体Varian Infinityplus-400型NMR谱仪上进行的,采用的是固体2.5 mm的魔角旋转探头. NMR实验中1H和13C的共振频率分别为400.13 MHz和100.60 MHz.1H和13C分别以四甲基硅烷(TMS)和六甲苯(HMB)作为标样定标.1H→13C交叉极化(CP/MAS)实验中,采用HMB作为标样优化Hartmann-Hahn条件,交叉极化时间为0.4 ms.1H MAS NMR的循环延迟为1 s,信号累加次数为1 800;13C CP/MAS和13C MAS NMR的循环延迟分别为0.05和0.1 s,信号累加次数分别为360 000和180 000.实验中我们分别在不同的魔角旋转转速上进行了实验,转速分别设置为4 kHz,8 kHz,18 kHz和29 kHz.
2 结果与讨论 2.1 催化剂的表征Brønsted酸位点的存在是分子筛催化羰基化反应的首要条件.1H MAS NMR谱图能够直接提供分子筛的酸性羟基信息[17].图 1为H-MOR和Cu-H-MOR的1H MAS NMR谱.在H-MOR的1H MAS谱中[图 1(a)],可以观测到δH4.2和2.4的两个信号,分别来自桥式羟基(SiOHAl,Brønsted酸位点)和弱酸性的硅羟基[18].

|
| 图 1 MOR (a)和Cu-H-MOR (b)分子筛的1H MAS NMR谱.魔角旋转转速为14 kHz Fig. 1 1H MAS NMR spectra of H-MOR (a) and Cu-H-MOR (b). The spinning rate is 14 kHz |
由于Cu2+离子的引入,会使体系中产生顺磁效应.顺磁效应会使体系中受到它影响的原子或者分子的电子云发生变形,从而使其在核磁检测中的T1(纵向弛豫时间)和T2(横向弛豫时间)发生改变.在谱图中与之对应的现象为谱峰变宽、化学位移发生偏移[19-23].由于顺磁效应会造成NMR谱图的变宽,实验中可以通过提高魔角旋转转速的方法使谱峰变窄以提高分辨率,因此在高转速条件下可以观测到一些由于顺磁效应影响在低转速下无法观测到的信号.
从图 1(b)可以看出,由于Cu2+的影响,H-MOR的桥式羟基(Brønsted酸位点)和硅羟基的信号分别位移到δH6.5和3.4处,并且Brønsted酸位的量减少,这说明Cu2+主要吸附在H-MOR分子筛的Brønsted酸位上,交换了部分的Brønsted酸质子.
2.2 反应中吸附物种的表征CH3OH和CO吸附到Cu-H-MOR分子筛上,并在180 ℃反应0.5 h后,会主要生成CH3COOCH3以及少量的CH3COOH[10].图 2为不同魔角旋转速度下,CH3OH与CO在Cu-H-MOR分子筛上羰基化反应的1H MAS NMR谱.当转速为4 kHz时[图 2(a)],只能观测到分子筛上的桥式羟基(δH6.5)和硅羟基(δH3.4).当转速提高到8 kHz时[图 2(b)],谱图中出现了δH1.3的信号,我们将其归属为Cu-H-MOR上甲基(-CH3)的1H NMR信号(在没有顺磁效应影响的分子筛上,-CH3的1H NMR化学位移为δH1.2).当转速提高到18 kHz时[图 2(c)],谱图中出现了δH8.2的信号,信号是一个明显的宽包,可能是由于反应中所生成的产物由于顺磁作用而产生的信号.当转速提高到29 kHz时[图 2(d)],谱图中出现了δH2.9的信号,这可能来自于受到Cu2+顺磁效应影响的吸附物种(由于各吸附物种在1H NMR谱图上难以区分,具体归属在13C NMR谱图中有详细阐述).

|
| 图 2 不同魔角旋转速度下CH3OH和CO在Cu-H-MOR分子筛上羰基化反应的1H MAS NMR谱.旋转速度分别为:(a) 4 kHz, (b) 8 kHz, (c) 18 kHz和(d) 29 kHz Fig. 2 1H MAS NMR spectra of reaction of CH3OH and CO on Cu-H-MOR. The spinning rate is: (a) 4 kHz, (b) 8 kHz, (c) 18 kHz and (d) 29 kHz |
图 3为不同魔角旋转速度下,CH3OH和CO在Cu-H-MOR分子筛上羰基化反应的13C CP/MAS NMR谱图.图 3(a)中可以看到,当转速为4 kH时,谱图中比较明显的是δC 60,50和27的信号.在分子筛体系中,δC50~60的信号一般来自于甲氧基(-OCH3)[13, 24],而δC 20~35的信号来自于甲基[11, 25].当转速提高到8 kHz时[图 3(b)],谱图中出现了δC 183和176的信号,可以归属于羰基(-CO)的信号[11, 25];同时还可以看出,甲基(δC 27)和甲氧基(δC50和60)部分的信号变化不大.我们之前的研究发现,乙酸甲酯的羰基信号在丝光沸石两个孔道中的化学位移是不同的,它在H-MOR中12-元环和8-元环孔道中的化学位移分别为δC 177和185[26].在图 3(b)中,在8 kHz转速条件下观测到的两个羰基信号(δC 176和183),它们在不同转速条件下的变化趋势相似,这说明它们可能是在MOR分子筛不同孔道内的同一种物质的羰基信号,我们将它们归属为Cu-H-MOR分子筛两种不同孔道内的产物乙酸甲酯.由于它们在较低转速下(8 kHz)就可以被观测到,说明它们虽然受到一定的顺磁效应的影响,但是这种影响不是特别大.随着转速继续提高到18 kHz时[图 3(c)],δC 183和176的信号变得更加清晰.当转速提高到29 kHz时[图 3(d)],谱图中出现了羰基(δC 172)和甲氧基(δC69)的信号.这说明体系中δC 172和69的信号所代表的物种与δC 183和176对应的物种相比,受到Cu2+离子顺磁效应的影响更大.我们把在δC 172出现的与产物乙酸甲酯不同的羰基信号归属为乙酰基中间产物,在以前的工作中[26],观测到了类似的乙酰基中间体,其运动性受到键连位点较强的限制作用,此羰基信号只有在很高的转速(29 kHz)下才能被观测到,说明它受到Cu2+的顺磁效应影响十分强烈.分子筛体系中CH3OH的化学位移一般在δC 48~52之间,在加热的条件下CH3OH会转化为表面吸附态的甲氧基(-OCH3),而甲氧基的信号在δC 56~60之间[13, 17].由于体系中顺磁离子的影响,会使其化学位移有所偏移,如果吸附物种与Cu2+十分接近,那么它受到的顺磁效应影响将更大,化学位移的偏移将更加明显.将δC 69的信号归属为甲氧基的信号,该信号的变化趋势与δC 172信号基本一致,因此它与乙酰基(δC172)一样受到Cu2+顺磁效应的影响较大.在研究CH3OH在Cu/ZnO/Al2O3催化剂上转化的实验中[27],Haw等人发现,CH3OH碳原子的信号由于金属铜离子所产生的顺磁效应的影响,化学位移由原来的δC 50偏移到δC 59.
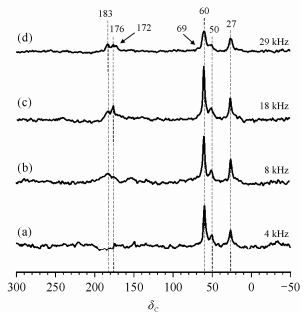
|
| 图 3 不同魔角旋转速度下CH3OH和CO在Cu-H-MOR分子筛上羰基化反应的13C CP/MAS NMR谱.旋转速度分别为:(a) 4 kHz, (b) 8 kHz, (c) 18 kHz和(d) 29 kHz Fig. 3 13C CP/MAS NMR spectra of reaction products of CH3OH and CO on Cu-H-MOR. The spinning rate is: (a) 4 kHz, (b) 8 kHz, (c) 18 kHz and (d) 29 kHz |
图 4为不同魔角旋转速度下,CH3OH和CO在Cu-H-MOR分子筛上羰基化反应的13C MAS NMR谱.在单脉冲的谱图中,可以直接观测13C产生的信号,而不依赖于质子,而且谱图可以用于定量分析体系中各物种之间的关系.当转速为4 kHz时[图 4(a)],可以观测到不同孔道内的乙酸甲酯羰基(δC 183和176)以及体系中甲氧基(δC60和50)的信号.当转速提高到8 kHz时[图 4(b)],可以发现由于受到Cu2+的影响,产物乙酸甲酯的羰基(δC183和176)以及体系中甲氧基(δC50~60)的信号都得到了增强.当转速提高到18 kHz时[图 4(c)],δC 50信号变化不大,其它信号都有所增强.当转速提高到29 kHz时[图 4(d)],在13C CP/MAS NMR谱中观测到的甲氧基信号(δC69)在13C MAS NMR谱中也可以观测到.而δC 172信号所代表的乙酰基的信号,由于本身量很少的关系,可能被δC 168~183信号所掩盖而无法观测.值得注意的是在13C CP/MAS NMR谱图中没有观测到的δC 168的信号在13C MAS NMR谱中十分明显,而且其信号强度随着魔角旋转转速的升高而增加.δC 168的信号在交叉极化实验中无法被观测到,说明其对应的物种周围没有H原子,而在体系中唯一没有H相连接的C原子只有CO分子,CO在H-MOR分子筛中化学位移为δC 183.因此,把δC 168的信号归属为被吸附的CO.CO分子在室温条件下是很难大量吸附在分子筛表面上的,而且我们的实验体系是经过真空处理的,因此认为CO分子是强吸附在Cu2+附近,由于受到Cu2+顺磁离子的影响,其化学位移发生改变.另外,随着魔角旋转转速的提高,δC 168信号明显增强,这说明该信号对应的物种受到Cu2+的影响较大.从图 4中可以看出,δC 183(乙酸甲酯的羰基信号)与δC 60(甲氧基)信号的变化趋势十分一致,这说明它们受到的顺磁影响十分接近,很有可能是同一个物种上的两个碳原子.经过前面的分析得知,δC 60信号所对应的甲氧基虽然会受到顺磁离子的影响,但是与δC 69信号所对应的甲氧基不同,它与Cu2+并不是十分接近,这一点与δC 186所代表的羰基信号是一致的.因此,将δC 186和60的信号分别归属为乙酸甲酯上的羰基和甲氧基.另外,δC 50的信号受到Cu2+顺磁效应的影响最小,它的化学位移变化也是最小的,分子筛上CH3OH的化学位移为δC 49~51.因此,将δC 50的信号归属为CH3OH.在13C MAS NMR谱中,并未观测到δC 27处的甲基信号,这可能是由于顺磁作用造成的.相关物种的13C化学位移见表 1.
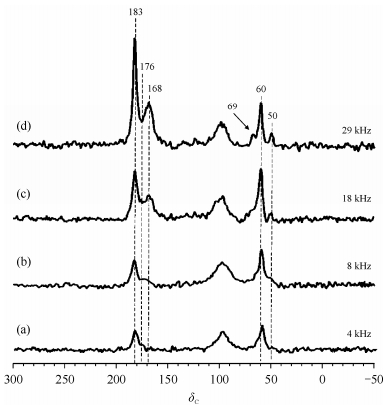
|
|
图 4 不同魔角旋转速度下CH3OH和CO在Cu-H-MOR分子筛上羰基化反应的13C MAS NMR谱.旋转速度分别为:(a) 4 kHz, (b) 8 kHz, (c) 18 kHz和(d) 29 kHz.d |
| 物种 | 化学位移/δC | 受Cu2+影响强弱 | 反应状态 |
| *CH3OH | 50 | 弱 | 反应物 |
| Cu-*CO | 186 | 强 | 中间产物 |
| Cu-O*CH3 | 69 | 强 | 中间产物 |
| Cu-O (*CO) CH3 | 172 | 强 | 中间产物 |
| CH3*COOCH3 | 183,176 | 中等 | 产物 |
| CH3COO*CH3 | 60 | 中等 | 产物 |
在H-MOR分子筛上,CH3OH与CO羰基化反应,首先是CH3OH与分子筛上的Brønsted酸位反应生成甲氧基;CO进攻甲氧基形成乙酰基,乙酰基的生成是决定羰基化反应速率的关键步骤;乙酰基继续与CH3OH反应可以生成产物乙酸或者乙酸甲酯.
Cu2+引入H-MOR分子筛后,它与H-MOR上的Brønsted酸位进行交换,为气体小分子的后续反应提供了便利.在Cu-H-MOR分子筛催化CH3OH和CO羰基化反应的过程中,观测到了反应物CH3OH和CO进入体系后在Cu2+周围发生了强烈的吸附,形成了与Cu2+十分接近的CO (δC168)和-OCH3 (δC 69),我们认为它们就吸附在Cu2+上,形成了铜羰基(Cu-CO)和铜甲氧基(Cu-O-CH3).反应中生成的乙酰基(δC 172)也是吸附在Cu2+周围,同样认为它可能也是直接吸附在Cu2+上,形成了铜乙酰基(Cu-(CO)-CH3).生成的产物乙酸甲酯(δC183、176以及60)距离Cu2+较远,它并没有直接吸附在Cu2+上.
通过生成的中间产物分析,我们认为CH3OH和CO在Cu-H-MOR分子筛上羰基化反应的过程主要经历了以下几个步骤(Scheme 1):当CH3OH和CO引入体系后,CO在Cu2+上形成吸附态的铜羰基(Cu-CO),CH3OH也可以发生脱水反应后吸附在Cu2+上形成铜甲氧基(Cu-OCH3).这使得后续的羰基化反应更加容易进行.在加热的条件下,CO进攻铜甲氧基,形成铜乙酰基(CuO-(CO)CH3),这是反应的决速步骤,在无铜离子修饰的分子筛上由于能够实现CO进攻甲氧基这一步的条件十分苛刻,只有在少数具有特殊孔道效应的分子筛中才能够完成这一步反应,如乙酰基只能在丝光沸石的8-元环孔道里形成[26].由于在Cu-H-MOR分子筛上,Cu2+对CO和-OCH3的吸附使得CO的插入形成乙酰基这一决速步骤变得容易,导致Cu-H-MOR比H-MOR催化反应活性更高.在形成中间产物铜乙酰基(CuO-(CO)CH3)后,它会继续与体系中的CH3OH反应生成最终产物乙酸甲酯.

|
| Scheme 1 Cu-H-MOR分子筛上CH3OH的羰基化反应机理示意图,Z表示分子筛骨架 Scheme1 Carbonylation reaction mechanism of methanol with CO on Cu-H-MOR zeolite. Z represents the zeolite framework |
通过固体NMR技术研究了CH3OH和CO在Cu-H-MOR分子筛上羰基化反应的过程,研究了羰基化过程中各吸附物种与Cu2+的相互作用,对反应中各吸附物种进行了归属.发现CH3OH与CO在Cu-H-MOR分子筛上羰基化反应的中间产物为铜甲氧基(Cu-OCH3)和铜乙酰基(Cu-O(CO)CH3),基于实验结果对羰基化反应机理进行了推测.由于CO和甲氧基(-OCH3)同时吸附在Cu2+上,CO更容易进攻此甲氧基,使得羰基化反应的决速步骤--乙酰基的生成更加容易进行,这正是Cu-H-MOR分子筛比H-MOR分子筛具有更高羰基化反应活性和选择性的原因.
| [1] | Pembleton R G., Ryan L M, Gerstein B C . NMR Probe for combined homonuclear multiple pulse decoupling and magic angle spinning[J]. Rev Sci Instrum , 1977, 48 (10) : 1286-1289 DOI:10.1063/1.1134866 |
| [2] | Fujimoto K, Shikada T, Omata K et al . Vapor-phase carbonylation of methanol with solid acid catalysts[J]. Chem Lett , 1984 (12) : 2047-2050 |
| [3] | Stepanov A G, Luzgin M V, Romannikov V N et al . NMR observation of the koch reaction in zeolite h-zsm-5 under mild conditions[J]. J Am Chem Soc , 1995, 117 (12) : 3615-3616 DOI:10.1021/ja00117a032 |
| [4] | Ellis B, Howard M J, Joyner R W, et al. Heterogeneous Catalysts for the Direct, Halide-Free Carbonylation of Methanol// Hightower J W, Delgass W N, Iglesia E, et al. 11th International Congress on Catalysis -40th Anniversary, Pts A and B[C]. Amsterdam: Elsevier Science Bv, 1996, 101: 771-779. |
| [5] | Xu Q, Inoue S, Tsumori N et al . Carbonylation of tert-butyl alcohol over H-zeolites[J]. J Mol Catal A-Chemical , 2001, 170 (1-2) : 147-153 DOI:10.1016/S1381-1169(01)00054-1 |
| [6] | Gounder R, Iglesia E . Catalytic Consequences of spatial constraints and acid site location for monomolecular alkane activation on zeolites[J]. J Am Chem Soc , 2009, 131 (18) : 6554-6565 DOI:10.1021/ja900829x |
| [7] | Uzun A, Bhirud V A, Kletnieks P W et al . A site-isolated iridium diethylene complex supported on highly dealuminated Y zeolite: synthesis and characterization[J]. J Phys Chem C , 2007, 111 (41) : 15064-15073 DOI:10.1021/jp073338p |
| [8] | Haw J F, Song W, Marcus D M et al . The mechanism of methanol to hydrocarbon catalysis[J]. Acc Chem Res , 2003, 36 (5) : 317-326 DOI:10.1021/ar020006o |
| [9] | Krawietz T R, Lin P, Lotterhos K E et al . Solid phosphoric acid catalyst: A multinuclear NMR and theoretical study[J]. J Am Chem Soc , 1998, 120 (33) : 8502-8511 DOI:10.1021/ja9813461 |
| [10] | Blasco T, Boronat M, Concepción P et al . Carbonylation of methanol on metal-acid zeolites: Evidence for a mechanism involving a multisite active center[J]. Angew Chem Int Edit , 2007, 46 (21) : 3938-3941 DOI:10.1002/(ISSN)1521-3773 |
| [11] | Bhan A, Allian A D, Sunley G J et al . Specificity of sites within eight-membered ring zeolite channels for carbonylation of methyls to acetyls[J]. J Am Chem Soc , 2007, 129 (16) : 4919-4924 DOI:10.1021/ja070094d |
| [12] | Bhan A, Iglesia E . A link between reactivity and local structure in acid catalysis on zeolites[J]. Acc Chem Res , 2008, 41 (4) : 559-567 DOI:10.1021/ar700181t |
| [13] | Cheung P, Bhan A, Sunley G J et al . Selective carbonylation of dimethyl ether to methyl acetate catalyzed by acidic zeolites[J]. Angew Chem Int Edit , 2006, 45 (10) : 1617-1620 DOI:10.1002/(ISSN)1521-3773 |
| [14] | Cheung P, Bhan A, Sunley G J et al . Site requirements and elementary steps in dimethyl ether carbonylation catalyzed by acidic zeolites[J]. J Cat , 2007, 245 (1) : 110-123 DOI:10.1016/j.jcat.2006.09.020 |
| [15] | Gounder R, Iglesia E . Catalytic consequences of spatial constraints and acid site location for monomolecular alkane activation on zeolites[J]. J Am Chem Soc , 2009, 131 (5) : 1958-1971 DOI:10.1021/ja808292c |
| [16] | Gounder R, Iglesia E . The roles of entropy and enthalpy in stabilizing ion-pairs at transition states in zeolite acid catalysis[J]. Acc Chem Res , 2012, 45 (2) : 229-338 DOI:10.1021/ar200138n |
| [17] | Freude D, Hunger M, Pfeifer H et al . H-1 MAS NMR-studies on the acidity of zeolites[J]. Chem Phys Lett , 1986, 128 (1) : 62-66 DOI:10.1016/0009-2614(86)80146-4 |
| [18] | Veefkind V A, Smidt M L, Lercher J A . On the role of strength and location of Bronsted acid sites for ethylamine synthesis on mordenite catalysts[J]. Appl Cat A-General , 2000, 194 : 319-332 |
| [19] | Iwahara J, Schwieters C D, Clore G M . Ensemble approach for NMR structure refinement against 1H paramagnetic relaxation enhancement data arising from a flexible paramagnetic group attached to a macromolecule[J]. J Am Chem Soc , 2004, 126 (18) : 5879-5896 DOI:10.1021/ja031580d |
| [20] | Kervern G, Pintacuda G, Zhang Y et al . Solid-state NMR of a paramagnetic DIAD-FeII catalyst: Sensitivity, resolution enhancement, and structure-based assignments[J]. J Am Chem Soc , 2006, 128 (41) : 13545-13552 DOI:10.1021/ja063510n |
| [21] | Balayssac S, Bertini I, Lelli M et al . Paramagnetic ions provide structural restraints in solid-state NMR of proteins[J]. J Am Chem Soc , 2007, 129 (8) : 2218-2219 DOI:10.1021/ja068105a |
| [22] | Bertini I, Gupta Y K, Luchinat C et al . Paramagnetism-based NMR restraints provide maximum allowed probabilities for the different conformations of partially independent protein domains[J]. J Am Chem Soc , 2007, 129 (42) : 12786-12794 DOI:10.1021/ja0726613 |
| [23] | Su Y, Mani R, Hong M . Asymmetric insertion of membrane proteins in lipid bilayers by solid-state NMR paramagnetic relaxation enhancement: A cell-penetrating peptide example[J]. J Am Chem Soc , 2008, 130 (27) : 8856-8864 DOI:10.1021/ja802383t |
| [24] | Jiang Y, Hunger M, Wang W . On the reactivity of surface methoxy species in acidic zeolites[J]. J Am Chem Soc , 2006, 128 (35) : 11679-11692 DOI:10.1021/ja061018y |
| [25] | Boronat M, Martinez-Sanchez C, Law D et al . Enzyme-like specificity in zeolites: A unique site position in mordenite for selective carbonylation of methanol and dimethyl ether with CO[J]. J Am Chem Soc , 2008, 130 (48) : 16316-16323 DOI:10.1021/ja805607m |
| [26] | Li B, Xu J, Han B et al . Insight into dimethyl ether carbonylation reaction over mordenite zeolite from in-situ solid-state NMR spectroscopy[J]. J Phys Chem C , 2013, 117 (11) : 5840-5847 DOI:10.1021/jp400331m |
| [27] | Lazo N D, Murray D K, Kieke M L et al . In situ carbon-13 solid-state NMR study of the Cu/ZnO/Al2O3 methanol synthesis catalyst[J]. J Am Chem Soc , 1992, 114 (22) : 8552-8559 DOI:10.1021/ja00048a030 |
 2014, Vol. 31
2014, Vol. 31



