文章信息
- 李海东, 张智颖, 韩叶清, 孙献平, 周欣
- LI Hai-dong, ZHANG Zhi-ying, HAN Ye-qing, SUN Xian-ping, ZHOU Xin
- 超极化气体肺部磁共振成像
- Lung MRI Using Hyperpolarized Gases
- 波谱学杂志, 2014, 31(3): 307-320
- Chinese Journal of Magnetic Resonance, 2014, 31(3): 307-320
-
文章历史
收稿日期: 2014-02-18
收修改稿日期: 2014-07-18


2. 中国科学院大学,北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
根据世界卫生组织2010年数据,我国每年因肺部疾病和肺癌死亡的人数约占国内死亡总人数的20%,所以肺部疾病形势十分严峻.目前,临床上常用于肺部疾病诊断的影像技术有基于X射线的胸透和计算机断层扫描(Computed Tomography,CT)等[1],这些技术可以获得肺部结构信息,但是他们都具有放射性,且不能获得肺部的气体交换功能的影像信息,而通常疾病的发生和发展都经历了一个从功能病变到结构病变的过程.因此,急需发展一种无放射性的探测肺部气体交换功能的影像技术,能用于肺部重大疾病的早期研究与诊疗.磁共振成像(MRI)技术具有非侵入、无放射性的特点,可以用来得到脑部、心脏和腹部等大部分活体器官和组织的影像,已被广泛地应用于活体成像研究和临床疾病诊断[2, 3].但是传统基于质子(1H)的MRI技术并不适用于肺部,原因在于:1) 肺部组织多为气固交界面,因而磁化率变化很大,导致质子的横向弛豫时间(T2)极短,即使采用超短TE的成像序列[4, 5],也只能获取肺部气管的部分信息. 2) 肺部由大部分空腔结构组成,其肺泡内气体的密度比普通组织低1 000倍左右,传统的MRI技术难以实现对肺泡内的气体成像.为了实现肺部气体的MRI,需要提高气体的极化度,从而增强MRI信号的灵敏度来实现.
MRI信号的灵敏度与观测核的共振频率、自旋密度和核的自旋极化度成正比.相同的磁场下原子核的共振频率是不变的,只能通过提高观测核的自旋密度或极化度来提高MRI信号的灵敏度.观测核的自旋密度是由样品决定的,肺泡中气体的自旋密度比普通组织低3个量级左右,而肺泡能承受的压力有限,肺泡中气体的自旋密度无法在活体状态下提高3个量级.因此,只能通过提高原子核的自旋极化度的方法来提高磁共振信号的灵敏度,从而实现肺部气体MRI.
降低样品温度和提高磁场强度是传统磁共振最常用的提高原子核的自旋极化度的方法,但是降低样品温度在活体实验中并不可行,因为降低样品温度会严重影响活体的生理状态.提高磁场强度的方法花费较大,同时高场的磁场不均匀性和比吸收率(Specific Absorption Rate, SAR)也对活体MRI提出很多的挑战.因此,利用传统提高磁共振灵敏度的方法不能实现肺部气体MRI.近些年来随着技术的不断进步,发展出了通过提高核自旋极化度而增强MRI信号的新技术,如仲氢诱导核极化(Para-Hydrogen Induced Polarization,PHIP)[6, 7]、动态核极化(Dynamic Nuclear Polarization,DNP)[8, 9]、自旋交换光抽运(Spin-Exchange Optical Pumping,SEOP)[10, 11]等.自旋交换光抽运的方法可以使惰性气体(如3He、129Xe)的极化度提高10 000倍以上(称之为“超极化气体”),大大提高气体磁共振信号的灵敏度,从而使肺部气体MRI成为可能. Albert等人在1994年利用SEOP技术增强了129Xe气体的极化度,第一次获得了肺部超极化气体MRI[12].目前,SEOP技术仍是提高肺部气体磁共振信号灵敏度最有效的方法.早在1950年,Kaslter第一次提出了光抽运(Optical Pumping,OP)[13]的方法,1991年之后SEOP技术被广泛地应用在磁共振领域[10].自旋交换光抽运的主要过程如下[14-17]:1) 激光光子的角动量通过圆偏振光抽运的方式转移至Rb的电子自旋;2) Rb原子通过超精细相互作用把其电子自旋角动量转移至惰性气体的核自旋. 3He和129Xe是目前超极化气体肺部磁共振成像最常用的气体,近几年也有文献报道超极化83Kr用于肺部气体磁共振成像研究[18-20].
1 超极化气体的磁共振性质及参数测量方法 1.1 超极化气体3He,83Kr和129Xe的磁共振性质如前所述,SEOP技术能增强惰性气体的核自旋极化度4个量级以上,而常用的超极化惰性气体主要有3He,129Xe,以及近年出现的83Kr,三者的主要磁共振参数如表 1所示:
| 惰性气体 | 核自旋量子数 | 核旋磁比(MHz/T) | 天然丰度 |
| 129Xe | 1/2 | 11.77 | 26.4% |
| 3He | 1/2 | 32.43 | 0.000137% |
| 83Kr | 9/2 | 1.64 | 11.49% |
3He和129Xe都是核自旋量子数为1/2的惰性气体,而83Kr的核自旋量子数为9/2,因此是四极核,其纵向弛豫时间(T1)对周围环境更为敏感.磁共振信号的灵敏度正比于核旋磁比的平方,在以上3种气体中3He的核旋磁比最大,它的MRI信号灵敏度也因而最高,所以早期高分辨率的超极化气体肺部结构MRI几乎都是利用超极化3He来实现的.但是,3He资源在地球上极其短缺,并对医学成像进行限量供应,导致其成本非常高,从而极大地阻碍了其应用. Salhi等人通过在实验中回收来循环利用3He气体[21],但是低温分离和纯化过程十分复杂.此外,3He几乎不溶于组织和血液[22],因此不能用于肺部气体交换功能的MRI.四极核83Kr的T1时间受其核临近的化学环境影响十分敏感,可以获得弛豫加权成像. Pavlovskaya等人在2005年第一次实现了超极化83Kr成像[19],Cleveland等人在2008年获得了超极化83Kr肺部MRI[23],但其信号灵敏度比超极化129Xe和3He都差很多,并且在肺部的T1时间不到5 s,所以极大地限制了其应用. 129Xe比3He的核旋磁比小,磁共振信号的灵敏度比3He低,但是近年来随着激光技术和超极化129Xe技术的不断发展,超极化129Xe的极化度进一步得到了显著的提高,可获得极化度大于70%的超极化129Xe[24, 25]. 129Xe资源丰富,可以从空气中分离获得,并且价格便宜,为其今后的临床应用提供了良好的基础.更重要的是129Xe具有良好的脂溶性,能溶解于生物组织和血液中;同时129Xe对其环境具有很强的化学位移敏感性,在肺部可以获得气体、血液和组织3个不同的化学位移信号. 129Xe的这些性质使其可以实现肺部气体交换功能的探测,因此超极化129Xe在肺部气体MRI中具有独特的优势.
1.2 超极化气体MRI的参数测量方法因为通过SEOP技术获得的超极化气体的极化度在肺部不能通过弛豫而恢复,属于“不可再生的”,所以传统质子MRI的相关参数的测量方法,如90°脉冲校准、T1测量、化学位移的标定等不能直接应用到超极化气体肺部MRI中,需要特定的技术来实现.以下将简要介绍超极化气体肺部MRI中常用的参数校准方法.
1.2.1 脉冲角度校准MRI中脉冲角度的校准对成像质量有很大的影响,传统MRI中常用的90°脉冲的校准方法为:给定一个大于5倍T1的时间间隔,然后改变脉宽或者功率等,获得的最大信号即为90°脉冲对应的参数.超极化气体的极化度是“不可再生的”,而生物体肺部每次吸入的量是一定的,并且在含有顺磁性氧气的肺泡中,超极化气体的T1通常在20 s左右[12],因此不能采用传统MRI校准90°脉冲的方法.超极化气体肺部MRI的脉冲校准采用一个较小的角度进行多次激发,并得到每次激发后的信号强度,然后根据A·sinα·(cosα)n-1=An[26, 27]计算出当前脉冲宽度和强度对应的90°脉冲的强度.在肺部超极化气体MRI中为了更有效地利用超极化气体,通常会预先吸入少量的超极化气体进行脉冲校准[27].
1.2.2 T1测量由于超极化气体的“不可再生的”特性,因此传统测量T1的方法(如饱和恢复法、翻转恢复法)都不能适用.小角度( < 10°)多次激发的方法是常用的超极化气体T1的测量方法:在一次屏气中,用多次小角度来激发采样,根据每次采样的信号强度大小和时间间隔拟合得到测量曲线,最后再拟合得到T1值[28].
1.2.3 化学位移定标传统以质子为基础的磁共振为了获得精确的化学位移,需要一个内部化学位移标定物.在超极化气体磁共振中,特别是在超极化129Xe MRI中,由于其溶解性和化学位移的敏感性,在肺部或者其他组织内会出现多个化学位移,因此需要进行标定.常用的标定方法为以气态信号作为δ 0,其他的化学位移根据气态信号的化学位移而进行标定.例如,超极化129Xe在肺部组织内一般有3个信号,其中把最大的气态信号的化学位移定标为δ 0,根据定标的气态化学位移可以获得129Xe在肺部组织的化学位移为δ 197,129Xe在血液中的化学位移为δ 212[27, 29].
1.3 超极化气体肺部MRI的脉冲序列及线圈选择超极化气体的MRI信号在肺部是“不可再生的”,因此在脉冲序列的选择中一般采用小角度激发的FLASH序列[30].为了获得更好的图像细节,并更充分地利用超极化气体的极化度,通常采用变角度采样方式,以在每次相位编码时获得相同的磁化矢量[31],Santyr等人在此基础之上发展了考虑弛豫和脉冲影响的变角采样方式,可以获得更好的成像结果[32].除了FLASH序列之外,利用Radial Encoding的采样方式可以获得超极化气体肺部MRI更为清晰的结构信息[33, 34],包括气管[35-37]等信息,但是Radial Encoding的采样方式通常比常规采样的时间更长,在离线重建中需要进行相对复杂的NUFFT变换[38].此外Saam等人通过回波平面成像(Echo Planar Imaging, EPI)的成像方式实现超极化气体肺部MRI的快速成像[39].为了进一步提高肺部磁共振成像的速度,Ajraoui等人根据压缩采样方法实现了超极化气体肺部MRI的压缩采样,只用1/3的采样数据,k空间重建出和全采样质量几乎相同的图像,使采样速度加快了3倍[40, 41].
在肺部成像线圈的选择上,由于肺部体积较大,为了获得较为均一的肺部超极化气态像,一般采用B1场更为均一的体线圈,通常为鸟笼线圈、马鞍线圈和柔性表面线圈;为了实现更快的采样以及获得更好的图像质量,还可以采用正交线圈[42]和相位阵列线圈[43, 44].
2 超极化气体的肺部通气结构成像超极化气体MRI可以获得反映肺部形态和通气状况的肺部影像,实现对肺部疾病的可视化检测[45-49],如图 1所示,超极化气体MRI可以区分哮喘的严重程度[49].结合质子的肺部轮廓成像,超极化气体肺部结构MRI可以定量地研究肺部通气障碍疾病. Lange等人利用超极化3He MRI中的肺部轮廓信息和通气信息计算出健康志愿者与不同程度哮喘病人的通气缺陷,其结果不仅与传统的呼吸量测定法一致,而且可以区分哮喘的严重程度[46],同时可以发现肺功能测试正常的吸烟者的通气缺陷[47].此后,研究者发展了一系列半自动化及自动化的算法,并逐渐转向超极化129Xe肺部MRI的研究[48],并证明利用超极化129Xe MRI及半自动的计算方式也可以区分健康志愿者及慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Disease, COPD)患者.
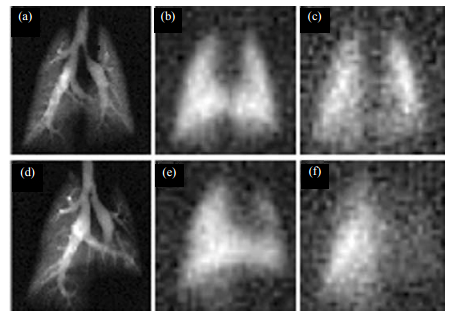
|
| 图 1 吸入超极化3He气体后的肺部冠状面成像. (a)健康志愿者,(b)轻度哮喘病人(FEV1预测值为132%),(c)中度哮喘患者(FEV1值为83%),(d)重度哮喘病人(FEV1预测值为34%)[49] Fig. 1 Coronal MR images obtained immediately after inhalation of hyperpolarized 3He gas in a healthy normal volunteer (a) and in patients with mild (FEV1 of 132% of predicted value) (b), moderate (FEV1 of 83% of predicted value) (c), and severe (FEV1 of 34% of predicted value) asthma (d)[49] |
利用超快速的成像序列,超极化气体肺部成像不仅可以实现对肺叶的静态成像,还可以获得肺部气管和支气管的动态成像,并得到分辨率为亚毫米的气管分布图像[50].利用呼吸机控制大鼠,在特定的时间点进行多次采样,通过超极化气体肺部MRI可以得到大鼠在吸气的过程中时间分辨率为6 ms的气体分布变化.通过调整成像激发角度等参数,可以得到气体在上级支气管及周围气管中的分布情况,这种方法同时提供了肺部的气体结构及肺部通气功能信息[35]. Albert等人对超极化气体气管成像进行了评估,证明使用两种不同超极化气体成像方式计算得到的人体0~5级支气管的直径与经典的Weibel模型是一致的[37]. Driehuys等人利用129Xe成像对健康及部分纤维化的大鼠进行检测,发现病灶部分存在明显的通气受限[51].
超极化气体的纵向弛豫时间T1会随着气体中顺磁性的氧浓度的增加而急剧减小[52, 53],超极化气体进入肺部后会和残留在肺泡中的氧气混合,在氧气浓度高的区域,超极化气体的T1变短、信号变弱,在通气成像上表现为低信号,因此超极化气体肺部通气MRI可以反映氧浓度的分布.肺泡中氧浓度的改变由肺泡中气体交换和通气引起,由此可以反映出肺部气体交换引起的病变[54-57],如COPD[58].
表观扩散系数(Apparent Diffusion Coefficient, ADC)可以反映气体在所处环境中的扩散运动状态.超极化气体在肺部的表观扩散系数分布图像可以反映肺部的局部结构信息,进而反映肺泡中的气体扩散功能,实现肺部疾病的检测.如肺气肿病人的肺泡变大,对气体运动的限制减小,导致气体的ADC值在肺气肿区域增大[59-62].不同的超极化气体分子的扩散系数不同,因此不同的气体探测的尺度也不相同. 129Xe的自扩散系数比3He低30倍,通过129Xe的扩散能够探测的长度尺度比3He的小,更适合测量肺泡和小气管的尺寸[63].此外还可以利用三通道(1H,3He和129Xe)系统实现对3He与129Xe扩散系数的同时测量,在一次采样中给出不同尺度下的肺部结构信息[64].
超极化惰性气体通气成像除对肺部结构进行探测之外,在肺癌的诊断方面也能够做出一定的贡献,Branca等人通过加入对肺部肿瘤靶向的超顺磁纳米颗粒造影剂,通过超顺磁造影剂来影响靶向区域的磁场均匀性,从而改变T2*,实现了对肺部肿瘤的靶向性检测[65].
3 超极化气体的肺部气体交换功能成像气体交换功能是肺部最为重要的生理功能,人体其他器官和组织的正常功能执行,也是和肺部功能密切相关.超极化气体不仅能对肺部结构进行成像,而且也能对肺部气体交换功能进行可视化探测.如通过测量换气分数可以获得肺部与外界气体交换(即,气气交换)的功能信息,利用129Xe的溶解性和化学位移敏感性可以获得反映肺泡中气体与肺部组织及血液中的气体交换(即,气血交换)的功能信息等.
3.1 超极化气体的肺部气气交换功能成像超极化气体肺部MRI不仅能探测肺部的结构,而且还可以探测肺部的气体换气功能,获得肺部气气交换功能的影像. Deninger等人利用在采样前多次呼吸等量超极化气体的方法得到信号强度和呼吸次数的关系,获得了反映肺部局部气气交换效率的肺部换气分数分布图,如在主气管的换气分数接近100%,在肺部的边缘部分的换气分数则在20%~40%[66, 32].
3.2 超极化气体的肺部气血交换功能成像气血交换被认为是肺部两个交换功能中更重要的一个生理功能,因为其直接影响血液的血氧含量,进而影响人体所有器官功能的正常发挥.超极化气体MRI可以对肺部的气血交换功能进行探测,并且能对肺部的气血交换功能进行可视化评价,从而实现疾病的早期诊疗.超极化气体对肺部气血交换功能的探测方式有间接探测和直接探测两种.
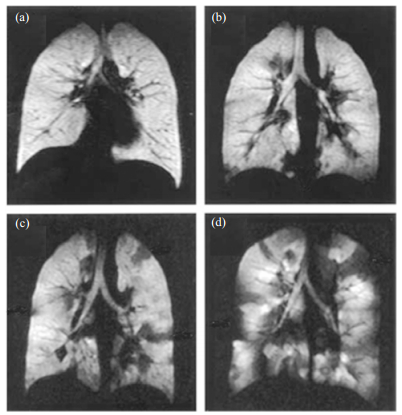
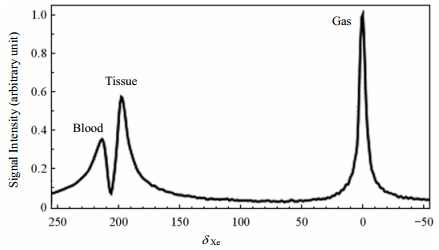
3.2.1 肺部气血交换功能的间接探测因为129Xe具有良好的脂溶性(在组织内的Ostwald溶解度为0.2,在血液中约为0.1),并且对周围环境有很大的化学位移敏感性,如图 2所示,超极化129Xe在肺部组织有3个信号[67]--肺泡内的气态信号、溶于组织和血液的溶解态信号. 3种状态的129Xe之间通过肺部的交换存在一个动态平衡.因此利用超极化129Xe不仅可以得到肺部结构成像和气体扩散功能,还能够探测肺部的气血交换功能,实现反映肺部气血交换功能的溶解态MRI.但是,超极化129Xe溶解态磁共振成像还存在两个难点:1) 溶解在肺部组织的超极化129Xe信号相对较小;2) 肺部是空腔结构,多为气-固交界面,磁化率变化很大导致肺部局部磁场很不均匀,溶解在肺部组织的129Xe的T2*非常短,因此谱宽很宽.为了解决这些问题Ruppert等人提出了利用选择性脉冲饱和溶解在肺部组织和血液中的129Xe,通过交换后气态129Xe信号的降低,来实现间接检测溶解态129Xe的弱信号.这种方法被称之为超极化129Xe极化转移对比(Xenon polarization Transfer Contrast, XTC),通过XTC的方法可以获得反应局肺实质密度和气体交换的超极化129Xe退极化图像[27]. Dregely等人在XTC的基础之上,加入了多个不同的交换时间点,从而发展了多交换时间的超极化129Xe极化转移对比(Multiple-exchange-time Xenon polarization Transfer Contrast, MXTC)方法,并提出反映正比于组织肺泡比的最大退极化值(MXTC-F)和正比于肺泡壁和肺泡间质厚度的气体交换时间的平方根值(MXTC-S)两个定量的参数[68].如图 3所示,MXTC-F在肺气肿病人的肺部分布结果和用超极化129Xe ADC磁共振成像和CT成像方法获得的结果一致[69]. Muradyan等人将此方法进一步发展,实现了单次呼吸内测量超极化129Xe极化转移对比(Single-Breath Xenon polarization Transfer Contrast, SB-XTC),并且可以在活体检测肺部不同位置的表面体积比[70].
|
| 图 2 超极化129Xe肺部NMR谱图. δ 0处为肺部气态信号,δ 197和δ 212处的峰分别为超极化129Xe在肺实质和肺部血红细胞的峰[27] Fig. 2 Representative 129Xe NMR spectrum from the dog chest. The large peak at δ 0 is due to the gas in the lung, while the peaks at δ 197 and δ 212 are believed to arise from 129Xe dissolved in the lung parenchyma and bound to hemoglobin, respectively[27] |

|
| 图 3 肺气肿患者肺部超极化129Xe成像和CT成像对比. (a) MXTC-F肺部分布图,(b) CT成像,(c)超极化129Xe ADC值(在肺气肿病变区域值变大)肺部分布图[69] Fig. 3 Results from CT and hyperpolarized 129Xe imaging methods for COPD subject. The three imaging techniques depict emphysema in the same regions of the lung, as decreased parameter values in MXTC-F (a) and CT (b) and increased parameter values in ADC (c)[69] |
间接探测的方法虽然可以反映肺部组织内的信号变化实现对肺部交换功能的探测,但是检测的灵敏度不高,也不能直接反映溶解态的129Xe在肺部组织的分布. 1999年,Swanson等人第一次利用化学位移成像(Chemical Shift Imaging, CSI)对大鼠的肺部溶解态129Xe进行了直接的成像,但是并不能区分溶解在组织和血液中的信号[29].为了实现对溶解在组织和血液的超极化129Xe分别成像来探测肺部的交换功能,Driehuys等人在2006年利用1D迪克森(Dixon)技术结合超短TE成像序列克服了溶解态的129Xe在肺部组织T2*很短的缺点,首次实现了对溶解在组织和血液中的超极化129Xe的分别成像.利用此技术对健康大鼠和肺纤维化大鼠模型的气体交换功能进行成像,如图 4所示,通过超极化129Xe肺部血液和组织的影像能区分出肺部纤维化区域和健康区域,获得通气成像不能获得的肺部气体交换功能分布信息[65].
为了能够定量的获得肺部气体交换功能,Qing等人利用多回波的3D径向编码技术在一次屏气内同时获得超极化129Xe在肺部的通气成像以及在组织和血液的溶解态成像,并定量获得反映肺部气体交换功能的超极化129Xe在肺部组织和血液中信号与气态信号的比值分布图.通过在一次屏气时间内,获得了超极化129Xe溶解态信号与气态信号比值在肺部的分布图,并证明可以区分健康志愿者、长期吸烟者和哮喘者.在健康志愿者肺部溶解态129Xe的信号与气态信号比值比长期吸烟者和哮喘者的比值高[71],这是因为长期吸烟者和哮喘者的肺部组织受到损伤而影响到肺部的气体交换功能,在相同时间内129Xe溶解在肺部组织的总量减少,导致溶解态129Xe与气态129Xe的信号比值变低.
除了对溶解于肺部超极化129Xe直接检测和成像之外,Driehuys等人把超极化129Xe溶解在生理盐水中,然后通过尾静脉注射方式,把溶解态的超极化129Xe输送到大鼠体内.血液把溶解态的超极化129Xe输送到肺部血液中,随后再扩散到肺泡中获得通气成像,这种方法可以获得直接吸入超极化129Xe气体通气成像不能得到的肺部气体交换信息.但是由于此方法是直接用注射器把溶有超极化129Xe的液体注射到大鼠体内,因此在成像过程中超极化129Xe的信号不是很稳定[72].针对此问题,Cleveland等人利用气体交换膜的方法,通过体外循环的方式把超极化129Xe溶解到肺部血液中进行循环[73, 74],这种方法既可以实现溶解态129Xe的成像,也可以通过溶解态超极化129Xe扩散到肺部实现气态129Xe成像,最后通过由溶解态的超极化129Xe到肺部气态超极化129Xe的成像获得肺部气体交换分布的信息.
为了进一步提高溶解态信号,Zhou等人提出了利用Hyper-SAGE (Hyperpolarized xenon Signal Amplification by Gas Extraction)的方法,通过把溶解态的信号相变成气态信号进行分离探测,可以把溶解态的超极化129Xe信号提高10倍以上,在肺部溶解态成像上具有很大的潜力[75].
4 展望超极化气体肺部MRI具有无放射性、无侵入的特点,在肺部疾病诊疗中有极大的潜力,吸引了众多研究者极大的兴趣.中国科学院武汉物理与数学研究所的研究小组已经在国内率先开展了相关研究工作,并且利用自主研发的仪器获得了中国第一幅活体的超极化气体MRI图像,同时对肺部气体交换功能进行了研究.尽管129Xe的旋磁比仅为3He的1/3,导致磁共振灵敏度不高,但是对比于3He的极其稀缺的资源,129Xe广泛的来源及较高的天然丰度给129Xe MRI的应用带来契机,特别是129Xe良好的脂溶性和化学位移敏感性,使其对肺部气体交换功能探测具有独特的优势,在肺部疾病早期检测方面具有极大的潜力.但是,超极化129Xe肺部MRI信号灵敏度需要进一步提高,以获得更高的肺部图像分辨率和更准确的肺部功能信息,这需要革新产生超高极化气体的方法、技术和仪器,优化超极化气体传输系统以减少极化度的损失,设计新的成像线圈更有效的利用极化度,发展新的成像脉冲序列来获得更多的肺部功能信息.同时需要与临床医学和生物化学等学科进行交叉创新,方能使这项技术得到更好的发展和应用.
| [1] | Kubo T, Lin P J P, Stiller W et al . Radiation dose reduction in chest CT: A review[J]. Am J Roentgenol , 2008, 190 (2) : 335-343 DOI:10.2214/AJR.07.2556 |
| [2] | Huang Ming-ming(黄明明), Lin Fu-chun(林富春), Gao Li-feng(高丽风) et al . Diabetic encephalopathy studied by magnetic resonance imaging and spectroscopy(糖尿病脑病的磁共振研究)[J]. Chinese J Magn Reson(波谱学杂志) , 2012, 29 (3) : 446-456 |
| [3] | Wang Qian-feng(王前锋), Li Jian-qi(李建奇), Wu Dong-mei(吴东梅) et al . High-resolution diffusion-weighted imaging on small animals on a clinical 3T MRI scanner(小动物高分辨扩散加权成像在临床MRI上的实现)[J]. Chinese J Magn Reson(波谱学杂志) , 2012, 29 (3) : 372-378 |
| [4] | Kveder M, Zupančič I, Lahajnar G et al . Water proton NMR relaxation mechanisms in lung tissue[J]. Magn Reson Med , 1988, 7 (4) : 432-441 DOI:10.1002/(ISSN)1522-2594 |
| [5] | Togao O, Tsuji R, Ohno Y et al . Ultrashort echo time (UTE) MRI of the lung: assessment of tissue density in the lung parenchyma[J]. Magn Reson Med , 2010, 64 (5) : 1491-1498 DOI:10.1002/mrm.v64:5 |
| [6] | Bowers C R, Weitekamp D P . Transformation of symmetrization order to nuclear-spin magnetization by chemical reaction and nuclear magnetic resonance[J]. Phys Rev Lett , 1986, 57 (21) : 2645-2648 DOI:10.1103/PhysRevLett.57.2645 |
| [7] | Golman K, Axelsson O, Johannesson H et al . Parahydrogen-induced polarization in imaging: Subsecond 13C angiography[J]. Magn Reson Med , 2001, 46 (1) : 1-5 DOI:10.1002/mrm.v46:1 |
| [8] | Ardenkj r-Larsen J H, Fridlund B, Gram A et al . Increase in signal-to-noise ratio of > 10, 000 times in liquid-state NMR[J]. Proc Natl Acad Sci USA , 2003, 100 (18) : 10158-10163 DOI:10.1073/pnas.1733835100 |
| [9] | Song C, Hu K N, Joo C G et al . Totapol: A biradical polarizing agent for dynamic nuclear polarization experiments in aqueous media[J]. J Am Chem Soc , 2006, 128 (35) : 11385-11390 DOI:10.1021/ja061284b |
| [10] | Zeng X, Wu C, Zhao M et al . Laser-enhanced low-pressure gas NMR signal from 129Xe[J]. Chem Phys Lett , 1991, 182 (6) : 538-540 DOI:10.1016/0009-2614(91)90120-X |
| [11] | Zhou X . Hyperpolarized Noble Gases as Contrast Agents: in In vivo NMR Imaging[M]. USA: Humana Press, 2011 . |
| [12] | Albert M, Cates G, Driehuys B et al . Biological magnetic resonance imaging using laser-polarized 129Xe[J]. Nature , 1994, 370 : 199-201 DOI:10.1038/370199a0 |
| [13] | Kastler A . Quelques suggestions concernant la production optique et la détection optique d'une inégalité de population des niveaux de quantifigation spatiale des atomes. Application à l'expérience de Stern et Gerlach et à la résonance magnétique[J]. J Phys Radium , 1950, 11 (6) : 255-265 DOI:10.1051/jphysrad:01950001106025500 |
| [14] | Appelt S, Baranga A B-A, Erickson C et al . Theory of spin-exchange optical pumping of 3He and 129Xe[J]. Phys Rev A , 1998, 58 (2) : 1412-1439 DOI:10.1103/PhysRevA.58.1412 |
| [15] | Happer W . Optical pumping[J]. Rev Mod Phys , 1972, 44 : 169-249 DOI:10.1103/RevModPhys.44.169 |
| [16] | Happer W, Miron E, Schaefer S et al . Polarization of the nuclear spins of noble-gas atoms by spin exchange with optically pumped alkali-metal atoms[J]. Phys Rev A , 1984, 29 (6) : 3092-3110 DOI:10.1103/PhysRevA.29.3092 |
| [17] | Walker T G, Happer W . Spin-exchange optical pumping of noble-gas nuclei[J]. Rev Mod Phys , 1997, 69 (2) : 629-642 DOI:10.1103/RevModPhys.69.629 |
| [18] | Hughes-Riley T, Six J S, Lilburn D M et al . Cryogenics free production of hyperpolarized 129Xe and 83Kr for biomedical MRI applications[J]. J Magn Reson , 2013, 237 : 23-33 DOI:10.1016/j.jmr.2013.09.008 |
| [19] | Pavlovskaya G E, Cleveland Z I, Stupic K F et al . Hyperpolarized krypton-83 as a contrast agent for magnetic resonance imaging[J]. Proc Natl Acad Sci USA , 2005, 102 (51) : 18275-18279 DOI:10.1073/pnas.0509419102 |
| [20] | Six J S, Hughes-Riley T, Lilburn D M et al . Pulmonary MRI contrast using surface quadrupolar relaxation (SQUARE) of hyperpolarized 83Kr[J]. Magn Reson Imag , 2014, 32 (1) : 48-53 DOI:10.1016/j.mri.2013.08.007 |
| [21] | Salhi Z, Großmann T, Gueldner M et al . Recycling of 3He from lung magnetic resonance imaging[J]. Magnet Reson Med , 2012, 67 (6) : 1758-1763 DOI:10.1002/mrm.23154 |
| [22] | Weathersby P, Homer L . Solubility of inert gases in biological fluids and tissues: A review[J]. Undersea Biomed Res , 1980, 7 (4) : 277-296 |
| [23] | Cleveland Z I, Pavlovskaya G E, Elkins N D et al . Hyperpolarized 83Kr MRI of lungs[J]. J Magn Reson , 2008, 195 (2) : 232-237 DOI:10.1016/j.jmr.2008.09.020 |
| [24] | Nikolaou P, Coffey A M, Walkup L L et al . Near-unity nuclear polarization with an open-source 129Xe hyperpolarizer for NMR and MRI[J]. Proc Natl Acad Sci USA , 2013, 110 (35) : 14150-14155 DOI:10.1073/pnas.1306586110 |
| [25] | Ruset I, Ketel S, Hersman F . Optical pumping system design for large production of hyperpolarized 129Xe[J]. Phys Rev Lett , 2006, 96 (5) : 053002 DOI:10.1103/PhysRevLett.96.053002 |
| [26] | Deninger A, Eberle B, Ebert M et al . Quantification of regional Intrapulmonary oxygen partial pressure evolution during apnea by 3He MRI[J]. J Magn Reson , 1999, 141 (2) : 207-216 DOI:10.1006/jmre.1999.1902 |
| [27] | Ruppert K, Brookeman J R, Hagspiel K D et al . Probing lung physiology with xenon polarization transfer contrast(XTC)[J]. Magn Reson Med , 2000, 44 (3) : 349-357 DOI:10.1002/(ISSN)1522-2594 |
| [28] | Mñller H E, Hedlund L W, Chen X J et al . Measurements of hyperpolarized gas properties in the lung. Part Ⅲ: 3He T1[J]. Magn Reson Med , 2001, 45 (3) : 421-430 DOI:10.1002/(ISSN)1522-2594 |
| [29] | Swanson S D, Rosen M S, Coulter K P et al . Distribution and dynamics of laser-polarized 129Xe magnetization in vivo[J]. Magn Reson Med , 1999, 42 : 1137-1145 DOI:10.1002/(ISSN)1522-2594 |
| [30] | Zhao L, Mulkern R, Tseng C-H et al . Gradient-echo imaging considerations for hyperpolarized 129Xe MR[J]. J Magn Reson B , 1996, 113 : 19-183 |
| [31] | Hargreaves B A, Vasanawala S S, Pauly J M et al . Characterization and reduction of the transient response in steady-state MR imaging[J]. Magn Reson Med , 2001, 46 (1) : 149-158 DOI:10.1002/(ISSN)1522-2594 |
| [32] | Santyr G E, Lam W W, Ouriadov A . Rapid and efficient mapping of regional ventilation in the rat lung using hyperpolarized 3He with flip angle variation for offset of RF and relaxation(FAVOR)[J]. Magn Reson Med , 2008, 59 (6) : 1304-1310 DOI:10.1002/(ISSN)1522-2594 |
| [33] | Black R D, Middleton H L, Cates G D et al . In vivo He-3 MR images of guinea pig lungs[J]. Radiology , 1996, 199 (3) : 867-870 DOI:10.1148/radiology.199.3.8638019 |
| [34] | Thomas A C, Nouls J C, Driehuys B et al . Ventilation defects observed with hyperpolarized 3He magnetic resonance imaging in a mouse model of acute lung injury[J]. Am J Resp Cell Mol , 2011, 44 (5) : 648 DOI:10.1165/rcmb.2009-0287OC |
| [35] | Chen B T, Brau A, Johnson G A . Measurement of regional lung function in rats using hyperpolarized helium-3 dynamic MRI[J]. Magn Reson Med , 2003, 49 (1) : 78-88 DOI:10.1002/(ISSN)1522-2594 |
| [36] | Chen X J, Chawla M S, Cofer G P et al . Hyperpolarized 3He NMR lineshape measurements in the live guinea pig lung[J]. Magn Reson Med , 1998, 40 (1) : 61-65 DOI:10.1002/(ISSN)1522-2594 |
| [37] | Lewis T A, Tzeng Y S, McKinstry E L et al . Quantification of airway diameters and 3D airway tree rendering from dynamic hyperpolarized 3He magnetic resonance imaging[J]. Magn Reson Med , 2005, 53 (2) : 474-478 DOI:10.1002/(ISSN)1522-2594 |
| [38] | Song J, Liu Y, Gewalt S L et al . Least-square NUFFT methods applied to 2D and 3D radially encoded MR image reconstruction[J]. IEEE Trans Biomed Eng , 2009, 56 (4) : 1134-1142 DOI:10.1109/TBME.2009.2012721 |
| [39] | Saam B, Yablonskiy D A, Gierada D S et al . Rapid imaging of hyperpolarized gas using EPI[J]. Magn Reson Med , 1999, 42 (3) : 507-514 DOI:10.1002/(ISSN)1522-2594 |
| [40] | Ajraoui S, Lee K J, Deppe M H et al . Compressed sensing in hyperpolarized 3He lung MRI[J]. Magn Reson Med , 2010, 63 (4) : 1059-1069 DOI:10.1002/mrm.v63:4 |
| [41] | Ajraoui S, Parra-Robles J, Wild J . Incorporation of prior knowledge in compressed sensing for faster acquisition of hyperpolarized gas images[J]. Magn Reson Med , 2012, 69 (2) : 360-369 |
| [42] | Nouls J, Fanarjian M, Hedlund L et al . A constant-volume ventilator and gas recapture system for hyperpolarized gas MRI of mouse and rat lungs[J]. Concept Magn Reson B , 2011, 39 (2) : 78-88 |
| [43] | Lee R F, Johnson G, Grossman R I et al . Advantages of parallel imaging in conjunction with hyperpolarized helium-a new approach to MRI of the lung[J]. Magn Reson Med , 2006, 55 (5) : 1132-1141 DOI:10.1002/(ISSN)1522-2594 |
| [44] | Zhu Y, Hardy C J, Sodickson D K et al . Highly parallel volumetric imaging with a 32-element RF coil array[J]. Magn Reson Med , 2004, 52 (4) : 869-877 DOI:10.1002/(ISSN)1522-2594 |
| [45] | Mathew L, Evans A, Ouriadov A et al . Hyperpolarized 3He magnetic resonance imaging of chronic obstructive pulmonary disease: Reproducibility at 3.0 Tesla[J]. Acad Radiol , 2008, 15 (10) : 1298-1311 DOI:10.1016/j.acra.2008.04.019 |
| [46] | de Lange E E, Altes T A, Patrie J T et al . Evaluation of asthma with hyperpolarized helium-3 MRI correlation with clinical severity and spirometry[J]. Chest , 2006, 130 (4) : 1055-1062 DOI:10.1378/chest.130.4.1055 |
| [47] | Woodhouse N, Wild J M, Paley M N et al . Combined helium-3/proton magnetic resonance imaging measurement of ventilated lung volumes in smokers compared to never-smokers[J]. J Magn Reson Imag , 2005, 21 (4) : 365-369 DOI:10.1002/(ISSN)1522-2586 |
| [48] | Virgincar R S, Cleveland Z I, Sivaram Kaushik S et al . Quantitative analysis of hyperpolarized 129Xe ventilation imaging in healthy volunteers and subjects with chronic obstructive pulmonary disease[J]. NMR Biomed , 2012, 26 (4) : 424-435 |
| [49] | Samee S, Altes T, Powers P et al . Imaging the lungs in asthmatic patients by using hyperpolarized helium-3 magnetic resonance: assessment of response to methacholine and exercise challenge[J]. J Allergy Clin Immun , 2003, 111 (6) : 1205-1211 DOI:10.1067/mai.2003.1544 |
| [50] | Johnson G A, Cofer G P, Hedlund L W et al . Registered 1H and 3He magnetic resonance microscopy of the lung[J]. Magn Reson Med , 2001, 45 (3) : 365-370 DOI:10.1002/(ISSN)1522-2594 |
| [51] | Driehuys B, Pollaro J, Cofer G P . In vivo MRI using real-time production of hyperpolarized 129Xe[J]. Magn Reson Med , 2008, 60 (1) : 14-20 DOI:10.1002/mrm.v60:1 |
| [52] | Jameson C J, Jameson A K, Hwang J K . Nuclear spin relaxation by intermolecular magnetic dipole coupling in the gas phase. Xe in oxygen[J]. J Chem Phys , 1988, 89 : 4074-4081 DOI:10.1063/1.454842 |
| [53] | Saam B, Happer W, Middleton H . Nuclear relaxation of 3He in the presence of O2[J]. Phys Rev A , 1995, 52 : 862-865 DOI:10.1103/PhysRevA.52.862 |
| [54] | Cieślar K, Alsaid H, Stupar V et al . Measurement of nonlinear pO2 decay in mouse lungs using 3He-MRI[J]. NMR Biomed , 2007, 20 (3) : 383-391 DOI:10.1002/(ISSN)1099-1492 |
| [55] | Cieślar K, Stupar V, Canet-Soulas E et al . Alveolar oxygen partial pressure and oxygen depletion rate mapping in rats using 3He ventilation imaging[J]. Magn Reson Med , 2007, 57 (2) : 423-430 DOI:10.1002/(ISSN)1522-2594 |
| [56] | Kadlecek S, Mongkolwisetwara P, Xin Y et al . Regional determination of oxygen uptake in rodent lungs using hyperpolarized gas and an analytical treatment of intrapulmonary gas redistribution[J]. NMR Biomed , 2011, 24 (10) : 1253-1263 DOI:10.1002/nbm.1685 |
| [57] | Wild J M, Fichele S, Woodhouse N et al . 3D volume-localized pO2 measurement in the human lung with 3He MRI[J]. Magn Reson Med , 2005, 53 (5) : 1055-1064 DOI:10.1002/(ISSN)1522-2594 |
| [58] | Marshall H, Parra-Robles J, Deppe M H et al . 3He pO2 mapping is limited by delayed-ventilation and diffusion in chronic obstructive pulmonary disease[J]. Magn Reson Med , 2014, 71 (3) : 1172-1178 DOI:10.1002/mrm.v71.3 |
| [59] | Kaushik S S, Cleveland Z I, Cofer G P et al . Diffusion-weighted hyperpolarized 129Xe MRI in healthy volunteers and subjects with chronic obstructive pulmonary disease[J]. Magn Reson Med , 2011, 65 (4) : 1154-1165 DOI:10.1002/mrm.22697 |
| [60] | Saam B T, Yablonskiy D A, Kodibagkar V D et al . MR imaging of diffusion of 3He gas in healthy and diseased lungs[J]. Magn Reson Med , 2000, 44 (2) : 174-179 DOI:10.1002/(ISSN)1522-2594 |
| [61] | Salerno M, Altes T A, Mugler J P et al . Hyperpolarized noble gas MR imaging of the lung: potential clinical applications[J]. Eur J Radiol , 2001, 40 (1) : 33-44 DOI:10.1016/S0720-048X(01)00347-3 |
| [62] | Van Beek E J R, Wild J M, Kauczor H U et al . Functional MRI of the lung using hyperpolarized 3-helium gas[J]. J Magn Reson Imag , 2004, 20 (4) : 540-554 DOI:10.1002/(ISSN)1522-2586 |
| [63] | Sun Xian-ping(孙献平), Han Ye-qing(韩叶清), Luo Qing(罗晴) et al . Hyperpolarized 129Xe magnetic resonance imaging and its applications in biomedicine(超极化129Xe磁共振波谱和成像及在生物医学中的应用)[J]. Physics(物理) , 2011, 40 (6) : 381-390 |
| [64] | Wild J M, Marshall H, Xu X et al . Simultaneous imaging of lung structure and function with triple-nuclear hybrid MR imaging[J]. Radiology , 2013, 267 (1) : 251-255 DOI:10.1148/radiol.12121153 |
| [65] | Driehuys B, Cofer G P, Pollaro J et al . Imaging alveolar-capillary gas transfer using hyperpolarized 129Xe MRI[J]. Proc Natl Acad Sci USA , 2006, 103 (48) : 18278-18283 DOI:10.1073/pnas.0608458103 |
| [66] | Deninger A J, Månsson S, Petersson J S et al . Quantitative measurement of regional lung ventilation using 3He MRI[J]. Magn Reson Med , 2002, 48 (2) : 223-232 DOI:10.1002/mrm.10206 |
| [67] | Sakai K, Bilek A M, Oteiza E et al . Temporal dynamics of hyperpolarized 129Xe resonances in living rats[J]. J Magn Reson B , 1996, 111 : 300-304 DOI:10.1006/jmrb.1996.0098 |
| [68] | Dregely I, Ruset I C, Mata J F et al . Multiple-exchange-time xenon polarization transfer contrast (MXTC) MRI: Initial results in animals and healthy volunteers[J]. Magn Reson Med , 2012, 67 (4) : 943-953 DOI:10.1002/mrm.23066 |
| [69] | Dregely I, Mugler J P, Ruset I C et al . Hyperpolarized Xenon-129 gas-exchange imaging of lung microstructure: First case studies in subjects with obstructive lung disease[J]. J Magn Reson Imag , 2011, 33 (5) : 1052-1062 DOI:10.1002/jmri.22533 |
| [70] | Muradyan I, Butler J P, Dabaghyan M et al . Single-breath xenon polarization transfer contrast (SB-XTC): Implementation and initial results in healthy humans[J]. J Magn Reson Imag , 2013, 37 (2) : 457-470 DOI:10.1002/jmri.v37.2 |
| [71] | Qing K, Ruppert K, Jiang Y et al . Regional mapping of gas uptake by blood and tissue in the human lung using hyperpolarized xenon-129 MRI[J]. J Magn Reson Imag , 2014, 39 (2) : 346-359 DOI:10.1002/jmri.24181 |
| [72] | Driehuys B, Mñller H E, Cleveland Z I et al . Pulmonary perfusion and xenon gas exchange in rats: MR imaging with intravenous injection of hyperpolarized 129Xe[J]. Radiology , 2009, 252 (2) : 386-393 DOI:10.1148/radiol.2513081550 |
| [73] | Cleveland Z I, Mñller H E, Hedlund L W et al . In vivo MR imaging of pulmonary perfusion and gas exchange in rats via continuous extracorporeal infusion of hyperpolarized 129Xe[J]. PLoS One , 2012, 7 (2) : e31306 DOI:10.1371/journal.pone.0031306 |
| [74] | Cleveland Z I, Mñller H E, Hedlund L W et al . Continuously infusing hyperpolarized 129Xe into flowing aqueous solutions using hydrophobic gas exchange membranes[J]. J Phys Chem B , 2009, 113 (37) : 12489-12499 DOI:10.1021/jp9049582 |
| [75] | Zhou X, Graziani D, Pines A . Hyperpolarized xenon NMR and MRI signal amplification by gas extraction[J]. Proc Natl Acad Sci USA , 2009, 106 (40) : 16903-16906 DOI:10.1073/pnas.0909147106 |
 2014, Vol. 31
2014, Vol. 31