文章信息
- 吴瑞琪, 李博, 刘悦, 徐富强
- WU Rui-qi, LI Bo, LIU Yue, XU Fu-qiang
- 光激活磁共振脑功能成像的研究现状及前景
- Current State and Future of Optogenetic Functional Magnetic Resonance Imaging
- 波谱学杂志, 2014, 31(2): 295-305
- Chinese Journal of Magnetic Resonance, 2014, 31(2): 295-305
-
文章历史
收稿日期: 2013-06-27
收修改稿日期: 2013-07-17


2. 武汉光电国家实验室,湖北 武汉 430074;
3. 中国科学院大学,北京 100049
2. Wuhan National Laboratory of Optoelectronics, Wuhan 430074, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
汉语表达中常说的“心中所想”、“心存意识”,延用了中国古代人以“心”为思维中心的论说.如今,人们已经普遍知道,大脑才是执行人类正常的思维活动、认知心理、社会行为的中心器官.神经精神疾病大多与大脑结构或功能受损有关,而这种损伤不仅会影响脑的功能,更会妨碍学习、思考、情感等活动.
极其复杂而又精密的大脑是将人类有别于其他动物的最重要的器官.人脑由数量惊人的神经元(~1011个)和神经胶质细胞组成,而把脑中这些神经元连接起来的突触,即负责传递信号的结构,数量更为巨大(~2×1015个),形成无穷数目的神经回路或网络,作为行使大脑正常生理功能,如学习、思考、情感和行为等的结构基础.反过来当某些回路受各种因素影响而发生不同程度的变异时,就会出现与之相应的神经精神疾病.如此复杂的组成形式让我们在对大脑的结构及功能的研究中遭遇了重大的挑战,同时,得力于这种组成形式所奠定的智慧和研究智慧形成的过程,使我们对大脑的认识不断地深入,同时也促进了人类的智慧.
对大脑这个结构和功能都极为复杂的器官的研究,人们使用了各类科学技术与方法[1-3].但磁共振成像(Magnetic Resonance Imaging, MRI)技术,因其综合了无损性、高穿透性、较高的时空间分辨率等优势,从而得到了迅速发展.伴随MRI技术应用的拓展,被用于反映大脑功能活动状态的磁共振脑功能成像(functional MRI, fMRI),经过20年的飞速发展,已成为基础脑科学和神经精神疾病研究中最重要的研究手段之一,被广泛地应用于神经科学、心理科学和认知科学等各个领域中.
fMRI技术已经对神经生物学的发展做出了巨大的贡献,并仍具有强大潜力.新发展起来的光遗传学技术(Optogenetics),与fMRI结合的新方法--光激活磁共振脑功能成像(Optogenetic fMRI, ofMRI, opto-fMRI)的出现,为fMRI技术更有效地推动神经生物学的发展,提供了契机.该技术能够通过选择性地控制大脑中特定类型的神经细胞的活动,实现对特定大脑网络中的某个或某些特定节点活动,获得相关神经网络的应答特性,从而解析相关网络的结构、功能、以及相关脑区在特定脑功能中的作用及其相互关系;同时,可以综合高时空精准的扰动与功能性血液动力学响应情况,用于分析神经活动、大脑能量代谢及其血氧水平依赖(Blood Oxygen Level Dependent, BOLD)信号之间的特征关系.本文将对ofMRI的研究现状及发展前景做概括性的介绍.
1 技术介绍 1.1 fMRI技术简介早在1990年,S.Ogawa等人利用MRI技术在活体麻醉大鼠上发现了BOLD效应[4].次年,第一批人脑的fMRI实验[5],打开了在体脑功能研究的新篇章.fMRI技术凭借低辐射、高穿透、高分辨、高通量等优势,近年来被迅速应用于脑科学研究,发展成为生物影像学中最重要的研究手段之一.其应用领域由起初的大脑皮层功能的定位,到不同脑区的功能图谱的绘制;从对各种感觉、感知系统等基本脑功能机制的研究,到对学习、记忆、心理、认知等高级脑功能的探索[6].
fMRI的基本原理是利用MRI技术检测神经活动引起的血液动力学变化来研究神经活动.用于研究血液代谢的MRI方法有BOLD-fMRI[4, 7]、灌注成像[8]、扩散张量成像[9, 10]和脑血容积成像[11, 12]等.通常所说的fMRI指的是在研究应用中占主导地位的BOLD-fMRI.其信号基础大致可以认为是,某个脑区的神经活动增加,则该脑区的能量消耗随之增加,但能量供应和代谢需求并非定量匹配,这种不匹配导致脱氧血红蛋白(顺磁性)的含量降低,从而提高局部脑区中质子的T2*弛豫时间,最终导致MRI信号上升(正向BOLD).而当某个脑区神经活动降低时,将导致MRI信号下降(负向BOLD).由此,BOLD-fMRI就为神经科学工作者提供了一项无损、实时观察大脑在行使不同任务时与之相应的脑区及其神经活动的改变程度的技术.
目前,fMRI技术已经被大量应用于神经科学、心理科学和认知科学的基础和临床研究中:如视觉、嗅觉、触觉等基本感觉及学习和记忆等高级认知功能等神经机制问题[13-16],和各类脑疾病包括老年痴呆症、帕金森和癫痫等神经系统疾病[17-19],以及孤独症、抑郁症和精神分裂症等心理精神疾病[20-22].BOLD-fMRI如此广泛地被应用,这使研究清楚BOLD的具体机制变得尤为重要和紧迫.
但实际上,BOLD信号来源与脑血流、脑血容、脑氧消耗代谢率、血管密度与尺寸、磁场强度等一系列的变化均有关系[23, 24].而另一方面,神经活动与脑血流、脑血容和血氧饱和度间的关系也相当复杂,使得神经活动与BOLD信号的关系更为复杂.关于二者关系目前主要存在两个观点:1.神经胶质细胞在介导突触活动诱导的局部脑血流上升过程中起重要作用[25-27].2.神经活动升高时能量代谢的加快对局部脑血流的上升起主要作用[28].当然,各观点并不完全冲突,神经活动导致的局部血液动力学改变很可能是多种因素的综合结果.N. K. Logothetis课题组已经通过结合电生理等方法来试图推测功能性血液动力学信号与神经活动关系,也得到了很大的认可[29],但由于具体分子通路机制问题仍无定论,因此结论还需推敲及验证.
总之,神经活动与BOLD的关联性勿容质疑,但二者间的具体作用机制还亟待研究.
1.2 光遗传学技术简介光遗传学技术是近几年发展起来的利用转基因技术将光敏感离子通道基因导入细胞的一种新型技术.光敏离子通道是一类在特定波长的激发光照射下能被活化的蛋白.利用光遗传学方法使特定类型神经细胞的膜上表达该类离子通道后,再用相应频段的光激发便能调控细胞活动.在光遗传技术出现前,人们常用电刺激来诱发神经元活动,但电刺激最大的缺点是缺乏特异性,无法实现神经元的精确定位.而化学药物结合转基因技术虽然可以精确定位到特定神经元,但化学刺激却无法实现时间上的精确控制.光遗传技术能同时做到细胞特异性(细胞类型精确)和时间特异性(ms尺度),并且将损害降到更低.目前发现了多种不同的光敏蛋白,在神经研究中最常用到的两种光敏感元件分别是视紫红质通道蛋白2 (channelrhodopins-2, ChR2)和嗜盐菌紫质(halrohodopsin,NpHR).ChR2最早在莱茵衣藻(Cblamydomonas Reinbardtii)上被发现[30],它是一种对蓝光敏感的通道蛋白,在~473 nm波长的光激发时,离子通道被打开,从而引起Na+和少量Ca2+内流,K+外流.假设细胞膜上表达这种蛋白,光诱发下能使细胞产生去极化从而达到兴奋细胞的目的(图 1);而对~589 nm的黄光敏感的NpHR最早被发现于嗜盐碱菌(Natronomonas)中[31].如果在细胞膜上表达这种光敏感的氯离子通道,再用黄光激发,Cl-将内流产生超极化,从而抑制细胞活动(图 1).由于这两种光敏蛋白的最高效率诱发光的波长相差~100 nm,为我们实现组合研究脑区的兴奋性活动(去极化)和抑制性活动(超极化)提供了机会.ChR2和NpHR的发现开拓了神经科学研究的一个新领域,并呈现出巨大的发展潜力,从而使光遗传学技术被《Nature》评为2010年的年度技术[32].

|
| 图 1 目前常用的两种光敏蛋白工具:ChR2和NpHR.(a) channelrhodopsin-2 (ChR2)和halorhodopsin (NpHR)离子通道的示意图.ChR2在波长为~473 nm的蓝光激发下被激活,引起Na+和少量Ca2+内流,K+外流,导致细胞的去极化;NpHR在波长为~589 nm的黄光激发下被激活,引起Cl-内流,导致细胞的超极化.(b) ChR2和NpHR的激发光光谱.二者的被最高效激活的激发光波长分别是~473 nm和~589 nm,相差~100 nm (修改自文献[47]) Fig. 1 Two conventional photoreactive proteins. (a) Schematic of channelrhodopsin-2 (ChR2) and the halorhodopsin (NpHR) pump. Following illumination with blue light (activation maximum 473 nm), ChR2 allows the entry of cations (mostly Na+ and very low levels of Ca2+) into the cell. NpHR is activated by yellow light illumination (activation maximum 589 nm) and allows the entry of Cl- anions. (b) Action spectra for ChR2 and NpHR. The excitation maxima for ChR2 and NpHR are separated by 100 nm, making it possible to activate each opsin independently with light (Ref.[47]) |
将光遗传学技术应用到动物上的关键是要实现在动物特定类型的细胞转入能表达光敏感膜蛋白的基因.通常的做法有3种:1.转基因动物.目前已成功实现了分别表达ChR2 [33]和NpHR [34]通道蛋白的两种系列的转基因小鼠.2.病毒载体.这是目前光遗传学研究的主导:将光敏基因跟细胞特异的启动子融合成目的片段,并利用病毒(例如二腺相关病毒,Adeno-Associated Viral Vector, AAV)作为载体将目的基因导入宿主细胞的染色体中[35].3. cre-依赖的表达体系.这个方法同时结合了转基因动物和病毒载体两种技术:在表达细胞特异性的cre-重组酶的转基因动物中导入双向倒转的光敏基因,表达cre-重组酶的细胞能够通过不可逆的反向重组来活化光敏基因,实现将光敏蛋白在动物的特定类型的细胞中表达[36].
光遗传学在近年来得到迅猛的发展,据统计全世界有多于800家科研单位在进行相关应用与研究.光遗传学技术已经在神经科学研究中发挥了重要作用.例如,可用于研究特异性的神经元的活动对动物行为的调控机制[37];亦可用于研究精神/神经疾病的生物学基础[38].有理由相信该技术将不断地被优化,比如光敏蛋白的灵敏度将得到更大提高;更多种类的满足不同研究需求的光敏蛋白将被发现.另外,光遗传技术也将会应用到更多研究领域中,推动相关领域的发展.
1.3 ofMRI技术简介光遗传学技术在神经科学中被越来越被推广,并和多种经典的研究技术(如电生理记录,行为等)得到了很好地结合,并取得了前所未有的进展[39, 40].而fMRI作为神经学研究中不可替代的脑影像技术,一旦与光遗传学技术有效结合,不仅能为研究fMRI信号的生理基础提供新途径,同时更为深入研究大脑的内在结构与功能提供有效的技术支持.
ofMRI能实现在对全脑网络环路中某个或某些节点的特定类型的神经细胞的精确刺激,获取全脑网络的血液动力学信息.通常的做法是,对已经在特定脑区的特定细胞群中成功导入光敏感蛋白的动物,进行微创伤实验,在相应脑区插入光纤进行光激活刺激以直接扰动该脑区的神经活动.同时,在高场强磁共振成像系统下,利用适配的线圈采集fMRI数据,并进行分析,以考察全脑的功能代谢活动的变化.1.可以改变不同类型的光敏蛋白或者靶细胞群,这样不同脑区微环路中的不同类型的细胞对fMRI血液动力学信号的贡献将有可能被揭示;2.也可以光激活已经导入光敏蛋白的特定功能脑区,研究它对整个脑网络的调控功能.甚至可以同时施加外周刺激,用以研究大脑内在的功能连接的变化以及这种内在变化对大脑感知外界的影响.
2 ofMRI的发展现状 2.1 研究进展2010年来自斯坦福大学和加利福尼亚大学的研究者合作发表了第一篇关于ofMRI的研究[41].他们用AAV5-CaMKⅡ a::ChR2 (H134R)-EYFP标记大鼠的初级运动皮层(Primary Motor Cortex, M1),并通过BOLD-fMRI观察到了相关脑区的活动,首次将光遗传学技术和MRI技术结合.这种AAV光控病毒的构建理念是:光敏蛋白ChR2在a钙/钙调蛋白激酶Ⅱ (CaMKⅡ a)的启动下,特异性地表达于投射神经元中(中间神经元和胶质细胞中不被表达);同时,附带的增强型YFP能在组织切片上标识被启动表达光敏蛋白的细胞,并追踪相关脑区的结构连接.病毒表达成功后,作者对动物进行了ofMRI研究,采用频率为20 Hz,脉宽为15 ms,输出功率约为6 mW的473 nm蓝光激活M1区域,在M1和丘脑中均检测到了明显的BOLD激活(图 2).同年,M. Desai等人在清醒的thy1-chr2转基因小鼠上进行了ofMRI研究[42].发现光激活初级体感皮层时,在刺激位点和同侧次级体感皮层、M1、尾状核及对侧尾状核等脑区都检测到BOLD响应.
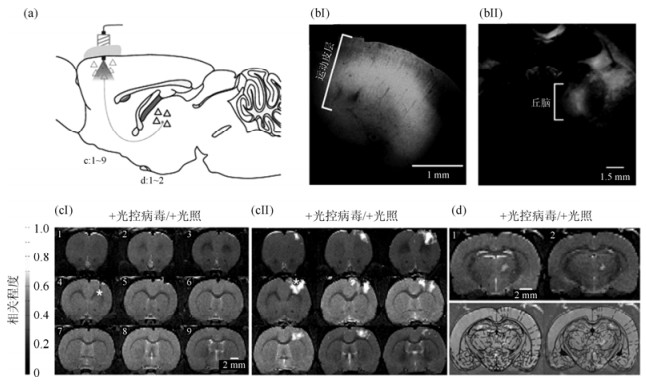
|
| 图 2 大鼠皮层中被光控病毒感染的原位区域被光激活所诱发的全脑BOLD响应.(a)病毒感染区域和光刺激区域模式图.(bⅠ) ChR2-EYFP在原位感染区域(运动皮层)的分布情况.(bⅡ) ChR2-EYFP在运动皮层投射区域丘脑的分布情况.(cⅠ)不进行病毒感染的对照组在光刺激下没有产生正的BOLD信号.(cⅡ)光激活运动皮层的投射神经元活动,在原位区域检测到可观的正BOLD信号(*,光刺激位点).(d)运动皮层的神经活动能诱导丘脑的BOLD信号.其中(c)和(d)中的各片层分别在(a)中标出(修改自文献[41]) Fig. 2 BOLD activation induced by optical stimulation on start site. (a) AAV5-CaMKⅡα::ChR2-EYFP injection and optical stimulation in M1. Slices in (c): '1~9' and (d): '1~2'. (bⅠ) Confocal images of ChR2-EYFP expression in motor cortex. (bⅡ) ChR2-EYFP in thalamus. (cⅠ), (cⅡ) BOLD activation observed with AAV5-CaMKⅡα::ChR2-EYFP but not with saline injection (asterisk, optical stimulation). (d) Thalamic ofMRI during M1 optical stimulation (top); superimposed on the Paxinos atlas (bottom) (Ref.[41]) |
此外,ofMRI也能作为研究BOLD信号特征的一个手段.I. Kahn等人利用频率为40 Hz,脉宽为8 ms,光纤尖端功率约为15 mW的473 nm蓝光精确激活thy1-chr2转基因小鼠的新皮层的椎体神经元,结合MRI和电生理,记录到了BOLD响应、单单位放电、多单位放电和局部场电位[43].并通过解析光激活引起的fMRI信号与神经电活动的关系,发现BOLD信号与神经活动在时间上符合线性转换模型(图 3).这就证实了BOLD-fMRI能被广泛使用的一个核心假设:局部脑区的间接的血液动力学响应强度与直接的神经活动强度在一定范围内大致呈线性相关.

|
| 图 3 BOLD信号的时间线性相关性.(a)多个独立的光刺激间诱发出等效的BOLD响应.一个1 s刺激和两个相隔2 s的1 s刺激的平均BOLD-fMRI时间响应曲线的时移线性加和结果等价于3个相隔2 s的1 s刺激的响应情况.(b)两个刺激和一个刺激的BOLD响应曲线之差,以及6个刺激和5个刺激的BOLD响应曲线之差均与单个刺激的血液动力响应函数相匹配(修改自文献[43]) Fig. 3 BOLD temporal linearity. (a) Optical stimulation evoked equivalent responses across multiple independent trains. Average time series of the BOLD fMRI response to one 1 s interval (single) and two trains of 1 s intervals (double) with an interstimulus interval of 2 s. Linear summation of the single trial to a 3 s shifted single trial (dashed line) provides a qualitative estimate of the temporal summation. (b) A hemodynamic response function fitted to the single trial condition is plotted against the subtracted responses for the single-double and quintuple-sextuple trial conditions (Ref.[43]) |
这些研究证明了局部脑区的投射神经元的兴奋能够诱导当地及相关脑区的BOLD激活.再结合组织荧光检测,为研究大脑的解剖连接与功能连接关系提供了新思路.尽管目前关于ofMRI领域的研究成果还非常有限,但集结了光遗传学和fMRI两项技术的巨大优势,ofMRI这项交叉的新兴技术势必具有非常广阔的应用前景.
2.2 技术限制研究人员已经开创了ofMRI的技术先河,但是任何一项方法都有它的局限之处,我们只有对技术进行全面的认识,才能更有效地发展和应用这项技术.
光遗传学技术采用的激活神经细胞的手段是损伤微小的光波,然而光照射到组织上,光子能量与组织晶格间会发生相互作用,将导致局部组织温度升高;而在另一方面,组织的核磁共振信号强度会受到温度的影响[44],所以对于理解光照区域的ofMRI信号时,我们应尤其小心.已有文章证明,光照本身引起的温度上升的确会改变BOLD信号的强度[45].我们的实验结果也表明,在对小鼠进行ofMRI实验时,能够在光照区域检测到不可忽视的负向BOLD信号(图 4).我们分析发现局部区域的负向BOLD信号强度与光强度密切相关:光功率越大,BOLD信号下降越明显.

|
| 图 4 光刺激的附近区域能被诱发产生负向BOLD信号(未发表数据).(a)用473 nm蓝光激活小鼠皮层,在光纤尖端附近检测到了负向BOLD信号.(b)分别用10 Hz、20 Hz、30 Hz和40 Hz等不同刺激频率(10 ms的脉宽,持续激光功率为~15 mW)的光诱导的BOLD响应曲线.显示刺激频率越强,引起的负向BOLD信号也越强.(N=8) Fig. 4 The negative BOLD signal in optical stimulation site. (a) The negative BOLD signal was observed at stimulation site, induced by the 473 nm blue light pulse. (b) BOLD response curves induced by 10 Hz, 20 Hz, 30 Hz and 40 Hz laser pulses. (10 ms pulse width, ~15 mW continuous power). The results showed a positive relationship between the stimulation frequency and the negative BOLD signal. (N=8) |
提醒人们在进行ofMRI研究时,务必进行严格的实验设计和数据分析方法.比如,增强对照组实验、剔除光照特征信号等等.另外,也对光遗传学技术提出要求:希望获得灵敏度更高、光热效应更小的光敏蛋白,以降低光照本身对BOLD信号的影响.这样,我们才能得到更可靠的研究结果与推断.
3 ofMRI的发展前景光遗传学技术能够多水平、多模式地控制神经活动,与fMRI技术结合,不仅能为研究fMRI信号的生理基础提供途径,同时更能为解决新的神经科学问题提供技术支持.
在通过利用ofMRI技术阐明BOLD信号所代表的能量代谢与生理基础的相关问题上,研究人员可以通过光遗传学的手段对不同类型的神经细胞转入不同类型的光敏感蛋白,细分研究特定细胞的特定活动对血液动力学信号做出的贡献.具体来讲,可以通过构建不同的病毒载体或者结合不同cre系列转基因动物(如:PV::cre,thy1::cre),以实现在投射神经元、局部神经元或胶质细胞膜上转入兴奋性的ChR2或者抑制性的NpHR离子通道蛋白.然后用对应波长的光(~473 nm或~589 nm)进行组合激活相应的神经细胞,同时检测出细胞活动所诱发的BOLD信号.再经过严格的数据分析方法解析出各种效应所引起的BOLD响应,从而获取神经活动与BOLD信号的特征关系.在此基础上,随着技术的发展,如果将ofMRI技术、电生理技术和深度光学成像技术进行结合(ofMRI技术检测BOLD信号,电生理技术直接记录神经元活动,同时光学成像技术直接观测脑血流、脑血容、血氧饱和度等血液动力学指标),并实现将这些技术所获得的高通量数据进行精密的分析,那研究清楚BOLD信号的生理基础机制便指日可待.
此外,ofMRI技术更是研究全脑神经网络功能连接的有效手段.通过实现对神经环路中某特定节点的特定类型的细胞进行精确激活,fMRI技术能获取全脑的血液动力学信息,从而研究出某个或某些特定的脑区对网络系统产生的功能效应.尤其是在考察相关脑区对整个网络的反馈作用机制的问题上,ofMRI具有其他技术不可替代的优势.由于大脑消耗的大多数能量都被用于处理内在的功能活动,真正用于接收外部刺激所消耗的能量很少.高级中枢能根据自身的状态对外周输入的信号进行整合,并作出适当的调节、控制指令.传统fMRI的研究方法主要集中于外部刺激对大脑中枢系统的扰动,很难研究这种神经网络内部的相互调控作用.然而ofMRI可以很好地用于解决内部脑区的相互调控.
更进一步,结合疾病模型动物,ofMRI也能研究不同神经疾病(如阿尔茨海默病、帕金森氏病、癫痫等)或者心理疾病(如抑郁症、强迫症、孤独症症等)的动物的全脑功能连接的改变,从而为研究相关疾病提供有价值的信息.
随着光遗传学技术的不断优化,以后将得到更灵敏、更多种类的适合不同需求的光敏工具,能为ofMRI技术的应用拓展空间.目前ofMRI技术主要集中在小动物上.今后如果在灵长类动物上开展研究,得到的结果将为在人体应用上提供更可靠的借鉴意义.2009年,麻省理工学院的研究者成功利用慢病毒载体在猕猴大脑皮质神经元中导入了ChR2基因,并证实其可在特定神经元长期稳定表达[46].这为研究灵长类动物的ofMRI提供了可行性,从而最终得到更接近人类正常和疾病状态下的全脑网络功能图谱,为对人脑功能网络的认识和对神经疾病的预测、诊断、治疗产生深远的影响.
| [1] | Bock D D, Lee W C A, Kerlin A M et al . Network anatomy and in vivo physiology of visual cortical neurons[J]. Nature , 2011, 471 : 177-182 DOI:10.1038/nature09802 |
| [2] | Chugani H T, Phelps M E, Mazziotta J C . Positron emission tomography study of human-brain functional-development[J]. Ann Neurol , 1987, 22 : 487-497 DOI:10.1002/(ISSN)1531-8249 |
| [3] | Micheva K D, Smith S J . Array tomography: A new tool for imaging the molecular architecture and ultrastructure of neural circuits[J]. Neuron , 2007, 55 : 824-824 DOI:10.1016/j.neuron.2007.08.007 |
| [4] | Ogawa S, Lee T M, Kay A R et al . Brain magnetic-resonance-imaging with contrast dependent on blood oxygenation[J]. P Natl Acad Sci USA , 1990, 87 : 9868-9872 DOI:10.1073/pnas.87.24.9868 |
| [5] | Belliveau J W, Kennedy Jr D N, McKinstry R C et al . Functional mapping of the human visual cortex by magnetic resonance imaging[J]. Science , 1991, 254 : 716-719 DOI:10.1126/science.1948051 |
| [6] | Logothetis N K . What we can do and what we cannot do with fMRI[J]. Nature , 2008, 453 : 869-878 DOI:10.1038/nature06976 |
| [7] | Aguirre G K, Zarahn E, D'Esposito M et al . The variability of human, BOLD hemodynamic responses[J]. Neuroimage , 1998, 8 : 360-369 DOI:10.1006/nimg.1998.0369 |
| [8] | Detre J A, Leigh J S, Williams D S et al . Perfusion Imaging[J]. Magnet Reson Med , 1992, 23 : 37-45 DOI:10.1002/(ISSN)1522-2594 |
| [9] | Basser P J, Mattiello J, LeBihan D . MR diffusion tensor spectroscopy and imaging[J]. Biophys J , 1994, 66 : 259-267 DOI:10.1016/S0006-3495(94)80775-1 |
| [10] | Conturo T E, Lori N F, Cull T S et al . Tracking neuronal fiber pathways in the living human brain[J]. P Natl Acad Sci USA , 1999, 96 : 10422-10427 DOI:10.1073/pnas.96.18.10422 |
| [11] | Belliveau J W, Kwong K K, Kennedy D N et al . Magnetic-resonance-imaging mapping of brain-function-human visual-cortex[J]. Invest Radiol , 1992, 27 : S59-S65 DOI:10.1097/00004424-199212002-00011 |
| [12] | Mandeville J B, Marota J J A, Kosofsky B E et al . Dynamic functional imaging of relative cerebral blood volume during rat forepaw stimulation[J]. Magnet Reson Med , 1998, 39 : 615-624 DOI:10.1002/(ISSN)1522-2594 |
| [13] | Engel S A, Glover G H, Wandell B A . Retinotopic organization in human visual cortex and the spatial precision of functional MRI[J]. Cereb Cortex , 1997, 7 : 181-192 DOI:10.1093/cercor/7.2.181 |
| [14] | Tan L H, Spinks J A, Gao J H et al . Brain activation in the processing of Chinese characters and words: a functional MRI study[J]. Hum Brain Mapp , 2000, 10 : 16-27 DOI:10.1002/(ISSN)1097-0193 |
| [15] | Thomas K M, King S W, Franzen P L et al . A developmental functional MRI study of spatial working memory[J]. Neuroimage , 1999, 10 : 327-338 DOI:10.1006/nimg.1999.0466 |
| [16] | Xu F, Liu N, Kida I et al . Odor maps of aldehydes and esters revealed by functional MRI in the glomerular layer of the mouse olfactory bulb[J]. Proc Natl Acad Sci USA , 2003, 100 : 11029-11034 DOI:10.1073/pnas.1832864100 |
| [17] | Greicius M D, Srivastava G, Reiss A L et al . Default-mode network activity distinguishes Alzheimer's disease from healthy aging: evidence from functional MRI[J]. Proc Natl Acad Sci USA , 2004, 101 : 4637-4642 DOI:10.1073/pnas.0308627101 |
| [18] | Sabatini U, Boulanouar K, Fabre N et al . Cortical motor reorganization in akinetic patients with Parkinson's disease: a functional MRI study[J]. Brain , 2000, 123 (Pt 2) : 394-403 |
| [19] | Springer J A, Binder J R, Hammeke T A et al . Language dominance in neurologically normal and epilepsy subjects: a functional MRI study[J]. Brain , 1999, 122 (Pt11) : 2033-2046 |
| [20] | Greicius M D, Flores B H, Menon V et al . Resting-state functional connectivity in major depression: abnormally increased contributions from subgenual cingulate cortex and thalamus[J]. Biol Psychiatry , 2007, 62 : 429-437 DOI:10.1016/j.biopsych.2006.09.020 |
| [21] | Just M A, Cherkassky V L, Keller T A et al . Functional and anatomical cortical underconnectivity in autism: evidence from an FMRI study of an executive function task and corpus callosum morphometry[J]. Cereb Cortex , 2007, 17 : 951-961 |
| [22] | Lynall M E, Bassett D S, Kerwin R et al . Functional connectivity and brain networks in schizophrenia[J]. J Neurosci , 2010, 30 : 9477-9487 DOI:10.1523/JNEUROSCI.0333-10.2010 |
| [23] | Uludag K, Muller-Bierl B, Ugurbil K . An integrative model for neuronal activity-induced signal changes for gradient and spin echo functional imaging[J]. Neuroimage , 2009, 48 : 150-165 DOI:10.1016/j.neuroimage.2009.05.051 |
| [24] | Zheng Y, Mayhew J . A time-invariant visco-elastic windkessel model relating blood flow and blood volume[J]. Neuroimage , 2009, 47 : 1371-1380 DOI:10.1016/j.neuroimage.2009.04.022 |
| [25] | Fox P T, Raichle M E, Mintun M A et al . Nonoxidative glucose consumption during focal physiologic neural activity[J]. Science , 1988, 241 : 462-464 DOI:10.1126/science.3260686 |
| [26] | Magistretti P J, Pellerin L . Cellular mechanisms of brain energy metabolism and their relevance to functional brain imaging[J]. Philos T Roy Soc B , 1999, 354 : 1155-1163 DOI:10.1098/rstb.1999.0471 |
| [27] | Shulman R G, Rothman D L, Behar K L et al . Energetic basis of brain activity: implications for neuroimaging[J]. Trends Neurosci , 2004, 27 : 489-495 DOI:10.1016/j.tins.2004.06.005 |
| [28] | Buxton R B, Frank L R . A model for the coupling between cerebral blood flow and oxygen metabolism during neural stimulation[J]. J Cerebr Blood F Met , 1997, 17 : 64-72 |
| [29] | Logothetis N K, Pauls J, Augath M et al . Neurophysiological investigation of the basis of the fMRI signal[J]. Nature , 2001, 412 : 150-157 DOI:10.1038/35084005 |
| [30] | Nagel G, Szellas T, Huhn W et al . Channelrhodopsin-2, a directly light-gated cation-selective membrane channel[J]. P Natl Acad Sci USA , 2003, 100 : 13940-13945 DOI:10.1073/pnas.1936192100 |
| [31] | Zhang F, Wang L P, Brauner M et al . Multimodal fast optical interrogation of neural circuitry[J]. Nature , 2007, 446 : 633-639 DOI:10.1038/nature05744 |
| [32] | Nature Methods Editorial. Method of the Year 2010[C]. Nat Methods, 2011, 8: 1. |
| [33] | Arenkiel B R, Peca J, Davison I G et al . In vivo light-induced activation of neural circuitry in transgenic mice expressing channelrhodopsin-2[J]. Neuron , 2007, 54 : 205-218 DOI:10.1016/j.neuron.2007.03.005 |
| [34] | Zhao S L, Cunha C, Zhang F et al . Improved expression of halorhodopsin for light-induced silencing of neuronal activity[J]. Brain Cell Biol , 2008, 36 : 141-154 DOI:10.1007/s11068-008-9034-7 |
| [35] | Boyden E S, Zhang F, Bamberg E et al . Millisecond-timescale, genetically targeted optical control of neural activity[J]. Nat Neurosci , 2005, 8 : 1263-1268 DOI:10.1038/nn1525 |
| [36] | Chakravarthy S, Keck T, Roelandse M et al . Cre-dependent expression of multiple transgenes in isolated neurons of the adult forebrain[J]. Plos One , 2008, 3 : e3059 DOI:10.1371/journal.pone.0003059 |
| [37] | Carter M E, Yizhar O, Chikahisa S et al . Tuning arousal with optogenetic modulation of locus coeruleus neurons[J]. Nat Neurosci , 2010, 13 : 1526-1117 DOI:10.1038/nn.2682 |
| [38] | Tonnesen J, Sorensen A T, Deisseroth K et al . Optogenetic control of epileptiform activity[J]. Proc Natl Acad Sci USA , 2009, 106 : 12162-12167 DOI:10.1073/pnas.0901915106 |
| [39] | Aravanis A M, Wang L P, Zhang F et al . An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology[J]. J Neural Eng , 2007, 4 : S143-156 DOI:10.1088/1741-2560/4/3/S02 |
| [40] | Tsai H C, Zhang F, Adamantidis A et al . Phasic firing in dopaminergic neurons is sufficient for behavioral conditioning[J]. Science , 2009, 324 : 1080-1084 DOI:10.1126/science.1168878 |
| [41] | Lee J H, Durand R, Gradinaru V et al . Global and local fMRI signals driven by neurons defined optogenetically by type and wiring[J]. Nature , 2010, 465 : 788-792 DOI:10.1038/nature09108 |
| [42] | Desai M, Kahn I, Knoblich U et al . Mapping brain networks in awake mice using combined optical neural control and fMRI[J]. J Neurophysiol , 2011, 105 : 1393-1405 DOI:10.1152/jn.00828.2010 |
| [43] | Kahn I, Desai M, Knoblich U et al . Characterization of the functional MRI response temporal linearity via optical control of neocortical pyramidal neurons[J]. J Neurosci , 2011, 31 : 15086-15091 DOI:10.1523/JNEUROSCI.0007-11.2011 |
| [44] | Parker D L . Applications of NMR imaging in hyperthermia -an evaluation of the potential for localized tissue heating and noninvasive temperature monitoring[J]. Ieee T Bio-Med Eng , 1984, 31 : 161-167 |
| [45] | Christie I, Wells J A, Southern P et al . fMRI response to blue light delivery in the naÏve brain: Implications for combined optogenetic fMRI studies[J]. Neuroimage , 2012, 66 : 634-641 |
| [46] | Han X, Qian X, Bernstein J G et al . Millisecond-timescale optical control of neural dynamics in the nonhuman primate brain[J]. Neuron , 2009, 62 : 191-198 DOI:10.1016/j.neuron.2009.03.011 |
| [47] | Zhang F, Aravanis A M, Adamantidis A et al . Circuit-breakers: optical technologies for probing neural signals and systems[J]. Nat Rev Neurosci , 2007, 8 : 577-581 DOI:10.1038/nrn2192 |
 2014, Vol. 31
2014, Vol. 31



