文章信息
- 高振华, 何小伟, 郭永彪, 邹传品
- GAO Zhen-hua, HE Xiao-wei, GUO Yong-biao, ZOU Chuan-pin
- α, α-二(2-羟乙基)苯乙腈分子内环合现象的核磁共振研究
- The NMR Study on the Intramolecular Cyclization of α, α-Bis(2-Hydroxyethyl)phenylacetonitrile
- 波谱学杂志, 2014, 31(2): 284-294
- Chinese Journal of Magnetic Resonance, 2014, 31(2): 284-294
-
文章历史
收稿日期: 2014-02-21
收修改稿日期: 2014-03-05


4-苯基取代的哌啶衍生物是治疗中枢神经系统疾病的一类重要药物,如哌替啶[1]和地芬诺辛[2]等.已报道的此类哌啶衍生物的合成策略主要有两种,其一是苯乙腈与氮取代二(2-卤乙基)胺环合构建哌啶环[3, 4];其二是α, α-二(2-卤乙基)苯乙腈与伯胺环合构建哌啶环[5, 6],两种合成策略均存在反应步骤长,反应底物范围受限等缺点.Ban等人[7]以α, α-二(2-羟乙基)苯乙腈(2a)为原料,提出了一种高效合成哌啶衍生物的新方法.在其研究中,首先尝试将化合物2a中两个羟基甲磺酰化,然后与伯胺环合构建哌啶环,但收率很低.后改为将化合物2a中两个羟基转化为三氟甲磺酸酯,再与伯胺环合构建哌啶环,通过对反应条件的筛选与优化,得到了较好的产率,但存在合成试剂昂贵、中间体稳定性差等缺点.
本文以苯乙腈为原料,提出了一种在二异丙基胺基锂(LDA)的作用下连续与两分子环氧乙烷反应,一步合成化合物2a的新方法.在产物2a的结构确证过程中,通过对1H NMR、13C NMR、DEPT、HSQC、HMBC等谱图的解析,发现该化合物存在分子内环合现象,化合物2a与3a是一对互变异构体,共存于如Scheme 1所示的平衡体系中.本文还合成了两个系列化合物2b、3b与2c、3c(结构如Scheme 2),进一步证明了此类化合物存在互变异构现象.该现象正是造成以化合物2a为原料,通过甲磺酰化合成哌啶衍生物产率低下的原因,对改进哌啶衍生物的合成方法具有一定的指导意义.

|
| Scheme1 |

|
| Scheme2 |
通过文献检索,此前仅有一篇文献对化合物2a的1H NMR进行了简单的归属[8],未提及化合物2a存在分子内环合的现象.文献中使用Varian A-60A型核磁共振谱仪,以氘代二甲基亚砜为溶剂给出了化合物2a的氢谱数据:1H NMR(DMSO-d6):δ 7.50(s, PhH),3.33(m, -CH2O), 2.21(m, -CH2-).我们使用氘代氯仿为溶剂所得化合物2a在400 MHz仪器的4(2′)、3(1′)氢谱化学位移数据与文献值相比,由于溶剂效应更偏向于低场;由于本文仪器的分辨率比文献[8]所用仪器高,归属得到化合物2a H-3 (或H-1′) (CH2)均不等价(见表 1);同时还存在有互变异构体3a的氢信号,得到H-4(CH2)和H-2′(CH2)均不等价(见表 2).
1 实验部分 1.1 试剂所用原料苯乙腈,对甲氧基苯乙腈、戊腈、正丁基锂均为市售化学纯;二异丙基胺、环氧乙烷、二氯甲烷等均为市售分析纯;无水四氢呋喃(THF)使用钠沙回流处理,以二苯甲酮为指示剂,使用前蒸出;所用氘代氯仿、氘代丙酮、氘代二甲基亚砜与氘代甲醇均为光谱纯.
1.2 仪器与测定条件所有NMR实验均在Bruker Avance Ⅲ-400型超导核磁共振谱仪上进行,采用氘代氯仿、氘代丙酮、氘代甲醇与氘代二甲基亚砜为溶剂.1H NMR、13C NMR以TMS为内标(δ 0),1H NMR工作频率为400.13 MHz,谱宽8 223.7 Hz;13C NMR工作频率为100.61 MHz,谱宽26 041.7 Hz.二维谱包括HSQC与HMBC谱,均采用标准脉冲程序.HSQC的F2 (1H)和F1 (13C)维的谱宽分别为5 341.9 Hz和16 666.7 Hz,采样数据点阵t2×t1=512×128;HMBC的F2 (1H)和F1 (13C)维的谱宽分别为5 330.5 Hz和22 347.8 Hz,采样数据点阵t2×t1=2 048×128.
HR-MS用美国Agilent公司的6520 Q-TOF型高分辨率质谱仪,电喷雾离子源.
1.3 化合物2、3的合成将二异丙基胺(7.70 mL,55 mmol)溶于50 mL无水THF中,氩气保护下降温至-40℃,滴入2.4 mol/L正丁基锂(23 mL,55 mmol),反应1 h;降温至-78℃,滴入反应物腈1(25 mmol),继续搅拌反应0.5 h;滴入环氧乙烷(2.42 g,55 mmol),反应0.5 h,缓慢升至0℃反应1 h,加入10 mL水终止反应.蒸除大部分THF,加入50 mL二氯甲烷与20 mL水萃取,水相用50 mL二氯甲烷再次萃取;合并有机相,饱和食盐水洗,无水硫酸钠干燥,过滤,蒸除溶剂,得粗品.经硅胶柱色谱分离得白色固体,收率60~70%.
1.4 化合物4、5的合成将化合物2a与3a (205 mg,1 mmol)溶于10 mL二氯甲烷中,加入三乙胺(0.42 mL,3 mmol),氩气保护下降温至0℃,滴入甲磺酰氯(0.23 mL,3 mmol),升至室温搅拌3 h;加入1 mL饱和碳酸氢钠水溶液终止反应.加入20 mL二氯甲烷与20 mL水萃取,水相用20 mL二氯甲烷再次萃取;合并有机相,饱和食盐水洗,无水硫酸钠干燥,过滤,蒸除溶剂,得粗品.经硅胶柱色谱分离得化合物4 (15 mg,4.2%)与化合物5 (224 mg,62.4%).
化合物4:1H NMR (CDCl3, 400 MHz): δ 7.56~7.36 (m, 5H), 4.20 (m, 4H), 2.94 (s, 6H), 2.59 (dt, J=14.1, 7.0 Hz, 2H), 2.46 (ddd, J=14.4, 6.8, 6.0 Hz, 2H); 13C NMR (CDCl3, 100 MHz): δ 135.0、129.6、129.0、125.7、120.3、64.69、43.25、39.67、37.41.
化合物5:1H NMR (CDCl3, 400 MHz): δ 7.59~7.31 (m, 5H), 4.68 (dd, J=12.7, 4.6 Hz, 1H), 4.34 (m, 2H), 4.01 (ddd, J=10.5, 7.8, 6.5 Hz, 1H), 3.14 (s, 3H), 2.93 (s, 3H), 2.85 (dd, J=13.4, 4.4 Hz, 1H), 2.55 (m, 1H), 2.48 (m, 2H); 13C NMR (CDCl3, 100 MHz): δ 175.8、136.4、129.5、128.6、126.2、72.01、65.81、53.04、42.39、37.98、37.37、35.45.
2 结果与讨论 2.1 化合物2a与3a的波谱解析化合物1a经上述反应后得到的粗产物,经硅胶柱色谱(石油醚:乙酸乙酯,1:1)分离后得到一较纯产物,经TLC检识为单一斑点.对其进行高分辨质谱分析,实测值为206.117 6,计算值为206.118 1,确定其分子式为C12H16NO2[M+H]+,与化合物2a一致.
为进一步确定其结构,我们采用1D NMR和2D NMR等核磁共振技术[9-11]对其进行归属.在氘代氯仿中,此产物的1H NMR出现了10组谱峰,最低场δH 7.26~7.40处的氢为苯环上的氢信号,较低场δH 3.30~4.50处的氢应为与氧相连的碳上的氢信号,高场处δH2.10~2.70为烷烃上的氢信号,由低场到高场其比例大致呈现为10:1:4:1:1:1:2:2:2:2(图 1),这与化合物2a的氢谱谱图是不相符的.其13C NMR数据显示为18个碳信号,远多于化合物2a.结合DEPT谱图分析,δC 122.4处为一个季碳信号,推测为化合物2a的氰基碳信号.在δC 176.1处也存在一个季碳信号,与文献中报道[12]的亚胺内酯结构中季碳信号相符,而γ-羟基腈类化合物本身存在成环的可能[13, 14],因此推测产物体系中存在如Scheme 1中化合物3a的结构,即说明产物可能是化合物2a和3a的混合物.对其HSQC分析,高场处δC 41.20、40.42、37.25为4组CH2信号,其中δC 37.25为2个碳信号的重叠峰;较低场δC 55.33和53.85为季碳信号,δC 68.06,65.05和58.71为4组与氧相连的CH2信号,其中δC 65.05为2个碳信号的重叠峰,其余为苯环上的2组季碳和10组叔碳信号,这与前面对产物是化合物2a和3a的混合物的推测相符.
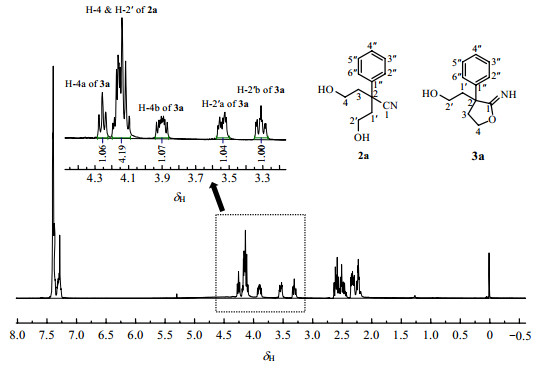
|
| 图 1 化合物2a和3a在氘代氯仿中的1H NMR图谱(400 MHz) Fig. 1 1H NMR spectrum of compounds 2a and 3a in chloroform-d (400 MHz) |
为进一步证明上述推断的合理性,我们对其异核多键相关谱(HMBC)进行了详细分析(图 2),并进行了碳氢信号的归属.在HMBC图中可以看到氰基碳δC 122.4与高场处的2组CH2信号δH 2.58和2.31 (δC 37.25,C-3与C-1')以及低场区的2组CH2信号δH4.14(4H,m,δC65.05,C-4与2')有明显的HMBC相关,这样即对化合物2a的C-3(1')和C-4(2')进行了归属.H-4(2')和H-3(1')与δC55.33有明显的HMBC相关,说明δC 55.33为化合物2a的C-2位.H-3(1',δH 2.58,2H,m,δH 2.31,2H,m)与δC144.1有相关,即为苯环上的季碳C-1''.这样,化合物2a的结构即被确定下来(见表 1).

|
| 图 2 化合物2a和3a在氘代氯仿中的HMBC图谱(400 MHz) Fig. 2 HMBC spectrum of compounds 2a and 3a in chloroform-d (400 MHz) |
| No. | Chemical shift | HSQC 1J(C, H) (cross signal) | Protons showing HMBC correlation coupling | |
| 1H | 13C | |||
| 1'' | / | 144.1 | / | 3(1′) [3J(C, H)] |
| 2''(6''), 3''(5''), 4'' | 7.26~7.40 | 126.0~128.8* | + | * |
| 1 | / | 122.4 | / | 3(1′) [3J(C, H)] 4(2′) [4J(C, H)] |
| 4(2′) | 4.14 | 65.05 | + | 3(1′) [2J(C, H)] |
| 2 | / | 55.33 | / | 3(1′) [2J(C, H)] 4(2′) [3J(C, H)] |
| 3(1′) | 2.58, 2.31 | 37.25 | + | 4(2′) [2J(C, H)] |
| *苯环上2''(6''), 3''(5''), 4''位置的碳氢信号在HSQC、HMBC谱中的信号重合,未做具体归属 | ||||
同时,我们发现在HMBC图上,除化合物2a的碳氢信号相关外,还有一部分碳氢信号呈现多键相关,且与化合物2a无任何相关,说明在氘代氯仿系统中,化合物1a的合成产物并非是单一化合物2a,而是由2a和3a组成的混合物.以下是对化合物3a的归属:δC 176.1处的亚胺酯的碳信号与较低场处的H-4a/b(δH4.25,1H,m,δH3.89,1H,m,δC 68.06)有强HMBC相关,说明确实生成了亚胺内酯结构.剩下的较低场处的另一组CH2信号即为C-2' (δH3.53,1H,m,3.30,1H,m,δC 58.71).C-1又与高场处的2组CH2信号δH 2.47,2.21有多键相关,结合HSQC谱确定为C-3或者C-1'信号.其中δH2.47处的氢信号与C-4有明显相关,即确定为H-3(δH2.47,δC 40.42),剩下的一组CH2即为H-1' (δH2.21,δC 41.20).由H-4,H-3,H-2',H-1'与季碳δC53.85的HMBC相关,证明此季碳为C-2.H-3和H-1'与苯环上季碳δC 139.2的相关,证明为C-1''.至此,上述讨论证明了化合物3a的存在(见表 2).
| No. | Chemical shift | HSQC 1J(C, H) (cross signal) | Protons showing HMBC correlation coupling | |
| 1H | 13C | |||
| 1 | / | 176.1 | / | 3 [3J(C, H)] 1′ [3J(C, H)] 4 [3J(C, H)] |
| 1'' | / | 139.2 | / | 3 [3J(C, H)] 1′ [3J(C, H)] |
| 2''(6''), 3''(5''), 4'' | 7.26~7.40 | 126.0~128.8* | + | * |
| 4 | 4.25, 3.89 | 68.06 | + | 3 [2J(C, H)] |
| 2′ | 3.53, 3.30 | 58.71 | + | 1′ [2J(C, H)] |
| 2 | / | 53.85 | / | 3 [2J(C, H)] 1′ [2J(C, H)] 4 [3J(C, H)] 2′ [3J(C, H)] |
| 1′ | 2.21 | 41.20 | + | 2′ [2J(C, H)] 3 [3J(C, H)] |
| 3 | 2.47 | 40.42 | + | 4 [2J(C, H)] 1′ [3J(C, H)] |
| *苯环上2''(6''), 3''(5''), 4''位置的碳氢信号在HSQC、HMBC谱中的信号重合,未做具体归属 | ||||
在确定了化合物2a和3a的结构后,我们尝试对化合物2a和3a苯环上2''(6'')、3''(5'')、4''位置的碳氢信号进行归属.13C NMR数据中尚未归属的6个碳信号(如图 3)δC 128.8、128.6、127.4、126.7(126.74)、126.7(126.69)、126.0其化学位移值均处在低场,与苯环碳信号相符.结合DEPT与HSQC谱图分析,以上6个碳均为叔碳,且均存在与苯环氢信号δH 7.26~7.40的HSQC相关,证明δC128.8、128.6、127.4、126.7(126.74)、126.7 (126.69)、126.0为化合物2a和3a的C-2''(6'')、C-3''(5'')、C-4''.因氢谱中苯环上的氢信号重叠,且此处碳信号化学位移值差别不大,造成无法通过HSQC、HMBC等2D NMR对化合物2a和3a的C-2''(6'')、C-3''(5'')、C-4''进行准确地归属,故在表 1与表 2中未列出化合物2a和3a的C-2''(6'')、C-3''(5'')、C-4''分别的化学位移值.

|
| 图 3 化合物2a与3a在氘代氯仿中的13C NMR图谱(400 MHz) Fig. 3 13C NMR spectrum of compounds 2a and 3a in chloroform-d (400 MHz) |
根据1D、2D NMR技术,我们证明了在氘代氯仿系统中,化合物1a的合成产物为化合物2a和3a的混合物.对其低场区的氢信号进行积分分析,化合物2a的H-4、H-2'峰面积与化合物3a的H-4a、H-4b、H-2'a、H-2'b的峰面积之比大约为1:1,说明化合物2a和3a在氘代氯仿中各以约50%的形式存在.
2.2 化合物2a与3a在不同氘代试剂中的氢谱分析以上我们讨论了化合物2a与3a在氘代氯仿中的1D、2D NMR归属情况,通过对氢谱氢信号的积分,发现化合物2a与3a在氘代氯仿中的比例约为1:1.从反应机理的角度考虑,我们认为化合物2a发生分子内环合生成3a,化合物2a与3a是一对互变异构体,因此设计通过更换溶剂观察化合物2a与3a在不同溶剂中的比例变化情况.

|
| 图 4 化合物2a与3a在不同溶剂中的1H NMR (400 MHz).(a)化合物2a与3a在氘代氯仿中;(b)化合物2a与3a在氘代丙酮中;(c)化合物2a与3a在氘代甲醇中;(d)化合物2a与3a在氘代二甲基亚砜中 Fig. 4 1H NMR spectra of compounds 2a and 3a in different solvents (400 MHz). (a) Compounds 2a and 3a in chloroform-d; (b) Compounds 2a and 3a in acetone-d6; (c) Compounds 2a and 3a in methanol-d4; (d) Compounds 2a and 3a in DMSO-d6 |
如图 4所示(a)~(d)分别为化合物2a与3a在氘代氯仿、氘代丙酮、氘代甲醇与氘代二甲基亚砜中的氢谱放大图.通过对其氢谱的分析可以看出,与氘代氯仿相比,化合物2a与3a在氘代丙酮、氘代甲醇、氘代二甲基亚砜中的比例发生了明显的变化,在以上4种氘代溶剂中化合物2a与3a的比例分别为:1:1(氘代氯仿),1:3(氘代丙酮),1:8(氘代甲醇)与1:13(氘代二甲基亚砜),不同溶剂条件下比例不同,证明化合物2a与3a间存在互变异构平衡.
2.3 同系列化合物(2b、3b与2c、3c)在不同氘代试剂中的氢谱分析为了进一步证明化合物2a与3a间存在互变异构平衡,我们又合成了系列化合物2b、3b与2c、3c.通过1D与2D NMR分析发现化合物2b、3b和2c、3c与化合物2a、3a具有相似的波谱规律;通过对不同氘代试剂中1H NMR的分析,发现与化合物2a、3a相同,在不同的氘代溶剂中,化合物2b、3b与2c、3c比例不同(见表 3),这进一步证明了此类结构的化合物存在互变异构现象.化合物2与3在不同溶剂中的比例分布具有规律性,在低极性溶剂条件下,平衡偏向于开环产物2a、2b与2c,在高极性溶剂条件下,平衡偏向于关环产物3a、3b与3c.
| 底物 | 产物 | 产物比例(化合物2:化合物3) | |||
| 氯仿 | 丙酮 | 甲醇 | DMSO | ||
| 1a | 2a, 3a | 1:1 | 1:3 | 1:8 | 1:13 |
| 1b | 2b, 3b | 3:4 | 1:4 | 1:10 | 1:13 |
| 1c | 2c, 3c | 4:1 | 3:4 | 1:5 | 1:6 |
前面提到,Ban等人[7]尝试将化合物2a甲磺酰化,然后与伯胺环合构建哌啶环,但收率很低.我们通过NMR谱图分析证明化合物2a并不是单一化合物,而是一种与化合物3a构成的互变异构平衡体系.对化合物2a进行甲磺酰化时(Scheme 3),不仅会生成目标化合物4,还将产生副产物5.因化合物3a中亚胺基的反应活性远大于2a中的羟基,甲磺酰化反应时会拉动平衡右移,造成化合物3a甲磺酰化产物5 (62.4%)的产率远大于目标化合物4(4.2%).因化合物2a分子内环合导致化合物4产率低下,这正是以α, α-二(2-羟乙基)苯乙腈为原料,经甲磺酰化后再与伯胺反应难以制备哌啶衍生物的原因.

|
| Scheme3 |
本文对α, α-二(2-羟乙基)苯乙腈类化合物的1H NMR、13C NMR、DEPT、HSQC、HMBC等进行了谱图解析,结合衍生化反应结果,证明此类化合物存在因分子内环合所致的互变异构现象.该现象解释了使用α, α-二(2-羟乙基)苯乙腈为原料,甲磺酰化后再与伯胺反应生成哌啶衍生物产率低下的原因,对改进哌啶衍生物的合成方法具有一定的指导意义.
| [1] | Robert F, Foley K M, Grabinski P Y et al . Central nervous system excitatory effects of meperidine in Cancer Patients[J]. Ann Neurol , 1983, 13 (2) : 180-185 DOI:10.1002/(ISSN)1531-8249 |
| [2] | Jackson L S, Stafford J E . The evaluation and application of a radioimmunoassay for the measurement of diphenoxylic acid, the major metabolite of diphenoxylate hydrochloride, in human plasma[J]. Journal of Pharmacological Methods , 1987, 18 (3) : 189-197 DOI:10.1016/0160-5402(87)90069-6 |
| [3] | Thompson D, Reeves P C . Facile synthesis of N-substituted-4-cyano-4-phenylpiperidines via phasetransfer catalysis[J]. J Heterocycl Chem , 1983, 20 (3) : 771-772 DOI:10.1002/jhet.v20:3 |
| [4] | Anker R M, Cook A H, Heilbron I M . Experiments in the piperidine series[J]. J Chem Soc , 1945 : 917-920 DOI:10.1039/jr9450000917 |
| [5] | Lomenzo S A, Rhoden J, Izenwasser S et al . Synthesis, dopamine and serotonin transporter binding affinities of novel analogues of meperidine[J]. Bioorg Med Chem Lett , 1999, 9 (23) : 3273-3276 DOI:10.1016/S0960-894X(99)00606-X |
| [6] | Bergel F, Morrison A L, Rinderknecht H . A new synthesis of pethidine and similar compounds[J]. J Chem Soc , 1944 : 265-267 DOI:10.1039/jr9440000265 |
| [7] | Asano S, Ban H . A convenient one-pot prepapation of N-substituted 4-phenylpiperidines[J]. Heterocycles , 2008, 75 (1) : 183-188 DOI:10.3987/COM-07-11206 |
| [8] | Wilt J W, Niinemae R . Synthesis and solvolysis of β, β-divinyl-β-phenethyl tosylate[J]. J Org Chem , 1979, 44 (14) : 2533-2538 DOI:10.1021/jo01328a044 |
| [9] | Gao Hong-chang(高红昌), Fang Xiao-wen(方晓雯), Zhang Tao(张涛) et al . NMR studies for the 1, 2-dihydro-4-(4-hydroxy-phenyl) (2H) phthal azine-1-one(1, 2-二氢-4-(4-羟基苯基) (2H)二氮杂萘-1-酮的NMR研究)[J]. Chinese J Magn Reson(波谱学杂志) , 2001, 18 (4) : 343-349 |
| [10] | Zhang Zhi(张志), Mao Wen-ping(毛文平), Liu Chao-yang(刘朝阳) . Progress in development of paulse programmer for nucler magnetic resonance(核磁共振脉冲序列发生器研究进展)[J]. Chinese J Magn Reson(波谱学杂志) , 2012, 29 (3) : 339-345 |
| [11] | Yang Qiu-qing(杨秋青), Liu Bo-qian(刘博谦), Han Kang(韩康) . Pure and mixed enantionmer of moxifloxacin hydrochloride studied by NMR spectroscopy(盐酸莫西沙星对映体及混合体的核磁共振研究)[J]. Chinese J Magn Reson(波谱学杂志) , 2012, 29 (1) : 119-127 |
| [12] | Khadem H S, Crossman A, Allen A et al . Peroxidation of saccharide phenylhydrazones: novel hydrazono-1, 4-lactones[J]. J Org Chem , 1991, 56 (24) : 6944-6946 DOI:10.1021/jo00024a046 |
| [13] | Larcheveque M, Debal A . A convenient synthesis of γ-hydroxy and γ-keto nitriles[J]. Synthetic Commun , 1980, 10 (1) : 49-57 DOI:10.1080/00397918008080053 |
| [14] | Matsui H, Ishimoto S . The structure of ω-cyanoalkanols (Ⅰ) infrared spectrometric studies[J]. Tetrahedron Lett , 1966, 7 (17) : 1827-1830 DOI:10.1016/S0040-4039(00)90265-X |
 2014, Vol. 31
2014, Vol. 31



