文章信息
- 吴春丽, 李杰明, 魏会杰, 蒋月明, 杭晔, 陈新丽, 朱凯
- WU Chun-li, LI Jie-ming, WEI Hui-jie, JIANG Yue-ming, HANG Ye, CHEN Xin-li, ZHU Kai
- 阿托伐他汀内酯的波谱学数据与结构确证
- Spectral Analysis and Structural Elucidation of Atorvastatin Lactone
- 波谱学杂志, 2014, 31(2): 268-277
- Chinese Journal of Magnetic Resonance, 2014, 31(2): 268-277
-
文章历史
收稿日期: 2013-05-07
收修改稿日期: 2013-09-05


阿托伐他汀内酯(atorvastatin lactone, 1),化学名为(4R,6R)-6-{2-[2-(4-氟苯基)-5-异丙基-3-苯基-4-(苯基氨基甲酰基)吡咯-1-基]-2-基}-4-羟基四氢-2H-吡喃-2-酮,是阿托伐他汀钙[1, 2](一种治疗低血胆甾醇和防止动脉硬化的药物)合成过程中最易产生的一种杂质.经文献检索发现,文献[3, 4]报道的重点都是阿托伐他汀内酯合成方法的研究,其文献[3]中仅报道了阿托伐他汀内酯的一维氢谱和碳谱数据,对3个芳环上的碳氢信号没有给予归属,且内酯环上的碳氢信号归属均出现了错误,有关阿托伐他汀内酯的UV,IR及1H NMR,13C NMR谱的全归属尚未见到报道.我们对其进行了比较全面的波谱表征,测定了阿托伐他汀钙内酯的紫外吸收光谱(UV)、红外吸收光谱(IR)、核磁共振氢谱(1H NMR)、氢-氢相关谱(1H-1H COSY)、核磁共振碳谱(13C NMR)、DEPT谱、异核单量子相关谱(HSQC)、异核多键相关谱(HMBC)及质谱(MS),分析讨论了1H NMR和13C NMR谱的特征,并对所有峰进行了归属,同时分析讨论了其IR吸收峰所对应的官能团的振动形式以及MS的主要碎片离子的可能的裂解方式.上述工作对该类产品的研究提供了更多的结构及光谱和波谱信息,为阿托伐他汀钙的质量研究提供较为全面的参考依据.

|
| 图 1 阿托伐他汀内酯的结构式 Fig. 1 The structure of atorvastatin lactone |
紫外光谱用岛津UV-2550(日本岛津)测定;红外光谱用Nicolet IS10 FT-IR红外光谱仪(美国Nicolet公司)测定,KBr压片;1H NMR、1H-1H COSY、13C NMR、DEPT、HSQC和HMBC谱均用Bruker AV 400型核磁共振波谱仪(瑞士Bruker公司)测定,核磁共振谱仪装备有5 mm探头和控温单元(VTU),实验控制温度为296 K.样品溶于DMSO-d6,以TMS为内标,1H NMR和13C NMR的工作频率分别为400.13 MHz和100.62 MHz,1H 90°脉冲宽度为10.8 μs,13C 90°脉冲宽度为6.5 μs,二维谱采用正检测探头反向模式检测,1H-1H COSY实验谱宽为5 330 Hz,累加次数为16,采样数据点阵t2×t1=1 024×512,零填充后FT变换点阵F2×F1=2 048×1 024;HSQC实验中13C谱宽为24 038 Hz,1H谱宽为5 330 Hz,采样数据点阵t2×t1=1 024×512,HMBC实验中13C谱宽为24 038 Hz,1H谱宽为5 330 Hz,累加次数为16,d2=1/2 JCH=3.45 ms(JCH为碳氢偶合常数),采样数据点阵t2×t1=1 024×256.质谱用Waters Q-Tof Micro高分辨质谱仪(美国Waters公司)测定,ESI源;元素分析用FLASH EA 1112元素分析仪(美国Thermo公司).
1.1.2 试剂氘代试剂DMSO-d6(美国CIL公司);其他所有试剂均为分析纯.
1.2 化合物1的制备阿托伐他汀内酯(atorvastatin lactone, 1)原料由本课题组分离制备得到,经HPLC测试纯度为99.84%,符合结构鉴定所需的纯度.
2 结果与讨论 2.1 UV化合物1在甲醇中的最大紫外吸收在246.00 nm处,吸收带强度(摩尔吸收系数εmax)为29 734.06,是由苯环、取代苯环和吡咯环的n→π*和π→π*引起的吸收带,为K吸收带,同时由于氮杂环中原子的未成键p电子对的p-π共轭作用,使紫外吸收红移.
2.2 IR化合物1采用KBr压片法,在阿托伐他汀内酯的IR吸收光谱中,3 365 cm-1处宽峰为缔合羟基O-H伸缩振动吸收峰,3 254 cm-1处强峰为酰胺的N-H伸缩振动吸收峰;2 971 cm-1、2 921 cm-1处中强峰为甲基C-H的伸缩振动吸收峰;1 651 cm-1为酰胺C=O的伸缩振动吸收峰;1 578 cm-1为羧酸C=O的伸缩振动吸收峰;1 595 cm-1、1 578 cm-1、1 509 cm-1、1 436 cm-1为苯环的骨架伸缩振动;843 cm-1表明分子存在1,4-二取代苯环结构;746 cm-1、691 cm-1表明分子存在苯环单取代.上述结果表明分子中含有单取代苯环、1, 4-取代苯环、酰胺基团、羧酸基团和甲基基团.具体的红外数据及归属见表 1.
| Absorption band/cm-1 | Mode of vibration | Group | Intensity |
| 3365 | ν O-H | -OH | 强且宽 |
| 3254 | ν N-H | -NH | 强 |
| 3055 | ν=C-H | Ar-H | 中强 |
| 2971,2921 | ν C-H | -CH3 | 中强 |
| 1651 | ν C=O | -NHCO | 强 |
| 1578 | ν COO | -COOH | 强 |
| 1595,1578,1509,1436 | ν C=C | Ar | 强 |
| 1317 | ν Ar-N | =C-N | 强 |
| 1216 | ν Ar-F | Ar-F | 中强 |
| 1159 | ν C-O | -COOH | 中强 |
| 843 | δ Ar-H | Ar-H | 中强 |
| 746,691 | δ Ar-H | Ar-H | 中强 |
化合物1质谱采用电喷雾电离源(ESI),正离子检测得到本品的[M+Na]+563.230 7峰和[M+H]+541.250四峰,与阿托伐他汀内酯的分子量一致.根据化合物1的结构,对主要碎片进行解析.阿托伐他汀内酯分子进行碰撞活化分解(CAD),分子中的酰胺键发生C-N键的α裂解,裂解成m/z 448.195 7的碎片;碎片中的内酯环裂解,再脱一分子CO2,得m/z 422.219 7的碎片.其主要碎片的可能裂解途径见图 2.

|
| 图 2 阿托伐他汀内酯的碎片裂解图 Fig. 2 Pyrolysis fragments of atorvastatin lactone |
化合物1的元素分析(EA)测定值(ω / %,括号内为理论值):C:73.19 (73.31);H:6.09(6.15);N:5.23(5.18);O:11.93(11.84).元素实测平均值与理论计算值误差均 < 3‰,说明阿托伐他汀内酯符合分子式C33H33N2O4F.
2.5 1H NMR和1H-1H COSY化合物1的1H NMR谱,共显示33个氢,重氢交换后显示31个氢,其中C-10位羟基和N-26位酰胺活泼氢被置换.δ 9.83为单峰,氢个数为1,重氢交换后峰消失,归属为N-26位的酰胺氢.δ 5.19为单峰,氢个数为1,重氢交换后峰消失,归属为C-10位上的羟基氢.δ 7.54~6.98为苯环上的氢,具体归属得结合HSQC及HMBC谱.H-10由于受羟基吸电子作用影响,其化学位移处于较低场δ 4.53~4.49,而H-8旁虽是O原子,但同时受C=O的推电子作用,其化学位移处于稍低场δ 4.07.δ 4.04~3.90(m, 2H)归属为H-6,结合1H-1H COSY中δ 2.64~2.58/δ 4.04~3.90及δ 2.38~2.33/δ4.04~3.90交叉峰的出现,判断δ 2.64~2.58和δ 2.38~2.33为H-7的两个质子峰.根据1H-1H COSY中δ 1.82~1.75/H-8有耦合,判断δ 1.82~1.75为H-9;H-11/H-10有耦合,判断δ 1.68~1.55为H-11.δ 1.40(d, 6H)归属为H-34和H-35,结合1H-1H COSY中δ 3.27~3.23/δ 1.40交叉峰的出现,可知δ 3.27~3.23为H-33.苯环中质子的归属见后面的分析,具体的1H NMR和1H-1H COSY数据及归属见表 2,1H-1H COSY谱图见图 3.
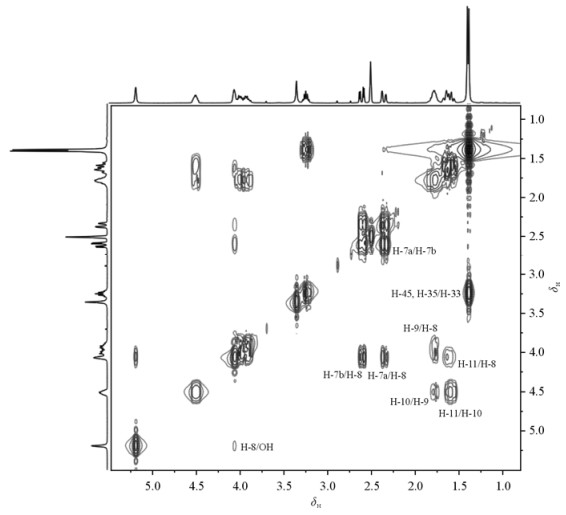
|
| 图 3 阿托伐他汀内酯1H-1H COSY谱图 Fig. 3 1H-1H COSY spectrum of atorvastatin lactone |
| Position | δH | δH(Ref.[3]) | Multiplicity | Proton number | 1H-1H COSY |
| 26** | 9.83 | 6.87 | s | 1H | / |
| 28, 32* | 7.54、7.52 | 7.20~6.96 | d, J=8.0 Hz | 2H | / |
| 14, 18, 15, 17, 20, 24* | 7.31~7.19 | m | 6H | / | |
| 21, 23, 29, 31* | 7.10、7.09 | d, J=4.0 Hz | 4H | / | |
| 22, 30* | 7.04~6.98 | m | 2H | / | |
| OH** | 5.19 | 2.37 | br s | 1H | / |
| 10** | 4.53~4.49 | 4.29~4.16 | m | 1H | H-9, H-11 |
| 8** | 4.07 | 4.54~4.44 | s | 1H | H-7, H-9, H-11 |
| 6 | 4.04~3.90 | 4.10~3.98 | m | 2H | H-7 |
| 33 | 3.27~3.23 | 3.58~3.48 | dt, J=7.0 Hz, 14.0 Hz | 1H | H-34, 35 |
| 7a* | 2.64~2.58 | / | dd, J=4.5 Hz, 16.0 Hz | 1H | H-6, H-8, H-7b |
| 7b* | 2.38~2.33 | dd, J=2.1 Hz, 16.0 Hz | 1H | H-6, H-8, H-7a | |
| 9** | 1.82~1.75 | 1.60~1.55 | m | 2H | H-8, H-10 |
| 11** | 1.68~1.55 | 2.66~2.49 | m | 2H | H-10 |
| 34, 35 | 1.40 | 1.53~1.50 | d, J=6.7 Hz | 6H | H-33 |
| *为文献中未明确归属的氢信号;**为文献中归属错误的氢信号. | |||||
化合物1共有4个芳环,本实验对碳谱峰进行逐个归属如下:
C-13~C-18苯环中,F取代基致使苯环上的碳原子发生了裂分,根据其偶合常数可确定该苯环上各碳谱峰的归属:J=244.0 Hz的163.4、160.9两重峰归属为C-16,由于受F强吸电子诱导作用,在所有芳环碳中处于最低场.J=21.0 Hz的116.1、115.9两重峰归属为C-15、C-17位两个等同碳,受其邻位碳上F取代基推电子共轭作用,处于所有芳环碳中的最高场.J=8.2 Hz的133.9、133.8两重峰归属为C-14、C-18位两个等同碳,受其间位碳上F取代基吸电子诱导作用,化学位移处在较低场.J=3.0 Hz的129.0处两重峰归属为C-13.上述的化学位移和偶合常数与氟代苯中相应碳的化学位移和偶合常数都接近[5, 6].
δ 129.6、128.9、128.1和119.9处的谱峰特别强,为两个苯环上的四类等同碳.δ 119.9峰在HMBC谱中和H-26(NH,δ 9.83)远程偶合,有C-28/H-26,C-32/H-26交叉峰,归属为C-28和C-32,它们受其邻位C-27的酰胺取代基的推电子共轭作用,处于较为高场.在HSQC谱中,可相应归属得到H-28(δ 7.54)和H-32(δ 7.52).δ 128.1峰在HMBC谱中和H-28、H-32远程偶合,有C-29/H-28,C-29/H-32,C-31/H-28,C-31/H-32交叉峰,归属为C-29和C-31.同时,在HMBC谱中有C-29/(δ 7.04~6.98),C-31/(δ7.04~6.98)交叉峰,故将δ 7.04~6.98归属为H-30.其余的δ 129.6,δ 128.9应为吡咯环的3位苯取代基的C-21、C-23和C-20、C-24两对等同碳.受吡咯环推电子共轭作用,邻位C-20和C-24(δ128.9)处在相对高场.
峰强中等的δ 125.9和δ 123.5应为芳环上两个次甲基碳.受对位碳上酰胺基的共轭推电子作用,位于相对高场的峰δ 123.5归属于C-30,处于相对低场的δ 125.9峰则应归属于C-22.
其余的谱峰为芳环上的季碳峰,这些碳核在核磁共振中的弛豫时间相对较长,故峰强度相对较弱.在HMBC谱中,δ 139.9处峰与H-6、H-33、H-34和H-35有远程耦合,归属为C-5.因其受N的吸电子诱导作用,化学位移位于较低场.峰δ 127.8只受H-6的远程偶合,归属为C-2.峰δ 118.2受H-33的远程偶合,归属为C-4.δ 136.5处峰受H-28和H-32的远程偶合,归属为C-27,受酰胺基N原子的吸电子诱导作用,化学位移处在较低场.剩余的两个尚未归属的季碳中,C-3为吡咯环β位,其化学位移应比苯环碳处在更高场(δ 121.3),且这比较接近于吡咯环β位另一碳C-4的化学位移(δ 118.2);而化学位移在较低场(δ 135.2)的谱峰则归属为C-19.
根据2.5节中已归属的氢谱结果,再由HSQC中的相关信号,可进一步归属出位于高场的剩余所有碳信号:δ 73.43为C-10;δ 61.59为C-8;δ 40.30为C-6;δ 38.92为C-7;δ 37.34为C-9;δ 35.08为C-11;δ 26.14为C-33;δ 22.87、δ 22.74为C-34和C-35.
具体的13C NMR、DEPT、HSQC和HMBC数据及归属见表 3,HSQC和HMBC图分别见图 4、5.
| No. | δC | δC(Ref.[3]) | DEPT | HSQC | HMBC |
| 12 | 170.2 | 169.4 | C | / | H-11 |
| 25 | 166.5 | 164.9 | C | / | H-26 |
| 16 | 163.4、160.9 | 162.3 | C | / | H-15、17,H-14、18 |
| 5 | 139.9 | 141.3 | C | / | H-6,H-33,H-34、35 |
| 27 | 136.5 | 138.2 | C | / | H-28、32,H-29、31 |
| 19 | 135.2 | 134.4 | C | / | H-20、24,H-21、23 |
| 14、18 | 133.9、133.8 | 133.1 | CH | H-14,H-18 | H-15、17,H-18、14 |
| 21、23* | 129.6 | / | CH | H-21,H-23 | H-20、24,H-23、21 |
| 13* | 129.0 | / | C | / | H-15、17 |
| 20、24* | 128.9 | / | CH | H-20,H-24 | H-24、20,H-21、23 |
| 29、31* | 128.1 | / | CH | H-29,H-31 | H-31、29,H-30 |
| 2* | 127.8 | / | C | / | H-6,H-14、18 |
| 22 | 125.9 | 126.6 | CH | H-22 | H-20、24,H-21、23 |
| 30* | 123.5 | / | CH | H-30 | H-28、32 |
| 3 | 121.3 | 122.1 | C | / | H-21、23 |
| 28、32 | 119.9 | 119.7 | CH | H-28,H-32 | H-29、31,H-28、32,H-30,H-26 |
| 4** | 118.2 | 130.4 | C | / | H-33 |
| 15、17 | 115.8、116.1 | 115.6 | CH | H-17,H-15 | H-14、18,H-15、17 |
| 10** | 73.43 | 62.4 | CH | H-10 | H-9,H-11 |
| 8** | 61.59 | 73.0 | CH | H-8 | H-7,H-9 |
| 6 | 40.30 | 40.7 | CH2 | H-6 | H-7 |
| 7** | 38.92 | 37.1、37.0 | CH2 | H-7 | H-6,H-9 |
| 9** | 37.34 | 35.6 | CH2 | H-9 | H-11,H-7 |
| 11** | 35.08 | 38.5 | CH2 | H-11 | H-9 |
| 33 | 26.14 | 26.1 | CH | H-33 | H-34,H-35 |
| 34、35 | 22.87、22.74 | 22.0、21.7 | CH3 | H-34,H-35 | H-33,H-34,H-35 |
| *为文献中未明确归属的碳信号;**为文献中归属错误的碳信号. | |||||

|
| 图 4 阿托伐他汀内酯的HSQC谱图 Fig. 4 HSQC spectrum of atorvastatin lactone |

|
| 图 5 阿托伐他汀内酯的HMBC谱图 Fig. 5 HMBC spectrum of atorvastatin lactone |
在NMR谱信号归属中,我们对比了本文与文献报道的碳谱和氢谱数据,可以看到:首先,谱图测定的溶剂不一致.文献中氢谱、碳谱分别以CDCl3、CD3OD作溶剂,而本文均采用DMSO-d6作为溶剂.因溶剂本身对谱图的测定会有一定的影响,所以,不同溶剂测得的数据会有所不同.我们注意到化合物1含有4个苯环,起初我们以CDCl3作为溶剂测定氢谱,未完全氘代的溶剂CHCl3会对苯环氢的积分有一定的影响,所以选择DMSO-d6作为测定溶剂,实验表明DMSO溶剂峰不会对化合物1碳氢信号峰的归属造成影响.其次,谱图信号的归属有一定的差别.文献仅仅通过碳谱和氢谱信号峰对化合物1的碳氢进行了简单的归属,难免会出现大量错误,且论据不足.本文通过1H NMR、1H-1H COSY、13C NMR、DEPT、HSQC、HMBC等手段,对化合物1的结构进行了全面分析与验证,明确归属了其所有的碳氢信号峰.
综上分析,通过MS、EA确定了阿托伐他汀内酯的分子式,红外光谱显示出各基团的特征吸收.目标化合物1的1H NMR和13C NMR实验结果与其结构式一致,由DEPT实验确定了全去偶13C NMR谱中各碳的类型,根据1H NMR、1H-1H COSY和HSQC谱归属了含质子的碳原子,HMBC谱显示出碳氢远程偶合的异核相关信息,进一步证实了碳氢信号的归属,季碳信号的指认和结构单元的连接顺序.各图谱归属合理,根据以上分析结果确证了阿托伐他汀内酯(化合物1)的化学结构.
| [1] | Hu Xiao(胡晓), Chu Lan(楚兰), Liu Qi(刘琦) . Effects of atorvastatin calcium on carotid atherosclerosis and the stability of plaques(阿托伐他汀钙抗颈动脉粥样硬化及稳定斑块的作用)[J]. Chinese J Cerebrovasc Dis(中国脑血管病杂志) , 2008, 5 (9) : 390-394 |
| [2] | Chen Xiao-rong(陈小容), Nie Ben-gang(聂本刚) . Effects of atorvastatin on vascular congnitive impairment combined with hyperlipidemia(阿托伐他汀钙对血管性认知障碍合并高脂血症患者的血脂及认知功能的影响)[J]. Chinese General Practice(中国全科医学) , 2009, 8 (12) : 1382-1384 |
| [3] | Pramod S, Martin E M . A novel strategy towards the atorvastatin lactone[J]. Tetrahedron , 2010, 66 : 9738-9744 DOI:10.1016/j.tet.2010.10.028 |
| [4] | Jan S, Jaroslav H, Lukas P et al . , Synthesis of some impurities and/or degradation products of atorvastatin[J]. Collect Czech Chem Commun , 2008, 73 (2) : 229-246 DOI:10.1135/cccc20080229 |
| [5] | Ning Yong-cheng(宁永成) . Structural Identification of Organic Compounds and Organic Spectroscopy(有机化合物结构鉴定与有机波谱学)[M]. Beijing(北京): Science Press(科学出版社), 2000 : 27 -223. |
| [6] | Yu De-quan(于德全), Yang Jun-shan(杨峻山) . Manual of Analytical Chemistry(7th sort): Nuclear Magnetic Resonance Spectroscopy(分析化学手册(第七分册)-核磁共振波谱分析)[M]. Beijing(北京): Chemical Industry Press(化学工业出版社), 1999 . |
 2014, Vol. 31
2014, Vol. 31



