文章信息
- 朱新术, 崔家涛, 冯银刚, 张景涛, 崔球
- ZHU Xin-shu, CUI Jia-tao, FENG Yin-gang, ZHANG Jing-tao, CUI Qiu
- 热纤梭菌中心代谢产物的归属及初步代谢组分析
- Metabolomic Analysis of Clostridium thermocellum
- 波谱学杂志, 2014, 31(2): 243-252
- Chinese Journal of Magnetic Resonance, 2014, 31(2): 243-252
-
文章历史
收稿日期: 2013-05-30
收修改稿日期: 2013-11-25


2. 中国科学院大学,北京 100049;
3. 中国科学院生物燃料重点实验室,中国科学院青岛生物能源与过程研究所, 山东 青岛 266101
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. CAS Key Laboratory of Biofuels, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, China
木质纤维素是地球上最丰富的可再生资源之一,将其转化为生物燃料是极具潜力的化石能源替代方案.由于目前木质纤维素的转化过程复杂导致成本过高,因此人们提出了整合生物加工(Consolidated bioprocessing,CBP)技术,将木质纤维素的降解、转化和燃料的生成整合在同一个生物体(通常为微生物)中,从而减少中间环节降低生产成本.热纤梭菌是一种嗜热厌氧的革兰氏阳性细菌,能够高效的降解利用木质纤维素,并可以通过厌氧发酵产生乙醇,因而是目前最有潜力的CBP菌株之一[1].然而,野生型热纤梭菌存在一些不足,包括降解木质纤维素产生的乙醇浓度较低难以回收利用,存在其他代谢通路产生大量的副产物,无法利用半纤维素和木质素等,严重制约了其工业化应用[2].通过代谢工程手段对其代谢通路进行改造,是克服这些瓶颈的有效手段,而通过代谢物组学策略对其代谢通路和代谢瓶颈进行分析,将为热纤梭菌的代谢工程改造提供合适的靶点和方案.
代谢物、代谢路径、代谢网络和代谢表型是细胞和环境因子相互作用的最终结果,作为系统生物学的重要组成部分,代谢物组学(metabolomics/metabonomics)是从整体上揭示细胞在受到内外干扰的最终结果.代谢物组学已广泛用于病理生理学、药理毒理学、以及微生物细胞胁迫-响应机制研究[3-5].已有学者利用基于气相色谱-质谱联用的代谢物组学方法分析了低浓度乙醇(0.5%,V/V)对热纤梭菌野生株进行“冲激”的动态代谢物组学研究,结果发现纤维二糖和糖磷酸在细胞中的积累导致了菌体的生长抑制现象,并且与转录组学和蛋白质组学相结合研究,发现乙醇冲激条件下热纤梭菌野生株发生的最大变化是氮源同化相关的基因和蛋白质[6].核磁共振(NMR)方法和质谱方法在代谢物组学研究中具有一定的互补性,NMR方法具备一些质谱方法所不具备的优点,特别是NMR方法没有偏向性,可能鉴定到特殊的代谢物组分,并可以进一步通过多维NMR技术解析代谢物的结构[7-9].目前文献中尚无使用NMR方法对热纤梭菌的代谢组进行研究的报道,而对热纤梭菌代谢物的归属是进行代谢组研究的基础.
这里,利用基于NMR的代谢物组学技术分析热纤梭菌的水相代谢物,除了检测到常见的代谢物如氨基酸、有机酸、醇类、核苷酸等之外,还检测到热纤梭菌样品含有几种较特殊的代谢物,包括纤维糊精、磷酸烯醇式丙酮酸以及赤藓糖-4-磷酸.本文详细分析了这3种代谢物的归属,并讨论了他们的生理意义.在此基础上,利用多元统计学方法对热纤梭菌野生株和乙醇耐受株进行了初步代谢物组学研究.
1 实验部分 1.1 仪器及试剂NMR试剂:NaCl、K2HPO4·3H2O和NaH2PO4·2H2O为分析纯级试剂,购自国药集团化学试剂有限公司.D2O (99.9% D)和4, 4-dimethyl-4-silapentane-1-sulfonic acid (DSS)购自剑桥同位素试剂实验室(Miami, USA).磷酸盐缓冲液(100 mmol/L, pH 7.4)使用含10% D2O配制,提供NMR锁场信号,0.02 mmol/L 4, 4-dimethyl-4-silapentane-1-sulfonic acid (DSS)作为化学位移校正和浓度定量的内标.
1.2 菌株、培养基和培养条件热纤梭菌野生株和乙醇耐受株由中国科学院青岛生物能源与过程研究所徐健研究员馈赠.菌种用25% (V/V)甘油管保存于-80℃冰箱备用.热纤梭菌培养使用的培养基为改良的GS-2培养基,其组分为(g/L):KH2PO41.0,K2HPO4·3H2O 5.0,尿素1.0,MgCl2·6H2O 2.5,CaCl2·2H2O 0.05,FeSO4·7H2O 0.001 25,Cysteine hydrochloride 3.0,纤维二糖10.0,MOPS 6.0,酵母粉10.0,Na3C6HO7·2H2O 3.0和刃天青0.002;pH 7.6.所有培养基均在厌氧箱(10% CO2, 5% H2和85% N2)中制备,用铝盖包裹的橡胶塞密封后,在115℃灭菌20 min.热纤梭菌接种后,在60℃培养箱培养.热纤梭菌的生长曲线使用600 nm的吸光度(OD600)测定.
1.3 热纤梭菌胞内代谢物组提取热纤梭菌培养至对数生长后期时,离心(10 800 g,4℃)10 min收集菌体,菌体沉淀用磷酸缓冲液洗两遍,以去掉残余的培养基组分和细胞碎片,然后使用热乙醇法淬灭细胞代谢活动并提取其代谢物.具体步骤包括:使用磷酸缓冲液清洗菌体沉淀,用去离子水悬浮细胞,快速加入3倍体积的无水沸乙醇,95℃水浴保持5 min,随后室温下冷却.离心(13 000 g,4℃) 5 min收集上清液,用旋转蒸发仪低温旋蒸去除乙醇至1 mL左右,然后用冷冻干燥机(-40℃,24 h)彻底除去水分,最后密封保存到-80℃冰箱备用.
1.4 NMR实验大约40 mg冻干粉样品溶于500 μL D2O,加入100 μL磷酸盐缓冲液(100 mmol/L,pH 7.4,10% D2O,0.02 mmol/L DSS),离心(13 000 g,4℃)5 min,上清液移入5 mm NMR样品管进行分析.所有的NMR谱均通过Bruker AVⅢ 600型核磁共振谱仪(5 mm反向超低温探头)298 K采集,对应的质子共振频率为600.13 MHz,脉冲序列为标准的noesypr1d.每个实验的90°脉宽设置约为10 μs,谱宽为12 kHz,采样点数32 768,采样时间1.36 s,FID累加64次.在傅立叶变换前,将所有1H NMR谱的FID乘以增宽因子为0.5 Hz的指数窗函数.
为了对1H NMR信号进行归属,采集了样品的J-Res、1H-1H COSY、1H-1H TOCSY、1H-13C HSQC和1H-13C HMBC等一系列2D NMR谱.J-Res的谱宽分别为50 Hz (F1)和6 313 Hz (F2),采样数据矩阵为2 048×50,每个FID累加48次.对于COSY和TOCSY实验,1H-1H COSY的F2 (1H)和F1 (1H)维的谱宽均为6 000 Hz,采样数据矩阵为2 048×126,每个FID累加64次.TOCSY实验中,选用MLEV-17组合脉冲进行自旋锁定,混合时间为100 ms.HSQC的采样期间用强度为5 000 Hz的组合脉冲(GARP)对13C信号去偶,F2(1H)和F1 (13C)维的谱宽分别为6 313 Hz和26 410 Hz,采样数据矩阵为2 048×128;HMBC的F2 (1H)和F1(13C)维的谱宽分别为6 786 Hz和33 202 Hz,采样数据矩阵为2 048×126,每个FID累加200次.数据填零得到矩阵为4 096×2 048.在傅立叶变换前加sine或相移sine窗函数对2D NMR谱进行处理.
1H NMR谱图首先用TopSpin (v2.0, Bruker Biospin)进行手动的相位和基线的校正.然后对NMR谱图δ 0.5~9.5区间通过AMIX软件包(v3.8.3,Bruker Biospin)均匀地划分成3 166个积分区间,每个区间长度为0.003 ppm (1.8 Hz).经分段积分的原始NMR数据可以获得一组二维n(观测样本数)× d(变量数即积分间隔)的数据矩阵,每个矩阵元素的值为相应区段的积分面积.使用总面积归一化方法,利用SIMCA-P+(v11.0,Umetrics, Sweden)软件包里面的PCA工具,均值中心化的NMR数据,结果分别用Scores图和Loadings图来表示.
1.5 LC-MS分析为了确定热纤梭菌纤维糊精的聚合度,样品进一步使用ESI-MS进行分析.所用系统为Agilent 1290 Infinity超高效液相色谱和Agilent 6430三重四级杆质谱(Agilent Technologies, Santa Clara, CA, USA).色谱条件:色谱柱:ACQUITY UPLC® HSS T3 (2.1 mm×150 mm×1.8 μm, Waters, Dublin, Ireland);二元流动相:A,1‰甲酸水溶液;B,1‰甲酸乙腈溶液;洗脱梯度:0~8 min,0% B,8~10 min,0%~10% B,10~20 min,10% B, 20~28 min,10%~40% B,28~40 min,40%~80% B,40~45 min,80%~95% B,45~50 min,95% B,50~51 min,95%~0% B,51~60 min,0% B;流速:200 μL/min;进样体积:10 μL;柱温:25℃.质谱条件:电喷雾电离源正离子模式;喷雾温度:250℃;脱溶剂氮气流速:1 L·min-1;毛细管电离电压:3 kV;孔径电压:80 V;检测器电压:2.5 kV;质量扫描范围:200~2 000 D;试验气路:氮气.采用软件MassHunter (Version 1.3.0)进行数据采集及处理.
2 结果与讨论 2.1 热纤梭菌代谢物NMR信号归属使用获得的1H NMR谱及2D COSY,TOCSY,HSQC和HMBC等谱图,基于文献数据[10, 11]和MMCD数据库[12], 对热纤梭菌的1H NMR谱中的代谢物进行了归属,共获得了39种水相代谢物的归属.这些代谢物主要包括氨基酸、糖类、有机酸、有机胺、醇类和核苷酸及其衍生物等.除了常见的水相代谢物,还鉴定到了几种较特殊的代谢物,包括纤维糊精(Cellodextrin,CD)、磷酸烯醇式丙酮(Phosphoenolpyruvate,PEP)、赤藓糖-4-磷酸(D-Erythrose-4-phosphate,E4P),其结构式及其化学位移归属如图 1和表 1所示.下面对这几种特殊代谢物的归属及其生物学意义进行较为详细的分析和讨论.

|
| 图 1 纤维糊精(Cellodextrin, CD)、磷酸烯醇式丙酮酸(Phosphoenolpyruvate, PEP)、赤藓糖-4-磷酸(D-Erythrose-4-phosphate, E4P)的化学结构式. Fig. 1 Chemical structures of Cellodextrin (CD), Phosphoenolpyruvate (PEP) and D-Erythrose-4-phosphate(E4P) |
| Assignment | Position | δC | δH(J/Hz) | HSQC | 1H -1H COSY | HMBC |
| Cellodextrin | 1 | 101.4 | 4.92 (m) | + | H-2 | H-1, H-2 |
| (CD) | 2 | 82.4* | 3.59* (m) | + | H-1, H-3 | H-1, H-3 |
| 3 | 75.9* | 3.80* (m) | + | H-2, H-4 | H-2, H-4 | |
| 4 | 69.5* | 3.52* (m) | + | H-3 | H-2, H-3, H-5 | |
| 5 | 76.5* | 3.46* (m) | + | H-6 | H-4, H-6 | |
| 6, 6’ | 61.6 | 3.80*, 3.94* (m) | + | H-5 | H-4, H-5 | |
| α-1 | 95.5 | 5.23 (d, 3.7) | + | / | / | |
| β-1 | 98.1 | 4.64 (d, 7.8) | + | / | / | |
| Phosphoenolpyruvate | 3, 3’ | 102.4 | 5.18/5.36 (s) | + | / | / |
| (PEP) | 2 | 151.0 | / | / | / | H-3, H-3’ |
| 1 | 172.4 | / | / | / | H-3, H-3’ | |
| Erythrose-4-phosphate | 1 | 94.2 | 5.29 (d, 1.5) | + | H-2 | H-2, H-3, H-4 |
| (E4P) | 2 | 75.3 | 4.14 (m) | + | / | / |
| 3 | 81.4 | 4.38 (m) | + | / | / | |
| 4, 4’ | 71.5 | 4.03, 3.90 (m) | + | / | / | |
| *为文献[13]中未明确归属的碳氢信号 | ||||||
纤维糊精是由不同数量的葡萄糖分子间脱去1分子H2O以β-1, 4糖苷键结合构建成不同聚合度的纤维糊精.热纤梭菌水相代谢物的TOCSY [图 2(b)]谱图表明:δ4.92与δ3.46、δ3.52、δ3.59、及δ3.80的质子形成耦合网络,HSQC谱图[图 3(a)]给出其对应的C的化学位移,分别为δ101.4、δ76.5、δ69.5、δ82.4、δ75.9;其中,δC101.4为β-(1-4)糖苷键C-1原子, δC 82.4为β-(1-4)糖苷键C-2原子,而δC 61.6与δH3.80、3.94为糖环末端的亚甲基碳氢原子,而δ 69.5、δ75.9、δ 76.5分别为连有-OH的糖环上的次甲基C-4、C-3及C-5的信号,两个异头碳质子α-H-1 δ5.23 (d,3.7 Hz)及β-H-1 δ 4.64 (d,8.0 Hz)也可以观察到.这些信号与文献[13]中报道的纤维糊精C-1、C-6及两个异头碳质子α, β-H-1的化学位移一致,而C-2~C-5及H的化学位移值则补充了文献中归属不完整的数据.因此,这些信号被归属为纤维糊精.然而,纤维糊精的聚合度信息难以从NMR谱图中得到,为此,样品进一步使用ESI-MS进行分析(详见2.2节).

|
| 图 2 热纤梭菌水相代谢物的2D COSY(a)、TOCSY(b)、HSQC(c)和HMBC(d) NMR谱图,纤维糊精(Cellodextrin,CD)、磷酸烯醇式丙酮酸(Phosphoenolpyruvate,PEP)、赤藓糖-4-磷酸(D-Erythrose-4-phosphate,E4P)信号归属如图所示 Fig. 2 2D COSY(a)、TOCSY(b)、HSQC(c) and HMBC(d) NMR spectra of extracts of Clostridium thermocellum. Signals for Cellodextrin (CD), Phosphoenolpyruvate (PEP) and D-Erythrose-4-phosphate (E4P) are indicated |
热纤梭菌胞内代谢产物还发现了含有高能磷脂键的PEP典型信号,在HSQC谱图中[图 2(c)],低场δ5.18(s)和δ5.36(s)的两个质子连接在同一个碳原子上(δ 102.4),提示这两个质子为“CH2=C*”,且邻位碳(C*)为不对称碳原子;在HMBC谱图中[图 2(d)],δ5.18和δ5.36两个单峰分别与δ150.6(烯基碳)和δ172.4(羧/羰基碳)碳原子耦合,所以这个代谢物可能为磷酸烯醇式丙酮酸(PEP),实验观测到的化学位移值与MMCD数据库中PEP标准品(expnmr_00106)的化学位移一致,进一步确认了PEP的归属.
2.1.3 赤藓糖-4-磷酸的归属热纤梭菌乙醇提取物中还可能存在磷酸戊糖途径(PPP途径)中的四碳糖-赤藓糖-4-磷酸,通过COSY谱δ5.29与δ4.14的质子耦合[图 2(a)],进一步通过2D HSQC谱[图 2(c)]和HMBC谱[图 2(d)]显示δH5.29 (δC94.2)与δC81.4、δC71.5、δC75.3耦合.以上信息结合MMCD标准物数据库(expnmr_00050)的化学位移,推断此物质为赤藓糖-4-磷酸.
2.2 纤梭菌纤维糊精ESI-MS鉴定为了确定热纤梭菌纤维糊精的聚合度,样品进一步使用ESI-MS进行分析,其结果如图 3所示.不同聚合度的(N=2~10)纤维糊精的重复单元葡萄糖残基的CH-1~6原子的归属如图 2(c)所示,然而,纤维糊精的聚合度信息是难以从NMR谱图中得到的.从ESI-MS谱图(图 3)可知,不同聚合度的纤维寡糖加钠离子峰(m/z):365.0、527.0、689.0、851.3、1 013.0、1 175.0、1 337.0、1 499.3、1 661.6可以被检测到,各组分间的差值为1个葡萄糖残基的分子量162,分别对应纤维二糖至纤维十糖的分子量;此外,纤维寡糖加二钠离子峰(m/z):517.9、599.1、680.3、761.2、842.3、923.1,由于带两个正电荷,故其组分间的差值为81,进一步证实了不同聚合度n(最大N=10)的纤维糊精的归属.
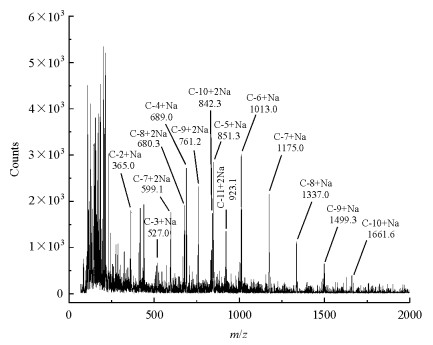
|
| 图 3 热纤梭菌水相提取物的ESI-MS谱图, 不同聚合度(N=2~10)分子量相差162的纤维寡糖加钠离子的一系列峰(m/z): 365.0、527.0、689.0、851.3、1 013.0、1 175.0、1 337.0、1 499.3、1 661.6以及部分分子量相差81的纤维寡糖加二钠离子峰(m/z): 599.1、680.3、761.2、842.3、923.1如图所示 Fig. 3 ESI-MS spectra of aqueous extracts of Clostridium thermocellum. Characteristic signals for cellodextrin (CD) are indicated |
为了验证基于1H NMR的代谢物组能否反映热纤梭菌的生理生化状态,使用主成分分析(PCA)进一步处理野生型和乙醇耐受菌株的NMR数据.结果发现3组样本只用两个主成分就可以解释超过98.1%的变量(数据未展示),这表明这3种代谢表型之间存在潜在的本质区别.乙醇耐受型与野生型热纤梭菌在有/无乙醇胁迫下两两比较的PCA图表明(图 4):与野生型相比,CD和E4P在耐受型菌株中的含量较高;而在3%乙醇胁迫下,CD和E4P含量降低.首先对于E4P,由于热纤梭菌基因组缺少正常磷酸戊糖途径的关键酶6-磷酸葡萄糖酸脱氢酶[14],所以E4P可能来源于非氧化的磷酸戊糖途径(noPPP).在微生物细胞内,磷酸戊糖途径主要是为合成代谢提供NADPH和5-磷酸核糖是生成的四碳、五碳、七碳化合物的重要的多功能代谢途径.E4P在耐受菌株中的积累表明,noPPP的增强可能增强其乙醇耐受性.至于PEP,3个表型的热纤梭菌都检测到该化合物,且耐受型比野生型热纤梭菌中的含量要低,这表明乙醇可能抑制了热纤梭菌糖酵解途径.PEP通过丙酮酸把糖酵解路径和TCA循环连接起来,处于糖酵解和TCA循环的重要节点上.Herrero等人利用31P NMR研究表明,乙醇抑制热纤梭菌生长主要与糖酵解路径的抑制有关[15].最后讨论一下CD的情况,由于本文所用培养基是以纤维二糖为唯一碳源,因此纤维糊精只能是热纤梭菌主动合成的,并且已有文献报道热纤梭菌野生株能以纤维二糖为唯一碳源合成平均聚合度为4~5的纤维糊精[16],而本文NMR及LC-MS结果却证实热纤梭菌耐受株可以合成最大聚合度为10的纤维糊精,这进一步说明了热纤梭菌野生型与乙醇耐受株存在生理学差异,后者可以合成聚合度更大的纤维糊精.此外,纤维糊精的1H NMR信号在整个氢谱中是最强的,这表明热纤梭菌合成了大量的纤维糊精,这可能是热纤梭菌的一种能量储备方式,同时也暗示热纤梭菌乙醇耐受性的获得可能是由于菌体把纤维二糖合成为纤维糊精以抵抗乙醇的胁迫的缘故.综合对以上3种特殊代谢物的讨论,我们初步认为热纤梭菌乙醇耐受性的获得可能与纤维二糖主动合成纤维糊精途径、非氧化磷酸戊糖途径的增强及糖酵解途径的抑制等代谢途径密切相关,实际情况还需要进一步分析验证.

|
| 图 4 乙醇耐受型热纤梭菌未添加乙醇(CT ET0)分别与野生型(CT WT0) (a)和乙醇耐受型添加3%乙醇(CT ET3) (b)的1H NMR数据的PCA分析的scores图(左)和loading图(右) Fig. 4 PCA scores (Left) and loadings (Right) plot of 1H NMR spectra of ethanol-tolerant Clostridium thermocellum (CT) without ethanol (CT ET0) compared to wild-type (CT WT0) (a) and ethanol-tolerant with 3% ethanol (CT ET3) (b), respectively |
本文第一次报道了热纤梭菌水相代谢物组分析.综合运用1D与2D NMR和LC-MS等实验测试技术,除了检测到热纤梭菌水相中的氨基酸、糖类、有机酸、有机胺、醇类和核苷酸及其衍生物等常见代谢物之外,还解析归属了3种特殊的代谢物,即纤维糊精、磷酸烯醇式丙酮酸和赤藓糖-4-磷酸.并更正了文献[13]中信号的归属错误,完善了该化合物的NMR数据.这些特殊代谢物,反映了热纤梭菌中特殊的代谢和生理状况.最后利用检测结果,对热纤梭菌的野生型和乙醇耐受菌株进行了初步的多变量统计学分析,结果表明,热纤梭菌乙醇耐受性的获得可能与纤维二糖主动合成纤维糊精途径、非氧化磷酸戊糖途径的增强及糖酵解途径的抑制等代谢途径密切相关.实际情况还需要进一步深入研究.
| [1] | Lynd L R, van Zyl W H, McBride J E et al . Consolidated bioprocessing of cellulosic biomass: an update[J]. Curr Opin Biotech , 2005, 16 (5) : 577-583 DOI:10.1016/j.copbio.2005.08.009 |
| [2] | Brown S D, Guss A M, Karpinets T V et al . Mutant alcohol dehydrogenase leads to improved ethanol tolerance in Clostridium thermocellum[J]. P Natl Acad Sci USA , 2011, 108 (33) : 13752-13757 DOI:10.1073/pnas.1102444108 |
| [3] | Szeto S S W, Reinke S N, Sykes B D et al . Mutations in the Saccharomyces cerevisiae succinate dehydrogenase result in distinct metabolic phenotypes revealed through H-1 NMR-based metabolic footprinting[J]. J Proteome Res , 2010, 9 (12) : 6729-6739 DOI:10.1021/pr100880y |
| [4] | Zhao Xiu-ju(赵秀举), Wang Yu-lan(王玉兰) . Applications of NMR based metabonomic approaches in the assessment of drug toxicity(代谢组NMR分析与药物毒理研究)[J]. Chinese J Magn Reson(波谱学杂志) , 2011, 28 (1) : 1-17 |
| [5] | Ye Y F, Zhang L M, Hao F H et al . Global metabolomic responses of Escherichia coli to heat stress[J]. J Proteome Res , 2012, 11 (4) : 2559-2566 DOI:10.1021/pr3000128 |
| [6] | Yang S, Giannone R, Dice L et al . Clostridium thermocellum ATCC27405 transcriptomic, metabolomic and proteomic profiles after ethanol stress[J]. BMC Genomics , 2012, 13 (1) : 336-353 DOI:10.1186/1471-2164-13-336 |
| [7] | Yan Xian-zhong(颜贤忠), Zhao Jian-yu(赵剑宇), Peng Shuang-qing(彭双清) et al . Metabonomics in post-genomic era(代谢组学在后基因组时代的作用)[J]. Chinese J Magn Reson(波谱学杂志) , 2004, 21 (2) : 263-271 |
| [8] | Lindon J C, Holmes E, Nicholson J K . Recent developments and applications of NMR-based metabonomics[J]. Chinese J Magn Reson , 2006, 23 (1) : 101-127 |
| [9] | Tian Yuan(田园), Tang Hui-ru(唐惠儒) . Identification and structural determination of saccharides in rat feces(大鼠粪样中几种糖类物质的结构确定)[J]. Chinese J Magn Reson(波谱学杂志) , 2012, 29 (3) : 361-371 |
| [10] | Fan T W M, Lane A N . Structure-based profiling of metabolites and isotopomers by NMR[J]. Prog Nucl Magn Reson Spectrosc , 2008, 52 (2-3) : 69-117 DOI:10.1016/j.pnmrs.2007.03.002 |
| [11] | Fan W M T . Metabolite profiling by one-and two-dimensional NMR analysis of complex mixtures[J]. Prog Nucl Magn Reson Spectrosc , 1996, 28 (2) : 161-219 DOI:10.1016/0079-6565(95)01017-3 |
| [12] | Cui Q, Lewis I A, Hegeman A D et al . Metabolite identification via the Madison Metabolomics Consortium Database[J]. Nat Biotechnol , 2008, 26 (2) : 162-164 DOI:10.1038/nbt0208-162 |
| [13] | Matulova M, Delort A M, Nouaille R et al . Concurrent maltodextrin and cellodextrin synthesis by Fibrobacter succinogenes S85 as identified by 2D NMR spectroscopy[J]. Eur J Biochem , 2001, 268 (14) : 3907-3915 DOI:10.1046/j.1432-1327.2001.02300.x |
| [14] | Rydzak T, McQueen P D, Krokhin O V et al . Proteomic analysis of Clostridium thermocellum core metabolism: relative protein expression profiles and growth phase-dependent changes in protein expression[J]. BMC Microbiol , 2012, 12 (1) : 214-232 DOI:10.1186/1471-2180-12-214 |
| [15] | Herrero A A, Gomez R F, Roberts M F . 31P NMR-studies of Clostridium thermocellum-Mechanism of end product inhibition by ethanol[J]. J Biol Chem , 1985, 260 (12) : 7442-7451 |
| [16] | Zhang Y H P, Lynd L R . Cellodextrin preparation by mixed-acid hydrolysis and chromatographic separation[J]. Anal Biochem , 2003, 322 (2) : 225-232 DOI:10.1016/j.ab.2003.07.021 |
 2014, Vol. 31
2014, Vol. 31



