文章信息
- 安艳捧, 杨晓艳, 李洪德, 李宁, 唐惠儒
- AN Yan-peng, YANG Xiao-yan, LI Hong-de, LI Ning, TANG Hui-ru
- 大鼠尿液中N-氧化烟酰胺和伪尿嘧啶核苷的NMR分析
- NMR Analysis of Nicotinamide N-Oxide and Pseudouridine in Rat Urine
- 波谱学杂志, 2014, 31(2): 232-242
- Chinese Journal of Magnetic Resonance, 2014, 31(2): 232-242
-
文章历史
收稿日期: 2013-05-20
收修改稿日期: 2013-07-21


2. 中国科学院大学,北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
N-氧化烟酰胺和伪尿嘧啶核苷是大鼠尿液代谢组的重要组成成分.N-氧化烟酰胺是哺乳动物中烟酰胺在黄嘌呤氧化酶作用下的还原产物[1, 2].尿液中N-氧化烟酰胺的含量可以作为烟酰胺摄入是否过量的标志物[3].伪尿嘧啶核苷是尿嘧啶核苷的异构体与tRNA降解的最终产物.尿嘧啶核苷可以在伪尿嘧啶核苷合酶的作用下转变成伪尿嘧啶核苷,而后直接从尿中排泄.因此尿液中伪尿嘧啶核苷的含量可以作为体内RNA转化的标志物[4].研究发现,尽管尿液中伪尿嘧啶核苷作为癌症诊断的标志物缺乏特异性,但是癌症患者尿液中伪尿嘧啶核苷的含量一般较高,因此尿液中伪尿嘧啶核苷的含量可以作为癌症诊断、分级与预后疗效的辅助信息[5-8].此外,尿液中伪尿嘧啶核苷还与体内的代谢速率与能量摄入[9, 10]及炎症相关[11].因此,尿样中N-氧化烟酰胺和伪尿嘧啶核苷的含量变化应当引起关注.
尿液代谢组所携带的信息非常丰富.其代谢物组成包含氨基酸及其衍生物、有机羧酸、有机胺类、能量相关代谢产物、维生素相关代谢产物、肠道菌群相关代谢物[12]以及各种金属离子[13]等.因其组成的复杂性,尿液中代谢物存在对详细信号归属的困难,以致目前尿液中能够归属的代谢物仅仅数百种,但对于一些具有重要生理指示意义的尿液代谢物的核磁共振信号依然需要详尽归属.其中,尿液中维生素B3(烟酸与烟酰胺)代谢物的信号归属是一个比较突出的问题.N-氧化烟酰胺很早就被报道[1, 14],N-氧化烟酰胺在DMSO中的核磁共振信号也已得到了归属[15].尽管尿液中N -氧化烟酰胺的核磁共振氢谱归属已有报道[16, 17],但对核磁共振的具体归属并不一致.此外,核酸研究中常见的伪尿嘧啶核苷的核磁共振数据已有报道[18],但文献中仍然未见尿液中自由态伪尿嘧啶核苷的核磁共振数据.N-氧化烟酰胺和伪尿嘧啶核苷分别与维生素B3(烟酸与烟酰胺)代谢和尿嘧啶核苷代谢相关.因此,尿液中N-氧化烟酰胺和伪尿嘧啶核苷的归属是研究人(或动物)体内维生素代谢和核苷代谢的基础.
鉴于此,本文利用多种2D NMR (1H-1H COSY,1H-1H TOCSY,1H-1H J-RES,1H-13C HSQC和1H-13C HMBC)技术对大鼠尿液中N-氧化烟酰胺和伪尿嘧啶核苷两种代谢物的结构进行了确定,并对其1H和13C的化学位移进行了归属,这将为尿液代谢组分析提供基础数据.
1 实验部分 1.1 化学试剂分析纯化学试剂三水磷酸氢二钾(K2HPO4·3H2O)和二水磷酸二氢钠(NaH2PO4·2H2O)购于国药集团化学试剂有限公司(中国,上海).分析纯试剂叠氮钠(NaN3)购于天津福晨化学试剂厂.重水(D2O,99.9%氘代)和2, 2, 3, 3-氘代三甲基硅烷丙酸钠(2, 2, 3, 3-trimethylsilyl propionic acid-D4, TSP, 98%氘代)购自美国Cambridge Isotope Laboratories公司(MA, USA).
1.2 样品制备大鼠尿液样本(-80℃保存)常温解冻后,取0.55 mL尿液和0.055 mL含有0.1% TSP和0.1% NaN3(w/v)的缓冲液(1.5 mol/L,K2HPO4/NaH2PO4=4:1,100% D2O,pH 7.4)至1.5 mL EP样品管中,涡旋震荡30 s混匀后,离心(4℃,16 099 g, 10 min)取上清液0.55 mL转移至5 mm NMR样品管待测.
1.3 NMR实验条件NMR实验在配有超低温探头的Bruker AVⅢ 600型核磁共振谱仪上完成(Bruker Biospin, Germany),对应的1H和13C的共振频率分别为600.13 MHz和150.90 MHz,实验温度为298 K.1H NMR谱采用NOESYGPPR1D脉冲序列[RD-90°-t1-90°-tm-90°-ACQ]完成.实验参数如下:谱宽(SW)为12 019.230 Hz,等待时间(RD)为2 s,混合时间(tm)为100 ms,t1为4 μs,90°脉宽大约为10 μs,采样时间为1.36 s,采样点数为32 k,FID累加次数为64.
为了对信号进行准确的归属,对样品采集一系列的2D NMR谱.这些包括1H-1H同核相关谱(Correlation Spectroscopy, COSY)、1H-1H同核质子全相关谱(Total Correlation Spectroscopy, TOCSY)、1H-1H 2D J分解谱(J-Resolved Spectroscopy,J-RES),1H-13C异核单量子相关谱(Heteronuclear Single Quantum Coherence,HSQC)和1H-13C异核多重键相关谱(Heteronuclear Multiple Bond Coherence,HMBC).在COSY和TOCSY实验中,直接采样维(F2)和间接采样维(F1)的谱宽均为6 313.131 Hz,采样点数分别为2 048 (F2)和128 (F1),每一条FID累加次数为64.在TOCSY实验中,选取Dipsi组合脉冲进行自旋锁定,混合时间(tm)为90 ms.J偶合分解谱的采样点数分别为4 096 (F2)和32 (F1),每一条FID累加次数为64.1H-13C相关谱采用脉冲梯度场选择性的HSQC和HMBC序列.HSQC在采样期间使用组合脉冲(GARP)对13C进行去偶,采样点数分别为2 048 (F2)和128 (F1),谱宽分别为6 313.131 Hz和26 410.104 Hz,每一条FID累加次数为400.在HMBC实验中,采样点数分别为2 048 (F2)和128 (F1),谱宽分别为6 313.131 Hz和33 201.938 Hz,每一条FID累加次数为480.数据填零后得到2 048×2 048的数据矩阵,在傅立叶变化前加上适当窗函数对2D NMR谱进行处理.所有谱图在TOPSPIN (V3.0, Bruker Biospin, Germany)软件中进行处理,根据TSP定标.
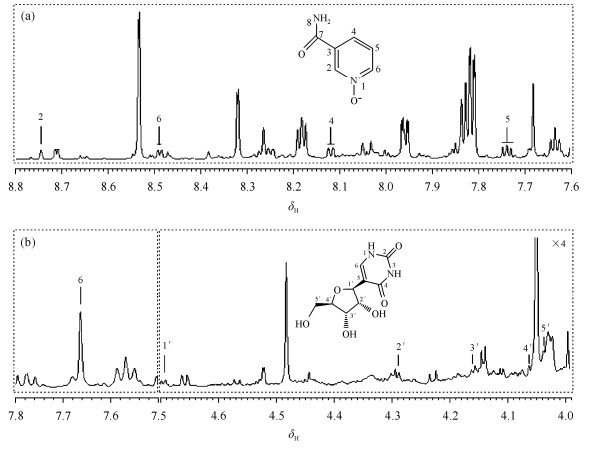
2 结果与讨论 2.1 大鼠尿液中N-氧化烟酰胺和伪尿嘧啶核苷的1D 1H NMR谱大鼠尿液中N-氧化烟酰胺[图 1(a)]和伪尿嘧啶核苷[图 1(b)]的1D 1H NMR谱显示两种代谢物在尿样中的含量较低.尿液1D 1H NMR谱在δH8.74、8.49、7.74和8.12处存在一组信号,该代谢物的信号与烟酰胺的信号较为接近.同样在δH7.68、4.68、4.29、4.16、4.05和4.03也存在一组信号.为了确定两种代谢物的结构,下面采用2D NMR谱对其进行仔细归属.
|
| 图 1 大鼠尿液中N-氧化烟酰胺(a)和伪尿嘧啶核苷(b)的1D 1H NMR谱 Fig. 1 1H NMR spectra of nicotinamide N-oxide (a) and pseudouridine (b) in rat urine |
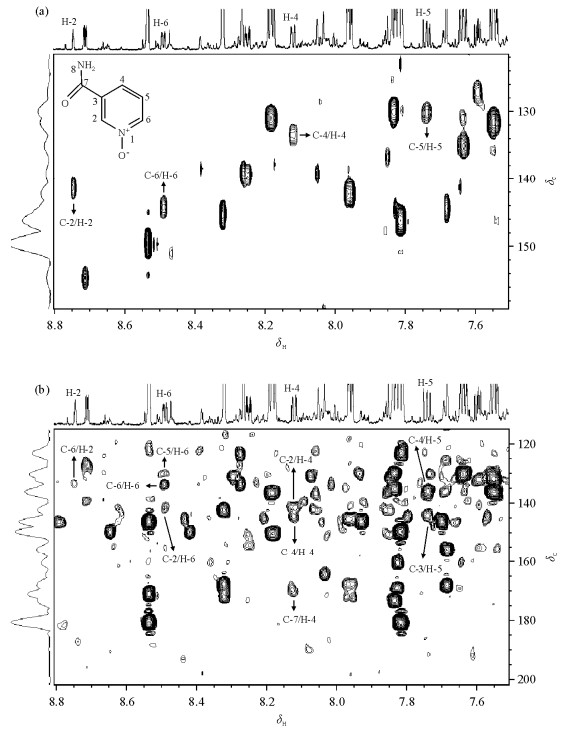
首先,1H-1H COSY谱[图 2(a)]中显示位于δH8.12(H-4)与7.74(H-5),δH7.74(H-5)与8.49(H-6)的质子对之间存在强的耦合连接关系,δH8.74(H-2)与8.12(H-4)和8.49(H-6)的质子对之间存在弱的耦合连接关系.其次,1H-1H TOCSY谱[图 2(b)]中显示位于δH8.74(H-2)、8.12(H-4)、7.74(H-5)和8.49(H-6)的4个质子之间存在耦合关系.这些说明此代谢物结构中存在典型的吡啶环,并且其结构很可能与烟酰胺的结构有关.再次,1H-13C HSQC谱[图 3(a)]显示δH8.74(H-2)、8.12(H-4)、7.74(H-5)和8.49(H-6)所对应的13C的信号分别为δC141.4(C-2)、133.4(C-4)、130.2(C-5)和144.2(C-6).1H-13C HMBC谱[图 3(b)]显示δH8.49(H-6)与δC141.4(C-2)、130.2(C-5)和133.4(C-4)之间存在远程耦合关系;δH8.74(H-2)与δC133.4(C-4)之间存在远程耦合关系;δH8.12(H-4)与δC141.4(C-2)、144.2(C-6)以及170.4(C-7)之间存在远程耦合关系.δH7.74(H-5)与δC144.2(C-6)之间存在远程耦合关系,同时δH7.74(H-5)与δC135.9(C-3)也存在远程耦合关系,并且δC135.9不直接携带质子.由此可以进一步确定此代谢物具有烟酰胺的结构骨架.在烟酰胺代谢途径中,只有N-氧化烟酰胺与烟酰胺具有这样的结构相似性.进一步与N-氧化烟酰胺的1H和13C的化学位移信息(表 1)比较可以确定此代谢物为N-氧化烟酰胺.

|
| 图 2 大鼠尿液中N-氧化烟酰胺1H-1H COSY谱(a)和1H-1H TOCSY谱(b) Fig. 2 1H-1H COSY spectrum (a) and 1H-1H TOCSY spectrum (b) of nicotinamide N-oxide in rat urine |
|
| 图 3 大鼠尿液中N-氧化烟酰胺1H-13C HSQC谱(a)和1H-13C HMBC谱(b) Fig. 3 1H-13C HSQC spectrum (a) and 1H-13C HMBC spectrum (b) of nicotinamide N-oxide in rat urine |
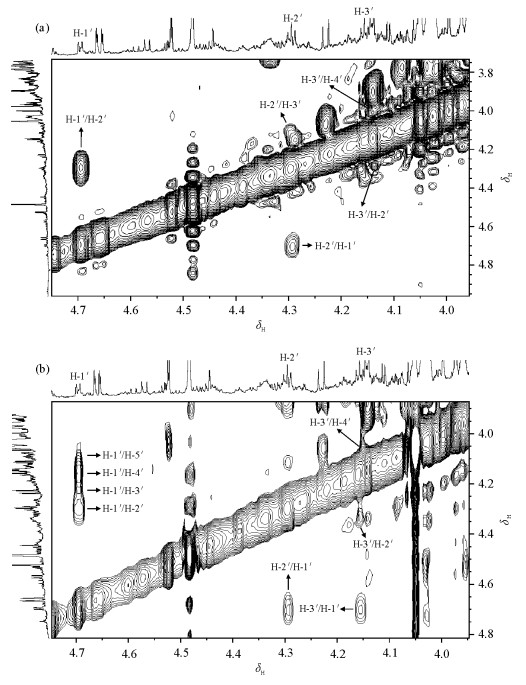
首先,1H-1H COSY谱[图 4(a)]中显示位于δH4.68(H-1')与4.29(H-2'),δH4.29(H-2')与4.16(H-3'),δH4.16(H-3')与4.05(H-4')的质子对之间存在耦合连接关系.其次,1H-1H TOCSY谱[图 4(b)]中显示位于δH4.68(H-1')、4.29(H-2')、4.16(H-3')、4.05(H-4')和4.03(H-5')的五个质子存在耦合关系.再次,1H-13C HSQC谱[图 5(a)]显示δH4.68(H-1')、4.29(H-2')、4.16(H-3')、4.05(H-4')和4.03(H-5')所对应的13C的信号分别为δC81.9(C-1')、76.4(C-2')、73.5(C-3')、74.1(C-4')和64.4(C-5').这些信息说明此代谢物中存在核糖的结构碎片.1H-13C HMBC谱[图 5(b)]显示δH4.16(H-3')与δC81.9(C-1')和64.4(C-5')之间存在远程耦合关系,进一步说明核糖碎片的存在.同时,δH4.29(H-2')与δC113.6(C-5)之间存在远程耦合关系;δH4.68(H-1')与δC113.5(C-5)、168.5(C-4)、144.5(C-6)和76.4(C-2')之间存在远程耦合关系.这些信息均提示核苷酸结构的存在.此外,与δH4.68(H-1')和4.29(H-2')相耦合的δC113.6(C-5)同时也与δH7.68(H-6)的信号存在耦合关系,并且δH7.68(H-6)还与δC156.1 (C-2)、168.5(C-4)和81.9(C-1')之间存在远程耦合关系.综合以上信息可以确定此代谢物为伪尿嘧啶核苷,其详细的1H和13C的化学位移信息列在表 1中.
|
| 图 4 大鼠尿液中伪尿嘧啶核苷1H-1H COSY谱(a)和1H-1H TOCSY谱(b) Fig. 4 1H-1H COSY spectrum (a) and 1H-1H TOCSY spectrum (b) of pseudouridine in rat urine |

|
| 图 5 大鼠尿液中伪尿嘧啶核苷1H-13C HSQC谱(a)和1H-13C HMBC谱(b) Fig. 5 1H-13C HSQC spectrum (a) and 1H-13C HMBC spectrum (b) of pseudouridine in rat urine |
尿液中N-氧化烟酰胺的核磁共振氢谱归属虽然已有文献报道[16, 17],但是文献对其核磁共振氢谱的信号归属并不一致,其原因可能是文献对其信号的归属主要借助于相关软件,并未通过二维谱进行详细信号归属.而对于N-氧化烟酰胺在DMSO中的核磁共振碳氢信号的归属虽然也有文献报道[15],但是由于溶剂的区别,其化学位移可能存在差别(表 1),因此只能为尿液中N-氧化烟酰胺的核磁共振信号归属提供辅助信息.
| Metabolites | Position | δC | δH | δHa, b, c, d | δCc, d |
| nicotinamide N-oxide | 1 | / | / | / | / |
| 2 | 141.4 | 8.74(1H, m) | 8.73(br)a 8.73b 8.57(1H)c |
138.4c | |
| 3 | 135.9 | / | / | 134.2c | |
| 4 | 133.4 | 8.12 (1H, m) | 8.11(m)a 8.11b 8.32(1H)c |
125.0c | |
| 5 | 130.2 | 7.74(1H, dd) | 7.73(dd)a 7.73b 7.49(1H)c |
127.07c | |
| 6 | 144.2 | 8.49(1H, m) | 8.47(m)a 8.48b 7.73(1H)c |
141.4c | |
| 7 | 170.4 | / | / | 164.8c | |
| 8 | / | / | 4.10(2H)c | / | |
| pseudouridine | 1 | / | / | / | / |
| 2 | 156.1 | / | / | 141.6d | |
| 3 | / | / | / | / | |
| 4 | 168.5 | / | / | 165.4d | |
| 5 | 113.6 | / | / | 110.6d | |
| 6 | 144.5 | 7.68(1H, s) | 7.50(1H, d)d | 141.5d | |
| 1' | 81.9 | 4.68(1H, d) | 4.51(1H, d)d | 83.5d | |
| 2' | 76.4 | 4.29(1H, dd) | 4.13(1H, t)d | 79.3d | |
| 3' | 73.5 | 4.16(1H, dd) | 3.98(1H, t)d | 73.5d | |
| 4' | 74.1 | 4.05(1H, dd) | 3.85(1H, m)d | 70.9d | |
| 5' | 64.4 | 4.03(2H, dd) | 3.68(1H, dd)d 3.56(1H, dd)d |
61.6d | |
| a为文献[16]中归属的尿样中N-氧化烟酰胺的碳氢信号;b为文献[17]中归属的尿样中N-氧化烟酰胺的碳氢信号;c为文献[15]中归属的DMSO溶剂中N-氧化烟酰胺的碳氢信号; d为文献[18]中归属的D2O中伪尿嘧啶核苷的碳氢信号 | |||||
伪尿嘧啶核苷的核磁共振信号归属在文献中也有报道[18],但是由于伪尿嘧啶核苷在尿液中的浓度较低,从而为基于二维谱的尿液中伪尿嘧啶核苷的详细核磁共振信号归属带来困难.因此目前并未发现尿液中自由态伪尿嘧啶核苷核磁共振信号归属的报道.
本文通过2D NMR谱图对大鼠尿液中N-氧化烟酰胺和伪尿嘧啶核苷两种代谢物的核磁共振信号进行详细归属,从而更正或者补充了尿液中两种代谢物的核磁共振信号归属信息,为研究人(或者动物)体内维生素B3(烟酸与烟酰胺)代谢和尿嘧啶核苷代谢提供基础.
3 结论本文利用2D NMR (1H-1H COSY、1H-1H TOCSY、1H-1H J-RES、1H-13C HSQC和1H-13C HMBC)对尿液中N-氧化烟酰胺和伪尿嘧啶核苷两种重要代谢物的结构进行了归属与确定,获得了两种代谢物详细的1H和13C的化学位移信息,为尿液代谢组的分析提供了基础数据.
| [1] | Chaykin S, Dagani M, Johnson L et al . The fate of nicotinamide in the mouse urinary metabolites[J]. Spectrochim Acta A , 1966, 240 (2) : 932-938 |
| [2] | Chaykin S, Bloch K . The metabolism of nicotinamide-N-oxide[J]. BBA , 1959, 31 (1) : 213-216 |
| [3] | Fukuwatari T, Wada H, Sasaki R et al . Effects of excess nicotinamide administration on the urinary excretion of nicotinamide N-oxide and nicotinuric acid by rats[J]. Biosci Biotech Bloch , 2004, 68 (1) : 44-50 DOI:10.1271/bbb.68.44 |
| [4] | Borek E, Baliga B S, Gehrke C W et al . High turnover rate of transfer RNA in tumor tissue[J]. Cancer Res , 1977, 37 (9) : 3362-3366 |
| [5] | Tamura S, Fujii J, Nakano T et al . Urinary pseudouridine as a tumor marker in patients with small cell lung cancer[J]. Clin Chim Acta , 1986, 154 (2) : 125-132 DOI:10.1016/0009-8981(86)90004-5 |
| [6] | Tamura S, Fujioka H, Nakano T et al . Urinary pseudouridine as a biochemical marker in the diagnosis and monitoring of primary hepatocellular carcinoma[J]. AM J Gastroenterol , 1988, 83 (8) : 841-845 |
| [7] | Rasmuson T, Bjork G R . Urinary excretion of pseudouridine and prognosis of patients with maligent lymphoma[J]. Acta Oncol , 1995, 34 (1) : 61-67 DOI:10.3109/02841869509093640 |
| [8] | Seidel A, Brunner S, Seidel P et al . Modified nucleosides: an accurate tumour marker for clinical diagnosis of cancer, early detection and therapy control[J]. Brit J Cancer , 2006, 94 (11) : 1726-1733 |
| [9] | Topp H, Fusch G, Schoech G et al . Noninvasive markers of oxidative DNA stress, RNA degradation and protein degradation are differentially correlated with resting metabolic rate and energy intake in children and adolescents[J]. Pediatr Res , 2008, 64 (3) : 246-250 DOI:10.1203/PDR.0b013e31817cfca6 |
| [10] | Topp H, Schoch G . Whole-body degradation rates of transfer-, ribosomal-, and messenger ribonucleic acids and resting metabolic rate in 3-to 18-year-old humans[J]. Pediatr Res , 2000, 47 (1) : 163-168 DOI:10.1203/00006450-200001000-00027 |
| [11] | Bolton C E, Broekhuizen R, Lonescu A A et al . Cellular protein breakdown and systemic inflammation are unaffected by pulmonary rehabilitation in COPD[J]. Thorax , 2007, 62 (2) : 109-114 DOI:10.1136/thx.2006.060368 |
| [12] | Cai Yi(蔡毅), Hao Fu-hua(豪富华), Wang Yu-lan(王玉兰) . NMR-based metabonomics analysis of biofluids and tissues in kungming mice(昆明小鼠常见体液与组织代谢组的NMR分析)[J]. Chinese J Magn Reson(波谱学杂志) , 2013, 30 (1) : 55-68 |
| [13] | Jiang Li-miao(江李苗), Tang Hui-ru(唐惠儒) . An NMR method for determining concentrations of calaium and magnesium ions in mammalian urines(脯乳动物尿液中钙镁离子浓度的1H NMR测定方法)[J]. Chinese J Magn Reson(波谱学杂志) , 2013, 30 (1) : 80-85 |
| [14] | Bonavita V, Kaplan N O, Narrod S A . Metabolites of nicotinamide in mouse urine effects of azaserine[J]. J Blol Chem , 1961, 236 (3) : 936-939 |
| [15] | Atac A, Karabacak M, Kose E et al . Spectroscopic (NMR, UV, FT-IR and FT-Raman) analysis and theoretical investigation of nicotinamide N-oxide with density functional theory[J]. Spectroc Acta Pt A-Molec Biomolec Spectr , 2011, 83 (1) : 250-258 DOI:10.1016/j.saa.2011.08.027 |
| [16] | Kim I Y, Jung J, Jang M et al . 1H NMR-based metabolomic study on resistance to diet-induced obesity in AHNAK knock-out mice[J]. Biochem Bloph Res Co , 2010, 403 (3-4) : 428-434 DOI:10.1016/j.bbrc.2010.11.048 |
| [17] | Jung J Y, Kim I Y, Kim Y N et al . 1H NMR-based metabolite profiling of diet-induced obesity in a mouse mode[J]. Bmb Res , 2012, 45 (7) : 419-424 DOI:10.5483/BMBRep.2012.45.7.248 |
| [18] | Desaulniers J P, Chang Y C, Aduri R et al . Pseudouridines in rRNA helix 69 play a role in loop stacking interactions[J]. Org Blomol Chem , 2008, 6 (21) : 3892-3895 DOI:10.1039/b812731j |
 2014, Vol. 31
2014, Vol. 31



