文章信息
- 杨晓艳, 吴香玉, 安艳捧, 唐惠儒
- YANG Xiao-yan, WU Xiang-yu, AN Yan-peng, TANG Hui-ru
- 吲哚丙酮酸的酮-烯醇互变异构化的NMR研究
- An NMR Study on Keto-Enol Tautomerism of Indole-3-Pyruvic Acid
- 波谱学杂志, 2014, 31(1): 81-90
- Chinese Journal of Magnetic Resonance, 2014, 31(1): 81-90
-
文章历史
收稿日期: 2013-05-13


2. 中国科学院大学,北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
吲哚丙酮酸是生物体内一种重要的代谢物.在植物体内,吲哚丙酮酸是经色氨酸途径合成植物激素吲哚乙酸的前体物质[1-4].吲哚丙酮酸也是植物根系微生物合成该植物激素从而促进微生物与植物相互作用的重要代谢物[5].在动物细胞内,吲哚丙酮酸还是一种重要的还原剂,它能够捕获氧自由基而形成犬尿酸等物质[6, 7].作为一种α-酮酸,酮式吲哚丙酮酸羰基旁的α-质子具有一定酸性且可以发生迁移,从而形成烯醇式结构(图 1).有文献报道吲哚丙酮酸容易发生酮-烯醇互变异构化,且在水溶液中不易稳定存在[8],并且这种变化还会影响到其在生物体内的生理功能[9].因此,吲哚丙酮酸的酮-烯醇互变异构现象已得到广泛关注.
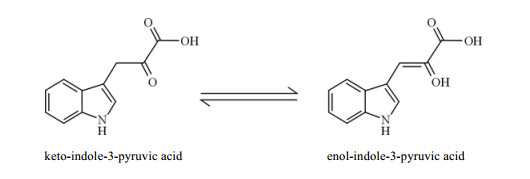
|
| 图 1 吲哚丙酮酸的酮-烯醇互变异构反应 Fig. 1 Keto-enol tautomerism of indole-3-pyruvic acid |
α-酮酸类物质的酮-烯醇互变异构特性,很早就被发现并通过多种分析手段进行了研究.该互变反应最早是通过三氯化铁溶液滴定法来检测烯醇式物质[10].1915年,Bougault等人[11]研究发现,苯丙酮酸在晶体状态下主要以烯醇式形式存在,在水溶液中会逐步转化为酮式.1947年,Painter等人[12]研究了4-羟基苯丙酮酸在不同温度和pH条件下酮-烯醇互变异构过程,发现碱性溶液中烯醇式4-羟基苯丙酮酸能迅速转变为酮式结构,中性或酸性溶液中此反应速率较慢,升高温度会加快该反应.随着分析手段地发展,有文献报道采用纸层析法[13]、紫外分光光度计[14]和红外拉曼光谱法[15, 16]来定性或者半定量地研究α-酮酸的酮-烯醇互变异构反应,发现疏水性溶剂中烯醇式结构含量较高,酮式结构在质子性溶剂中含量较高.
NMR是研究酮-烯醇互变异构现象的重要工具,能原位反映该互变动态变化过程并提供详细的物质结构信息,尤其适合定量分析.Lee等人[17]采用NMR及IR技术详细研究了苯丙酮酸甲酯及其对位取代物的结构,发现这些物质在乙腈和氯仿中主要是烯醇式结构(烯键δH 6.53),并且会有少量转化为酮式结构(亚甲基δH 4.12).基于以上特点,NMR也被广泛的应用于复杂生物样品中多种代谢物的结构解析及物质确定[18, 19].但是利用NMR方法对吲哚丙酮酸酮-烯醇互变异构的研究未见报道,其两种互变异构体的NMR(δH和δC)数据也暂无报道.因此,本文利用多维NMR技术对吲哚丙酮酸在乙腈和水溶液中的主要结构进行了详细研究.
1 实验部分 1.1 化学试剂吲哚丙酮酸(纯度≥97%)购自Sigma-Aldrich有限公司.三水合磷酸氢二钾(K2HPO4• 3H2O)、二水合磷酸二氢钠(NaH2PO4• 2H2O)购自国药集团化学试剂有限公司(上海).分析纯试剂叠氮钠(NaN3)购于天津福晨化学试剂厂.氘代乙腈(Acetonitrile-D3,99.8%氘代)、重水(D2O,99.9% D)、2,2,3,3-氘代三甲基硅烷丙酸钠(TSP,2,2,3,3-trimethylsilyl propionic acid-D4)购自美国Cambridge Isotope Laboratories公司.配制溶液的双蒸水来自Millipore纯水系统,电阻值为15 MΩ.
含0.1% TSP和0.1% NaN3 (w/v)的磷酸盐缓冲溶液(1.5 mol/L,pD 7.4)由K2HPO4• 3H2O与NaH2PO4• 2H2O在D2O中配制而成.将1 mg左右吲哚丙酮酸溶于500 μL水中,并加入50 μL磷酸盐缓冲溶液,混匀后转移至5 mm NMR样品管待测.称量1 mg左右吲哚丙酮酸溶于600 μL氘代乙腈,混匀后转移至5 mm NMR样品管待测.
1.2 NMR实验条件所有NMR实验均在配有超低温探头的Bruker AVANCE III 600型谱仪完成,其对应的1H和13C的共振频率分别为600.13 MHz和150.90 MHz,实验温度为296 K.溶于CD3CN的样品核磁谱图根据溶剂峰定标(δH 1.94,δC 1.39).溶于水中的样品核磁谱图根据TSP定标.一维谱采用Noesypr1d序列完成,90°脉宽设置约为10 μs左右,等待时间(RD)为2 s,混合时间(tm)为100 ms.所有样品的采样点数为32 k,采样次数(ns)为32次.氘代乙腈溶液谱宽设置为7 796.26 Hz,水溶液谱宽设置为10 802.34 Hz.1H-1H COSY、1H-1H TOCSY以及1H-13C HSQC和1H-13C HMBC等4种二维谱均采用标准程序脉冲采样.1H-1H COSY和1H-1H TOCSY的F2(1H)和F1(1H)维的谱宽均分别为6 601.43 Hz(氘代乙腈)或者9 001.95 Hz(水溶液),F2和F1维的采样点数分别为2 048和160.氘代乙腈溶液的HSQC谱中,F2(1H)和F1(13C)维的谱宽分别为5 999.68 Hz和32 028.60 Hz,F2(1H)和F1(13C)维的采样点数分别为2 048和180.HMBC采样参数设置与HSQC相同.水溶液的HSQC谱中,F2(1H)和F1(13C)维的谱宽分别为7 211.54 Hz和33 333.33 Hz,F2(1H)和F1(13C)维的采样点数分别为2 048和100.HMBC采样参数设置与HSQC相同,F2(1H)和F1(13C)维的采样点数分别为2 048和108.
2 结果与讨论 2.1 吲哚丙酮酸在不同溶剂中1D NMR谱吲哚丙酮酸溶液的1H NMR谱(图 2)显示该物质在不同溶剂中其谱图有显著差异.在CD3CN溶液中,吲哚丙酮酸在δH6.92处的单峰和δH7.91处的双峰,其积分面积比约为1:1,提示烯醇式吲哚丙酮酸的存在[图 2(a)].上述谱图中也能看到一组丰度较低的信号,提示上述溶液中还存在含量较低的另一种形式.其中两个处于δH 6.76和9.63的宽峰提示两个不同活泼氢的存在;在δH 4.27处可观察到的一个单峰很可能是酮式吲哚丙酮酸β位上的质子信号.在水溶液中,吲哚丙酮酸在δH 4.25和7.31处的两个单峰面积比是2:1,提示该物质在此溶液中可能以酮式存在[图 2(b)].此外,水溶液中也存在一个丰度较低的组分.其芳香区存在于δH6.81和7.95的两个单峰及δH7.88处的一个双峰,提示这个低丰度组分可能为烯醇式吲哚丙酮酸的信号.为了确定上述推论,下面采用2D NMR谱对上述两个溶液中存在的物质结构进行了仔细确定.

|
| 图 2 吲哚丙酮酸在氘代乙腈(a)与水溶液(b)中的1D1H NMR谱 Fig. 2 1H NMR spectra of indole-3-pyruvic acid in (a) CD3CN and (b) H2O |
首先,吲哚丙酮酸氘代乙腈溶液的1H-1H COSY谱(图 3)中显示处于δH7.91与6.92、δH7.76与7.14、δH7.46与7.20、δH7.20与7.14的质子对之间存在耦合连接关系.其1H-1H TOCSY谱中显示位于δH 7.14、7.20、7.46和7.76的4个质子存在耦合关系.这些都说明吲哚环结构的存在.其次,1H NMR谱[图 2(a)]中显示有δH 6.76和9.63两个宽峰,它们各自的积分面积与芳香环上单个质子的信号积分面积比约为1:1,说明两个可交换质子分别源于-NH和-COOH.同时,在1H-1H COSY谱(图 4)中,δH 9.63处的宽峰与δH 7.91处的单峰有耦合关系,但δH 6.76处的信号与其它信号之间不存在任何耦合关系.因此可以推断δH 9.63处的宽峰为-NH的信号,而δH 6.76的宽峰对应与-COOH中的质子信号.再次,1H-13C HSQC谱(未显示)中可见δH7.91的双峰与δH6.92的单峰对应的13C的信号分别为δC129.1和105.5.1H-13C HMBC谱(图 5)中显示δH6.92与δC127.3(C-8)、129.1(C-2)、137.7(C-α)及165.3(COOH)有远程耦合关系;δH7.91与δC105.5(C-β)、110.5(C-1)、127.3(C-8)及137.1(C-3)有远程耦合关系.由此不难确认这一组信号属于烯醇式吲哚丙酮酸.
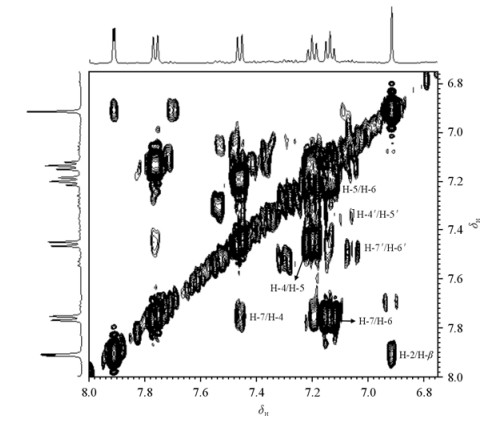
|
| 图 3 吲哚丙酮酸氘代乙腈溶液芳香区1H-1H COSY谱 Fig. 3 1H-1H COSY spectrum of indole-3-pyruvic acid in CD3CN in the aromatic region |
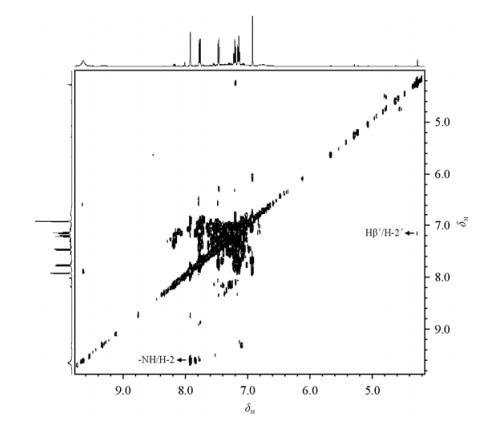
|
| 图 4 吲哚丙酮酸氘代乙腈溶液的1H-1H COSY谱 Fig. 4 1H-1H COSY spectrum of indole-3-pyruvic acid in CD3CN |
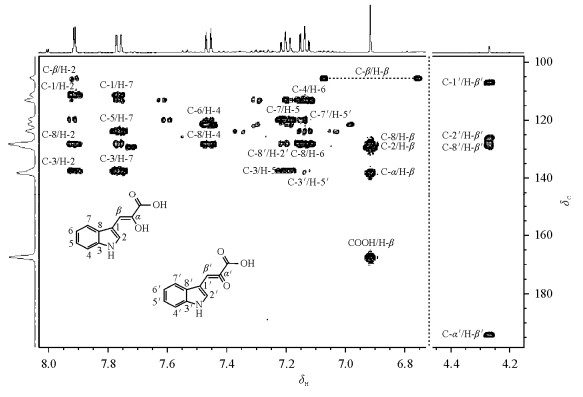
|
| 图 5 吲哚丙酮酸氘代乙腈溶液1H-13C HMBC谱 Fig. 5 1H-13C HMBC spectrum of indole-3-pyruvic acid in CD3CN |
使用同样的推理可以确定一维谱[图 2(a)]中那些丰度很小的信号来自酮式吲哚丙酮酸.这些低丰度信号中,位于δH7.13、7.40及7.47等信号来自典型的吲哚环结构;位于δH 4.27的质子与位于δC35.7的碳直接连接(1H-13C HSQC谱),提示该碳是不携带氮或者氧原子的烷基碳.这个质子与位于δH 7.19的吲哚环中质子(H-2′)在1H-1H COSY谱中(图 4)存在微弱的交叉峰,说明他们之间很可能存在三键耦合关系.1H-13C HMBC谱(图 5)中显示位于δH4.27的质子分别与δC106.7(C-1′)、125.7(C-2′)、127.8(C-8′)、193.7(C-α′)存在远程耦合.由此判断这些低丰度信号很可能来自酮式吲哚丙酮酸.
基于上述分析,氘代乙腈溶液中烯醇式吲哚丙酮酸的主要1H、13C NMR信息和酮式结构的部分信息均得到了充分提取(见表 1).结合一维氢谱[图 2(a)]可知,在氘代乙腈中烯醇式吲哚丙酮酸是主要存在形式,其与酮式吲哚丙酮酸的浓度之比约为9:1.推测出现此现象的原因是,在烯醇式吲哚丙酮酸的烯键与吲哚环以及羧基能形成共轭结构,使得该物质更容易稳定存在氘代乙腈溶液中,而酮式结构则不能形成大的共轭结构.因此,在氘代乙腈溶液中酮-烯醇互变反应平衡朝着生成烯醇式吲哚丙酮酸的方向移动.为了得到酮式吲哚丙酮酸完整的NMR数据,接下来使用2D NMR技术对水溶液中吲哚丙酮酸的结构进行了研究.
| δC | δH(J/Hz) | HSQC | 1H -1H COSY | HMBC | Forms and Solvents | |
| 1 | 110.5 | / | / | / | H-2, H-7 | enol form |
| 2 | 129.1 | 7.91(1H, s) | + | H-β | H-β | CD3CN |
| 3 | 137.1 | / | / | / | H-2, H-5, H-7 | |
| 4 | 113.5 | 7.46 (1H, dd) | + | H-5 | H-6 | |
| 5 | 123.9 | 7.20 (1H, m) | + | H-4, H-6 | H-7 | |
| 6 | 121.5 | 7.14 (1H, m) | + | H-7, H-5 | H-4 | |
| 7 | 120.0 | 7.76(1H, dd) | + | H-6 | H-5 | |
| 8 | 127.3 | / | / | / | H-2, H-4, H-6, H-β | |
| α | 138.0 | / | / | / | H-β | |
| β | 105.5 | 6.92 (1H, s) | + | H-2 | H-2 | |
| COOH | 165.3 | 6.76 (1H, s) | + | / | H-β | |
| NH | / | 9.63 (1H, s) | + | / | H-2 | |
| 1′ | 106.7 | / | / | / | H-β′ | keto form |
| 2′ | 125.7 | 7.19 (1H, s) | + | H-β′ | H-β′ | CD3CN |
| 3′ | 137.4 | / | / | / | H-2′, H-5′ | |
| 4′ | 112.6 | 7.40 (1H, dd) | + | H-5′ | / | |
| 5′ | 123.2 | 7.13 (1H, m) | + | H-4′ | / | |
| 7’ | 119.8 | 7.47(1H, dd) | + | / | H-5′ | |
| 8′ | 127.8 | / | / | / | H-2′, H-β′ | |
| α′ | 193.7 | / | / | / | H-β′ | |
| β′ | 35.70 | 4.27 (2H, s) | + | H-2′ | / | |
| 1 | 112.2 | / | / | / | H-2, H-7 | enol form |
| 2 | 129.5 | 7.95 (1H, s) | + | / | / | H2O |
| 3 | 138.5 | / | / | / | H-2, H-5, H-7 | |
| 4 | 115.0 | 7.56 (1H, dd) | + | H-5 | H-6 | |
| 5 | 125.4 | 7.31 (1H, m) | + | H-4 | H-7 | |
| 6 | 124.7 | 7.27 (1H, m) | + | H-7 | H-4 | |
| 7 | 121.4 | 7.88 (1H, dd) | + | H-6 | H-5 | |
| 8 | 129.2 | / | / | / | H-2, H-4, H-6, H-β | |
| α | 144.1 | / | / | / | H-β | |
| β | 102.6 | 6.81 (1H, s) | + | H-2 | ||
| COOH | 174.3 | / | / | / | H-β | |
| 1′ | 108.2 | / | / | / | H-2′, H-7′, H-β′ | keto form |
| 2′ | 128.1 | 7.31 (1H, s) | + | H-β′ | H-β′ | H2O |
| 3′ | 139.1 | / | / | / | H-2′, H-5′, H-7′ | |
| 4′ | 114.7 | 7.54 (1H, dd) | + | H-5′ | H-6′ | |
| 5′ | 128.2 | 7.26 (1H, m) | + | H-4′, H-6′ | H-7’ | |
| 6′ | 122.2 | 7.18 (1H, m) | + | H-7′, H-5′ | H-4’ | |
| 7′ | 121.4 | 7.57 (1H, dd) | + | H-6′ | H-5’ | |
| 8′ | 129.7 | / | / | / | H-2′, H-4′, H-6′, H-β′ | |
| α′ | 207.1 | / | / | / | H-β′ | |
| β′ | 39.20 | 4.25 (2H, s) | + | H-2′ | H-2′ |
首先,1H NMR谱(图 2)显示,吲哚丙酮酸的酮式及烯醇式两种结构的化学位移在水溶液与氘代乙腈溶液中有明显不同,这些差异可能是不同的溶剂化作用导致的.其次,1H-1H COSY谱(图 6)显示δH7.57与7.18、δH7.54与7.26、δH7.26与7.18等质子对间存在耦合连接关系,1H-1H TOCSY谱显示δH7.18、7.26、7.54和7.57四个质子之间存在耦合关系.这些与位于δH7.31质子的存在已经比较清晰地说明它们来自吲哚环的结构.再次位于δH4.25的质子与吲哚环中H-2′(δH7.31)存在弱的COSY交叉峰,说明这两个质子之间存在三键耦合关系.1H-13C HSQC谱图(未显示)中信息表明,δH4.25和7.31直接相连的13C信号分别为δC39.20和128.1.另外,1H-13C HMBC谱(图 7)显示δH4.25与δC108.2(C-1′)、128.1(C-2′)、129.7(C-8′)、207.1(C-α′)存在远程耦合关系,δH7.31与δC 108.2(C-1′)、129.7(C-8′)、139.1(C-3′)也存在耦合关系.由此不难确认这组信号来自酮式吲哚丙酮酸.
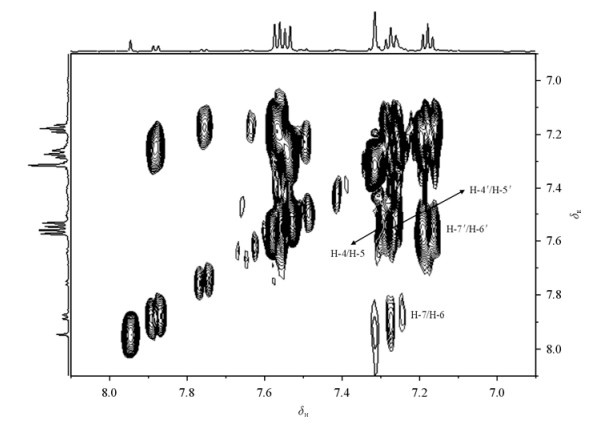
|
| 图 6 吲哚丙酮酸水溶液1H-1H COSY谱 Fig. 6 1H-1H COSY spectrum of indole-3-pyruvic acid in H2O |
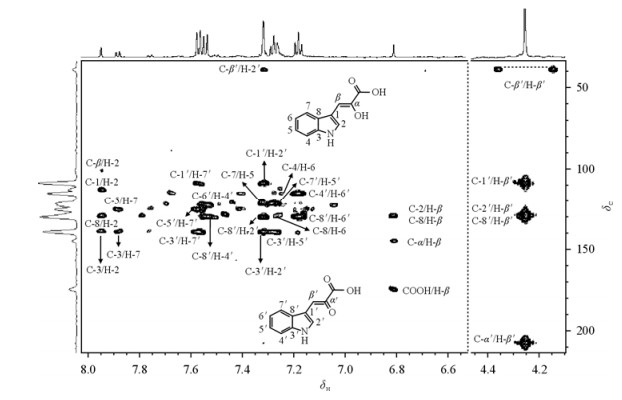
|
| 图 7 水溶液中吲哚丙酮酸的1H-13C HMBC谱 Fig. 7 1H-13C HMBC spectrum of indole-3-pyruvic acid in H2O |
水溶液1H NMR谱[图 2(b)]中还可以检测到一组强度较弱的信号.1H-1H COSY谱(图 6)显示δH7.88与7.27、δH7.56与7.31存在连接关系.1H-1H TOCSY谱图提示δH7.27、7.31、7.56和7.88这4个质子有耦合关系.1H-13C HSQC谱图中δH6.81对应的13C信号为δC102.6.1H-13C HMBC(图 7)显示δH6.81与δC129.2(C-8)、129.5(C-2)、144.1(C-α)、174.3(COOH)有耦合关系,这些表明这组低丰度信号来自烯醇式吲哚丙酮酸.以上两种结构的详细归属列于表 1中.
上述物质结构归属提示在水溶液中酮式吲哚丙酮酸是优势结构,其浓度与烯醇式吲哚丙酮酸的浓度之比约为9:1.该浓度比与氘代乙腈溶剂中两种结构的浓度比正好相反,推测其原因可能是吲哚丙酮酸的羧基在水溶液中电离所带负电荷对酮式吲哚丙酮酸中的羰基形成诱导效应.因此,水溶液中酮-烯醇互变反应平衡朝着生成酮式吲哚丙酮酸的方向移动.
3 结论上述分析表明,吲哚丙酮酸无论是在乙腈还是水溶液中均存在两种互变异构体.在乙腈溶液中主要以烯醇式结构存在,而在在水溶液中酮式结构是吲哚丙酮酸的主要存在形式.本文使用多维NMR技术对吲哚丙酮酸的两种结构进行了详细地归属和确定,获得了两种异构体完整的1H、13C NMR信息.这些研究结果为吲哚丙酮酸酮-烯醇互变异构及相关研究提供了基础数据.
| [1] | Badenochjones J, Summons R E, Rolfe B G et al . Phytohormones, Rhizobium mutants, and nodulation in legumes.4. auxin metabolites in pea root-nodules[J]. J Plant Growth Regul , 1984, 3 (1) : 23-39 |
| [2] | Cooney T P, Nonhebel H M . The measurement and mass-spectral identification of indole-3-pyruvate from tomato shoots[J]. Biochem Biophys Res Commun , 1989, 162 (2) : 761-766 DOI:10.1016/0006-291X(89)92375-9 |
| [3] | Cooney T P, Nonhebel H M . Biosynthesis of indole-3-acetic acid in tomato shoots: measurement, mass-spectral identification and incorporation of -2H from -2H2O into indole-3-acetic acid, D-and L-tryptophan, indole-3-pyruvate and tryptamine[J]. Planta , 1991, 184 (3) : 368-376 |
| [4] | Moore T C, Shaner C A . Synthesis of indoleacetic acid from tryptophan via indolepyruvic acid in cell-free extracts of pea seedlings[J]. Arch Biochem Biophys , 1968, 127 (1) : 613-621 |
| [5] | Koga J . Structure and function of indolepyruvate decarboxylase, a key enzyme in indole-3-acetic-acid biosynthesis[J]. Biochim Biophys Acta-Protein Struct Molec Enzym , 1995, 1249 (1) : 1-13 DOI:10.1016/0167-4838(95)00011-I |
| [6] | Politi V, Dalessio S, DiStazio G . Recent Advances in Tryptophan Research: Tryptophan and Serotonin Pathways[M]. New York: Plenum Press Div Plenum Publishing Corp, 1996 . |
| [7] | Perkins M N, Stone T W . Actions of kynurenic acid and quinolinic acid in the rat hippocampus in vivo[J]. Exp Neurol , 1985, 88 (3) : 570-579 DOI:10.1016/0014-4886(85)90072-X |
| [8] | Libbert E, Brunn K, Drawert A et al . Pathways of IAA production from tryptophan by plants and by their epiphytic bacteria: metabolism of indolepyruvic acid and indolelactic acid[J]. Biol Plant , 1970, 12 (4) : 246-255 |
| [9] | Bartolini B, Corniello C, Sella A . Developments in Tryptophan and Serotonin Metabolism[M]. New York: Kluwer Academic/Plenum Publ, 2003 . |
| [10] | Penrose L, Quastel J H . Metabolic studies in phenylketonuria[J]. Biochem J , 1937, 31 (2) : 266-274 DOI:10.1042/bj0310266 |
| [11] | Bougault J, Hemmerle R . Dynamic isomerism of phenylpyruvic acid[J]. C R Hebd Seances Acad Sci , 1915, 160 : 100-102 |
| [12] | Painter H A, Zilva S S . The tautomeric conversion of p-hydroxyphenylpyruvic acid[J]. Biochem J , 1947, 41 (4) : 520-522 DOI:10.1042/bj0410520 |
| [13] | Schwarz K . Separation of enol and keto tautomers of aromatic pyruvic acids by paper chromatography[J]. Arch Biochem Biophys , 1961, 92 (1) : 168-175 DOI:10.1016/0003-9861(61)90232-6 |
| [14] | Kaper J M, Gebhard O, Veldstra H et al . Studies on indolepyruvic acid.2. ultraviolet spectrophotometry[J]. Arch Biochem Biophys , 1963, 103 (3) : 475-487 DOI:10.1016/0003-9861(63)90441-7 |
| [15] | Nazario G, Schwarz K . Infrared spectra of indolepyruvic acid -study of keto-enol equilibrium in different organic solvents[J]. Arch Biochem Biophys , 1968, 123 (3) : 457-461 DOI:10.1016/0003-9861(68)90166-5 |
| [16] | Hanai K, Kuwae A, Kawai S et al . Keto-enol tautomerism and vibrational spectra of phenylpyruvic acids[J]. J Phys Chem , 1989, 93 (16) : 6013-6016 DOI:10.1021/j100353a016 |
| [17] | Lee H H, Takai T, Senda H et al . Molecular structure of methyl phenylpyruvates studied by H-1 NMR and IR spectroscopies and quantum mechanical calculations[J]. J Mol Struct , 1998, 449 (1) : 69-75 DOI:10.1016/S0022-2860(98)00374-3 |
| [18] | Yan Xing(严星), Zhang Li-min(张利民), An Yan-peng(安艳捧) et al . NMR-based metabonomic analysis for sulprostone-induced mice(硫前列酮影响小鼠代谢的NMR研究)[J]. Chinese J Magn Reson(波谱学杂志) , 2013, 30 (1) : 40-54 |
| [19] | Tian Yuan(田园), Tang Hui-ru(唐惠儒) . Identification and structural determination of saccharides in rat feces(大鼠粪样中几种糖类物质的结构确定)[J]. Chinese J Magn Reson(波谱学杂志) , 2012, 29 (3) : 361-371 |
 2014, Vol. 31
2014, Vol. 31



