近年来,化石燃料的进一步消耗,以及燃料燃烧导致的大气污染物和温室气体的排放,使得寻找其他可替代清洁能源成为目前研究热点之一.氢气由于具有无污染、热值高、来源广、安全无毒等特点[1, 2],受到研究者的广泛关注.然而在常规工业生产中,氢气的获得通常需要在高温高压条件下使用镍基催化剂来重整天然气和水[3, 4],其过程耗能高且步骤复杂[5].1972年,Fujishima和Honda[6]在n型半导体TiO2单晶电极上观察到水的光电催化分解作用.自此之后,国内外的研究人员对光解水产氢领域产生了浓厚的兴趣.然而,纯水的光催化效率极低,很难应用到实际生产中.Kawai和Sakata[7]发现,在纯水中引入牺牲剂(引入光生电子或空穴)可以获得更高的光解水效率.甲醇拥有比水更强的氧化能力、更快的氧化过程和不可逆的性质,通常作为电子牺牲剂应用于光解水产氢反应.添加甲醇牺牲剂的光解水产氢反应包含两个半反应[8]:1)水与光生电子结合分解产生氢气;2)甲醇消耗光生空穴在催化剂表面发生重整氧化.据我们所知,在水和甲醇同时存在的体系中,水和甲醇中的活泼质子会形成氢键,并且发生质子交换.在先前研究中,我们发现水和甲醇之间的质子交换会影响光解水产氢的氢气质子来源[9],并且有研究[10]提到甲醇浓度会直接影响甲醇的氧化产物,这意味着甲醇与水之间的相互作用对光催化反应的影响确实存在.因此,甲醇与水之间相互作用机理的研究对进一步了解多溶液体系非均相催化反应起到至关重要的作用.
在众多经典n型半导体材料中,二氧化钛(TiO2)由于具有高活性、安全无毒、化学性质稳定(耐化学和光腐蚀)的性质,加之原料成本低、分布广,成为光催化领域中被广泛关注的催化剂之一.TiO2包含三种典型晶型:锐钛矿相(anatase)、金红石相(rutile)和板钛矿相(brookite).金红石相TiO2(110)常被用于甲醇重整反应机理的研究[11, 12],而化学性质更加稳定、反应活性更高的锐钛矿相TiO2(101)的研究也取得了不错的进展[13, 14].1991年,Banfield等[15]在自然界中首次发现了青铜矿相TiO2(TiO2(B)),它具有比锐钛矿相(3.79 g/cm3)[16]和金红石相(4.13 g/cm3)[17, 18] TiO2更小的密度(3.64 g/cm3)[19],类似钙钛矿的松散层状结构,属于TiO2的介稳态结构,在受热过程中容易向锐钛矿相转化.目前,TiO2(B)已经在锂离子电池[20]、光催化等[21]领域受到较多关注.近年来,已经有大量分析手段被用于探究使用不同晶型TiO2作为催化剂时甲醇重整反应的机理,包括扫描隧道显微镜(STM)[22]、红外光谱(IR)[23]、X射线光电子能谱(XPS)结合程序升温脱附(TPD)[24],飞秒双光子光电子能谱(2PPE)[25]、频振动光谱(SFG)[26]和密度泛函理论(DFT)计算[27-29]等.然而,这些研究手段大多需要在超真空、固气界面或理想状态下实现,并不能真实地反映光解水反应过程.而原位核磁共振(operando NMR)技术在实时监测真实固液反应中具有不可替代的作用.
已有研究对甲醇重整反应的一级产物甲二醇、半缩醛,二级产物甲酸、甲酸甲酯进行了归属[30],并研究了金属负载[31]、气体压强变化等对于产物产率的影响.然而据我们所知,光催化甲醇重整过程中甲醇和水之间的相互作用,以及影响该相互作用的因素尚未见报道.
本文采用原位液体NMR技术对光催化甲醇重整过程中甲醇与水之间密切的相互作用(包括氢键相互作用及质子交换)进行了系统研究,并探究了催化剂的种类(不同晶型,以及同一晶型不同形貌的TiO2)、体系温度、光照反应条件对该相互作用的影响.
1 实验部分 1.1 试剂、仪器与样品合成试剂:钛酸四丁酯(国药沪试,CP,≥98%)、无水乙醇(国药沪试,GR,≥99.8%)、乙酰丙酮(Aladdin,AR,99%)、纳米钛粉(Aladdin,99.8%金属基准,60 nm)、氨水(Aladdin,AR,25% ~ 28%)、过氧化氢30%水溶液(国药沪试,GR,≥30.0%)、羟基乙酸(Aladdin,98%)、硫酸(国药沪试,AR,95%~98%)、氢氧化钠(国药沪试,AR,片状,≥96.0%)、四氯化钛(Aladdin,AR,99.0%)、乙二醇(Aladdin,GC,≥99.5%)、盐酸(国药沪试,AR,36.0% ~ 38.0%)、去离子水、甲醇(Aladdin,色谱级plus,≥99.9%)、氘代甲醇(Aladdin,99.8% D)、氘水(Aladdin,99.8% D),锐钛矿相纳米TiO2(Sigma-Aldrich,< 100 nm,99.99%).
仪器:磁力搅拌器(HJ-4A四头多联磁力搅拌器)、真空干燥箱(丙林DZF-6020-T)、马弗炉(上海禾工,HG-12-4B)、管式炉(上海MFLGK306-12)、离心机(良友仪器TG16-WS).
锐钛矿相纳米TiO2(TiO2-A)的合成:取5 mL钛酸四丁酯于烧杯A中,加入25 mL无水乙醇,搅拌,配成混合溶液Ⅰ.向烧杯B中加入10 mL无水乙醇、2 mL去离子水、0.5 mL乙酰丙酮,搅拌,配成溶液Ⅱ.将溶液Ⅰ用滴管以1滴/s的速度缓慢滴入溶液Ⅱ中,得到浅黄色的TiO2溶胶液.在常温条件下静置陈化48 h,即得到乳黄色的凝胶液.将凝胶液于70 ℃下真空干燥过夜,得到橙黄色的块状结晶,研磨,得浅黄色粉末.将该粉末放置在马弗炉中以2 ℃/min的速度升温至400 ℃,退火2 h,自然降温,即可得到TiO2-A样品.TiO2-A样品使用前统一放置于真空干燥箱中进行干燥处理,排除表面水分的干扰.
金红石相纳米TiO2(TiO2-R)的合成:使用TiO2-A中的方法配制前体凝胶液.然后将研磨得到的粉末放置在马弗炉中以2 ℃/min的速度升温至700 ℃,退火2 h,自然降温,即可得到TiO2-R样品.TiO2-R样品使用前统一放置于真空干燥箱中进行干燥处理,排除表面水分的干扰.
青铜矿相纳米TiO2(TiO2-B)的合成:冰水浴条件下,在盛有3.5 mL氨水的烧杯中加入10 mL过氧化氢水溶液,随磁力搅拌缓慢加入0.1 g纳米钛粉.然后缓慢加入0.25 g羟基乙酸,80 ℃下磁力搅拌以除去过量氨水和过氧化氢,得到黄色溶液.当黑色粉末完全溶解后,自然冷却至室温.搅拌下加入6 mL去离子水和0.2 mL硫酸,得到暗红色溶液.将溶液转移至容积为50 mL的水热釜特氟龙衬里内,110 ℃下水热反应20 h,自然降至室温.将沉淀用水和反复清洗4次,醇洗,70 ℃下干燥过夜.研磨得到的固体,转移至马弗炉内,1 ℃/min升温至300 ℃,退火2 h,自然降温,即可得到TiO2-B样品.TiO2-B样品使用前统一放置于真空干燥箱中进行干燥处理,排除表面水分的干扰.
TiO2-B-管的合成:取5 mL钛酸四丁酯于烧杯A中,加入25 mL无水乙醇,搅拌,配得溶液Ⅰ.在烧杯B中加入10 mL无水乙醇、2 mL去离子水,加入0.5 mL乙酰丙酮,搅拌,制得溶液Ⅱ.以1滴/s的速度滴加溶液Ⅰ至溶液Ⅱ中,剧烈磁力搅拌,得到TiO2溶胶液.自然陈化48 h,溶胶液变为凝胶态.70 ℃下真空干燥过夜,研磨.配制10 mol/L的NaOH溶液.将得到的粉末在搅拌状态下均匀分散在70 mL NaOH溶液中.将该混合液转移至反应釜内,120 ℃下水热反应24 h,自然降温.去除上清液,离心得到沉淀.将沉淀水洗、酸洗(0.01 mol/L盐酸)、水洗至中性、醇洗后,70 ℃下真空干燥,研磨.将得到的粉末置于管式炉,N2氛围中以1 ℃/min升温至400 ℃,保温2 h,自然降温,即可得到TiO2-B-管样品.TiO2-B-管样品使用前统一放置真空干燥箱中进行干燥处理,排除表面水分的干扰.
TiO2-B-棒的合成:按照TiO2-B-管的方法得到研磨成粉末的纳米颗粒.按照1:1的体积比制得70 mL无水乙醇和10 mol/L NaOH混合溶液,搅拌,将得到的混合液转移至水热釜内,180 ℃下水热反应24 h,自然降温.去除上清液,离心得到沉淀,将沉淀水洗、酸洗(0.01 mol/L盐酸)、水洗、醇洗后,置于干燥箱内70 ℃真空干燥过夜,研磨.将得到的粉末置于管式炉,在N2氛围以1 ℃/min的速度升温至400 ℃,退火2 h,自然降温,即可得到TiO2-B-棒样品.TiO2-B-棒样品使用前统一放置真空干燥箱中进行干燥处理,排除表面水分的干扰.
TiO2-B-颗粒的合成:保持环境干燥,将盛有30 mL乙二醇的烧杯置于冰水浴中,迅速将1 mL四氯化钛溶液注入烧杯中,搅拌1 h.然后边搅拌,边继续注入1 mL去离子水,将混合溶液转移至容积为50 mL的水热釜特氟龙衬里内,加热至150 ℃,水热反应4 h.滤去上清液,离心得到沉淀,水洗醇洗交替进行4次,70 ℃真空干燥过夜.研磨,将得到的粉末转移至坩埚内,放置在马弗炉中,空气气氛1 ℃/min加热至400 ℃,保温2 h,自然降温,即可得到TiO2-B-颗粒样品.TiO2-B-颗粒样品使用前统一放置真空干燥箱中进行干燥处理,排除表面水分的干扰.
Pt负载TiO2-R和TiO2-B-管的合成:使用光沉积法合成1 wt. % Pt负载的TiO2-R和TiO2-B-管催化剂.适量氯铂酸溶液(1 g Pt/mL)加入到含100 mg待负载TiO2催化剂的装置中,再加入90 mL去离子水和10 mL甲醇,搅拌.回流管冷凝水温度保持在6 ℃,将体系反复抽真空3次,并达到稳定.此时,使用Xe灯全波段光照2 h.60 ℃下烘干样品,转移至马弗炉中,300 ℃煅烧1 h(升温速率为5 ℃/min),自然降温,即可得到1 wt. % Pt负载TiO2-R和TiO2-B-管催化剂,分别命名为TiO2-R-Pt和TiO2-B-管-Pt.样品使用前统一放置真空干燥箱中进行干燥处理,排除表面水分的干扰.
Pd负载锐钛矿相纳米TiO2的合成:使用共沉淀法合成1 wt. % Pd负载的锐钛矿相TiO2,该实验使用商用锐钛矿相纳米TiO2(购自Sigma-Aldrich).将100 mg锐钛矿相纳米TiO2样品加入到50 mL的瓷坩埚中,加入相对于样品的1 wt. % Pd的氯化钯溶液(1 g Pd/mL),超声分散均匀.在80 ℃条件下搅拌烘干,随后将瓷坩埚放入马弗炉中以2 ℃/min升温速度升温180 ℃并保温30 min,反应结束后,冷却至室温,即可得到Pd负载的锐钛矿相纳米TiO2样品,命名为Pd/TiO2.Pd/TiO2样品使用前统一放置真空干燥箱中进行干燥处理,排除表面水分的干扰.
1.2 实验参数使用X射线衍射仪(Bruker D8 Advance)对合成的不同晶型和不同形貌的TiO2样品进行了XRD测试:Cu靶,测试电压为20 kV,电流为2 mA,扫描速度为5˚/min.
TiO2-B-棒、TiO2-B-管及TiO2-B-颗粒的扫描电子显微(SEM)图片使用日立公司S-4800型SEM仪器获得,加速电压为5.0 kV.
本研究中未进行光照的一维、二维实验主要采用非原位NMR技术,光催化过程中的系列NMR实验采用原位NMR技术.原位NMR技术,即在产物不进行分离的情况下直接对光催化体系中的组分进行直接观察,实验装置示意图如图 1(a)所示.在NMR样品管中配置好催化剂+甲醇+水的溶液体系,静置过程不光照,光催化甲醇重整光源为Xe灯(全波段照射),并直接将反应前后的催化剂悬浮液置于NMR设备中进行检测.

|
图 1 (a) 原位NMR实验装置和(b)光催化分解水制氢检测装置示意图 Fig. 1 Schematic diagram of (a) the operando NMR device, and (b) the detection device of hydrogen produced from water splitting |
对氘代甲醇+水(无催化剂)体系、甲醇+氘水(无催化剂)体系(空白组),以及加入TiO2系列催化剂(Pd/TiO2、TiO2-A、TiO2-B、TiO2-R,TiO2-B-棒、TiO2-B-管、TiO2-B-颗粒.TiO2-R-Pt、TiO2-B-管-Pt)的甲醇+氘水体系的1H NMR谱图使用配备安捷伦HXY三通道静态探头的NMR谱仪(Varian,700 MHz)采集,1H核共振频率为700.13 MHz,实验温度为276 K~298 K,谱宽(SW)为15 ppm,脉冲宽度为4 μs(45˚),采样时间为2.5 s,采样次数为16.对无催化剂加入的甲醇+氘水体系(480 μL D2O+20 μL CH3OH)进行2D EXSY谱采集,SW为7 ppm,采样时间为0.8 s,采样温度分别为298 K和283 K,混合时间100 ms,采样次数为4.NMR谱图以内标三甲基硅丙磺酸钠(DSS,0.5 wt. %)定标.
光催化分解水制氢系统包括:气相色谱采样系统(GC2060,上海锐敏仪器)、真空气体循环系统、Xe灯光源(北京泊菲莱公司,300 W,全波段)及进样系统.具体操作步骤如下:将10 mg制备好的1 wt. % Pd/TiO2催化剂加入到光解水制氢反应器[图 1(b)]中,随后加入100 mL甲醇水溶液(V甲醇: V水=1:9),超声(思昊科学仪器SH-2L)分散均匀.将搅拌磁子加入到反应器中,并密封好反应器.然后把反应器装入光解水制氢系统中,将反应器置于水浴环境中保温(278 K、283 K、288 K、293 K),用真空泵对整个制氢系统进行抽真空处理,并检查整个体系的气密性,循环水温度控制在288 K.待整个体系达到平衡状态后,打开Xe灯光源,并将电流控制在15 A.待Xe灯光源稳定后,放置于制氢反应器上方进行照射.气相色谱实验具体参数为:柱温是313 K,进样温度是323 K,检测器温度是373 K,载气为Ar,气压为0.3 MPa.
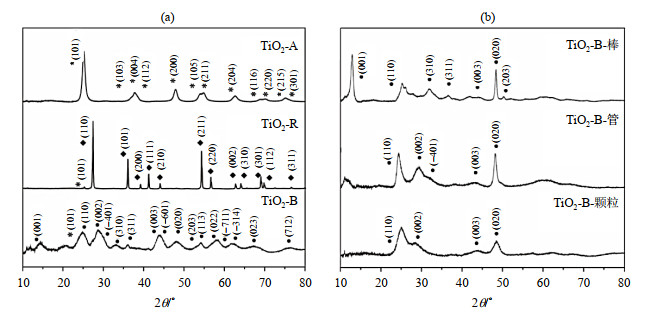
2 结果与讨论 2.1 TiO2催化剂的表征图 2(a)为不同晶型的TiO2的XRD谱图.经比对,合成的TiO2-A具有锐钛矿相TiO2固有的(101)、(103)、(004)、(112)、(200)、(105)、(211)、(204)、(116)、(220)、(215)及(301)衍射特征峰.合成的TiO2-R具有金红石相TiO2固有的(110)、(101)、(200)、(111)、(210)、(211)、(220)、(002)、(310)、(301)、(112)及(311)衍射特征峰和极少量的锐钛矿相TiO2的(101)衍射特征峰,这可能是由于金红石相的完全转化需要在极高温度下完成,很难转化完全.由于青铜矿相TiO2的亚稳定性,很难稳定存在于自然界,容易引入或转化为锐钛矿相结构,合成的TiO2-B的XRD谱图中可发现具有青铜矿相TiO2的固有(001)、(110)、(002)、(-401)、(310)、(311)、(003)、(-601)、(020)、(203)、(113)、(022)、(-711)、(-314)、(023)及(712)衍射特征峰,但是同时这些峰强度变弱,峰宽增加,说明我们得到的样品晶粒尺寸小、晶体结构不够完整,晶格周期性不如锐钛矿相和金红石相TiO2.宽峰涵盖了部分锐钛矿相TiO2的特征峰,提示我们得到的样品可能是青铜矿相和锐钛矿相TiO2的混合相结构.
|
图 2 (a) TiO2-A、TiO2-R、TiO2-B和(b) TiO2-B-棒、TiO2-B-管、TiO2-B-颗粒的XRD谱图 Fig. 2 XRD patterns of (a) TiO2-A, TiO2-R, TiO2-B, and (b) TiO2-B-rod, TiO2-B-tube, TiO2-B-particle |
我们对合成的不同形貌的青铜矿相TiO2样品也进行了XRD测试,如图 2(b)所示.所有样品都具有青铜矿相TiO2的典型(110)、(003)、(020)衍射特征峰,TiO2-B-棒拥有清晰的(001)衍射特征峰,(310)、(311)衍射特征峰也较为清晰,TiO2-B-管及TiO2-B-颗粒拥有明显的(002)衍射特征峰,总体趋势差异不大,均可归属为TiO2-B.图 3为TiO2-B-棒、TiO2-B-管及TiO2-B-颗粒的SEM图片,从图中可以观察到清晰的棒、管、颗粒形貌.

|
图 3 (a) TiO2-B-棒、(b) TiO2-B-管和(c) TiO2-B-颗粒的SEM照片 Fig. 3 SEM images of (a) TiO2-B-rod, (b) TiO2-B-tube, and (c) TiO2-B-particle |
在光催化过程中,光照射到催化剂上时,会产生光生电子(e-)和空穴(h+),当反应体系中存在作为牺牲剂的甲醇时,水与光生电子结合的同时,甲醇也与空穴结合,这降低了空穴和电子的复合,从而提升了光催化的效率.在以往的研究中,甲醇的羟基与水分子之间存在的密切相互作用(包括氢键和质子交换)通常被忽略.然而在真实溶液体系中,甲醇与水之间的联系是客观存在的,而它们之间的相互作用也一定程度上影响着甲醇重整产物的产率.常规的检测手段通常难以发现这种相互作用,而液体NMR方法为观测这种相互作用提供了可能.在我们的研究中,我们不仅证实甲醇与水之间存在氢键相互作用,并且存在密切的质子交换.而光照、温度、催化剂类型均会对这些相互作用产生一定的影响.
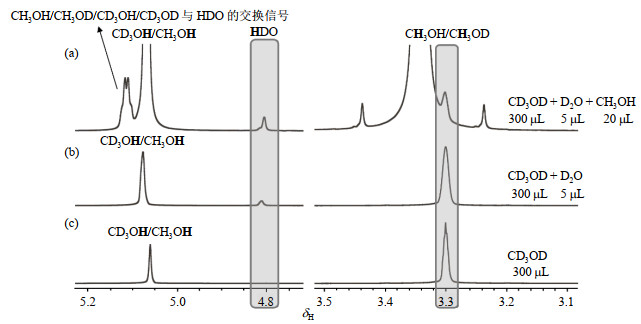
2.2.1 甲醇的羟基峰与水峰的归属为了对甲醇与水的相互作用进行研究,首先,我们对光解水液体环境中的甲醇的羟基峰与水峰进行归属.我们采用了向300 μL氘代甲醇(CD3OD,99.8% D)中逐量增加氘水(D2O,99.8% D)和普通甲醇(CH3OH)的体系来避免过高的水峰对NMR信号的干扰.同时为了避免催化剂的影响,不向体系中加入催化剂.
如图 4(c)所示,在纯CD3OD样品的1H NMR谱中,我们可以观察到两个峰,分别位于δH 5.05和δH 3.30,从文献[30]可知,它们分别被归属为甲醇的羟基(CD3OH/CH3OH)和-CH3基团(CH3OH/CH3OD).向该体系中加入5 μL D2O后,如图 4(b)所示,1H NMR谱中出现了一个明显的新峰(δH 4.82),我们将其归属于HDO.继续向该体系中加入20 μL CH3OH.如图 4(a)所示,一个较弱的新信号在甲醇的羟基峰左侧δH 5.11处出现.由于甲醇+水的混合体系在常温常压环境中化学性质稳定,所以可以排除甲醇和水发生化学反应产生新物质造成的影响.考虑到研究体系中存在多种活泼质子,这个峰的出现极有可能来自于含活泼质子的CH3OH/CH3OD/CD3OH/CD3OD与HDO之间的交换信号.在此体系中纯D2O的含量很低,因此我们没有考虑D2O对上述活泼质子交换反应的影响.
|
图 4 (a) 5 μL D2O + 20 μL CH3OH + 300 μL CD3OD、(b) 5 μL D2O + 300 μL CD3OD,以及(c) 300 μL CD3OD体系的1H NMR谱图(无催化剂加入,276 K) Fig. 4 1H NMR spectra of (a) 5 μL D2O+20 μL CH3OH+300 μL CD3OD, (b) 5 μL D2O+300 μL CD3OD, and (c) 300 μL CD3OD systems without catalyst at 276 K |
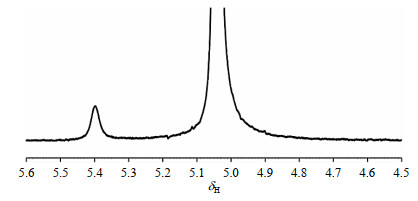
为了进一步对甲醇与水之间的质子交换进行研究,我们在无催化剂的情况下对甲醇+水体系进行了1D 1H NMR和2D EXSY实验.首先,我们配制了普通甲醇+氘水(20 μL CH3OH+480 μL D2O)混合溶液体系,并进行了1H NMR实验,实验温度为276 K.如图 5所示,δH 4.50~5.60之间出现了两个明显的信号,分别为与水存在相互作用的部分甲醇羟基的信号(~δH 5.40,后文简称甲醇-OH),以及甲醇和氢氘水的羟基信号(CH3OH/HDO,~δH 5.04).值得注意的是,在上述CD3OD(大量)+D2O+CH3OH体系中,δH 4.50~5.60之间我们观测到3个信号峰,而在D2O(大量)+CH3OH体系中,该区间只出现了2个信号.这可能是由于随着D2O含量的增加,CH3OH被D2O氘代为CH3OD,进而导致HDO含量增加,CH3OH和HDO趋于合并为一个峰.
|
图 5 无催化剂时,20 μL CH3OH+480 μL D2O体系的1HNMR谱图(276 K) Fig. 5 1H NMR spectrum of 20 μL CH3OH+480 μL D2O system without catalyst at 276 K |
为了进一步对该交换峰进行研究,我们使用2D EXSY实验来观测该体系中的1H-1H交换信息.图 6为不同温度下20 μL CH3OH+480 μL D2O体系的2D EXSY实验谱图.与图 5中的信号相比,图 6中甲醇-OH化学位移略往高场移动,分别在图 6(a)δH 5.12和δH 4.81,以及图 6(b) δH 5.34和δH 5.00出现,这主要是由于图 6的实验温度略高于图 5.当温度为283 K时,δH 5.34和δH 5.00处的两个峰出现了明显的交换现象.随着温度升高,反对角线上的交换峰的信号强度明显增强,表明随着温度升高,质子交换速度明显加快.

|
图 6 (a) 298 K和(b) 283 K下,无催化剂时,20 μL CH3OH+480 μL D2O体系的2D EXSY谱图 Fig. 6 2D EXSY spectra of 20 μL CH3OH+480 μL D2O system without catalyst at (a) 298 K and (b) 283 K |
相对于大量CD3OD环境下进行实验的图 4,图 5和图 6中我们观察到交换信号峰向低场移动的趋势,可能是由D2O加入量的增加导致的.
2.3 光照和温度对甲醇和水相互作用的影响为了研究不同反应条件下甲醇和水之间的相互作用,我们将1 mg Pd/TiO2催化剂加入至20 μL CH3OH+480 μL D2O体系中,超声10 min,无光照条件下静置24 h后,并利用Xe灯全波段照射,并对反应不同时间的体系进行原位1H NMR实验.据我们所知,体系中氢键的增强可以削弱对氢键质子的屏蔽,在1H NMR谱图中表现为出峰位置向低场位移;当氢键相互作用变弱时,则表现为出峰位置向高场偏移.因此,通过观察不同时刻水峰和甲醇-OH峰的出峰位置,可以得到反应过程中水与甲醇之间氢键相互作用的变化趋势.
图 7所示为甲醇-OH峰和水峰的位置随光照时间(反应时间)的变化趋势.光照开始后,甲醇-OH峰的位置从δH 5.39向高场移动至约δH 5.15,而水峰位置变化不大,仅从δH 5.037向高场移动至δH 5.025,这暗示了水和甲醇之间的相互作用受到了光照时间的影响.随着光照时间的增加,这一影响越来越大.光照约35~40 min后,甲醇-OH峰的位置变化达到了一个平台期.在第45 min进行测试时甲醇-OH峰基本消失.甲醇-OH峰会受到甲醇与水之间氢键和质子交换作用强弱的影响,并表现出一定的位移或峰形/强度的变化(氢键相互作用表现为其出峰位置变化,质子交换表现为其峰形和强度).

|
图 7 1 mg Pd/TiO2+480 μL D2O+20 μL CH3OH体系中,甲醇-OH峰和水峰的化学位移随光照反应时间的变化(276 K) Fig. 7 1H chemical shift changes of CH3OH/H2O and H2O signals with the irradiation time of 1 mg Pd/TiO2+480 μL D2O +20 μL CH3OH system at 276 K |
在不同温度下进行全波段光照光解水产氢实验的H2产量与1H NMR降温实验中甲醇-OH峰出峰位置及强度变化有良好的匹配性(图 8).光解水产氢实验的H2产量是利用色谱进行检测的,样品组成为10 mg Pd/TiO2+90 mL H2O+10 mL CH3OH,Xe灯光照1 h.1H NMR实验样品组成为1 mg Pd/TiO2+480 μL D2O+20 μL CH3OH.从图 8可以看出,当温度从293 K下降至283 K的过程中,H2产量由2.5 μmol上升至约15 μmol,温度降低,虽然导致质子交换速率的降低(1H NMR谱图中甲醇-OH的峰逐渐尖锐),但同时氢键相互作用的加强(图 8 1H NMR谱图中的两峰之间的距离和甲醇-OH的位置)对反应的促进作用占更主要的因素,所以依旧表现出了随着温度降低,产氢效率增高的现象.283 K时,体系内甲醇和水之间的相互作用达到了最有利于光催化产氢的条件.当温度继续降低至278 K的时候,甲醇与水之间的质子交换速率受到更强的抑制,氢键相互作用对体系活性的促进作用已经很难弥补由于分子能量降低、原子运动减少导致的体系活性的下降,表现出产氢效率的显著下降.

|
图 8 不同温度下,光催化甲醇重整反应的H2产量与1H NMR谱图甲醇-OH的出峰位置和强度的对比 Fig. 8 Comparisons of hydrogen evolution with 1H NMR chemical shift and peak intensities of CH3OH/H2O at different temperatures |
除温度和光照时间会影响光催化甲醇重整反应体系中甲醇与水之间的相互作用外,催化剂的选择对甲醇-OH峰的影响也十分明显.将不同TiO2催化剂加入甲醇+水体系时,我们发现,有些催化剂的加入会导致甲醇-OH峰立即消失,有些则几乎没有变化,这说明不同催化剂对于甲醇与水之间相互作用产生了不同的影响.甲醇与水之间密切的相互作用有利于其与催化剂表面的光生空穴或电子结合,从而在甲醇重整过程中起到有利的作用.于是,我们合成了一系列不同晶型的TiO2样品,并系统研究了其对甲醇和水相互作用的影响.
2.4.1 TiO2催化剂的晶型对甲醇和水相互作用的影响将1 mg催化剂(TiO2-A、TiO2-R和TiO2-B)加入480 μL D2O+20 μL CH3OH体系中.30 ℃下,将配制好的试样NMR样品管在超声仪中以最大功率超声10 min,并在无光照条件下静置24 h,以排除催化剂沉淀对测试的扰动,然后再将NMR样品管倾斜至与水平面保持20˚,使用Xe灯照射24 h以观察重整产物.对所有试样在276 K下进行1D 1H NMR实验.如图 9所示,光照前以TiO2-A和TiO2-R作为催化剂的体系中均在~δH 5.40处(灰色阴影部分)出现了甲醇-OH信号(与图 5相同),而以TiO2-B为催化剂时,该信号完全消失,这预示着加入TiO2-B后,甲醇与水之间的相互交换速率提升,这可能与TiO2-B催化剂本身的性质有关.

|
图 9 加入TiO2-B、TiO2-A和TiO2-R后,20 μL CH3OH+480 μL D2O体系的1H NMR谱图(276 K) Fig. 9 1H NMR spectra of 20 μL CH3OH+480 μL D2O system with TiO2-B, TiO2-A, TiO2-R as catalysts at 276 K |
室温条件下,光照前,我们采集了所有样品的1H NMR谱图.使用DSS为标准归一化处理体系中相关峰对应的峰面积(表 1).光照前,未加入催化剂的空白对照体系中甲醇-OH峰面积明显高于含催化剂体系:空白对照组(31.622 μmol) > TiO2-A(29.345 μmol) > TiO2-R(24.003 μmol) > > TiO2-B(0 μmol).在无光照环境下静置24 h后,加入不同晶型TiO2催化剂的甲醇+水体系中甲醇-OH峰面积可观察到轻微升高,这可能是由于当体系中催化剂形成比较稳定的固液环境后,有部分催化剂的表面被覆盖,质子交换的速率略有下降.从催化剂加入后明显降低的甲醇-OH峰面积可以推出,催化剂的加入确实影响了甲醇与水之间的相互作用,质子交换速率在催化剂加入后有所上升,这与催化剂促进反应进一步发生一致.
| 表 1 使用不同类型的催化剂时,体系中各物质的含量(μmol) Table 1 The amounts (μmol) of substances in the reaction systems using different catalysts |
用Xe灯全波段照射各个体系24 h后,在δH 4.83和δH 4.73处发现了两个峰,分别对应甲醇重整产物甲二醇(HOCH2OH)和半缩醛(CH3OCH2OH).归一化处理后,各体系中各重整产物的产量如表 1所示,HOCH2OH的产量趋势为:TiO2-B(7.963 μmol) > TiO2-A(5.764 μmol) > TiO2-R(3.482 μmol),CH3OCH2OH的产量趋势为:TiO2-B(4.720 μmol) > TiO2-A(3.781 μmol) > TiO2-R(2.114 μmol),重整效率为:TiO2-B > TiO2-A > TiO2-R.
值得注意的是,TiO2-B催化剂体系的甲醇重整产量最高,而δH 5.40处的甲醇-OH峰完全消失,说明该催化剂的加入大幅提升了甲醇-OH与水之间的质子交换速率.此外,TiO2-B作为单斜晶相的TiO2,在电荷传输方面有其他晶相不具备的独特优势,单斜晶相晶胞小,利于电荷的各向异性传输,拥有较高的电荷分离效率,甲醇与水的密切关系使得它们同时接触到催化剂上的光生空穴和电子的可能性大幅上升,导致重整产物的产量提升.
对比于TiO2-R,TiO2-A作为催化剂的体系中甲醇-OH峰面积更高,暗示着TiO2-R对体系中甲醇和水之间的质子交换促进作用更强.然而,TiO2-R作催化剂的体系甲醇重整产物产量却低于TiO2-A体系.表 2列举了不同晶型TiO2催化剂的比表面积,可以发现,其他合成条件一致时,更高的焙烧温度导致获得的TiO2-R(0.778 8 m2/g)的比表面积较TiO2-A(44.379 8 m2/g)更小,TiO2-R是TiO2中最稳定的晶型,缺陷少,可作为反应活性中心的位点的暴露也较少,电子和空穴极易复合,TiO2-A较TiO2-R暴露出更多的缺陷和空位,较多的氧空位可以用来捕获电子发生反应.催化剂诱导甲醇分子和水分子发生密切质子交换,并且不同晶型的催化剂表现出不同的促进作用,TiO2-R形成温度高于TiO2-A,但同时伴随比表面积的下降,致使发生密切质子交换的甲醇分子和水分子并不能都被催化剂上的活性位点吸附、结合光生空穴和电子,因此相对于TiO2-A,以TiO2-R为催化剂时,呈现出受晶型因素影响的相同反应时间内甲醇重整产物产量的下降.
| 表 2 不同TiO2催化剂的比表面积 Table 2 The specific surface areas of different TiO2 catalysts |
对于导致甲醇-OH峰信号完全消失的TiO2-B催化剂,我们也探究了其不同形貌是否会影响甲醇和水的相互作用.我们将5 mg催化剂加入480 μL D2O+20 μL CH3OH体系中配制得到试样.30 ℃下,将配制好试样的NMR样品管放置在超声仪中以最大功率超声10 min,无光照条件静置24 h以上,以排除催化剂沉淀对测试的扰动,再将NMR样品管倾斜至与水平面呈20˚角,Xe灯照射24 h,观察重整产物.
如图 10所示,光照前后所有形貌的催化剂试样都没有发现位于δH 5.40的甲醇-OH峰信号,与TiO2-B催化剂表现一致,这说明TiO2晶型对甲醇+水体系质子交换作用的影响大于形貌,即催化剂的表面结构对于甲醇和水的交换作用起到重要作用.当不同形貌的TiO2-B催化剂加入甲醇+水体系时,甲醇与水之间的质子交换速率都被大大促进.由图 10我们也可以发现,经过Xe灯全波段照射24 h后,甲醇重整产物以甲二醇(δH 4.83)和半缩醛(δH 4.73)为主,而且产率有明显的区别,将所有的峰以DSS峰面积为1作为基准归一化处理(表 1),HOCH2OH的产量:TiO2-B-颗粒(29.614 μmol) > TiO2-B-管(11.356 μmol) > TiO2-B-棒(7.032 μmol),CH3OCH2OH的产量:TiO2-B-颗粒(18.038 μmol) > TiO2-B-管(8.279 μmol) > TiO2-B-棒(5.372 μmol),甲醇重整总体效率:TiO2-B-颗粒 > TiO2-B-管 > TiO2-B-棒.
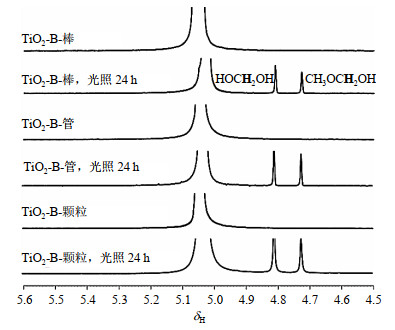
|
图 10 以不同形貌TiO2-B为催化剂时,20 μL CH3OH+480 μL D2O体系光照前后的1H NMR谱图(276 K) Fig. 10 1H NMR spectra of 20 μL CH3OH+480μL D2O systems with TiO2-B in different morphologies as catalysts before and after light irradiation at 276 K |
当晶型基本一致(TiO2-B)时,甲醇与水的质子交换速率的提升导致了甲醇-OH峰一致消失,质子交换的速率非常迅速,不再可以通过1H NMR谱图中甲醇-OH信号峰的宽窄、积分面积所代表的物质的量高低进行表达.表 2中也对这三种不同形貌的TiO2-B进行了BET比表面积测试,可发现TiO2-B-管(285.939 9 m2/g) > TiO2-B-颗粒(218.793 8 m2/g) > TiO2-B-棒(24.676 9 m2/g),但甲醇重整总体效率为TiO2-B-颗粒 > TiO2-B-管 > TiO2-B-棒,这表明比表面积并非是决定同晶型不同形貌催化剂影响甲醇重整总体效率的主要原因,催化剂对甲醇与水质子交换速率强弱的影响也是影响催化剂性能的因素之一.
从甲醇-OH峰量级上来看,晶型差异会导致甲醇与水之间质子交换强弱的明显差异,同晶型不同形貌的催化剂虽然无法从1H NMR谱图中观察到甲醇-OH信号的变化,但对甲醇和水之间的质子交换速率的影响依旧存在,并最终影响催化剂作用于甲醇重整的性能.
2.4.3 贵金属负载对甲醇和水相互作用的影响纯TiO2的光催化效率通常很低,贵金属负载对于提升TiO2的光催化效率起到至关重要的作用.为了深入探究贵金属负载对甲醇和水相互作用的影响,我们分别对TiO2-R-Pt和TiO2-B-管-Pt进行了相同溶液组分的1H NMR实验(如图 11所示).将1 mg TiO2-R-Pt和5 mg TiO2-B-管-Pt分别置于两个NMR样品管内,再加入480 μL D2O和20 μL CH3OH得到试样,超声10 min保证催化剂在液体中获得良好的分散性,并在无光照条件下静置24 h,然后倾斜NMR样品管至与水平面呈20˚角,用Xe灯光照24 h观察甲醇重整产物.值得注意的是,负载大大提升了甲醇重整的产率.相比于未负载Pt时,TiO2-R-Pt和TiO2-B-管-Pt催化体系产物的产量大大增加(表 1).有趣的是,在图 11(a)的第1条和第3条谱线中,我们观察到无光照条件稳定24 h后的TiO2-R-Pt体系中,在TiO2-R谱图中尖锐的甲醇-OH峰信号变宽,并降低为几乎为平直的宽包信号(并非消失为直线,见表 1中对TiO2-R-Pt无光照静置24 h后甲醇-OH信号物质的量的计算).因此,我们可以推出Pt的负载可以促进催化剂对甲醇与水之间质子交换速率.结合表 1中对配置后直接测试和静置24 h测试的甲醇-OH信号物质的量的计算与图 11(a)中第2条和第3条谱图,可观察到TiO2-R-Pt在经过静置过程后,体系内甲醇与水质子交换速率有较细微的提升,这通常来自于催化剂与反应液体的进一步接触对质子交换的促进.对于TiO2-B-管-Pt体系[图 11(b)第3条谱线],受负载的影响,随着静置时间的增加,相对稍强的沉降作用降低了催化剂与反应液体的接触,对液相体系质子交换速率的促进作用减弱,导致了δH 5.40处甲醇-OH峰的出现.在Xe灯光源照射前,为了增加固相催化剂和液相体系的接触面积,超声和为扩大与光源接触面积进行NMR样品管倾斜的操作促进了固相催化剂与液相体系的接触,使甲醇和水之间的质子交换速率上升,表现出甲醇-OH峰的消失[图 11(b)第2条和第4条谱线].

|
图 11 以(a) TiO2-R-Pt和(b) TiO2-B-管-Pt为催化剂时,20 μL CH3OH+480 μL D2O体系在静置前,静置24 h后和光照24 h后的1H NMR谱图(276 K) Fig. 11 1H NMR spectra of 20 μL CH3OH+480 μL D2O system with (a) TiO2-R-Pt, and (b) TiO2-B-tube-Pt as catalysts before deposition, after 24 h deposition and 24 h irradiation at 276 K |
因此,除光照可以发现明显的氢键作用的存在外,反应条件的变化同样对氢键有着影响.通过NMR实验我们发现了甲醇的羟基峰与水之间存在氢键相互作用和密切质子交换的证据.甲醇-OH峰会受到甲醇与水之间氢键和质子交换作用强弱的影响,并表现出一定的偏移或峰强度的变化,有时候以宽包的形式存在.甲醇与水之间的相互作用反映了甲醇与水之间空间位置的接近,对于与催化剂表面的光生空穴和电子发生反应,及降低光生空穴和电子的复合率起到了良性的作用.
3 结论本文使用原位NMR技术对真实固液体系下甲醇重整过程中甲醇与水之间的相互作用进行了系统研究,证实了甲醇+水体系中氢键相互作用及质子交换的存在.并探究了催化剂晶型和形貌、光照和温度对此相互作用的影响.结果表明,光照可以促进甲醇与水之间的相互作用.不同晶型及形貌的催化剂对于甲醇和水之间质子交换速率的影响不同.在文中研究体系中,对于提升甲醇和水之间的质子交换速率影响大小的顺序为TiO2-B > TiO2-R > TiO2-A.对于效率较高的TiO2-B催化剂,我们进一步考察了形貌及贵金属负载对其质子交换的影响,结果表明在研究的形貌中,TiO2-B-颗粒具有较高的甲醇重整性能,且负载贵金属可以进一步增加质子交换速度及最终的催化性能.此外,温度同样影响甲醇重整体系中的氢键相互作用和质子交换速率,适宜的温度对于促进甲醇与水间的相互作用及提高甲醇重整效率具有重要的作用.
利益冲突 无
| [1] | CUI Y J, DING Z X, FU X Z, et al. Construction of conjugated carbon nitride nanoarchitectures in solution at low temperatures for photoredox catalysis[J]. Angew Chem Int Edit, 2012, 51(47): 11814-11818. DOI: 10.1002/anie.201206534. |
| [2] | DONG F, LI Y H, WANG Z Y, et al. Enhanced visible light photocatalytic activity and oxidation ability of porous graphene-like g-C3N4 nanosheets via thermal exfoliation[J]. Appl Surf Sci, 2015, 358: 393-403. DOI: 10.1016/j.apsusc.2015.04.034. |
| [3] | LWIN Y, DAUD W R W, MOHAMAD A B, et al. Hydrogen production from steam-methanol reforming: thermodynamic analysis[J]. Int J Hydrogen Energ, 2000, 25(1): 47-53. DOI: 10.1016/S0360-3199(99)00013-0. |
| [4] | RAMESHAN C, WEILACH C, STADLMAYR W, et al. Steam reforming of methanol on PdZn near-surface alloys on Pd (111) and Pd foil studied by in-situ XPS, LEIS and PM-IRAS[J]. J Catal, 2010, 276(1): 101-113. DOI: 10.1016/j.jcat.2010.09.006. |
| [5] | MIYAO T, YAMAUCHI M, NAITO S. Liquid phase methanol reforming with water over silica supported Pt-Ru catalysts[J]. Catal Today, 2003, 87(1-4): 227-235. DOI: 10.1016/j.cattod.2003.10.003. |
| [6] | FUJISHIMA A, HONDA K. Electrochemical photolysis of water at a semiconductor electrode[J]. Nature, 1972, 238(5358): 37-38. DOI: 10.1038/238037a0. |
| [7] | KAWAI T, SAKATA T. Photocatalytic hydrogen production from liquid methanol and water[J]. J Chem Soc, Chem Commun, 1980, 15: 694-695. |
| [8] | KUDO A. Photocatalyst materials for water splitting[J]. Catal Surv Asia, 2003, 7(1): 31-38. DOI: 10.1023/A:1023480507710. |
| [9] | WANG X L, LIU W Q, YU Y Y, et al. Operando NMR spectroscopic analysis of proton transfer in heterogeneous photocatalytic reactions[J]. Nat Commun, 2016, 7(1): 1-7. |
| [10] | 叶曼. 原位核磁共振技术探究液态环境中甲醇光催化重整反应机理[D]. 上海: 华东师范大学, 2019. |
| [11] | XU C B, YANG W S, GUO Q, et al. Photoinduced decomposition of formaldehyde on a TiO2(110) surface, assisted by bridge-bonded oxygen atoms[J]. J Phys Chem Lett, 2013, 4(16): 2668-2673. DOI: 10.1021/jz401349q. |
| [12] | WANG T J, HAO Q Q, WANG Z Q, et al. Deuterium kinetic isotope effect in the photocatalyzed dissociation of methanol on TiO2(110)[J]. J Phys Chem C, 2018, 122(46): 26512-26518. DOI: 10.1021/acs.jpcc.8b09077. |
| [13] | XU C B, YANG W S, GUO Q, et al. Molecular hydrogen formation from photocatalysis of methanol on anatase-TiO2(101)[J]. J Am Chem Soc, 2014, 136(2): 602-605. DOI: 10.1021/ja411020t. |
| [14] | BENNETT D A, CARGNELLO M, GORDON T R, et al. Thermal and photochemical reactions of methanol on nanocrystalline anatase TiO2 thin films[J]. Phys Chem Chem Phys, 2015, 17(26): 17190-17201. DOI: 10.1039/C5CP02307F. |
| [15] | BANFIELD J F, VEBLEN D R, SMITH D J. The identification of naturally occurring TiO2(B) by structure determination using high-resolution electron microscopy, image simulation, and distance-least-squares refinement[J]. Am Mineral, 1991, 76(3/4): 343-353. |
| [16] | ASAHI R, TAGA Y, MANNSTADT W, et al. Electronic and optical properties of anatase TiO2[J]. Phys Rev B, 2000, 61(11): 7459. DOI: 10.1103/PhysRevB.61.7459. |
| [17] | MATSUI M, AKAOGI M. Molecular dynamics simulation of the structural and physical properties of the four polymorphs of TiO2[J]. Mol Simulat, 1991, 6(4-6): 239-244. DOI: 10.1080/08927029108022432. |
| [18] | GRANT F A. Properties of rutile (titanium dioxide)[J]. Rev Mod Phys, 1959, 31(3): 646. DOI: 10.1103/RevModPhys.31.646. |
| [19] | DYLLA A G, HENKELMAN G, STEVENSON K J. Lithium insertion in nanostructured TiO2(B) architectures[J]. Accounts Chem Res, 2013, 46(5): 1104-1112. DOI: 10.1021/ar300176y. |
| [20] | WILKENING M, HEINE J, LYNESS C, et al. Li diffusion properties of mixed conducting TiO2-B nanowires[J]. Phys Rev B, 2009, 80(6): 064302. DOI: 10.1103/PhysRevB.80.064302. |
| [21] | KUO H L, KUO C Y, LIU C H, et al. A highly active bi-crystalline photocatalyst consisting of TiO2(B) nanotube and anatase particle for producing H2 gas from neat ethanol[J]. Catal Lett, 2007, 113(1/2): 7-12. DOI: 10.1007/s10562-006-9009-1. |
| [22] | SANCHES F F, MALLIA G, HARRISON N M. Simulating constant current STM images of the rutile TiO2(110) surface for applications in solar water splitting[J]. Mater Res Soc Symp Proc, 2013, 1494: 339-344. DOI: 10.1557/opl.2013.236. |
| [23] | CHEN T, FENG Z C, WU G P, et al. Mechanistic studies of photocatalytic reaction of methanol for hydrogen production on Pt/TiO2 by in situ Fourier transform IR and time-resolved IR spectroscopy[J]. J Phys Chem C, 2007, 111(22): 8005-8014. DOI: 10.1021/jp071022b. |
| [24] | HERMAN G S, DOHNALEK Z, RUZYCKI N, et al. Experimental investigation of the interaction of water and methanol with anatase− TiO2(101)[J]. J Phys Chem B, 2003, 107(12): 2788-2795. DOI: 10.1021/jp0275544. |
| [25] | ZHOU C Y, REN Z F, MA Z B, et al. Photochemistry of Methanol on TiO2(110)[C]//Conference on molecular energy transfer. Oxford, UK: 2011, 44-0. |
| [26] | SCHLEGEL S J, HOSSEINPOUR S, GEBHARD M, et al. How water flips at charged titanium dioxide: an SFG-study on the water-TiO2 interface[J]. Phys Chem Chem Phys, 2019, 21(17): 8956-8964. DOI: 10.1039/C9CP01131E. |
| [27] | LANG X F, LIANG Y H, SUN L L, et al. Interplay between methanol and anatase TiO2(101) surface: The effect of subsurface oxygen vacancy[J]. J Phys Chem C, 2017, 121(11): 6072-6080. DOI: 10.1021/acs.jpcc.6b11356. |
| [28] | BERARDO E, HU H S, VAN DAM H J J, et al. Describing excited state relaxation and localization in TiO2nanoparticles using TD-DFT[J]. J Chem Theory Comput, 2014, 10(12): 5538-5548. DOI: 10.1021/ct500787x. |
| [29] | ZHANG H M, YU X H, MCLEOD J A, et al. First-principles study of Cu-doping and oxygen vacancy effects on TiO2 for water splitting[J]. Chem Phys Lett, 2014, 612: 106-110. DOI: 10.1016/j.cplett.2014.08.003. |
| [30] |
LIU W Q, SONG Y H, WANG X L, et al. In operando nuclear magnetic resonance spectroscopy study on photocatalytic methanol reforming[J].
Chinese J Magn Reson, 2019, 36(3): 298-308.
刘文卿, 宋艳红, 王雪璐, 等. 光催化甲醇重整机理的原位核磁共振研究[J]. 波谱学杂志, 2019, 36(3): 298-308. |
| [31] |
YE M, YANG Y N, ZHANG R, et al. Effects of co-catalysts and wavelength of light on the products of photocatalytic methanol reforming: an operando NMR study[J].
Chinese J Magn Reson, 2019, 36(4): 490-501.
叶曼, 杨以宁, 张燃, 等. 原位核磁共振技术研究共催化剂类型以及光照波长对甲醇光催化重整产物的影响[J]. 波谱学杂志, 2019, 36(4): 490-501. |
 2021, Vol. 38
2021, Vol. 38 
