湖泊作为地球上的一个特殊地质单元,具有独立的流域沉积体系、水文体系、生态环境体系,是大气圈、生物圈、土壤圈和陆地水圈相互作用的自然综合体与连接点(王苏民和李建仁,1991)。在湖泊的演化发展过程中,古湖盆中不仅蕴含着大量的油气、盐类等矿产资源,而且记录了地球演化过程中的气候、构造活动等,成为地学上研究的一个主体单元和热点领域。其中,由于湖泊的独特沉积-生态系统,各种环境的物理、化学和生物要素相互作用和变化的信息被记录在沉积物中,自McCrea(1950)和Urey等(1951)利用湖泊沉积物中碳酸盐碳(δ13 C)、氧同位素组成(δ18 O)作为古环境替代指标以来,对古温度、降雨、湖泊水面变化等古环境重建做了大量工作,被认为是古环境和湖泊古水文重建的一个十分有效的指标(Abbott et al.,2000; Anderson and Kaltin, 2001; Saucer et al.,2001; Benson and Paillet, 2002; Lamb et al.,2005; Bright et al.,2006; Zhang et al.,2011)。
由于湖泊沉积物中自生碳酸盐的形成与湖泊水介质有密切关系,然而,其碳、氧同位素组成研究表明受多种因素的影响,而且不同湖泊类型的影响机制也不尽相同。因此,尽管目前将湖泊沉积物中碳酸盐的碳、氧同位素组成作为古环境指标被广泛应用,但实际上对不同湖泊的解释差异较大。而湖泊中的有机质与湖泊流域之间有必然的联系,有机质碳同位素组成反映了流域的植被状况和湖泊生态系统特征,对湖泊记录的古生态环境演变过程有较好的指示作用。但是,正由于受湖泊沉积物中有机质陆源和湖泊內源的影响,以及这两者之间贡献的差异,从而导致有机质碳同位素组成与生态系统之间仍然缺乏有效的定量关系。本文主要通过中国西部地区大量分布的封闭-半封闭湖泊表层沉积物中碳酸盐的碳、氧、有机碳同位素组成的分析,通过与现代湖泊流域、水介质特征等之间关系的分析,认识在中国西部地区生态植被类型简单、流域较短、人类影响不大的环境下,湖泊碳酸盐碳、氧同位素组成与环境的响应,以及不同有机质贡献差异下有机碳同位素组成的响应特征。
1 研究区域概况及分析样品采集现代湖泊表层沉积物样品主要采自中国西部新疆(博斯腾湖、赛里木湖、乌伦古湖、巴里坤湖)、青藏高原(可可西里28个湖泊、高原中-西部52个湖泊、东部31个湖泊)、内蒙古、外蒙古(Gun Nuur)、中国东北地区(45~48° N,123~126° E,24个湖泊)等地(图 1),样品采集同时对水介质电导率、DO、pH值、深度等利用WTW Multi 340i德国产多参数水质仪进行测定。新疆、内蒙古、外蒙古,以及青藏高原湖泊主要为封闭-半封闭淡水-微咸水-咸水湖,湖泊周围植被不发育,以草本植物为主,受人类活动的影响较小。湖泊主要由大气降水、冰雪融水、地下水等补给,蒸发/降水量大; 中国东北地区的湖泊一般水体较浅,多为半开放-开放性湖泊,湖泊周围植被较好,以木本和草本为主,水体受人为影响营养化比较严重。湖泊主要由大气降水、地下水等补给,蒸发/降水量相对较小。

|
图 1 采样点位置图(主要标出青藏高原中-西部地区、可可西里地区,东北地区) Figure 1 The locations of samples from the Tibet Plateau and Northeastern China |
采集的湖泊表层沉积物用冷冻干燥器干燥,然后用大于200目分析筛分离出草根等植物残体,以及微体生物壳体。已有的研究表明,沉积物中粒径小于200~300目的颗粒碳酸盐为自生碳酸盐(姜加明和吴敬禄,2003)。
将处理好的样品分为2份,1份用于碳酸盐含量、总有机质含量(TOC)和δ13 C、δ18 O分析。碳酸盐含量采用酸溶法分析,一定量的沉积物、碳酸盐标准分别与10%稀盐酸反应后,测定产生CO2气体的压力,计算后得到沉积物中碳酸盐含量; TOC分析采用重铬酸钾-浓硫酸滴定法分析。将处理后的沉积物样品加入到稳定同位素分析前处理系统中,与100%浓磷酸在真空下反应,产生的CO2纯化后收集到指状样品管中,然后引入到MAT-252同位素仪中测试。采用NBS-19和实验室标样进行误差控制,样品分析误差小于0.3‰。分析结果以V-PDB表示。对于湖泊沉积物,由于碳酸盐含量普遍偏低、砂质含量相对较高,这样的不纯碳酸盐样采用样品量较大的离线方式分析,得到的结果准确性比在线方式测定高。
将另外1份处理好的沉积物样用稀盐酸去除碳酸盐矿物并洗至中性,然后冷冻干燥。干燥后的样品在氧气流中高温(800℃左右)燃烧,液氮冷阱中纯化后,在酒精-液氮冷阱中收集产生的CO2,引入到MAT-252同位素仪中测试。采用实验室工作标准进行样品误差控制,样品分析误差小于0.6‰。分析结果以V-PDB表示。通过与元素分析仪-质谱仪的在线测试相比,由于湖泊沉积物中有机质含量较低,尤其是砂质含量高的沉积物有机质含量更低,而在线测试通常要求样品总量较小,因此,尽管在线法也有标准样品的控制,但测定的结果偏差仍较大。经过盐酸处理的沉积物样品,通过元素分析仪进行C/N值测定。
3 结果及讨论根据对中国西部地区青藏高原、新疆等地,以及东北地区现代湖泊水体盐度(电导率)、pH等参数的现场测定结果,按照水体中盐度含量小于2g/L为淡水湖、2~15g/L为微咸水湖、15~24g/L为微咸水-咸水湖、24~35g/L为咸水湖、大于120g/L为盐湖的划分,研究区中水体主要为淡水-微咸水,少量盐湖主要采集于柴达木盆地和青藏高原的现代盐湖中。 图 2反映了研究区不同盐度类型湖泊沉积物中碳酸盐碳、氧同位素组成(图 2a,2b)、有机碳同位素组成(图 2c)、有机质含量(图 2d)、C/N值(图 2e)、碳酸盐含量(图 2f)与水体电导率之间的关系。从图中可以明显反映出在水体盐度极低情况下(<0.1mS/cm)时,沉积物中碳酸盐含量也极低,碳、氧同位素组成变化较大而无相关性,表明可能受到有机质(Leng and Marshall, 2004)或者外源原生碳酸盐矿物(图 2b,碳酸盐氧同位素组成可达10‰左右)的影响; 碳酸盐矿物在从淡水到盐湖环境中均存在,但在淡水-微咸水中有较高含量; 沉积物中有机碳同位素组成主要为-15‰~-30‰,并且不受湖泊水体盐度的影响。有机质在淡水湖泊中含量相对较高,且不受水体盐度的影响; 从C/N值反映出淡水湖泊中有机质有不同的来源,在盐湖中有机质含量较低。
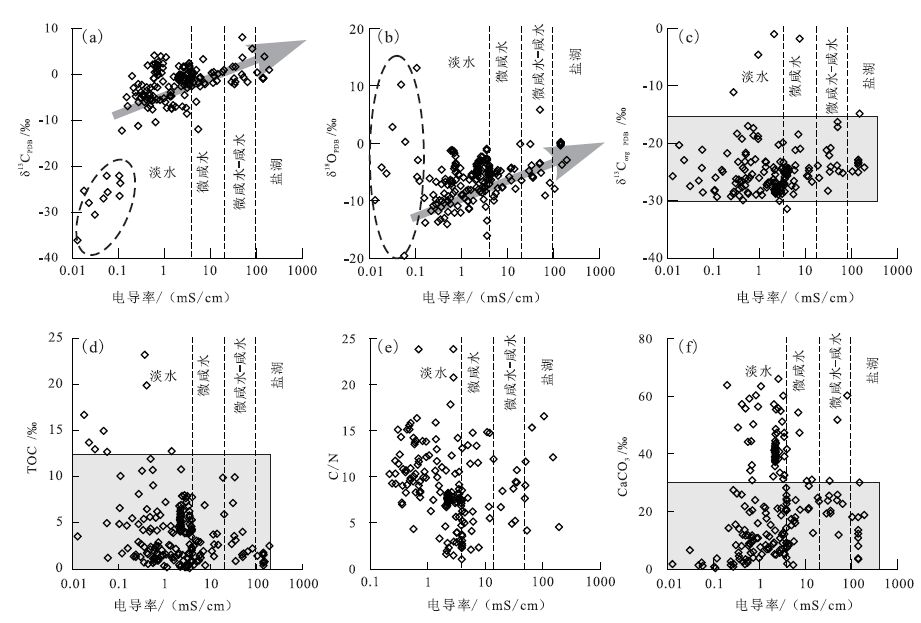
|
图 2 研究区不同类型湖泊沉积物中δ13 C和δ18 O、有机质以及碳酸盐含量与电导率之间的关系 Figure 2 The correlations of conductivity of lake water versus stable isotopes and organic matters and carbonate contents of sediments in different salinity lakes |
对中国西部地区青藏高原、新疆等地,以及东北地区现代湖泊沉积物中δ13 C、δ18 O的分析(图 3)。结果表明,中国西部地区湖泊表层沉积物中δ13 C、δ18 O的相关性较好(平均R=0.64),而东北地区湖泊几乎没有相关性。并且,从δ13 C、δ18 O值也表明这2个地区有明显差异,西部地区湖泊δ13 C为-8‰~+6‰,δ18 O为+2‰~-14‰,大量的湖泊中 δ18 O 在0以上; 而东北地区湖泊δ13 C主要为-4‰~-8‰,δ18 O为-4‰~-12‰,明显比西部地区偏负。这主要受控于湖泊性质,西北地区湖泊主要为封闭-半封闭湖泊,水体主要来源于降水、地下水,以及冰雪融水,导致 δ18 O 有较大的变化范围。并且,δ13 C、δ18 O两者之间较好的相关性代表了湖泊的封闭特征,并且在研究区封闭-半封闭湖泊中,随着水体盐度的上升,碳、氧同位素组成偏重,与Talbot(1990)的研究结果一致。东北地区湖泊水体来源相对单一,主要以大气降水为主,湖泊沉积物 δ18 O 也相对偏负,但变化范围较窄,并且没有出现0以上的数值。这与东北地区湖泊的开放性、水体盐度、滞留时间、湖泊生产力、有机质污染等环境因素有直接的关系(Zhang et al.,2013)。
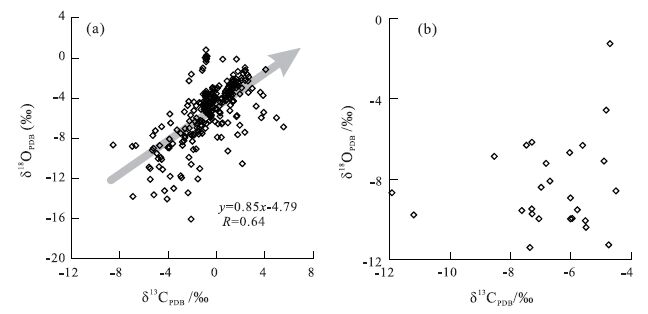
|
图 3 中国西部地区(a)和东北地区(b)湖泊表层沉积物δ13 C、δ18 O特征 Figure 3 The covariance between carbon and oxygen isotopes of carbonates in the bulk sediments in Western(a)and Northeastern(b)China |
从新疆、青藏高原湖泊分析结果可见,沉积物δ13 C、δ18 O之间有较好的正相关性(图 3a),并且一个比较明显的特征是δ13 C偏重,在0~+6‰范围的湖泊较多。在以前的研究中也发现湖泊沉积物的δ13 C、δ18 O之间具有正、负两种类型的相关性。Talbot(1990)对中亚和非洲大量湖泊分析,δ13 C、δ18 O之间具有正相关性,并且水体滞留时间越长相关性越明显,而开放性湖泊则没有相关性。Leng和Marshall(2004)也对大量湖泊沉积物δ13 C、δ18 O相关性分析,发现淡水、咸水湖中δ13 C、δ18 O均为正相关,只是δ13 C、δ18 O值有明显差异,而以地下水补给的湖泊则无相关性。对于δ13 C、δ18 O呈正相关、并且偏重的主要原因,尽管这两者的控制因素可能不完全一致,但是湖水的盐度(硬度)、生物的生产率以及湖泊水体的碳和与大气中CO2的交换、碳酸盐形成时湖水的温度等都会影响δ13 C值。
例如,湖泊中与大气CO2平衡时的自生碳酸盐δ13 C在+2‰~+7‰左右,最高可达+10‰(Romanek et al.,1992; Schwalb et al.,1999)。根据湖泊水体中溶解HCO3-与CO2同位素平衡分馏计算,水温在0℃和30℃时,HCO3-中δ13 C为+4.0~0.4‰(Romanek et al.,1992)。这些影响因素中,湖水盐度影响更为显著。当湖水盐度增大时,湖水对CO2的溶解力降低,碳酸盐富集重碳同位素(Mook,1980)。研究表明,湖泊的蒸发和水体中CO2的移出(脱气作用)对δ13 C的影响也比较明显(Schwalb et al.,1999),特别是湖泊中有富含CO2的热泉、以及富含CO2的地下水补给并产生脱气作用时,湖泊水体中富集13 C(Michaelis et al.,1985)。Zhang等(2013)对中国西北地区和东北地区湖泊表层沉积物碳酸盐含量、δ13 C、δ18 O分析时发现,湖泊环境中碳酸盐含量小于30%时,δ13 C、δ18 O相关性很差; 而当碳酸盐含量大于30%时,δ13 C、δ18 O之间的相关性变好,δ13 C、δ18 O偏重(图 4)。从 图 3中可以看出,碳酸盐含量极低的沉积物主要在河流入湖环境和开放性湖泊中,水体较淡(<0.1mS/cm); 随着盐度的增加,碳酸盐含量上升,但盐湖中碳酸盐含量较低。在中国西北地区同一湖泊中(如博斯腾湖、乌伦古湖等),样品分析结果表明,碳酸盐含量相对较高的沉积物主要分布在湖中心部位,具有水体盐度变高、水体滞留时间长的特征。因此,也说明湖泊水体盐度和滞留时间是控制湖泊沉积物δ13 C、δ18 O特征及相关性的主要因素,中国西部地区水体盐度与湖泊水体的蒸发/补给比有直接的关系。
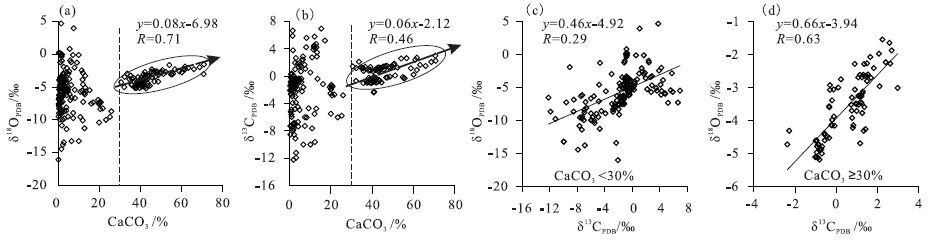
|
图 4 博斯腾湖和乌伦古湖表层沉积物δ13 C、δ18 O与碳酸盐含量之间的关系(Zhang et al.,2013) Figure 4 Correlations between carbonate contents of bulk lake sediments to δ13 C vs. δ18 O and correlation between δ13 C vs. δ18 O in northeastern and northwestern China(after Zhang et al.,2013) |
Bowen(1990)认为湖泊碳酸盐δ13 C和δ18 O 值两者如果呈反相关,其 δ18 O 主要受温度影响,温度高有利于碳酸盐富集 18O。δ13 C主要受大气CO2与湖泊水体中碳的交换、湖水的硬度、湖泊生产力等因素影响,其值的波动间接地指示温度变化,温度低有利于碳酸盐富集13 C(Emrich et al.,1970)。吴敬禄和王苏民(1996)认为,当碳酸盐富集 18O而贫13 C时,δ18 O波动则主要受温度控制,并且 δ18 O 高代表气候暖期; 反之,则为冷期。若碳酸盐δ13 C、δ18 O呈同步变化,则 δ18 O 变化主要受湖泊水体同位素波动影响,δ18 O高,指示湖泊水体处于蒸发浓缩期,湖泊水体盐度较高; 反之,为湖泊淡化期。通过对中国东北地区现代湖泊表层样的分析结果,很明显可以看出湖泊初级生产力对δ13 C、δ18 O相关性有密切关系,温度较高的湖泊水体生产力较高,造成沉积物δ13 C偏负,但相关性不是特别明显(图 3b)。
在湖泊系统中,生产力影响湖泊沉积物δ13 C、δ18 O。有机质含量和类型则可以直接反映生产力的大小。因此,沉积物中δ13 Corg是指示湖泊环境生态体系的有力指标之一。Leng和Marshall(2004)研究表明,沉积物中δ13 C直接受到有机质的影响。中国东北地区和西北地区湖泊表层沉积物中δ13 Corg与沉积物δ13 C、δ18 O、TOC、C/N分析结果表明(图 5),δ13 Corg与δ13 C总体上呈弱的正相关性(图 5a),但δ13 C为+2‰~-10‰时,明显无相关性,而对应的δ13 Corg大约为-22‰~-30‰; δ13 C>+2‰时,δ13 Corg为-22‰~-16‰,也没有相关性。即是说,湖泊沉积物中δ13 Corg与δ13 C之间没有必然的关系,只是与湖泊的状况有关,即在开放性和水体盐度低、滞留时间短的湖泊中,δ13 Corg偏轻; 而在水体滞留时间长的湖泊δ13 Corg偏重。异常偏重的δ13 Corg主要出现在较淡水-微咸水湖泊中(图 2c),由于湖泊中沉水植物来源有机质造成(张成君等,2004)。从 图 5b中可以看出,δ13 Corg与 δ18 O 之间没有相关性,无论有机母质类型如何,δ18 O总是在0~-12‰范围,δ18 O明显受水体性质控制。

|
图 5 中国东北地区和西北地区湖泊表层沉积物δ13 Corg与沉积物碳酸盐δ13 C、 δ18 O 及有机质含量、C/N关系 Figure 5 The correlations of δ13 Corg vs. δ13 C,δ18 O,TOC and C/N in the lake sediments in Northeastern and Northwestern China |
湖泊沉积物中有机质含量可以反映湖泊生产力、流域植被状况,δ13 Corg可指示湖泊沉积物中有机母质的来源、湖泊的生产力、大气CO2的浓度、流域植被,以及水动力等特征(Talbot,1990; Aravena et al.,1992; Meyers,1994a)。从中国东北和西部地区现代湖泊中,有机碳含量主要在0~5%时,δ13 Corg主要为-24‰~-30‰; 少量湖泊中TOC为5%~20%时,δ13 Corg主要为-22‰~-16‰。由 图 5d明显可以看出,δ13 Corg与有机母质类型有关。研究表明,湖泊沉积物中能影响δ13 Corg的因素主要包括水介质的硬度、湖泊生产力、酸碱度、温度、CO2等(Meyers and Horie, 1993; Williams and Liu, 1997),但有机质的来源可能是其中最重要的因素。
湖泊沉积物中有机母质来源通常可以利用有机质C/N、正构烷烃生物标志化合物等来确定。例如,沉积物中有机质以水生植物或藻类来源为主时,C/N为4~10; C/N为10~20时代表了沉水或浮游植物,或者与陆生植物的混合来源; 挺水植物或陆生高等植物来源为主时,C/N>20(Meyers,1994b; Lamb et al.,1995); 浮游生物的C/N<6(Lerman,1979),硅藻的C/N则为5~8; 淡水水生植物的C/N为12~30,C3植物的C/N为26~49,C4植物的C/N为20~50,甚至可以达到84(Hedges et al.,1986)。在热带地区流域植被的C/N相对较高,一般大于20(Hedges et al.,1986; Talbot and Johannessen, 1992)。水藻和光合作用合成细菌的正构烷烃主导成分是C17,沉水和漂浮大型植物等非外源维管植物往往有最大的C21、C23和C25正构烷烃丰度,而陆地植物的表皮蜡质层则含有较多的C27、C29和C31(Xie et al.,2002; Meyers,2003)。 图 2d和图 2e中反映出研究区有机质含量较高的湖泊主要为淡水-微咸水,而有机质的来源以內源为主。盐度较高的湖泊中,TOC含量较低,可能只与盐湖中的盐藻来源有关。对中国东北地区和西北地区湖泊表层沉积物有机质含量(TOC)、C/N、δ13 Corg分析表明(图 6a,6b),沉积物中TOC与有机类型有明显的关系,湖泊中以浮游植物来源有机母质为主时(C/N<6),TOC含量较低,为0~2%; 以硅藻为主的藻类来源时(C/N=5~8),TOC主要为2%~8%,最高可达18%左右; 而以水生植物来源为主时(C/N=8~12),TOC分布范围较宽且较均匀,为1%~14%; 以水生植物和陆生植物来源为主时(C/N=12~17),TOC主要为0~8%; 而以陆生植物来源为主时(C/N>17),TOC含量较低,为0~2%,但很明显中国西部和东北地区湖泊中有机母质主要以陆生植物来源为主的湖泊较少,在100多个湖泊中仅有3个湖泊沉积物中有机母质仅来源于陆生植物。
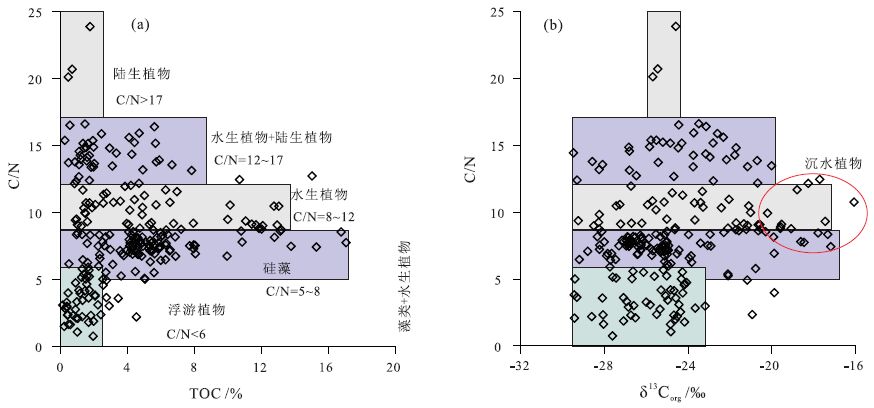
|
图 6 湖泊沉积物中有机质类型(C/N)与有机碳含量(TOC)和δ13 Corg之间的关系 Figure 6 The relationships among C/N,TOC and δ13 Corg in the lake surface sediments |
相对于不同有机母质来源的湖泊沉积物δ13 Corg具有明显的分布特征(图 6b)。以浮游植物为有机母质主要来源时,δ13 Corg主要为-30‰~-23‰; 以藻类来源为主时,δ13 Corg主要为-30‰~-16‰; 以水生植物来源为主时,δ13 Corg主要为-30‰~-16‰。以前的研究表明,有机母质以沉水植物来源为主时,δ13 Corg偏重,咸水比淡水中沉水植物的δ13 Corg偏重(Zhang et al.,2003; 张成君等,2004)。因此,沉积物有机质C/N为8~12范围时,很可能代表了湖泊沉积物中有机质主要来源于挺水植物(δ13 Corg相对偏轻,可能小于-20‰~-24‰)和沉水植物(δ13 Corg相对偏重,可能大于-20‰~-24‰)。从生态上看,湖泊环境中通常挺水植物与沉水植物同时出现也较为常见。而有机母质以水生植物和陆生植物混合来源为主时,δ13 Corg主要为-30‰~-20‰,分布比较均匀; 而以陆生植物为主要有机质来源时,δ13 Corg分布比较窄,为-26‰~-24‰。由于能代表有机母质以陆生植物来源为主的湖泊较少,这个数值范围不是很准确,只能表示以陆生植物来源为主的湖泊,沉积物δ13 Corg相对偏轻。
从不同地区湖泊沉积物中TOC含量分析(图 6a),总体上反映出以内源有机质来源为主的湖泊TOC含量较高,δ13 Corg变化范围较大(-30‰~-16‰),这也说明沉积物中有机质与湖泊的生产力有直接的关系。已有研究表明,有机质从母源到沉积物过程中,以及沉积物形成后会持续进行有机质的降解,包括微生物的分解和环境因素造成的有机质降解的早成岩作用。这些早期成岩作用在水体的光合作用层中就开始进行了,在生物扰动的沉积层中作用更加强烈。Meyers(1994a)发现来源于藻类的短链有机质比长链有机质容易分解,因此,湖泊内源的“新鲜”短链正构烷烃不如外源的长链正构烷烃稳定,会造成它的“优先”降解(Meyers,1997)。特定化合物单烃碳同位素组成也反映出,泥炭沉积有机质有明显的早期成岩作用(Macko et al.,1994)。因此,通过对西部和东北地区现代湖泊表层沉积物中有机质含量分析,湖泊环境中有机母质以内源水生生物来源为主的湖泊沉积物中TOC含量高,而陆生植物来源为主的湖泊TOC含量低。由于早成岩作用的影响,说明湖泊沉积物中内源水生生物对沉积物有机质TOC的影响更明显。尽管一些学者认为在植物死亡、埋藏过程中,具有很小的或者几乎没有碳同位素分馏(Connin et al.,2001),同时认为,正构烷烃广泛分布于细菌、藻类以及高等植物等生物体中,相对于其他类型的有机质,正构烷烃比较稳定,能可靠地反映其有机质来源(朱扬明等,2003)和较好地保持原始环境的信息。但是,对百慕大Mangrove湖沉积物的研究结果表明,早期成岩作用造成δ13 Corg值-2‰的改变,但是当沉积物中有机质含量超过20%时,有机质的成岩改造作用才比较明显,而含量低于2%~3%时就不明显了。同时,也发现湖积物有机质遭受氧化作用会使其δ13 Corg值偏正(Talbot and Livingstone, 1989)。此外,湖泊有机淤泥的发酵作用的增强可能会导致δ13 Corg值的增大(Hakansson,1985)。因此,不同有机质来源的湖泊沉积物中δ13 Corg都可能会产生一些差异,改变的程度可能不是特别明显,不会严重影响对原始有机母质的判识。尤其是正常的湖泊沉积物中有机质含量普遍较低,影响程度较低。而对于泥炭沼泽环境,由于沉积物中有机质含量较高,沉积物δ13 Corg可能会有相对较大的改变。
4 结论(1) 中国西部地区湖泊δ13 C为-8‰~+6‰,δ18 O为+2‰~-14‰,大量的湖泊中 δ18 O 在0以上。δ13 C、δ18 O之间较好的相关性代表了湖泊的封闭、水体滞留时间长、水体咸化特征。湖泊沉积物中碳酸盐含量大于30%时,湖泊表现出δ13 C、δ18 O之间较好的相关性; 中国东北地区湖泊δ13 C主要为-4‰~-8‰,δ18 O为-4‰~-12‰,δ13 C、δ18 O都明显比中国西部地区偏负,δ13 C、δ18 O之间几乎没有相关性,与东北地区湖泊的开放性、湖泊生产力等环境因素有直接的关系。
(2) 沉积物中TOC与有机类型有明显的关系,湖泊中以浮游植物来源有机母质为主时(C/N<6),TOC含量较低,为0~2%左右,δ13 Corg主要为-30‰~-23‰; 以硅藻为主的藻类来源时(C/N=5~8),TOC主要分布为2%~8%,最高可达18%左右,δ13 Corg主要为-30‰~-16‰; 而以挺水植物和沉水植物来源为主时(C/N=8~12),TOC分布范围较宽且较均匀,为1%~14%,以挺水植物来源δ13 Corg为-30‰~-24‰,沉水植物来源δ13 Corg为-24‰~-16‰; 以水生植物和陆生植物来源为主时(C/N=12~17),TOC主要为0~8%,δ13 Corg主要为-30‰~-20‰; 而以陆生植物来源为主时(C/N>17),TOC含量较低,为0~2%左右,δ13 Corg为-26‰~-24‰。以内源有机质来源为主的湖泊TOC含量较高。
致谢: 樊荣、赵琦、李军等参加了野外采样和室内分析工作,在此表示感谢!
| [1] | Abbott R J, Smith L C, Milne R I, Crawford R M M, Wolff K, Balfour J. 2000. Molecular analysis of plant migration and refugia in the Arctic. Science , 289 (5483) : 1343–1346. DOI:10.1126/science.289.5483.1343 |
| [2] | Anderson L G, Kaltin S. 2001. Carbon fluxes in the Arctic Ocean-potential impact by climate change. Polar Research , 20 (2) : 225–232. DOI:10.1111/por.2001.20.issue-2 |
| [3] | Aravena R, Warner B G, MacDonald G M, Hanf K I. 1992. Carbon isotope composition of lake sediments in relation to lake productivity and radiocarbon dating. Quaternary Research , 37 (3) : 333–345. DOI:10.1016/0033-5894(92)90071-P |
| [4] | Benson L, Paillet F. 2002. HIBAL:A hydrologic-isotopic-balance model for application to paleolake systems. Quaternary Science Reviews , 21 (12-13) : 1521–1539. DOI:10.1016/S0277-3791(01)00094-4 |
| [5] | Bowen R. 1990. Isotopes and climates. London, New York:Elsevier Applied Science : 75–140. |
| [6] | Bright J, Kaufman D S, Forester R M, Dean W E. 2006. A continuous 250,000 yr record of oxygen and carbon isotopes in ostracode and bulk-sediment carbonate from Bear Lake, Utah-Idaho. Quaternary Science Reviews , 25 (17-18) : 2258–2270. DOI:10.1016/j.quascirev.2005.12.011 |
| [7] | Connin S L, Feng X, Virginia R A. 2001. Isotopic discrimination during long-term decomposition in an arid land ecosystem. Soil Biology and Biochemistry , 33 (1) : 41–51. DOI:10.1016/S0038-0717(00)00113-9 |
| [8] | Emrich K, Ehhalt D H, Vogel J C. 1970. Carbon isotope fractionation during the precipitation of calcium carbonate. Earth and Planetary Science Letters , 8 (5) : 363–371. DOI:10.1016/0012-821X(70)90109-3 |
| [9] | Hedges J I, Clark W A, Quay P D, Richey J E, Devol J A H, de M Santos U. 1986. Compositions and fluxes of particulate organic material in the Amazon River. Limnology and Oceanography , 31 (4) : 717–738. DOI:10.4319/lo.1986.31.4.0717 |
| [10] | Lamb A L, Leng M J, Sloane H J, Telford R J. 2005. A comparison of the palaeoclimate signals from diatom oxygen isotope ratios and carbonate oxygen isotope ratios from a low latitude crater lake. Palaeogeography, Palaeoclimatology, Palaeoecology , 223 (3-4) : 290–302. DOI:10.1016/j.palaeo.2005.04.011 |
| [11] | Lamb H F, Gasse F, Benkaddour A, Van Der Kaars S, Perkins W T, Pearce N J, Roberts C N. 1995. Relation between century-scale Holocene arid intervals in tropical and temperate zones. Nature , 373 (6510) : 134–137. DOI:10.1038/373134a0 |
| [12] | Leng M J, Marshall J D. 2004. Palaeoclimate interpretation of stable isotope data from lake sediment archives. Quaternary Science Reviews , 23 (7-8) : 811–831. DOI:10.1016/j.quascirev.2003.06.012 |
| [13] | Lerman A. 1979. Geochemical processes:Water and sediment environments. New York:John Wiley and Sons, Inc . |
| [14] | Macko S A, Engel M H, Qian Y R. 1994. Early diagenesis and organic matter preservation-a molecular stable carbon isotope perspective. Chemical Geology , 114 (3-4) : 365–379. DOI:10.1016/0009-2541(94)90064-7 |
| [15] | McCrea J M. 1950. On the isotopic chemistry of carbonates and a paleotemperature scale. The Journal of Chemical Physics , 18 (6) : 849–857. DOI:10.1063/1.1747785 |
| [16] | Meyers P A, Horie S. 1993. An organic carbon isotopic record of glacial-postglacial change in atmospheric pCO2 in the sediments of Lake Biwa, Japan. Palaeogeography, Palaeoclimatology, Palaeoecology , 105 (3-4) : 171–178. DOI:10.1016/0031-0182(93)90082-T |
| [17] | Meyers P A. 1994a. Preservation of elemental and isotopic source identification of sedimentary organic matter. Chemical Geology , 114 (3-4) : 289–302. DOI:10.1016/0009-2541(94)90059-0 |
| [18] | Meyers P A. 1994b. Preservation of elemental and isotopic source identification of sedimentary organic matter. Chemical Geology , 144 (3-4) : 289–302. |
| [19] | Meyers P A. 1997. Organic geochemical proxies of paleoceanographic, paleolimnologic, and paleoclimatic processes. Organic Geochemistry , 27 (5-6) : 213–250. DOI:10.1016/S0146-6380(97)00049-1 |
| [20] | Meyers P A. 2003. Applications of organic geochemistry to paleolimnological reconstructions:A summary of examples from the Laurentian Great Lakes. Organic Geochemistry , 34 (2) : 261–289. DOI:10.1016/S0146-6380(02)00168-7 |
| [21] | Michaelis J, Usdowski E, Menschel G. 1985. Partitioning of 13C and 12C on the degassing of CO2 and the precipitation of calcite; Rayleigh-type fractionation and a kinetic model. America Journal of Science , 285 (4) : 318–327. |
| [22] | Mook W G. 1980. Carbon-14 in hydrogeological studies. In:Fritz P, Fontes J C. Handbook of Environmental Isotope Geochemistry. Amsterdam:Elsevie . |
| [23] | Romanek C S, Grossman E L, Morse J W. 1992. Carbon isotopic fractionation in synthetic aragonite and calcite:Effects of temperature and precipitation rate. Geochimica et Cosmochimica Acta , 56 (1) : 419–430. DOI:10.1016/0016-7037(92)90142-6 |
| [24] | Sauer P E, Eglinton T I, Hayes J M, Schimmelmann A, Sessions A L. 2001. Compound-specific D/H ratios of lipid biomarkers from sediments as a proxy for environmental and climatic conditions. Geochimica et Cosmochimica Acta , 65 (2) : 213–222. DOI:10.1016/S0016-7037(00)00520-2 |
| [25] | Schwalb A, Burns S J, Kelts K. 1999. Holocene environments from stable isotope stratigraphy of ostracods and authigenic carbonate in Chilean Altiplano Lakes. Palaeogeography, Palaeoclimatology, Palaeoecology , 148 (1-3) : 153–168. DOI:10.1016/S0031-0182(98)00181-3 |
| [26] | Talbot M R, Livingstone D A. 1989. Hydrogen index and carbon isotopes of lacustrine organic matter as lake level indicators. Palaeogeography, Palaeoclimatology, Palaeoecology , 70 (1-3) : 121–137. DOI:10.1016/0031-0182(89)90084-9 |
| [27] | Talbot M R. 1990. A review of the palaeohydrological interpretation of carbon and oxygen isotopic ratios in primary lacustrine carbonates. Chemical Geology:Isotope Geoscience Section , 80 (4) : 261–279. DOI:10.1016/0168-9622(90)90009-2 |
| [28] | Talbot M R, Johannessen T. 1992. A high resolution palaeoclimatic record for the last 27,500 years in tropical West Africa from the carbon and nitrogen isotopic composition of lacustrine organic matter. Earth and Planetary Science Letters , 110 (1-4) : 23–37. DOI:10.1016/0012-821X(92)90036-U |
| [29] | Urey H C, Lowenstam H A, Epstein S, McKinney C R. 1951. Measurement of paleotemperatures and temperatures of the Upper Cretaceous of England, Denmark, and the southeastern United States. Geological Society of America Bulletin , 62 (4) : 399–416. DOI:10.1130/0016-7606(1951)62[399:MOPATO]2.0.CO;2 |
| [30] | Williams D F, Liu T S. 1997. The study of lake sediments for global change research. Earth Science Frontiers , 4 (1-2) : 34–42. |
| [31] | Zhang C J, Chen F H, Jin M. 2003. Study on modern plant C-13 in the Western China and its significance. Chinese Journal of Geochemistry , 22 (2) : 97–106. DOI:10.1007/BF02831518 |
| [32] | Zhang C J, Fan R, Li J, Mischke S, Dembele B, Hu X L. 2013. Carbon and oxygen isotopic compositions:How lacustrine environmental factors respond in Northwestern and Northeastern China. Acta Geologica Sinica , 87 (5) : 1344–1354. DOI:10.1111/acgs.2013.87.issue-5 |
| [33] | Xie S C, Wang Z Y, Wang H M, Chen F H, An C B. 2002. The occurrence of a grassy vegetation over the Chinese Loess Plateau since the last interglacier:The molecular fossil record. Science in China Series D:Earth Sciences , 45 (1) : 53–62. DOI:10.1007/BF02879696 |
| [34] | Zhang J W, Chen F H, Holmes J A, Li H, Guo X Y, Wang J L, Li S, Lü Y B, Zhao Y, Qiang M R. 2011. Holocene monsoon climate documented by oxygen and carbon isotopes from lake sediments and peat bogs in China:A review and synthesis. Quaternary Science Reviews , 30 (15-16) : 1973–1987. DOI:10.1016/j.quascirev.2011.04.023 |
| [35] | 姜加明, 吴敬禄. 2003. 北疆地区早全新世环境演化的湖泊沉积记录. 高校地质学报 , 9 (1) : 30–37. |
| [36] | 王苏民, 李建仁. 1991. 湖泊沉积-研究历史气候的有效手段:以青海湖、岱海为例. 科学通报 , 36 (1) : 54–56. |
| [37] | 吴敬禄, 王苏民. 1996. 青藏高原东部RM孔碳酸盐氧同位素揭示的末次间冰期气候特征. 科学通报 , 41 (17) : 1601–1604. |
| [38] | 张成君, 陈发虎, 尚华明, 曹洁. 2004. 中国西北干旱区湖泊沉积物中有机质碳同位素组成的环境意义:以民勤盆地三角城古湖泊为例. 第四纪研究 , 24 (1) : 88–94. |
| [39] | 朱扬明, 苏爱国, 梁狄刚, 程克明, 翁焕新, 彭德华. 2003. 柴达木盆地咸湖相生油岩正构烷烃分布特征及其成因. 地球化学 , 32 (2) : 117–123. |
 2016, Vol. 35
2016, Vol. 35

