北冰洋是具有广阔陆架的半封闭大洋,其边缘海面积大约占整个北冰洋的1/3,具有独特的地理环境。受全球变化影响,北极正发生着快速变化,伴随陆地径流输入、太平洋入流等的增加,海冰覆盖范围持续减小,近30年来海冰延伸范围减少了40%(Miller et al., 2010;Screen and Simmonds, 2010;Stroeve et al., 2012)。
西北冰洋的楚科奇海通过白令海峡与北太平洋相连。温暖、低盐、高营养盐的太平洋海水经白令海峡进入北冰洋,影响北冰洋的环流及生态过程(Grebmeier et al., 2006)。白令海峡锚系观测结果表明,随着北极海冰的消退,太平洋入流近10年来增加了50%(Woodgate et al., 2012),这可能会极大地促进北极陆架区“生物泵”的运转。太平洋入流携带的热能,将会加剧北冰洋海冰消退,增强淡化。近十年来,楚科奇海和加拿大海盆是北冰洋海冰减小幅度最大的地方(Steele et al., 2008),同时也成为北极淡水增加最为显著,淡化最强的区域(Rabe et al., 2011)。淡水增加,层化加强,将对海盆区上层海洋浮游生物群落结构产生显著的影响(Coupel et al., 2012),如,浮游藻类由硅藻向个体更小的微微型藻类发展(Li et al., 2009;庄燕培等,2012)。上层浮游植物群落组成发生变化,不仅对“生物泵”效率产生影响,还将影响食物链结构,以及碳的生物地球化学循环与输出效率。在北极高生产力陆架海区,由于水深较浅,冰融初期,大量冰藻在勃发后迅速沉降到海底,为底栖生物提供了丰富的食物,冰藻-底栖食物链发育;海冰减少、开阔水域增加,浮游生态系统充分发展,食物链加长,由底栖食物链为主转向浮游食物链为主,改变了整个海洋生态系统的结构,从而影响到有机碳向底部的输出和埋藏(Walsh et al., 2004;陈建芳等,2004;Grebmeier,2012)。
海洋沉积物中有机和无机沉积指标的使用为理解现在和长时间尺度的北冰洋的环境变化提供了重要的信息。在前人的研究中,沉积物中保留的有机碳(Corg)、生物硅(BSi)、绿素(chlorin)等信息均能够较好的反映海洋古生产力(Mortlock et al., 1991;Thunell et al., 1992;Winn et al., 1992;Harris et al., 1996;Bernárdez et al., 2005),但其表征的有机质来源不同。其中有机碳记录除包含海洋生源输入外,还包含陆源输入(吴莹等,2000;陈建芳,2002),生物硅反映部分浮游植物群落(主要是硅藻)的生产力(Bárcena et al., 2002),绿素反映的则是总海洋浮游植物生产力(Harris et al., 1996)。本文主要使用表层沉积物中绿素的含量分析了调查海区古生产力状况,并结合表层沉积物总有机碳和上层海洋叶绿素现存量,探讨了沉积有机碳对上层海洋生态结构变化的响应。
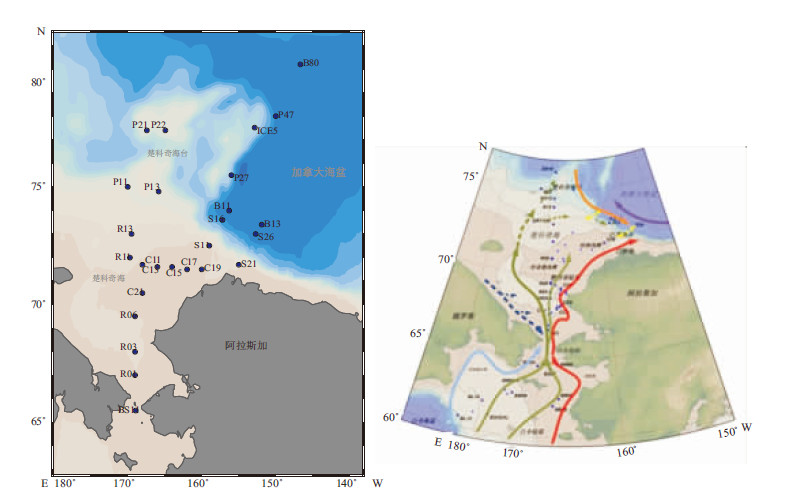
1 材料和方法 1.1 研究区域特征及采样站位楚科奇海位于东西伯利亚和阿拉斯加之间,多浅滩,陆架面积广阔,南部通过狭窄的白令海峡和白令海相连接,对北冰洋和太平洋的物质和能量交换起到了很大的作用。
由图 1所示,白令海北部和楚科奇海陆架区水团主要受太平洋入流控制:高盐(>32.5%Nacleqv),高营养盐的阿纳德尔流位于白令海和楚科奇海的西部;相对低盐(<31.8%Nacleqv),低营养盐的阿拉斯加沿岸流沿着白令海和楚科奇海的东部向北流;介于阿纳德尔流和阿拉斯加沿岸流之间,盐度为31.8%~32.5%Nacleqv的水流称为白令海陆架流(Grebmeier et al., 2006)。海冰融化后,在开阔海域,富含营养盐的白令海陆架流和营养盐耗尽的阿拉斯加沿岸流之间会形成很强的锋面,而在进入楚科奇海后,白令海陆架流会和阿纳德尔流混合,形成高盐高营养盐的白令海陆架-阿纳德尔流(Grebmeier et al., 1988;Feder et al., 2005)。楚科奇海北部则受到波弗特环流和大西洋深层水交换的影响,与太平洋入流一起影响水体中元素或悬浮物的输送(Bates et al., 2011;Giles et al., 2012)。
|
图 1 表层沉积物采样站位图及西北冰洋主要流场示意图(流场根据Grebmeier et al., 2006改绘) Fig. 1 Locations of sampling stations in the Western Arctic Ocean and Schematic of water mass type in the Western Arctic Ocean(modified after Grebmeier et al., 2006) 红色线为阿拉斯加沿岸流,绿色线为白令海陆架流,紫色线为波弗特环流,黄色线为陆架坡折区 |
本研究所需样品依托雪龙船在2003年的中国第2次北极科学考察航次中采集,样品的分布范围在西经146.7°~179.1°,北纬60.47°~80.22°。采样站位如图 1所示。表层沉积物均采用箱式采样器采集,取上层0~1 cm的样品。
1.2 沉积物绿素分析方法沉积物中绿素(Chlorin)主要为叶绿素a的代谢产物。绿素的提取、分析步骤参考Harris和Maxwell(1995)以及Higginson等(2003)的方法。具体来说,取200 mg冷冻干燥并研磨过的沉积物,先用90%的丙酮超声萃取两次,每次15 min,萃取后离心5 min(2500 rpm),收集上清夜。再用100%的丙酮萃取一次,收集萃取液,定容后用0.22 μm一次性滤头过滤后用高效液相色谱仪(HPLC)分析。
液相色谱条件:美国Waters公司E600高效液相色谱仪,配有474荧光检测器,717自动进样器,在脱柱条件下进行测定(λex=407 nm;λem=662 nm)。流动相为色谱纯甲醇,流速为1 ml/min,进样量为20 μL。
浓度计算方法:取一系列总有机碳含量不同的沉积物进行萃取,然后用可见分光光度计测定波长666 nm处的吸收值,根据Beer-Lambert定律计算出浓度[α666 nm=80.77 g-1·cm-1·L](Jeffrey and Humphrey, 1975)。将计算得出的浓度与荧光测定的峰面积绘制相关曲线。总绿素浓度即由荧光检测器得出的峰面积与紫外分光光度计测定的浓度相互间的关系式计算获得。
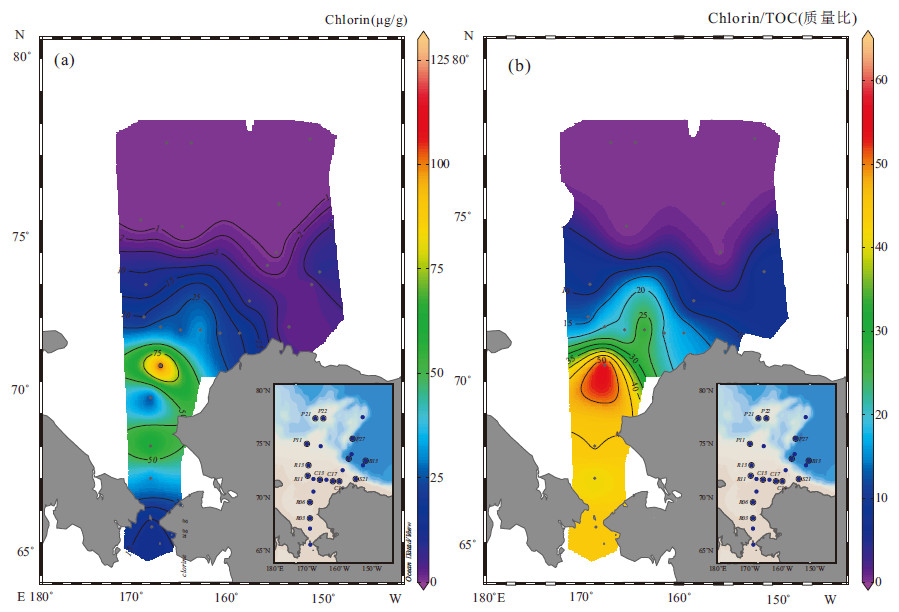
2 结果与讨论 2.1 绿素的分布特征由表 1可见绿素含量为0.04~125.29 μg/g,平均18.92 μg/g。根据前人的调查研究,东海海域绿素的浓度范围为0.03~7.71 μg/g(平均1.94 μg/g)(金海燕,2009)。南海表层沉积物绿素的含量变化范围为0.04~3.55 μg/g,平均0.41 μg/g(陈建芳,2005)。南海东北部表层沉积物绿素含量大多在0.5 μg/g左右,在深海盆区,绿素含量一般低于0.2 μg/g(Higginson et al., 2003;陈建芳,2005),西北冰洋陆架区绿素的含量相比远远高出一个和两个数量级。从图 2可以看出西北冰洋绿素及绿素和有机碳的比值表现出显著的纬向分布特征。楚科奇海南部绿素含量具有相对高值,基本都高于25 μg/g,在哈罗德浅滩的C21站甚至高达125 μg/g。这主要因为高营养盐的阿纳德尔流和白令海陆架流的输入促进了浮游植物的生长,加大了海源有机碳在楚科奇海陆架区的沉积,也加大了沉积绿素的输入。越往北绿素含量越低,海盆区绿素含量达到最低,均低于1.0 μg/g。以上除了海盆区海水营养盐含量低,海冰覆盖时间长,冰藻与浮游植物生产力输入较小的原因外,还因为海盆区水深较大,绿素在沉降过程中更容易降解,不易保存在沉积物中。
| 表 1 表层沉积物采样站位、有机碳及绿素含量 Table 1 The sampling stations,chlorin content and TOC content |
|
图 2 表层沉积物中绿素9(a)和绿素/有机碳比值(10-4)(b)分布 Fig. 2 Distributions of Chlorin(a) and Chlorin/TOC ratio(b) in surface sediments |
植物体内的色素可以吸收特定波长的光而进行光合作用,因此又称为光合色素。光合色素可分为3大类:叶绿素、类胡萝卜素和藻胆素。其中叶绿素普遍存在于各种高等植物及藻类体内。由于叶绿素a存在于大部分浮游植物体中,因此海洋生态研究中,通常用叶绿素a的浓度或含量来表征海水中浮游植物的生物量,即初级生产力(宁修仁和库蒂,1991;刘子琳等,2008)。叶绿素a在环境中极易降解,其降解过程不仅在水柱沉降过程中发生,如通过生物摄食、微生物降解等作用;即便沉降到沉积物表面,由于微生物降解、沉积物矿化等过程仍然存在色素降解作用(Harradine et al., 1996)。但是,叶绿素 a 分子结构中的巨型环(macrocyclic ring)则在相当长的时间内非常稳定(Eckardt et al., 1991;Chen et al., 2001)。在海洋沉积物中通常都能找到这种叶绿素降解产物的信息(Harris et al., 1995;Villanueva and Hastings, 2000;Reuss et al., 2005)。沉积物中叶绿素 a的降解产物-绿素,主要含有植酸钙镁(植基酯和甾基酯)以及脱镁叶绿酸(phytins),可用来表征光合作用生物的生物量和古生产力(Harris and Maxwell, 1995;Harris et al., 1996)。由于绿素表征的是总初级生产力,因此在表征古生产力时有一定的优势。
在水体中,海气界面的CO2交换主要通过生物泵实现,表层生产力是影响碳汇的重要因素;在沉积物中,绿素则记录着生物泵实际输送的碳汇。所以本文首先对“二北”上层水体的叶绿素浓度(叶绿素数据来自刘子琳等,2008)做水柱积分得到平均化的结果,了解水柱叶绿素a的在研究区域的分布状况,然后对上层海洋生产力状况和沉积物的古生产力做一个对比,探寻古生产力与表层生产力之间的关系。
叶绿素a水柱积分的计算公式如下:

式中:Dn表示水体深度,Cn表示对应深度的叶绿素a浓度。
|
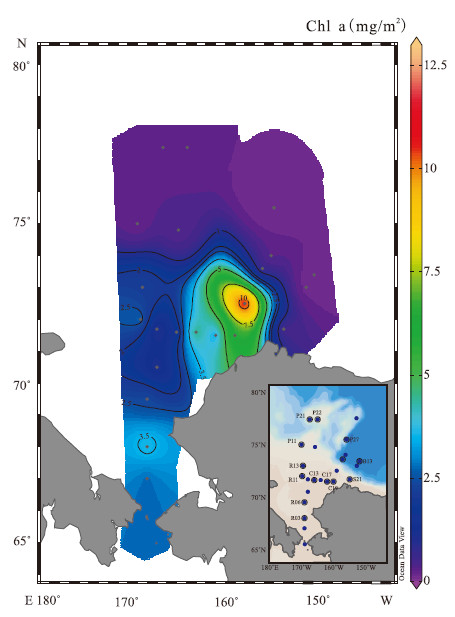
图 3 上层海洋叶绿素浓度分布 (100 m以浅,叶绿素数据来自刘子琳等,2008) Fig. 3 Distribution of Chl a in upper ocean (above 100 m,Chl a data from Liu et al., 2008) |
研究区域叶绿素a水柱积分(100 m以浅)范围在0.12~12.38 mg/m2之间,平均值为1.90 mg/m2。 最高值出现在波弗特陆坡的S11站,高达12.38 mg/m2,最低值则出现在海盆区的B80站。陆架区叶绿素a水柱积分的平均值为3.42 mg/m2,比海盆区的叶绿素a水柱积分(0.25 mg/m2)高了一个数量级。这和绿素的在陆架区和海盆区的分布类似。
但是通过相关性分析发现,上层海洋的叶绿素浓度与表层沉积物中的绿素浓度并没有显著相关性(r=0.054,p>0.05),楚科奇海陆架区的上层生产力和古生产力分布也存在一定的差异,比如在哈罗德浅滩,绿素含量最高的C21站位,上层水柱叶绿素的浓度较低,在表层沉积物绿素浓度较低的S11站位,上层水柱叶绿素含量却达到最高值。出现这些差异的第一个原因是上层水体初级生产力输出的颗粒在向下输送的过程中,还存在其他因素比如水动力作用以及水柱、沉积物中降解作用的影响。第2个原因是时间尺度上的差异,上层水柱叶绿素含量是一个瞬时采样得到的值,代表当时水柱的一个生产力状况,刘子琳等(2008)也指出后期对楚科奇海R断面做过两次重复观测,叶绿素呈倍数逐次下降的趋势,采样时间不同叶绿素含量就存在很大的差异。此外,楚科奇海陆架区的沉积速率为0.6~0.8 mm·yr-1(杨伟锋等,2002),说明表层沉积物的样品代表的是将近几年或十几年沉积绿素的一个平均值。所以,通过表层沉积物绿素与上层水体叶绿素水柱积分比较可以说明它们之间存在一定联系,瞬时的上层生产力在沉积物中有所体现,但在时间尺度上存在差异。
2.3 绿素对海源有机碳埋藏的指示作用有机碳含量指标可以用来评估海洋古生产力,但受到海洋环流,陆源输入,沉积分选等条件的影响,并不能很好地进行定量计算(黄永建等,2005)。Züllig(1981)指出沉积物中的叶绿素及其衍生物对于确定水体中古生产力比有机碳更为敏感,并利用色素信息研究了近500年间浮游植物种群的演替和发展情况。Higginson等(2003)利用沉积绿素信息反映了南海古生产力在过去145 kyr的变化。由表 2可以看到,表层沉积物绿素含量与有机碳含量存在显著的相关关系(r=0.449,p<0.05),表明在西北冰洋沉积物中,绿素相关有机质对沉积有机质有较大贡献。图 2和图 4显示,在楚科奇海陆架区,有机碳含量的分布和绿素分布相似,说明上层有机质可以快速有效地在陆架区沉积。海盆区不同于陆架区,有机碳量与绿素分布存在较大的差别。这主要是因为,海盆区海冰常年覆盖,受到营养盐和光限制影响,上层海洋生产力输入少,绿素沉积少;而且,海盆区沉积有机碳主要来自于侧向运移输入的陆源物质(Brown et al., 2014)。所以为了去除陆源有机碳的影响,单考虑海源输入有机碳与绿素含量的关系,本研究使用河流的有机碳δ13Corg值和海洋藻类产生的有机质的δ13Corg值作为两个端元,对表层沉积物中的有机碳来源进行一个大概的估算,得到海源输入有机碳比例(有机碳和δ13Corg数据来自李宏亮等,2008)。以往的研究认为,河流的有机碳δ13Corg值平均在-27.1‰左右(Rachold and Hubberten, 1999),海洋藻类产生的有机质的δ13Corg值平均在-21‰左右(Naidu et al., 2000),海冰藻类中δ13C值为-18.3‰~-20.6‰。而在CO2分压较高,生长缓慢的情况下,δ13Corg值会有所降低,为-26‰~-20‰(Schubert and Calvert, 2001;Stein et al., 2004)。由于在开阔水域中,海冰藻类相对贡献较低,就不计入端元的计算。
| 表 2 绿素含量、有机碳含量、绿素和有机碳比值, 海源输入有机碳参数之间的相关性分析 Table 2 Correlation relationships of chlorin content, TOC content,chlorin /TOC ratio and marine organic carbon fraction |

|
图 4 TOC含量(a)和海源输入所占百分含量(b)分布图(有机碳百分含量和碳同位素数据数据来自李宏亮等,2008) Fig. 4 Distribution of TOC(a) and marine-derived organic carbon(b)in surface sediments of Western Arctic |
由表 2看出绿素含量和海源输入有机碳不存在显著的相关关系,但绿素和有机碳的比值与海源输入的有机碳存在显著的相关关系(r=0.58,p<0.05)。这是由于绿素在沉积物中的含量受到水动力分选,颗粒物比表面积等因素的影响,其在沉积物中含量值与碳同位素计算的海源有机碳可能没有相关性。对绿素含量进行TOC归一化后,能够去除以上因素的影响,TOC归一化后的绿素含量与碳同位素计算的海源有机碳存在显著相关,说明绿素可以很好地定性地表征表层沉积中海源有机质的贡献。绿素指标的使用可以为理解现在和长时间尺度的北冰洋的上层海洋生态环境变化提供重要的信息。
3 结论研究海域绿素含量值为0.04~125.29 μg/g,平均值18.92 μg/g。研究海域绿素分布表现出显著的纬向分布特征,高营养盐的阿纳德尔流和白令海陆架流的输入促进了浮游植物的生长,加大了海源有机碳在楚科奇海陆架区的沉积,也加大了沉积绿素的输入。加拿大海盆区绿素含量低,主要因为海盆区营养盐含量低,加上海冰覆盖(光限制),藻类生产力低。另一个因素是,海盆区水深较大,绿素在沉降过程中更容易降解,不易保存在沉积物中。
通过对上层水体叶绿素水柱积分获得的结果和表层沉积的对比也可以看出,陆架区叶绿素a水柱积分的平均值为3.42 mg/m2,比海盆区的叶绿素a水柱积分(0.25 mg/m2)高了一个数量级。这和绿素的在陆架区和海盆区的分布类似。但因为时间尺度的不同,楚科奇海上层海洋叶绿素分布(代表瞬时)和表层沉积绿绿素分布(代表几年至十几年平均)存在空间差异。但用总有机碳归一化处理后的绿素与有机碳的比值,则与海源有机碳的百分含量有较好的相关性。因此,经过归一化以后的沉积记录中的绿素与有机碳比值可以为长时间尺度下北冰洋上层海洋生态环境变化提供重要的信息。
致谢:感谢中国第二次北极科学考察期间全体雪龙号船员和科考队员在采样过程中的无私帮助与支持。
| [1] | Bárcena M Á, Isla E, Plaza A, Flores J A, Sierro F J, Masqué P, Sanchez-Cabeza J A, Palanques A. 2002. Bioaccumulation record and paleoclimatic significance in the Western Bransfield Strait. The last 2000 years. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 49(4-5): 935-950 |
| [2] | Bates N R, Cai W J, Mathis J T. 2011. The ocean carbon cycle in the western Arctic Ocean: Distributions and air-sea fluxes of carbon dioxide. Oceanography, 24(3): 186-201 |
| [3] | Bernárdez P, Prego R, Francés G, González-Álvarez R. 2005. Opal content in the Ría de Vigo and Galician continental shelf: Biogenic silica in the muddy fraction as an accurate paleoproductivity proxy. Continental Shelf Research, 25(10): 1249-1264 |
| [4] | Brown K A, Mclaughlin F, Tortell P D, Varela D E, Yamamoto-Kawai M, Hunt B, Francois R. 2014. Determination of particulate organic carbon sources to the surface mixed layer of the Canada Basin, Arctic Ocean. Journal of Geophysical Research: Oceans, 119(2): 1084-1102 |
| [5] | Chen N H, Bianchi T S, McKee B A, Bland J M. 2001. Historical trends of hypoxia on the Louisiana shelf: application of pigments as biomarkers. Organic Geochemistry, 32(4): 543-561 |
| [6] | Coupel P, Jin H Y, Joo M, Horner R, Bouvet H A, Sicre M A, Gascard J C, Chen J F, Garcon V, Ruiz-Pino D. 2012. Phytoplankton distribution in unusually low sea ice cover over the Pacific Arctic. Biogeosciences, 9(11): 4835-4850 |
| [7] | Eckardt C B, Keely B J, Waring J R, Chicarelli M I, Maxwell J R, De Leeuw J W, Boon J J, Runnegar B, Macko S, Hudson J D. 1991. Preservation of chlorophyll-derived pigments in sedimentary organic matter [and discussion]. Philosophical Transactions of the Royal Society B: Biological Sciences, 333(1268): 339-348 |
| [8] | Feder H M, Jewett S C, Blanchard A. 2005. Southeastern Chukchi Sea(Alaska)epibenthos. Polar Biology, 28(5): 402-421 |
| [9] | Giles K A, Laxon S W, Ridout A L, Wingham D J, Bacon S. 2012. Western Arctic Ocean freshwater storage increased by wind-driven spin-up of the Beaufort Gyre. Nature Geoscience, 5(3): 194-197 |
| [10] | Grebmeier J M, McRoy C P, Feder H M. 1988. Pelagic-benthic coupling on the shelf of the northern Bering and Chukchi seas. I. Food supply source and benthic biomass. Marine Ecology Progress Series, 48(1): 57-67 |
| [11] | Grebmeier J M, Cooper L W, Feder H M, Sirenko B I. 2006. Ecosystem dynamics of the Pacific-influenced northern Bering and Chukchi Seas in the Amerasian Arctic. Progress in Oceanography, 71(2-4): 331-361 |
| [12] | Grebmeier J M. 2012. Shifting patterns of life in the Pacific Arctic and Sub-Arctic seas. Annual Review of Marine Science, 4: 63-78 |
| [13] | Harradine P J, Harris P G, Head R N, Harris R P, Maxwell J R. 1996. Steryl chlorin esters are formed by zooplankton herbivory. Geochimica et Cosmochimica Acta, 60(12): 2265-2270 |
| [14] | Harris P G, Maxwell J R. 1995. A novel method for the rapid determination of chlorin concentrations at high stratigraphic resolution in marine sediments. Organic Geochemistry, 23(9): 853-856 |
| [15] | Harris P G, Pearce G E S, Peakman T M, Maxwell J R. 1995. A widespread and abundant chlorophyll transformation product in aquatic environments. Organic Geochemistry, 23(2): 183-187 |
| [16] | Harris P G, Zhao M, Rosell-Melé A, Tiedemann R, Sarnthein M, Maxwell J R. 1996. Chlorin accumulation rate as a proxy for Quaternary marine primary productivity. Nature, 383(6595): 63-65 |
| [17] | Higginson M J, Maxwell J R, Altabet M A. 2003. Nitrogen isotope and chlorin paleoproductivity records from the Northern South China Sea: Remote vs. local forcing of millennial-and orbital-scale variability. Marine Geology, 201(1-3): 223-250 |
| [18] | Jeffrey S W, Humphrey G F. 1975. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton. Biochem Physiol Pflanz BPP, 167: 191-194 |
| [19] | Li W K W, McLaughlin F A, Lovejoy C, Carmack E C. 2009. Smallest algae thrive as the Arctic Ocean freshens. Science, 326(5952): 539 |
| [20] | Miller G H, Alley R B, Brigham-Grette J, Fitzpatrick J J, Polyak L, Serreze M C, White J W C. 2010. Arctic amplification: Can the past constrain the future?. Quaternary Science Reviews, 29(15-16): 1779-1790 |
| [21] | Mortlock R A, Charles C D, Froelich P N, Zibello M A, Saltzman J, Hays J D, Burckle L H. 1991. Evidence for lower productivity in the Antarctic Ocean during the last glaciation. Nature Letters, 351(6323): 220-223 |
| [22] | Naidu A S, Cooper L W, Finney B P, Macdonald R W, Alexander C, Semiletov I P. 2000. Organic carbon isotope ratios(δ13C)of Arctic Amerasian continental shelf sediments. International Journal of Earth Sciences, 89(3): 522-532 |
| [23] | Rachold V, Hubberten H W. 1999. Carbon isotope composition of particulate organic material in East Siberian rivers[M].//Land-Ocean Systems in the Siberian Arctic. Springer Berlin Heidelberg, 223-238 |
| [24] | Rabe B, Karcher M, Schauer U, Toole J M, Krishfield R A, Pisarev S, Kauker F, Gerdes R, Kikuchi T. 2011. An assessment of Arctic Ocean freshwater content changes from the 1990s to the 2006-2008 period. Deep Sea Research Part I: Oceanographic Research Papers, 58(2): 173-185 |
| [25] | Reuss N, Conley D J, Bianchi T S. 2005. Preservation conditions and the use of sediment pigments as a tool for recent ecological reconstruction in four Northern European estuaries. Marine Chemistry, 95(3-4): 283-302 |
| [26] | Stein R, Stein R, MacDonald R W. 2004. The organic carbon cycle in the Arctic Ocean. Berlin etc.: Springer |
| [27] | Schubert C J, Calvert S E. 2001. Nitrogen and carbon isotopic composition of marine and terrestrial organic matter in Arctic Ocean sediments:: implications for nutrient utilization and organic matter composition. Deep Sea Research Part I: Oceanographic Research Papers, 48(3): 789-810 |
| [28] | Screen J A, Simmonds I. 2010. The central role of diminishing sea ice in recent Arctic temperature amplification. Nature, 464(7293): 1334-1337 |
| [29] | Steele M, Ermold W, Zhang Jinlun. 2008. Arctic Ocean surface warming trends over the past 100 years. Geophysical Research Letters, 35(2): L02614, doi: 10.1029/2007GL031651 |
| [30] | Stroeve J C, Serreze M C, Holland M M, Kay J E, Malanik J, Barrett A P. 2012. The Arctic's rapidly shrinking sea ice cover: A research synthesis. Climatic Change, 110(3-4): 1005-1027 |
| [31] | Thunell R C, Miao Qingmin, Calvert S E, Pedersen T F. 1992. Glacial-holocene biogenic sedimentation patterns in the south China sea: productivity variations and surface water pCO2. Paleoceanography, 7(2): 143-162 |
| [32] | Villanueva J, Hastings D W. 2000. A century-scale record of the preservation of chlorophyll and its transformation products in anoxic sediments. Geochimica et Cosmochimica Acta, 64(13): 2281-2294 |
| [33] | Walsh J J, Dieterle D A, Maslowski W, Whitledge T E. 2004. Decadal shifts in biophysical forcing of Arctic marine food webs: Numerical consequences. Journal of Geophysical Research, 109(C5): C05031, doi: 10.1029/2003JC001945 |
| [34] | Winn K, Zheng L, Erlenkeuser H, Stoffers P, Erlenkeuser H. 1992. Stable oxygen/carbon isotopes and paleoproductivity in the South China Sea during the past 110, 000 years. In: Jin X, Kudrass H R, Pautot G, eds. Marine Geology and Geophysics of the South China Sea. Hangzhou: China Ocean Press, 154-166 |
| [35] | Woodgate R A, Weingartner T J, Lindsay R. 2012. Observed increases in Bering Strait oceanic fluxes from the Pacific to the Arctic from 2001 to 2011 and their impacts on the Arctic Ocean water column. Geophysical Research Letters, 39(24): L24603, doi: 10.1029/2012GL054092 |
| [36] | Züllig H. 1981. On the use of carotenoid stratigraphy in lake sediments for detecting past developments of phytoplankton. Limnology and Oceanography, 26(5): 970-976 |
| [37] | 陈建芳. 2002. 古海洋研究中的地球化学新指标. 地球科学进展, 17(3): 402-410 |
| [38] | 陈建芳, 张海生, 金海燕, 金明明, 刘子琳. 2004. 北极陆架沉积碳埋藏及其在全球碳循环中的作用. 极地研究, 16(3): 193-201 |
| [39] | 陈建芳. 2005. 南海沉降颗粒物的生物地球化学过程及其在古环境研究中的意义. 博士学位论文. 上海: 同济大学 |
| [40] | 黄永建, 王成善, 汪云亮. 2005. 古海洋生产力指标研究进展. 地学前缘, 12(2): 163-170 |
| [41] | 金海燕. 2009. 近百年来长江口浮游植物群落变化的沉积记录研究. 博士学位论文. 杭州: 浙江大学 |
| [42] | 李宏亮, 陈建芳, 金海燕, 金明明, 于晓果, 张海生. 2008. 楚科奇海表层沉积物的生源组分及其对碳埋藏的指示意义. 海洋学报, 30(1): 165-171 |
| [43] | 刘子琳, 陈建芳, 刘艳岚, 张宏, 陈忠元, 张海生. 2008. 北冰洋沉积物和海水叶绿素 α 浓度分布的区域性特征. 沉积学报, 26(6): 1035-1042 |
| [44] | 宁修仁, C.库蒂. 1991. 长江口及冲淡水区叶绿素 a、细菌、ATP、POC及微生物呼吸作用速率之间的关系. 海洋学报, 13(6): 831-837 |
| [45] | 吴莹, 张经, 曹建平, 张再峰, 刘素美, 陈洪涛, 熊辉. 2000. 长江流域有机碳同位素地球化学特征. 青岛海洋大学学报, 30(2): 309-314 |
| [46] | 杨伟锋, 陈敏, 刘广山, 蔡平河, 黄奕普. 2002. 楚克奇海陆架区沉积物中核素的分布及其对沉积环境的示踪. 自然科学进展, 12(5): 515-518 |
| [47] | 庄燕培, 金海燕, 陈建芳, 王斌, 李宏亮, 陈法锦, 卢勇, 徐杰. 2012. 北冰洋中心区表层海水营养盐及浮游植物群落对快速融冰的响应. 极地研究, 24(2): 151-158 |
 2015, Vol. 34
2015, Vol. 34


