我国是苹果生产第一大国,近年来,随着苹果集约化生产的不断发展以及矮化密植技术的持续推广,苹果再植病问题愈发严峻[1],因此寻找减轻苹果连作障碍发生的有效措施具有重要意义。造成苹果连作障碍发生的原因很多,大多数研究认为,长期连作土壤中有害真菌数量的增多、微生物群落结构的改变以及连作土壤中酚酸类物质含量的升高是造成苹果连作障碍发生的主要原因[2–3]。
高锰酸钾 (KMnO4) 属于无机氧化剂,具有强氧化性,因此有很强的杀菌、消毒、防腐保鲜能力,常用作消毒剂、水净化剂等。相比于其他氧化剂,高锰酸钾药源丰富,成本低,而且使用时对人畜安全、无毒,对作物无残留、无药害,对环境无污染,因此也被称为绿色氧化剂[4]。农业生产实践表明,用适宜浓度的高锰酸钾溶液进行种子消毒、叶面喷雾和灌根,对瓜果蔬菜立枯病、炭疽病、根腐病等有非常显著的防治效果。李伶俐等[5]在棉花栽培地中喷施高锰酸钾溶液,使棉花的产量、品质得到提升;刘星等[6]研究将高锰酸钾作为马铃薯块茎的消毒剂。本课题组前期研究发现,高锰酸钾不仅具有杀菌、消毒功能,并且还可以氧化分解根皮苷、根皮素等酚类物质[7–8],而根皮苷是造成苹果连作障碍发生的主要酚类化合物。此外,有研究表明适量添加Mn2+ 对植物的生长也具有积极的意义[9]。因此,在老龄苹果园土壤中施用适量高锰酸钾既可以降低土壤中的有害微生物数量,而且还能氧化分解连作土壤中酚类物质,这对减轻苹果连作障碍具有重要的意义。
木霉菌 (Trichoderma spp.) 是一种广泛存在于自然界且具有重要价值的植物病害生防菌,并且木霉菌无毒、无污染,用于作物土传病害的生物防治无明显风险,随着人们环保意识的增强,木霉生防菌已逐渐成为研究热点[10]。Azarmi等[11]研究认为木霉菌可以促进番茄幼苗的生长,并且能够提高番茄幼苗对营养元素的吸收;Asaduzzaman等[12]将辣椒种子用木霉菌液浸泡后,其萌发率显著提高,并且促进了辣椒幼苗的生长;冯程龙等[13]以小麦秸秆为载体生产的木霉生物有机肥显著提高了黄瓜产量。对连作障碍的研究中,康萍芝等[14]发现,施用哈茨木霉制剂能明显改善设施连作番茄根际土壤微生态环境,减轻番茄枯萎病发生,促进番茄植株生长;袁玉娟等[15]认为,哈茨木霉T37菌种可以显著降低设施黄瓜连作土壤中尖孢镰孢菌数量,并提高黄瓜产量。本课题前期研究发现,平邑甜茶幼苗与葱短期轮作条件下施用木霉菌肥后,可以显著改善连作土壤微生物环境,提高平邑甜茶幼苗生物量[16]。
本研究采取老龄苹果园土壤再植幼苗前进行高锰酸钾消毒,定植幼苗时施入木霉菌肥,拟通过两种方式的联用来增加对病原菌抑制的持续性以及改善连作土壤的微生物环境,完善其合理的营养配比,从而为减轻苹果连作障碍提供理论依据与技术支持。
1 材料与方法 1.1 试验材料试验于2017年4—10月在山东农业大学园艺科学与工程学院、国家苹果工程技术中心、作物生物学国家重点实验室进行,试验用土为山东省泰安市满庄镇小王庄村27年生老龄苹果园土,取自距树干80 cm、去表层土后深20—40 cm的区域,多点随机取样,混匀备用。土壤类型为棕壤,土壤容重1.27 g/cm3、土壤pH值5.17、NO3–-N 6.2 mg/kg、NH4+-N 4.5 mg/kg、速效钾88.2 mg/kg、有效磷10.1 mg/kg、有机质9.64 g/kg。
供试材料为苹果砧木品种平邑甜茶 (Malus hupeheusisRehd.) 实生苗。将平邑甜茶种子于4℃层积30 d,种子露白后,播种于育苗培养钵中。待幼苗长至6片真叶时,取长势基本一致的幼苗进行移栽。
高锰酸钾为固体,分析纯,施用浓度为0.1‰ (W∶W)。
木霉菌肥由德州创迪微生物资源有限公司提供,主要菌种为哈茨木霉 (Trichoderma hazianum)。
1.2 试验处理高锰酸钾灭菌在平邑甜茶定植前半个月 (本试验于2017年4月13日) 进行,具体操作如下:将高锰酸钾与老龄苹果园土壤按比例 (0.1 g∶1 kg) 混合均匀,装入泥盆中 (上部内径25 cm、下部内径17 cm、高18 cm)。再用水浇灌直至盆中上层土壤达到饱和。
在栽植前一天,将经过高锰酸钾灭菌的土壤倒出并与木霉菌肥混合均匀,装入盆中,适当浇水。设置4个处理:CK,老龄苹果园土壤;T1,老龄苹果园土壤增施木霉菌肥;T2,高锰酸钾处理老龄苹果园土壤;T3,老龄苹果园土壤经高锰酸钾消毒后增施木霉菌肥。2017年5月1日,各处理 (每个处理15盆,每盆装土7 kg) 统一栽植平邑甜茶幼苗,每盆定植2株,正常肥水管理。7月15日、8月15日、9月15日分3次取样品测定,每个处理取平邑甜茶幼苗3株,洗净后测定其生物量指标。9月15日在取平邑甜茶幼苗的同时,取土样,取样时去除表层与盆周围土,每个处理随机选取3盆,作为3个重复,分别过2 mm筛,及时放入–80℃冰箱,提取土壤DNA,后续进行q-PCR、T-RFLP分析。
1.3 试验方法 1.3.1 老龄苹果园土壤基础理化性质的测定有机质、氮、磷、钾测定参照鲍士旦《土壤农化分析》第三版的方法,有机质—重铬酸钾容量法 (稀释热法) ;速效磷 (P2O5) —钼锑抗比色法;速效钾 (K2O) —火焰光度法;铵态氮和硝态氮 (NH4+-H和NO3–-N) —CaCl2浸提流动注射分析仪法[17]。
1.3.2 生物量测定平邑甜茶幼苗株高、地径分别用米尺和游标卡尺 (上海申工) 测定,干、鲜质量用电子天平 (上海舜宇恒平) 测定。
1.3.3 根系呼吸速率测定根系呼吸速率测定采用Oxy -Lab氧电极自动测定系统,参照毛志泉等[18]的方法测定。
1.3.4 根系抗氧化酶活性测定超氧化物歧化酶 (SOD) 活性测定参照Zhang等[19]的方法,以抑制氮蓝四唑 (NBT) 光还原50%为1个酶活力单位 (U),用U/g, FW表示。过氧化物酶 (POD) 活性测定按Omran[20]的方法,测定470 nm吸光度的变化,以每分钟内引起 470 nm吸光度变化0.01的酶量为1个酶活力单位 (U),用U/(g·min), FW表示。过氧化氢酶 (CAT) 活性的测定按照Singh等[21]的方法。测定240 nm吸光度变化,以每分钟内使240 nm吸光度减少0.1的酶量为1个酶活力单位 (U),用U/(g·min), FW表示。
1.3.5 叶片光合参数的测定采用美国P-Systems公司生产的Ciras-3型光合仪测定光合速率及相关参数。8月23日10:00 左右 (天气晴朗) 各处理选取3株平邑甜茶幼苗,每株幼苗选取自下而上第3~5 片完全展开的、有代表性的健康成龄叶,固定叶片并做标记,测定净光合速率 (Pn)、蒸腾速率 (Tr)、气孔导度 (Gs)、胞间CO2浓度 (Ci)。
1.3.6 土壤总DNA提取及荧光定量分析土壤DNA的提取参考E.Z.N.ATM土壤DNA提取试剂盒 (Omega Bio-tek Omc. USA) 说明书操作。实时荧光定量采用CFX96TMThermal Cycler (Bio-Rad) 对土壤中层出镰孢菌 (Fusarium proliferatum) 和尖孢镰孢菌 (F. oxysporium) 基因拷贝数进行绝对定量分析。实时荧光定量PCR体系依据SYBR Premix Ex TaqTMKit TaKaRa试剂盒说明步骤完成。
25 μmL PCR反应体系:DNA模板1.5 μmL;SYBR Premix Ex Taq Ⅱ 12.5 μmL;引物各1 μmL;ddH2O 9 μmL。
层出镰孢菌PCR扩增反应程序:95℃预变性30 s;95℃变性5 s;60℃退火30 s。共计40个循环。
尖孢镰孢菌PCR扩增反应程序:95℃预变性30 s;95℃变性5 s;65℃退火30 s。共计40个循环。
1.3.7 T-RFLP图谱分析[22–23]用于真菌ITS片段扩增的引物采用带FAM荧光标记的真菌通用引物ITS1-F-FAM和ITS4,由上海生工生物工程技术服务有限公司合成。
ITS1-F-FAM:5’-CTTGGTCATTTAGAGG AAGTAA-3’;
ITS4:5’- TCCTCCGCTTATTGATAGC-3’。
50 μL真菌反应体系:25 μL Taq Master Mix;2 μL DNA模板;ITS1-F和ITS4各3 μL,加ddH2O 17 μL。PCR反应条件:94℃预变性3 min;94℃变性1 min (30 s),51℃退火1 min,72℃延伸1 min,共 34个循环;最后72℃延伸10min。取5 μL ITS-PCR扩增产物经1.5%琼脂糖凝胶电泳检测,然后用EasyPure PCR纯化试剂盒 (北京全式金生物技术有限公司) 纯化。将纯化产物用限制性内切酶Fast Digest HhaⅠ进行酶切。30 μL酶切反应体系:10 μL ITS-PCR纯化产物;2 μL HhaⅠ;2 μL Buffer;16 μL ddH2O。反应体系于37℃保温孵育15 min,将酶切产物送至上海生工生物技术有限公司进行测序。
1.4 数据处理采用Microsoft Excel 2003、origin8.5进行数据整理,用SPSS 19.0进行方差分析,邓肯氏新复极差法进行差异显著性检测。
2 结果与分析 2.1 不同处理对平邑甜茶幼苗生物量的影响由表1可以看出,3次取样结果显示老龄苹果园土施木霉菌肥 (T1)、高锰酸钾处理 (T2) 以及两种方式的联用 (T3) 均可以促进平邑甜茶幼苗的生长,其中以两者联用处理的促进效果最为显著。以9月数据为例进行分析,9月份时,两者联用处理 (T3) 的平邑甜茶幼苗株高、地径、鲜质量、干质量分别比连作对照 (CK) 提高了74.9%、73.2%、100.9%、92.3%,比木霉菌肥处理 (T1) 提高了34.0%、30.9%、34.9%、33.7%,比高锰酸钾处理 (T2) 提高了22.5%、23.0%、21.7%、17.3%。
| 表1 不同土壤处理对平邑甜茶生物量的影响 Table 1 Plant biomass of Malus hupeheusisRehd. in different orchard soil treatments |
 |
由图1可以看出,高锰酸钾与木霉菌肥联用处理 (T3) 的根呼吸速率,SOD、POD、CAT活性最高,其次为高锰酸钾处理 (T2)、木霉菌肥处理 (T1)、连作对照 (CK)。其中高锰酸钾与木霉菌肥联用处理 (T3) 的根呼吸速率,SOD、POD、CAT活性比连作对照 (CK) 分别提高了147.2%、145.1%、175.5%、81.3%,比木霉菌肥处理 (T1) 提高了41.7%、32.0%、39.8%、23.4%,比高锰酸钾处理 (T2) 提高了18.1%、17.6%、23.7%、11.9%。
 |
| 图1 不同处理对平邑甜茶幼苗根系根系呼吸速率及SOD、POD、CAT活性的影响 Fig. 1 Effects of different treatments on root activity, SOD, POD and CAT of Malus hupeheusis Rehd. [注(Note):CK—原状果园土壤Original orchard soil;T1—施木霉菌肥Applying Trichoderma fertilizer;T2—高锰酸钾消毒Disinfected with KMnO4;T3—高锰酸钾消毒+木霉菌肥KMnO4 disinfection + Trichoderma fertilizer application;柱上不同字母表示处理间差异显著 (P < 0.05) Different letters above the bars indicate significant difference at P < 0.05 level.] |
光合相关参数结果显示 (图2),高锰酸钾与木霉菌肥联用处理 (T3) 对平邑甜茶幼苗净光合速率 (Pn)、蒸腾速率 (Tr)、气孔导度 (Gs) 的提高幅度最为明显,但对胞间CO2浓度的影响不显著。该处理 (T3) 下平邑甜茶幼苗净光合速率、蒸腾速率、气孔导度分别是连作对照 (CK) 的1.96、2.91、1.73倍。其次为高锰酸钾处理 (T2)。
 |
| 图2 不同处理对平邑甜茶幼苗叶片净光合速率、蒸腾速率、气孔导度和胞间CO2浓度的影响 Fig. 2 Effects of different treatments on the Pn, Tr, Gs and Ci of Malus hupeheusisRehd. [注(Note):CK—原状果园土壤Original orchard soil;T1—施木霉菌肥Applying Trichoderma fertilizer; T2—高锰酸钾消毒Disinfected with KMnO4;T3—高锰酸钾消毒+木霉菌肥KMnO4 disinfection + Trichoderma fertilizer application;柱上不同字母表示处理间差异显著 (P < 0.05) Different letters above the bars indicate significant difference at P < 0.05 level.] |
图3表明,木霉菌肥处理 (T1)、高锰酸钾处理 (T2) 以及两者联用 (T3) 均能显著降低连作土壤中尖孢镰刀菌、层出镰孢菌的数量,以高锰酸钾与木霉菌肥联用处理 (T3) 对两种致病菌的抑制效果最为明显。相较于连作对照 (CK),两者联用处理的尖孢镰刀菌 (Fusarium oxysporum)、层出镰孢菌 (F. proliferatum) 基因拷贝数分别降低了69.7%、64.4%,显著高于木霉菌肥处理 (T1) 29.8%、29.3%以及高锰酸钾处理 (T2) 50.0%、49.7%。
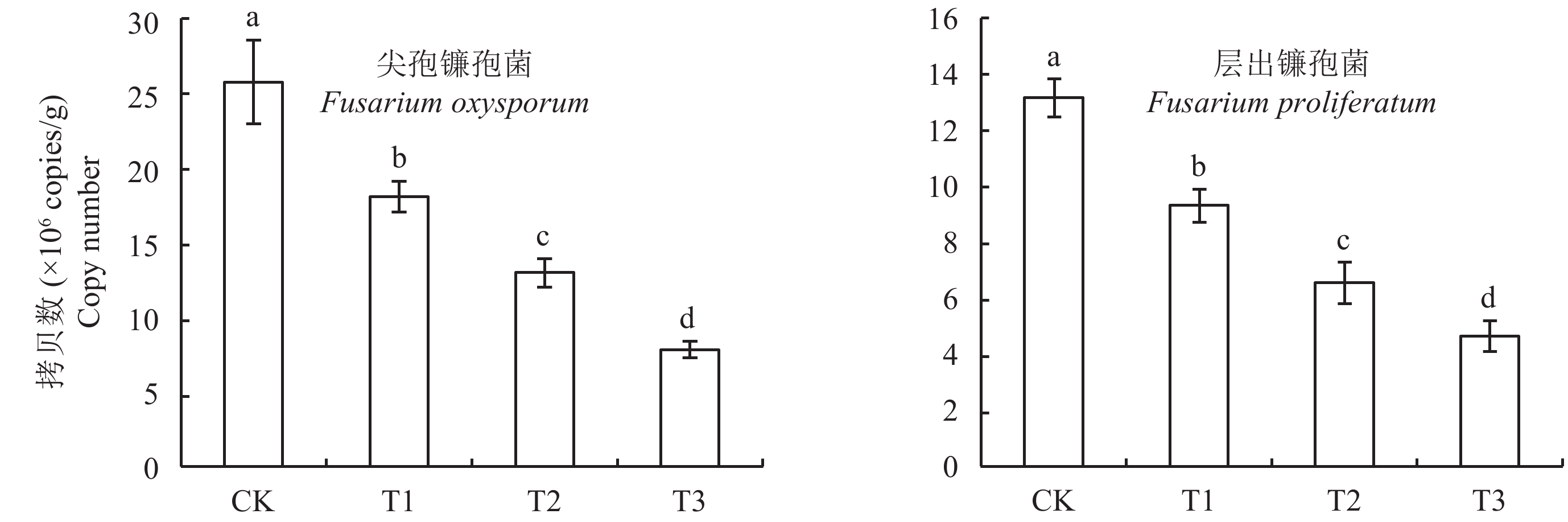 |
| 图3 不同处理连作土壤中尖孢镰刀菌、层出镰孢菌基因拷贝数 Fig. 3 Copy numbers of Fusarium oxysporumand Fusarium proliferatum in soils under different treatments [注(Note):CK—原状果园土壤Original orchard soil;T1—施木霉菌肥Applying Trichoderma fertilizer; T2—高锰酸钾消毒Disinfected with KMnO4;T3—高锰酸钾消毒+木霉菌肥KMnO4 disinfection + Trichoderma fertilizer application;柱上不同字母表示处理间差异显著 (P < 0.05) Different letters above the bars indicate significant difference at P < 0.05 level.] |
根据不同处理间的T-RFs在图谱中的分布及丰度进行主成分分析 (PCA) (图4),结果显示,连作对照 (CK) 与木霉菌肥处理 (T1) 位于第一象限,而高锰酸钾处理 (T2) 与高锰酸钾木霉菌肥两者联用处理 (T3) 的主成分均位于第四象限。并且两者联用处理 (T3) 与连作对照 (CK) 的距离最远,可见,高锰酸钾与木霉菌肥联用 (T3) 最显著地改变了连作土壤的真菌群落结构,在连作障碍的研究中,一般认为土壤消毒引起的真菌群落结构的显著变化往往有利于再植植株的生长, 更有利于减轻苹果连作障碍。
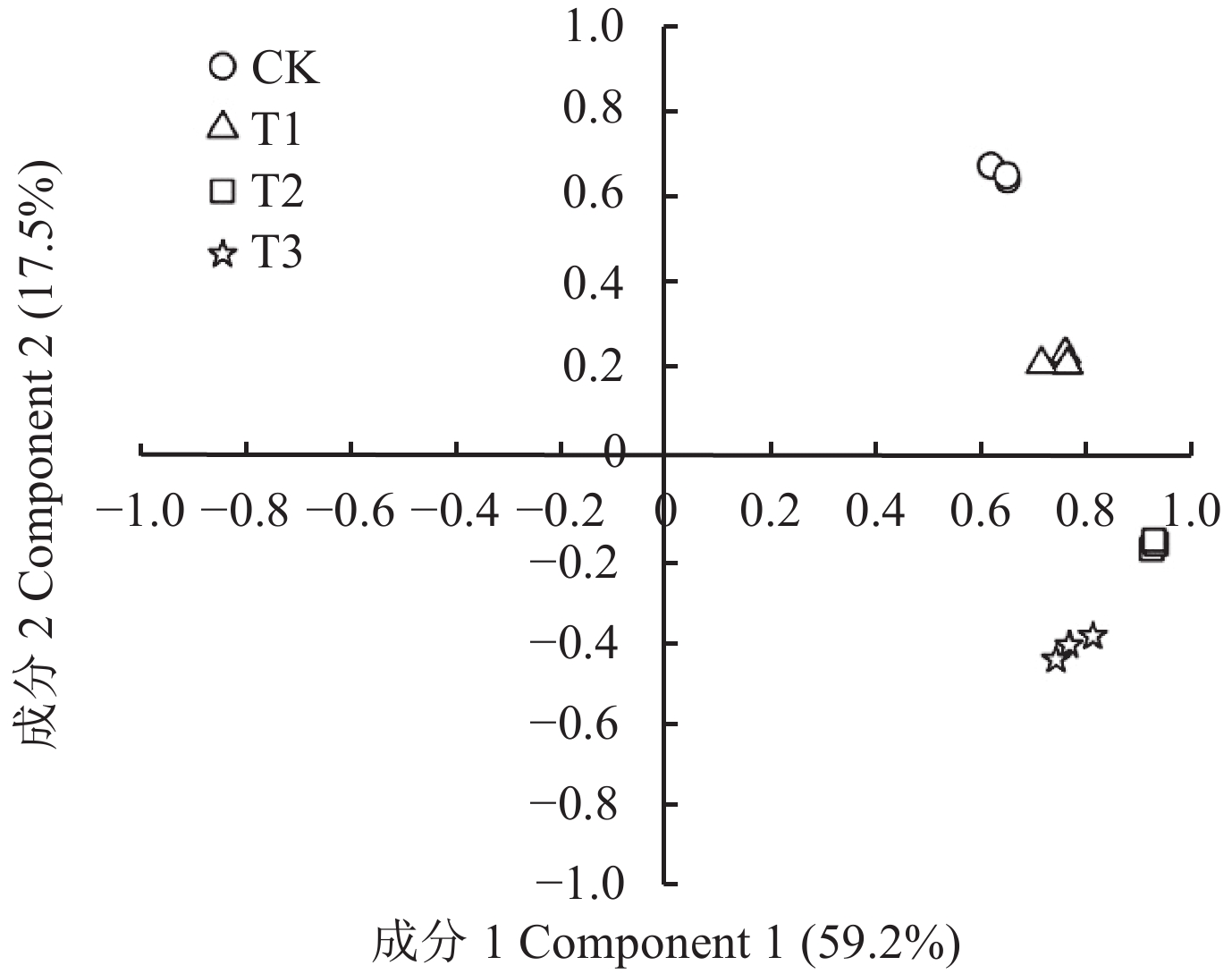 |
| 图4 不同处理间真菌 T-RFLP 图谱主成分分析 Fig. 4 Principal component analysis of T-RFLP patterns of fungi in different treatments [注(Note):CK—原状果园土壤Original orchard soil;T1—施木霉菌肥Applying Trichoderma fertilizer;T2—高锰酸钾消毒Disinfected with KMnO4;T3—高锰酸钾消毒+木霉菌肥KMnO4 disinfection + Trichoderma fertilizer application.] |
连作会显著抑制植株的生长发育,最直观的表现为植株长势变差,产量严重下降。且随着种植年限的增加,抑制作用会逐渐加重[24]。在苹果连作障碍的危害中,最突出的问题是幼苗成活率低、树势矮小、果实品质变差[25]。本研究表明,高锰酸钾消毒、增施木霉菌肥以及两者联用均能促进平邑甜茶幼苗的生长,其中以高锰酸钾消毒与木霉菌肥联用处理效果最佳,此外,以高锰酸钾作为土壤消毒剂来缓解连作问题还未见报道。从平邑甜茶幼苗植株的生理角度来看,两者联用显著提高了平邑甜茶幼苗的根呼吸速率,增强了其净光合速率以及蒸腾速率,进而促进了平邑甜茶幼苗的生长,使其株高、地径、鲜质量、干质量相较于其他处理都有了显著提升。其中的原因可能有两方面,一是由于高锰酸钾的强氧化性净化了土壤环境,减少了有害微生物对平邑甜茶幼苗根系的侵染,并且此前也有研究认为高锰酸钾的还原产物Mn2+、K+能够激活植株中多种酶的活性,进而促进叶片的光合作用[5]。二是连作土壤经高锰酸钾消毒后为木霉菌在连作土壤中的定殖提供了有利条件,而木霉菌属于有益菌,有利于平邑甜茶幼苗的生长,并且有研究认为木霉菌也能够调控某些生长激素、光合反应的基因表达从而促进糖代谢以及光合作用[26–28]。此外,由于木霉菌肥载体中存在大量有机质,这也为植株的生长提供了充足的营养。
3.2 高锰酸钾消毒后增施木霉菌肥对连作平邑甜茶幼苗抗氧化酶活性的影响大多数研究表明,正常条件下,植株体内自由基的产生与消除保持动态平衡。当遇到逆境胁迫时自由基的产生速率远远大于其消除速率,此时植物便会受到伤害[29]。长期连作条件下,恶化的土壤环境便成为苹果幼苗的逆境威胁,此时根系自由基存在的动态平衡便被打破,苹果幼苗的生长便会受到威胁。SOD (超氧化物歧化酶)、POD (过氧化物酶)、CAT (过氧化氢酶) 三者是保护植物免受过量自由基伤害的主要参与者,三者的协同作用,共同保护植物体内膜结构,降低自由基对膜结构的伤害[30]。本研究发现,无论是高锰酸钾消毒还是增施木霉菌肥以及两种方式的联用均能提高平邑甜茶幼苗根系的抗氧化酶活性。高锰酸钾处理提高根系抗氧化酶活性的主要原因还是与强氧化杀菌净化连作土壤微生物环境有关,这也与本课题前期研究结果相似[31]。木霉菌肥提高平邑甜茶幼苗抗氧化酶活性与庄敬华等[10]、李艳娟等[32]的研究结果相同。从生理角度来说木霉菌肥作为有益菌、拮抗菌优化了连作土壤环境,减轻了连作土壤对再植植株的逆境胁迫,此外,也有研究从分子角度认为木霉菌与植物互作后可以激活促分裂原活化蛋白激酶MPK6的活性,增加植物体内抗性蛋白含量,增强植物的系统抗性[33–34],其中SOD、POD、CAT便是植株体内重要的抗性蛋白。可见,两者联用增强了平邑甜茶幼苗对逆境条件的抗性。
3.3 高锰酸钾消毒后增施木霉菌肥对连作土壤有害真菌及真菌群落结构的影响徐文凤等[35]在我国环渤海苹果重茬园中分离出大量镰孢属真菌,分别为尖孢镰刀菌 (F. oxysporum)、层出镰孢菌 (F. proliferatum)、腐皮镰孢菌 (F. solani) 和串珠镰孢菌 (F. moniliforme) 。本研究对连作土壤中的尖孢镰刀菌 (F. oxysporum) 与层出镰孢菌 (F. proliferatum) 的基因拷贝数进行定量分析发现,高锰酸钾消毒与木霉菌肥联用对上述两种真菌的抑制作用最为明显,其次为高锰酸钾灭菌处理、木霉菌肥处理。关于高锰酸钾的杀菌作用,以前已有较多报道,而木霉菌的抑菌机理主要有2种,一是通过抗生、重寄生、溶菌、竞争作用来抑制病原菌生长,二是通过木霉菌诱导植株产生抗性机制来实现[36]。可见,连作土壤经高锰酸钾消毒后,土壤中致病菌数量已有所降低,而木霉菌肥的施用又明显抑制了病原菌的繁殖,两者的联用增强了对病原菌抑制的持久性。本课题组前期研究发现不同连作苹果园的土壤真菌群落结构有明显差异,并且土壤真菌构成一个独立的群落结构[22]。本研究中我们通过对T-RFLP图谱的主成分分析 (PCA) 发现,各处理均改变了连作土壤真菌群落结构,其中,高锰酸钾与木霉菌肥两者联用对真菌群落结构的改变最为明显,这更有利于减轻苹果连作障碍。
4 结论老龄苹果园土壤经高锰酸钾消毒后增施木霉菌肥能够显著降低土壤中真菌数量和改变群落结构,提高平邑甜茶幼苗的抗氧化酶活性,进而促进平邑甜茶幼苗的生长。本文仅在盆栽条件下研究了两种方式的联用对苹果砧木平邑甜茶幼苗的影响,其实际应用效果还需进一步通过田间试验进行验证。
| [1] |
陈学森, 韩明玉, 苏桂林, 等. 当今世界苹果产业发展趋势及我国苹果产业优质高效发展意见[J].
果树学报, 2010, 27(4): 598–604.
Chen X S, Han M Y, Su G L, et al. Discussion on today’s world apple industry trends and the suggestions on sustainable and efficient development of apple industry in China[J]. Journal of Fruit Science, 2010, 27(4): 598–604. |
| [2] | Dullahide S R, Stirling G R, Nikulin A, et al. The role of nematodes, fungi, bacteria, and abiotic factors in the etiology of apple replant problems in the Granite Belt of Queensland[J]. Australian Journal of Experimental Agriculture, 1994, 34(8): 1177–1182. DOI:10.1071/EA9941177 |
| [3] | Mazzola M. Elucidation of the microbial complex having a causal role in the development of apple replant disease in Washington[J]. Phytopathology, 1998, 88(9): 930–938. DOI:10.1094/PHYTO.1998.88.9.930 |
| [4] |
孙波. 腐植酸对高锰酸钾氧化酚类化合物的影响机理探究[D]. 哈尔滨: 哈尔滨工业大学硕士论文, 2013.
Sun B. Mechanism investigation of the influence of humic acid on phenol oxidation by permanganate[D]. Harbin: MS Thesis of Harbin Institute of Technology, 2013. |
| [5] |
李伶俐, 李文, 朱伟, 等. 喷施高锰酸钾对棉花生理特性及产量、品质的影响[J].
河南农业科学, 2017, 46(1): 48–52.
Li L L, Li W, Zhu W, et al. Effects of spraying potassium permanganate on physiological characteristics, yield and quality of cotton[J]. Journal of Henan Agricultural Sciences, 2017, 46(1): 48–52. |
| [6] |
刘星, 张文明, 张春红, 等. 土壤灭菌–生物有机肥联用对连作马铃薯及土壤真菌群落结构的影响[J].
生态学报, 2016, 36(20): 6365–6378.
Liu X, Zhang W M, Zhang C H, et al. Combination of the application of soil disinfection and bio-organic fertilizer amendment and its effects on yield and quality of tubers, physiological characteristics of plants, and the soil fungal community in a potato monoculture system[J]. Acta Ecologica Sinica, 2016, 36(20): 6365–6378. |
| [7] |
王青青, 胡艳丽, 周慧, 等. 根皮苷对平邑甜茶根系TCA循环酶的影响[J].
中国农业科学, 2012, 45(15): 3108–3114.
Wang Q Q, Hu Y L, Zhou H, et al. Effects of phloridzin on the tricarboxylic acid cycle enzymes of roots of Malus hupehensis Rehd [J]. Scientia Agricultura Sinica, 2012, 45(15): 3108–3114. |
| [8] |
毛志泉, 沈向, 刘恩太, 等. 一种降解根皮苷的方法[P]. 中国专利: CN102726269A, 2012-10-17.
Mao Z Q, Shen X, Liu E T, et al. A method for the degradation of phloridzin[P]. Chinese Patent: CN102726269A, 2012-10-17. |
| [9] |
郭素娟, 李广会, 吕文君, 等. 锰对板栗实生苗生长及生理效应的影响[J].
植物营养与肥料学报, 2012, 18(6): 1530–1536.
Guo S J, Li G H, Lü W J, et al. Influence of manganese on growth, physiological effects of chestnut seedlings[J]. Plant Nutrition and Fertilizer Science, 2012, 18(6): 1530–1536. |
| [10] |
庄敬华, 陈捷, 杨长成, 等. 生防木霉菌生物安全性评价[J].
中国农业科学, 2006, 39(4): 715–720.
Zhuang J H, Chen J, Yang C C, et al. Evaluation of biocontrol Trichoderma on biology security[J]. Scientia Agricultura Sinica, 2006, 39(4): 715–720. DOI:10.3321/j.issn:0578-1752.2006.04.010 |
| [11] | Azarmi R, Hajieghrari B, Giglou A. Effect of Trichoderma isolates on tomato seedling growth response and nutrient uptake [J]. African Journal of Biotechnology, 2011, 10: 5850–5855. |
| [12] | Asaduzzaman M, Alam M J, Islam M M. Effect of Trichoderma on seed germination and seedling parameters of chili [J]. Journal of Science Foundation, 2013, 8: 141–150. |
| [13] |
冯程龙, 王晓婷, 康文晶, 等. 利用小麦秸秆生产木霉分生孢子及其生物有机肥对黄瓜的促生效果[J].
植物营养与肥料学报, 2017, 23(5): 1286–1295.
Feng C L, Wang X T, Kang W J, et al. Trichoderma conidia production using wheat straw and growth promoting effect of its bio-organic fertilizer on cucumber[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(5): 1286–1295. |
| [14] |
康萍芝, 张丽荣, 沈瑞清, 等. 哈茨木霉制剂对设施连作番茄根际土壤微生物的生态效应及防病作用[J].
农药, 2013, 52(2): 128–131.
Kang P Z, Zhang L R, Shen R Q, et al. Ecological effect of Trichoderma harzianum preparations on rhizosphere soil microbes in facilities continuous cropping tomato and their disease prevention [J]. Agrochemicals, 2013, 52(2): 128–131. |
| [15] |
袁玉娟, 胡江, 凌宁, 等. 施用不同生物有机肥对连作黄瓜枯萎病防治效果及其机理初探[J].
植物营养与肥料学报, 2014, 20(2): 372–379.
Yuan Y J, Hu J, Ling N, et al. Effects and mechanisms of application with different bio-organic fertilizers in controlling Fusarium wilt of cucumber [J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(2): 372–379. |
| [16] | Pan F, Xiang L, Wang S, et al. Effects of short-term rotation and Trichoderma application on the soil environment and physiological characteristics of Malus hupehensis Rehd. seedlings under replant conditions [J]. Acta Ecologica Sinica, 2017, 37(5): 315–321. DOI:10.1016/j.chnaes.2017.09.003 |
| [17] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.
Bao S D. Soil and agricultural chemistry analysis[M]. Beijing: China Agriculture Press, 2000. |
| [18] |
毛志泉, 王丽琴, 沈向, 等. 有机物料对平邑甜茶实生苗根系呼吸强度的影响[J].
植物营养与肥料学报, 2004, 10(2): 171–175.
Mao Z Q, Wang L Q, Shen X, et al. Effect of organic materials on respiration intensity of annual Malus. hupehensis Rehd. root system [J]. Plant Nutrition and Fertilizer Science, 2004, 10(2): 171–175. DOI:10.3321/j.issn:1008-505X.2004.02.012 |
| [19] | Zhang Y K, Han X J, Chen X L, et al. Exogenous nitric oxide on antioxidative system and ATPase activities from tomato seedlings under copper stress[J]. Scientia Horticulturae, 2009, 123: 217–223. DOI:10.1016/j.scienta.2009.08.015 |
| [20] | Omran R G. Peroxide levels and the activities of catalase, peroxidase, and indoleacetic acid oxidase during and after chilling cucumber seedlings[J]. Plant Physiology, 1980, 65(2): 407–408. DOI:10.1104/pp.65.2.407 |
| [21] | Singh B K, Sharma S R, Singh B. Antioxidant enzymes in cabbage: variability and inheritance of superoxide dismutase, peroxidase and catalase[J]. Scientia Horticulturae, 2010, 124: 9–13. DOI:10.1016/j.scienta.2009.12.011 |
| [22] |
尹承苗, 王功帅, 李园园, 等. 连作苹果园土壤真菌的T-RFLP分析[J].
生态学报, 2014, 34(4): 837–846.
Yin C M, Wang G S, Li Y Y, et al. Assessment of fungal diversity in apple replanted orchard soils by T-RFLP analysis[J]. Acta Ecologica Sinica, 2014, 34(4): 837–846. |
| [23] |
王艳芳, 付风云, 李家家, 等. 甲壳素对连作条件下平邑甜茶幼苗生长及土壤环境的影响[J].
生态学报, 2016, 36(19): 6218–6225.
Wang Y F, Fu F Y, Li J J, et al. Effects of chitin on the growth of Malus hupehensis Rehd. seedlings and soil environment under replant condition [J]. Acta Ecologica Sinica, 2016, 36(19): 6218–6225. |
| [24] |
李天来, 杨丽娟. 作物连作障碍的克服-难解的问题[J].
中国农业科学, 2016, 49(5): 916–918.
Li T L, Yang L J. Overcoming continuous cropping obstacles-the difficult problem[J]. Scientia Agricultura Sinica, 2016, 49(5): 916–918. |
| [25] | Mazzola M, Manici L M. Apple replant disease: role of microbial ecology in cause and control[J]. Annual Review of Phytopathology, 2012, 50: 45–65. DOI:10.1146/annurev-phyto-081211-173005 |
| [26] | Contreras-Cornejo H A, Macías-Rodríguez L, Alfaro-Cuevas R, et al. Trichoderma spp. improve growth of Arabidopsis seedlings under salt stress through enhanced root development, osmolite production, and Na+ elimination through root exudates [J]. Molecular Plant-Microbe Interactions, 2014, 27(6): 503–514. DOI:10.1094/MPMI-09-13-0265-R |
| [27] | Morán-Diez E, Rubio B, Domínguez S, et al. Transcriptomic response of Arabidopsis thaliana after 24 h incubation with the biocontrol fungus Trichoderma harzianum [J]. Journal of Plant Physiology, 2012, 169(6): 614–620. DOI:10.1016/j.jplph.2011.12.016 |
| [28] | Shoresh M, Harman G E, Mastouri F. Induced systemic resistance and plant responses to fungal biocontrol agents[J]. Annual Review of Phytopathology, 2010, 48: 21–43. DOI:10.1146/annurev-phyto-073009-114450 |
| [29] | Srivastava R K, Pandey P, Rajpoot R, et al. Cadmium and lead interactive effects on oxidative stress and antioxidative responses in rice seedlings[J]. Protoplasma, 2014, 251(5): 1047. DOI:10.1007/s00709-014-0614-3 |
| [30] | Ahmad P, Jaleel C A, Salem M A, et al. Roles of enzymatic and nonenzymatic antioxidants in plants during abiotic stress[J]. Critical Reviews in Biotechnology, 2010, 30(3): 161. DOI:10.3109/07388550903524243 |
| [31] |
张素素, 徐少卓, 孙申义, 等. 土壤中根皮苷和根皮素对桃幼苗的影响[J].
园艺学报, 2017, 44(6): 1167–1173.
Zhang S S, Xu S Z, Sun S Y, et al. Effects of phloridzin and phloretin on prunus persica grafted seedlings[J]. Acta Horticulturae Sinica, 2017, 44(6): 1167–1173. |
| [32] |
李艳娟, 刘博, 庄正, 等. 哈茨木霉与绿色木霉对杉木种子萌发和幼苗生长的影响[J].
应用生态学报, 2017, 28(9): 2961–2966.
Li Y J, Liu B, Zhuang Z, et al. Effects of Trichoderma hazianum and T. viride on seed germination and seedling growth of Chinese fir [J]. Chinese Journal of Applied Ecology, 2017, 28(9): 2961–2966. |
| [33] | Contreras-Cornejo H A, López-Bucio J S, Méndez-Bravo A, et al. Mitogen-activated protein kinase 6 and ethylene and auxin signaling pathways are involved in arabidopsis root-system chitecture alterations by Trichoderma atroviride[J]. Molecular Plant-Microbe Interactions, 2015, 28(6): 701–709. DOI:10.1094/MPMI-01-15-0005-R |
| [34] | Eibinger M, Sigl K, Sattelkow J, et al. Functional characterization of the native swollenin from Trichoderma reesei: study of its possible role as C1 factor of enzymatic lignocellulose conversion[J]. Biotechnology for Biofuels, 2016, 9(1): 178. DOI:10.1186/s13068-016-0590-2 |
| [35] |
徐文凤. 环渤海湾地区重茬苹果园土壤真菌群落多样性及生防真菌的筛选[D]. 山东泰安: 山东农业大学硕士论文, 2011.
Xu W F. Diversity analysis of soil fungi from Bohai Bay apple replanted orchard and the screening of the antagonistic fungi[D]. Tai'an, Shandong: MS Thesis of Shandong Agricultural University, 2011. |
| [36] |
徐文, 黄媛媛, 黄亚丽, 等. 木霉-植物互作机制的研究进展[J].
中国生物防治学报, 2017, 33(3): 408–414.
Xu W, Huang Y Y, Huang Y L, et al. Advances on mechanism of Trichoderma-plant interaction[J]. Chinese Journal of Biological Control, 2017, 33(3): 408–414. |
 2018, Vol. 24
2018, Vol. 24  doi:
doi: 

