2. 农业部西北植物营养与农业环境重点实验室,陕西杨凌 712100;
3. 河南省林业科学研究院,河南郑州 450003
2. Key Laboratory of Plant Nutrition and the Agri-environment in Northwest China, Ministry of Agriculture, Yangling, Shaanxi 712100, China;
3. Academy of Forestry Sciences of Henan Province, Zhengzhou 450003, China
枣树因其具有防风固沙、调节气温、防止和减轻干热风的作用[1],已成为中国发展节水型林果业的首选树种。据统计,中国2014年枣树的种植面积已达280万hm2,居世界第一位。然而大量化肥和农药的施用及其他不合理的农业管理措施,使得枣区地力衰退问题日趋严重,影响了红枣的经济效益和品质,严重制约了红枣产业的可持续发展[2]。合理培肥是提高土壤肥力、维持枣区长期生产力的重要措施之一。
土壤微生物是土壤生态系统的重要组成部分,与土壤相互作用形成动态系统[3]。土壤酶活性作为衡量土壤质量变化的敏感指标,反映了土壤中各种生物化学过程的强度和方向[4]。微生物数量及群落比例通常被看作是衡量农田质量的重要指标之一[5]。因此,土壤微生物能全面指示土壤环境变化[6–7]。研究土壤肥力的维持机制,必须重视土壤微生物在土壤养分循环过程中的作用及其对不同培肥措施的响应。生物炭因其具有疏松多孔结构、吸附性强、表面积大等特点[8–10],近年来被作为土壤改良剂得到广泛的关注。研究表明,施入生物炭可提高土壤微生物生物量[11–12],改善土壤微生物的生存环境,进而为土壤微生物生长提供良好的栖息环境,促进微生物活动,增加土壤生物多样性[13–16]。但因生物炭性质、施用量及土壤类型等因素的差异,有关生物炭对土壤微生物学性质影响的研究结果并不一致[17–19]。目前,有关生物炭的研究多集中在红壤性水稻土[20]、风化土[21]等农田土壤上,而对林地土壤改良效应的研究较少。且以往研究多为1年的短期试验,限制了生物炭施入相对较长时间时对土壤的改良功能的理解,而有关生物炭与氮肥配施对枣区土壤微生物学特性的影响尚不清楚。迄今为止,已有较多关于水稻、玉米、小麦秸秆等生物炭方面的研究[5, 22],因此,本研究针对以花生壳为原料的生物炭与氮肥在不同配比条件下,对华北平原枣区土壤微生物学性质影响这一问题,通过3年田间试验,研究配施对枣区土壤微生物生物量、土壤酶活性以及微生物数量的影响,从土壤微生物学角度揭示其对土壤质量的改良状况,为生物炭在农田果园地区的科学应用和合理施肥提供可靠依据。
1 材料与方法 1.1 试验地概况试验于2013年4月―2015年10月在河南省濮阳市王助乡潘庄 (114°52′ E,35°20′ N) 进行。该区地处暖温带,年平均气温13.4℃,年平均降水量为502.3~601.3 mm,年平均日照时数为2454.5 h,无霜期一般为205 d。土壤类型为砂壤性潮土,试验前0—20 cm耕层土壤基本理化性质为:有机质10.61 g/kg、全氮0.68 g/kg、有效磷11.67 mg/kg、速效钾95.61 mg/kg、pH值8.47、容重1.42 g/cm3。
1.2 供试材料供试红枣品种为扁核酸 (Ziziphus jujubeMill.),树龄15年 (到2013年)。选择长势基本一致无病虫害的试验树,栽植密度为2 m × 3 m,每公顷约1650棵,设置保护行。
研究所用生物炭原料为花生壳秸秆,购自于河南商丘三利新能源有限公司,生产设备采用连续竖式生物质炭化炉,炭化温度为350~500℃。生产的生物黑炭磨细过1 mm筛备用,测定其理化性质,其pH 10.35、有机碳含量为467.20 g/kg、全氮5.90 g/kg、全钾11.5 g/kg、CEC 21.7 cmol/kg、容重0.45 g/cm3。
1.3 试验设计试验于2013年4月开始,采用随机区组设计,试验采用4 × 3完全方案设计,即设生物炭用量4个水平 (0、2.5、5和10 t/hm2,分别用C0、C1、C2和C3表示),氮肥用量3个水平 (300、450和600 kg/hm2,分别用N1、N2和N3表示),加上一个完全空白处理CK (不施生物炭和氮肥)。小区面积为30 m2,每个处理重复5次。施肥方式:在树冠下两侧0.5 m左右挖深20—30 cm的条状,于2013年4月一次性施入各用量生物炭,使生物炭与土混匀后覆土填平,此后的两年不再施入。化肥种类为尿素 (N 46%),其中70 %作为基肥施入,30%在7月中旬作为追肥施入。过磷酸钙 (P2O5 16%) 300 kg/hm2、硫酸钾 (K2O 45%) 300 kg/hm2,每季一次性随氮肥用以上相同方式施入。在作物生长期间根据天气及作物不同生育期,适量灌水,以满足作物正常生长发育所需。
1.4 样品采集及测定于2015年10月红枣采收后,避开生物炭等施肥区域,按照“S”形,用直径2 cm的土钻采集0—20 cm耕层土壤样品,剔除其中的石块、根系等杂物后,过直径2 mm筛混匀,于4℃冰箱保存,尽快进行土壤微生物生物量、酶活性和微生物数量的测定。
土壤微生物生物量碳 (MBC) 和生物量氮 (MBN) 采取氯仿熏蒸—K2SO4浸提法测定[23];土壤微生物生物量碳、氮含量均以熏蒸和未熏蒸土壤的有机碳、氮之差除以KE (0.45) 得到。
土壤脲酶活性采用靛酚比色法[24],以干土在单位时间内产生的NH3-N的毫克数来表示;碱性磷酸酶活性采用磷酸苯二钠比色法[25],以单位时间内释放的酚的毫克数来表示;蔗糖酶活性采用3,5–二硝基水杨酸比色法测定[26],用单位质量烘干土在单位时间内产生的葡萄糖的毫克数表示。
土壤微生物的数量通过平板计数法计算[27]:细菌数量采用牛肉膏蛋白胨培养基、真菌数量采用马丁氏培养基、放线菌数量采用高氏一号培养基。
1.5 试验数据处理试验数据采用Excel 2016、SPSS22.0 (IBM corporation,Aromonk,New York) 统计软件进行方差分析和多重比较 (LSD法),显著性水平设定为P < 0.05,结果以平均值 ± 标准误表示。
2 结果与分析 2.1 生物炭与氮肥配施对土壤微生物生物量的影响由图1A可知,土壤MBC含量总体上随生物炭与氮肥用量的增加呈增加趋势。与CK处理相比,MBC含量的增加幅度为45.1%~208.6%。其中,C3N2处理的MBC含量最高,C3N3处理次之,分别较对照提高了208.6%和60.2%。C0和C1水平下,增加施氮量没有显著增加土壤MBC含量;C2和C3水平下,增加氮肥用量,土壤MBC含量间差异显著。
同一氮肥用量下,土壤MBN含量随生物炭用量的增加而增加;同一生物炭用量下不同施氮处理间差异不显著 (图1B)。其中,C3N3处理的MBN含量最高,其次为C3N2和C3N1处理,分别较对照提高了159.4%、139.6%和118.4%。
生物炭、氮肥及其交互作用对土壤MBC/MBN均无显著影响,所有处理中以C3N2处理的MBC/MBN的比值最大,为5.80 (图1C)。生物炭用量、施氮水平及其交互作用对土壤微生物生物量碳 (MBC) 含量具有极显著影响 (表1,P < 0.01),添加生物炭对土壤微生物生物量氮 (MBN) 含量有极显著影响 ( P < 0.01),而施氮及其与生物炭的交互作用对MBN含量无显著影响。
 |
| 图1 生物炭与氮肥配施对土壤微生物生物量的影响 Fig. 1 Effect of biochar and nitrogen fertilizer amendments on soil microbial biomass [注(Note):柱上不同字母表示处理间差异达5%显著水平Different letters above the bars mean significant among the treatments at the 5% level.] |
| 表1 生物炭与氮肥交互条件下对土壤微生物生物量影响的方差分析表 Table 1 ANOVA analysis for the effects of biochar and nitrogen fertilizer on soil microbial biomass |
 |
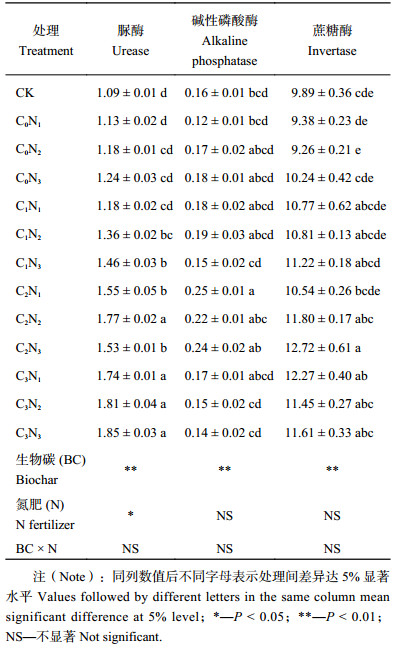
表2表明,经过3年的田间试验,添加生物炭和氮肥均对枣区土壤脲酶活性有显著影响 (P < 0.05)。同一氮肥用量水平下,土壤脲酶活性随生物炭用量的增加而增加;同一生物炭用量下,土壤脲酶活性总体上随氮肥用量的增加而增加。其中C 3N3处理的脲酶活性最高,C3N2处理次之,分别较对照提高了91.7%和66.1%。土壤碱性磷酸酶活性较低,其变化范围为0.12~0.25 mg/(g·d)。添加生物炭对土壤碱性磷酸酶活性有极显著影响 (P < 0.01),而施氮及其与生物炭的交互作用对碱性磷酸酶活性无显著影响。同一生物炭用量下,不同氮肥处理间差异不显著。生物炭与氮肥不同配比下,土壤蔗糖酶活性的变化趋势总体与碱性磷酸酶活性相似,施用生物炭对土壤蔗糖酶活性有极显著影响,而施氮及其与生物炭的交互作用对蔗糖酶活性无显著影响,所有施肥处理中,以C 2N3处理的土壤蔗糖酶活性最高,为12.72 mg/(g·d)。
| 表2 生物炭与氮肥配施对土壤酶活性的影响[mg/(g·d)] Table 2 Effect of biochar and nitrogen fertilizer amendments on soil enzyme activities |
 |
从表3可知,土壤微生物组成中细菌数量占绝对优势,放线菌次之,真菌数量最低。生物炭用量、施氮水平及其交互作用对土壤细菌、真菌和放线菌数量均有极显著影响 (P < 0.01)。不管是同一生物炭用量下增加氮水平,还是同一施氮水平下增加生物炭用量,土壤细菌的数量呈现出先增后降的趋势,但各处理仍显著高于对照 ( P < 0.05),土壤细菌的增加幅度为10.9%~80.4%。
同一氮肥用量下,真菌数量随生物炭用量的增加而显著增加 (P < 0.05),其中C 2N1处理的土壤真菌数量最多,较对照提高143.1%。中、低生物炭用量下,不同氮肥用量对土壤放线菌的数量影响较小,不同施氮水平间差异不显著。而高生物炭用量下,放线菌数量随施氮水平的增加而显著降低 (P < 0.05)。同一氮肥用量下,放线菌数量随生物炭用量的增加而增加。其中C 3N1处理的放线菌数量最高,较对照显著提高115.2%。
| 表3 不同生物炭与氮肥配施处理的土壤微生物数量 (cfu/g) Table 3 Soil microbial population affected by biochar and nitrogen fertilizer amendments |
 |
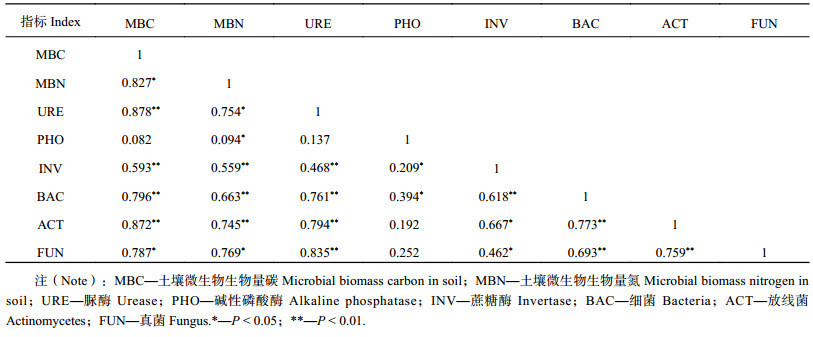
由表4可知,土壤微生物生物量碳与微生物生物量氮呈显著正相关 (r为0.827*,P < 0.05),土壤微生物生物量碳与土壤脲酶、蔗糖酶呈极显著正相关 ( r分别为0.878**和0.593**,P < 0.01)。土壤微生物生物量氮与脲酶、碱性磷酸酶和蔗糖酶呈显著或极显著相关关系 ( r分别为0.754*、0.094*和0.559**)。土壤脲酶和蔗糖酶与土壤细菌、真菌及放线菌数量呈显著或极显著正相关,碱性磷酸酶与蔗糖酶、细菌数量呈显著正相关 (r分别为0.209*和0.394*,P < 0.05)。相关性分析结果表明,土壤微生物生物量、酶活性和微生物数量之间相互依存,三者共同构成评价土壤肥力的重要指标。
| 表4 土壤微生物生物量、酶活性及微生物数量之间的相关性 Table 4 Correlation among soil microbial biomass, enzyme activities and microbial population |
 |
土壤微生物生物量碳 (MBC) 是土壤碳库中最活跃的部分,也是土壤生物肥力的重要标志[28]。本试验中,生物炭用量、施氮水平及其交互作用对土壤微生物生物量碳 (MBC) 含量具有极显著影响 (表2,P < 0.01),且MBC含量总体上随生物炭和氮肥用量的增加而显著增加,与对照相比,土壤MBC含量的增加幅度为45.1%~208.6%。Xu等 [29]研究发现,2%和4%的低用量玉米秸秆生物炭与氮肥配施对潮土土壤微生物生物量碳没有显著影响,但8%的生物炭用量显著提高其含量。这可能与生物炭的原料、施用量以及田间试验等其他不可控因素有关[30]。
土壤微生物生物量氮 (MBN) 作为土壤氮素养分循环过程中重要的“源”和“库”,直接调节土壤氮的供给[31]。本研究条件下,添加生物炭对土壤微生物生物量氮含量有极显著影响,且含量随生物炭用量的增加而增加,这与宋大利等[19]的研究结果土壤微生物生物量氮随生物炭用量的增加 (0、7.5和22.5 t/hm2) 而呈先增后降的趋势不一致,原因可能是由于本试验生物炭施用量相对较低 (0、2.5、5和10 t/hm2)。生物炭本身具有大的比表面积和孔隙度,可以为土壤微生物提供良好的栖息场所[32–33]。同时我们之前的研究[34–35]表明,生物炭与氮肥配施显著降低了土壤容重,提高了土壤有机质、全氮、全磷及有效养分含量,且土壤微生物生物量与土壤有机质、全氮及速效氮呈显著正相关关系,土壤理化性质的改善加速了土壤中有机物质的分解和生物炭本身养分的释放,提高了土壤微生物活性,从而利于土壤微生物生物量的增加。土壤MBC/MBN比值在本研究中总体上与对照无显著差异。陈心想等[36]研究发现,果树枝条热裂解制成的生物炭,施入土后显著降低了土壤的微生物量碳氮比。生物炭施入土壤后,可不同程度地影响土壤中碳、氮的分解,土壤微生物组成发生了变化,从而导致不同的土壤微生物量碳氮比[36–37]。
3.2 生物炭与氮肥配施对土壤微生物酶活性的影响脲酶是参与土壤氮素循环的重要水解酶,在一定程度上反映了土壤氮素的供应能力[38]。本研究中,生物炭与氮肥均不同程度地提高了枣区土壤脲酶活性,总体上脲酶活性随生物炭 (0、2.5、5和10 t/hm2) 和氮肥用量 (300、450、600 kg/hm2) 的增加而显著增加,所有处理中以C3N3处理的脲酶活性最高,较对照提高了91.7%,这与陈心想等[36]研究结果类似。生物炭具有吸附性,减少了氮素的淋失和挥发[39–40],本研究的氮肥用量也相对较高,为土壤微生物提供了丰富的氮源。生物炭和氮肥的施入,显著提高了枣区土壤全氮和速效氮含量,且土壤脲酶与全氮、速效氮呈显著正相关关系,增强了土壤氮素的有效性,提高了土壤脲酶的活性[34–35]。磷酸酶是土壤磷循环中的关键酶,表征土壤磷素营养状况[41]。蔗糖酶能促进糖类的分解,加速土壤碳素循环,其活性可以反映土壤有机质积累和转化的状况[42]。本试验条件下,生物炭与氮肥配施总体上对土壤碱性磷酸酶活性和蔗糖酶活性无显著影响,这可能是因为生物炭施入土壤后,蔗糖酶不能立即水解生物炭中所含的较难分解的碳物质而造成的[36]。另一方面,生物炭具有稳定性,决定了它在土壤中是一个不断累积、变化的过程。由于本试验周期有限,生物炭与氮肥配施对土壤酶活性的影响,需要长期监测研究。
3.3 生物炭与氮肥配施对土壤微生物数量的影响细菌在土壤有机物和无机物转化过程中起着重要作用,而真菌在土壤碳素和能源循环过程中发挥着巨大作用[43–44]。本研究结果发现,生物炭用量、施氮水平及其交互作用对土壤细菌、真菌和放线菌均有极显著影响 (P < 0.01)。与对照相比,土壤细菌、真菌和放线菌的增幅分别为10.9%~80.4%、6.6%~143.1%和50.6%~115.2%。但在本试验中,中、高用量的生物炭与氮肥配施对土壤真菌的数量有明显抑制作用,这与周玉祥等 [5]的盆栽试验研究,中、高用量 (3%和5%土壤干重) 的水稻和玉米秸秆生物炭显著提高了露天煤矿排土场土壤真菌的数量结果不同。这可能与土壤的pH有关,本研究的枣区潮土为碱性 (pH值8.47),所用花生壳生物炭对该研究区土壤pH值无显著影响[34],而真菌最适宜生长在酸性土壤中。同一种类的微生物数量在不同植被以及不同质地土壤中会有所差异。研究表明,土壤微生物总量增加有利于土壤肥力的提高,土壤微生物类群及比例的变化对土壤肥力的形成及养分的供应有良好的调节作用[45–47]。生物炭与氮肥配施显著提高了枣区土壤微生物数量,这可能是因为生物炭具有较强的吸附性和较大的孔隙度,可吸附土壤中的养分和水分,减少枣区土壤中的养分淋失,为土壤细菌、真菌和放线菌的生长繁殖创造了良好的条件[12]。同时,生物炭与氮肥配施提高了枣区土壤有机质、全氮、全钾以及速效氮、磷等养分含量,降低了土壤团聚体破坏率,提高了土壤水稳性大团聚体含量,改善了土壤团聚体结构[34–35, 48]。枣区土壤理化性质的改善,有利于微生物数量的增加。综合以上试验结果且考虑到实际生产成本,10 t/hm2的生物炭配施N 300 kg/hm2的氮肥最利于该枣区土壤微生态系统的维持或改良。
相关性分析表明,土壤微生物生物量、土壤酶活性以及微生物数量之间存在多种显著或极显著关系 (表4),说明三者之间相互依存,共同促进了枣区土壤微生物生态系统的改良。与传统的土壤施肥方式相比,生物炭施入后明显改善了土壤生物环境,但影响土壤微生物性质变化的因素有很多,是否与枣树根系分泌物对不同肥料的响应或是生物炭在土壤中存留的时间有关,仍需进一步研究。
4 结论1) 通过3年田间定位试验发现,生物炭对枣区土壤微生物生物量碳氮有极显著影响,且微生物生物量含量总体上随生物炭与氮肥用量的增加而增加。
2) 施用生物炭和氮肥均对土壤脲酶活性有显著影响,土壤脲酶活性随生物炭和氮肥用量的增加而增加,但配合施肥总体上对土壤碱性磷酸酶和蔗糖酶活性无显著影响。
3) 生物炭、氮肥及其交互作用可不同程度地提高土壤细菌、真菌和放线菌的数量。但中、高用量的生物炭与氮肥配施对土壤真菌的数量有明显的抑制作用。
4) 生物炭与氮肥配施对改善枣区土壤微生物性质有积极作用,可作为提高本地区土壤质量的有效措施之一。综合试验结果及实际生产成本,10 t/hm2生物炭配施N 300 kg /hm2的氮肥为该地区最佳施肥量,但两者配施的作用机理仍需长期的深入研究。
| [1] |
郭裕新. 枣[M]. 北京: 中国林业出版社, 1982.
Guo Y X. Jujube[M]. Beijing: China Forest Press, 1982. |
| [2] |
党维勤, 郑妍, 卜晓峰, 等. 谈黄土丘陵沟壑区红枣产业的发展[J].
中国水土保持, 2007, (5): 52–54.
Dang W Q, Zheng Y, Bo X F, et al. Discussion on the development of Chinese date industry in gullied rolling loess area[J]. Soil and Water Conservation in China, 2007, (5): 52–54. |
| [3] | Young I M, Crawford J W, Nunan N, et al. Microbial distribution in soils: physics and scaling[J]. Advances in Agronomy, 2008, 100: 81–121. DOI:10.1016/S0065-2113(08)00604-4 |
| [4] | Joergensen R G, Emmerling C. Methods for evaluating human impact on soil microorganisms based on their activity, biomass, and diversity in agricultural soils[J]. Journal of Plant Nutrition and Soil Science, 2006, 169(3): 295–309. DOI:10.1002/(ISSN)1522-2624 |
| [5] |
周玉祥, 宋子岭, 孔涛, 等. 不同秸秆生物炭对露天煤矿排土场土壤微生物数量和酶活性的影响[J].
环境化学, 2017, 36(1): 106–113.
Zhou Y X, Song Z L, Kong T, et al. Effect of straw biochar on soil microbe number and soil enzyme activities in opencast coal mine dump[J]. Environmental Chemistry, 2017, 36(1): 106–113. DOI:10.7524/j.issn.0254-6108.2017.01.2016041703 |
| [6] | Doran J W, Sarrantonio M, Liebig M A. Soil health and sustainability[J]. Advance in Agronomy, 1996, 56: 1–54. DOI:10.1016/S0065-2113(08)60178-9 |
| [7] | Liu E K, Zhao B Q, Mei X R, et al. Effects of no-tillage management on soil biochemical characteristics in Northern China[J]. Journal of Agricultural Science, 2010, 148: 217–223. DOI:10.1017/S0021859609990463 |
| [8] | Joseph S D, Campsarbestain M, Lin Y, et al. An investigation into the reactions of biochar in soil[J]. Australian Journal of Soil Research, 2010, 48(7): 501–515. DOI:10.1071/SR10009 |
| [9] | Anyika C, Abdul M Z, Ibrahim Z, et al. The impact of biochars on sorption and biodegradation of polycyclic aromatic hydrocarbons in soils-a review[J]. Environmental Science and Pollution Research International, 2015, 22(5): 3314–3341. DOI:10.1007/s11356-014-3719-5 |
| [10] | Kasozi G N, Zimmerman A R, Nkedikizza P, et al. Catechol and humic acid sorption onto a range of laboratory-produced black carbons (Biochars)[J]. Environmental Science and Technology, 2010, 44(16): 6189–6195. DOI:10.1021/es1014423 |
| [11] | Belyaeva O N, Haynes R J. Comparison of the effects of conventional organic amendments and biochar on the chemical, physical and microbial properties of coal fly ash as a plant growth medium[J]. Environment Earth Sciences, 2012, 66: 1987–1997. DOI:10.1007/s12665-011-1424-y |
| [12] | Liang B, Lehmann J, Sohi S P, et al. Black carbon affects the cycling of non-black carbon in soil[J]. Organic Geochemistry, 2010, 41(2): 206–213. DOI:10.1016/j.orggeochem.2009.09.007 |
| [13] | Knicker H. How does fire affect the nature and stability of soil organic nitrogen and carbon? A review[J]. Biogeochemistry, 2007, 85(1): 91–118. DOI:10.1007/s10533-007-9104-4 |
| [14] |
韩光明. 生物炭对不同类型土壤理化性质和微生物多样性的影响[D]. 沈阳: 沈阳农业大学博士学位论文, 2013.
Han G M. Effect of biochar on soil physicochemical property and microbial diversity in different soil type[D]. Shenyang: PhD Dissertation of Shenyang Agricultural University, 2013. |
| [15] | Makoto K, Tamai Y, Kim Y S, et al. Buried charcoal layer and ectomycorrhizae cooperatively promote the growth of Larix gmelinii seedlings[J]. Plant and Soil, 2010, 327(1/2): 143–152. |
| [16] | Solaiman Z M, Blackwell P, Abbott L K, et al. Direct and residual effect of biochar application on mycorrhizal root colonization, growth and nutrition of wheat[J]. Soil Research, 2010, 48(7): 546–554. DOI:10.1071/SR10002 |
| [17] | Dempster D N, Gleeson D B, Solaiman Z M, et al. Decreased soil microbial biomass and nitrogen mineralisation with Eucalyptus biochar addition to a coarse textured soil[J]. Plant and Soil, 2012, 354: 311–324. DOI:10.1007/s11104-011-1067-5 |
| [18] | Luo Y, Durenkamp M, Nobili M D, et al. Microbial biomass growth, following incorporation of biochars produced at 350℃ or 700℃, in a silty-clay loam soil of high and low pH[J]. Soil Biology and Biochemistry, 2013, 57: 513–523. DOI:10.1016/j.soilbio.2012.10.033 |
| [19] |
宋大利, 习向银, 黄绍敏. 秸秆生物炭配施氮肥对潮土土壤碳氮含量及作物产量的影响[J].
植物营养与肥料学报, 2017, 23(2): 369–379.
Song D L, Xi X Y, Huang S M, et al. Effects of combined application of straw biochar and nitrogen on soil carbon and nitrogen contents and crop yields in a fluvo-aquic soil[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(2): 369–379. DOI:10.11674/zwyf.16399 |
| [20] |
李明, 李忠佩, 刘明, 等. 不同秸秆生物炭对红壤性水稻土养分及微生物群落结构的影响[J].
中国农业科学, 2015, 48(7): 1361–1369.
Li M, Li Z P, Liu M, et al. Effects of different straw biochar on nutrient and microbial community structure of a red paddy soil[J]. Scientia Agricultura Sinica, 2015, 48(7): 1361–1369. DOI:10.3864/j.issn.0578-1752.2015.07.11 |
| [21] | Mankasingh U, Choi P C, Ragnarsdottir V. Biochar application in a tropical, agricultural region: A plot scale study in Tamil Nadu, India[J]. Applied Geochemistry, 2011, 26: 218–221. DOI:10.1016/j.apgeochem.2011.03.108 |
| [22] |
王群, 李飞跃, 曹心德, 等. 植物基与固废基生物炭的结构性质差异[J].
环境科学与技术, 2013, 36(8): 1–5.
Wang Q, Li F Y, Cao X D, et al. Different between characteristics of biochars derived from plant and solid waste[J]. Environmental Science & Technology, 2013, 36(8): 1–5. |
| [23] |
吴金水, 林启美, 黄巧云, 等. 土壤微生物生物量测定方法及其应用[M]. 北京: 气象出版社, 2006.
Wu J S, Lin Q M, Huang Q Y, et al. Soil microbial biomass-methods and application[M]. Beijing: China Meteorological Press, 2006. |
| [24] |
周礼恺. 土壤酶学[M]. 北京: 科学出版社, 1987.
Zhou L K. Soil enzymology[M]. Beijing: Science Press, 1987. |
| [25] | Dick R P. Methods of soil enzymology[M]. Madison: Soil Science Society of America, 2011: 163–168. |
| [26] |
关松荫. 土壤酶及研究方法[M]. 北京: 北京农业出版社, 1986.
Guan S Y. Soil enzyme and its research methods[M]. Beijing: China Agriculture Press, 1986. |
| [27] |
程丽娟, 薛泉宏. 微生物学实验技术[M]. 西安: 世界图书出版公司, 2000.
Cheng L J, Xue Q H. Laboratory manual of microbiology[M]. Xi’an: World Publishing Corporation Press, 2000. |
| [28] |
刘恩科, 赵秉强, 李秀英, 等. 长期施肥对土壤微生物量及土壤酶活性的影响[J].
植物生态学报, 2008, 32(1): 176–182.
Liu E K, Zhao B Q, Li X Y, et al. Biological properties and enzymatic activity of arable soils affected by long-term different fertilization systems[J]. Journal of Plant Ecology, 2008, 32(1): 176–182. |
| [29] | Xu N, Tan G C, Wang H Y, et al. Effect of biochar additions to soil on nitrogen leaching, microbial biomass and bacterial community structure[J]. European Journal of Soil Biology, 2016, 74: 1–8. DOI:10.1016/j.ejsobi.2016.02.004 |
| [30] | Liang F, Li G T, Lin Q M, et al. Crop yield and soil properties in the first 3 years after biochar application to a calcareous soil[J]. Journal of Integrative Agriculture, 2014, 13: 525–532. DOI:10.1016/S2095-3119(13)60708-X |
| [31] | Kolb S E, Fermanich, K J, Dornbush M E. Effect of charcoal quantity on microbial biomass and activity in temperate soils[J]. Soil Science Society of America Journal, 2009, 73: 1173–1181. DOI:10.2136/sssaj2008.0232 |
| [32] | Malcolm F. Black carbon sequestration as an alternative to bioenergy[J]. Biomass Bioenergy, 2007, 31: 426–432. DOI:10.1016/j.biombioe.2007.01.012 |
| [33] | Knicker H. How does fire affect the nature and stability of soil organic nitrogen and carbon? A review[J]. Biogeochemistry, 2007, 85: 91–118. DOI:10.1007/s10533-007-9104-4 |
| [34] |
袁晶晶, 同延安, 卢绍辉, 等. 生物炭与氮肥配施对土壤肥力及红枣产量、品质的影响[J].
植物营养与肥料学报, 2017, 23(2): 468–475.
Yuan J J, Tong Y A, Lu S H, et al. Effects of biochar and nitrogen fertilizer application on soil fertility and jujube yield and quality[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(2): 468–475. DOI:10.11674/zwyf.16285 |
| [35] |
袁晶晶, 同延安, 卢绍辉, 等. 生物炭与氮肥配施对枣园土壤培肥效应的综合评价[J].
农业工程学报, 2018, 34(1): 134–140.
Yuan J J, Tong Y A, Lu S H, et al. Comprehensive evaluation on soil fertility quality of jujube orchard under combined application of biochar and nitrogen fertilizer[J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(1): 134–140. DOI:10.11975/j.issn.1002-6819.2018.01.18 |
| [36] |
陈心想, 耿增超, 王森. 施用生物炭后土土壤微生物及酶活性变化特征[J].
农业环境科学学报, 2014, 33(4): 751–758.
Chen X X, Geng Z C, Wang S, et al. Effects of biochar amendment on microbial biomass and enzyme activities in loess soil[J]. Journal of Agro-Environment Science, 2014, 33(4): 751–758. DOI:10.11654/jaes.2014.04.019 |
| [37] | Chan K Y, Zwieten L V, Meszaros I, et al. Agronomic values of green waste biochar as a soil amendment[J]. Soil Research, 2007, 45(8): 629–634. DOI:10.1071/SR07109 |
| [38] | Nannipieri P, Giagnoni L, Renella G, et al. Soil enzymology: classical and molecular approaches[J]. Biology and Fertility of Soils, 2012, 48: 743–762. DOI:10.1007/s00374-012-0723-0 |
| [39] | Yanai Y, Toyota K, Okazaki M. Effects of charcoal addition on N2O emissions from soil resulting from rewetting air-dried soil in short-term laboratory experiments [J]. Soil Science & Plant Nutrition, 2007, 53(2): 181–188. |
| [40] | Yu O Y, Raichle B, Sink S. Impact of biochar on the water holding capacity of loamy sand soil[J]. International Journal of Energy & Environmental Engineering, 2013, 4(1): 1–9. |
| [41] |
杨招弟, 蔡立群, 张仁陟, 等. 不同耕作方式对旱地土壤酶活性的影响[J].
土壤通报, 2008, 39(3): 514–517.
Yang Z D, Cai L Q, Zhang R Z, et al. Soil enzymatic activities under different tillages practices in dryland[J]. Chinese Journal of Soil Science, 2008, 39(3): 514–517. |
| [42] | Sardans J, Peñuelas J, Estiarte M. Changes in soil enzymes related to C and N cycle and in soil C and N content under prolonged warming and drought in a Mediterranean shrub land[J]. Applied Soil Ecology, 2008, 39: 223–235. DOI:10.1016/j.apsoil.2007.12.011 |
| [43] | Govaerts B, Mezzalama M, Unno Y, et al. Influence of tillage, residue management, and crop rotation on soil microbial biomass and catabolic diversity[J]. Applied Soil Ecology, 2007, 37: 18–30. DOI:10.1016/j.apsoil.2007.03.006 |
| [44] |
陈蓓, 张仁陟. 免耕和覆盖对土壤微生物数量及组成的影响[J].
甘肃农业大学学报, 2004, 39(6): 634–638.
Chen B, Zhang R Z. Effects of no-tillage and mulch on soil microbial quantity and composition[J]. Journal of Gansu Agricultural University, 2004, 39(6): 634–638. |
| [45] |
沙涛, 程立忠, 王国华, 等. 秸杆还田对植烟土壤中微生物结构和数量的影响[J].
中国烟草科学, 2000, (3): 40–42.
Sha T, Cheng L Z, Wang G H, et al. Effects of applying crop straw on the microbial composition and quantity in tobacco cultivated soil[J]. Chinese Tobacco Science, 2000, (3): 40–42. |
| [46] |
贾志红, 杨珍平, 张永清, 等. 麦田土壤微生物三大类群数量的研究[J].
麦类作物学报, 2004, 24(3): 54–56.
Jia Z H, Yang Z P, Zhang Y Q, et al. Study on the quantity of three main colony of soil microbe in wheat farmland[J]. Journal of Triticeae Crops, 2004, 24(3): 54–56. |
| [47] | Petersen S O, Frohne P S, Kennedya C. Dynamics of a microbial community under spring wheat[J]. Soil Science Society of America Journal, 2002, 66: 826–833. DOI:10.2136/sssaj2002.8260 |
| [48] |
袁晶晶, 同延安, 卢绍辉, 等. 生物炭与氮肥配施改善团聚体结构提高红枣产量[J].
农业工程学报, 2018, 34(3): 159–165.
Yuan J J, Tong Y A, Lu S H, et al. Biochar and nitrogen amendments improving soil aggregate structure and jujube yields[J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(3): 159–165. DOI:10.11975/j.issn.1002-6819.2018.03.021 |
 2018, Vol. 24
2018, Vol. 24  doi:
doi: 

