铁位居植物必需微量元素的首位,在植物生命活动中起重要作用[1]。石灰性土壤中,铁易形成不溶性化合物而使可溶性有效铁的总量不足10–10 mol/L,使得植物表现出失绿黄化现象[2–3]。据研究,全世界约有1/3的土壤是石灰性土壤,约40%的土壤缺铁严重[4],因此缺铁胁迫对于植物来说是一种很普遍的非生物胁迫。虽然目前通过土施、枝干注射、叶片喷施铁肥及一些栽培措施等方法提高土壤中铁质量分数和树体中铁的供应,可以在一定程度上矫正果树缺铁失绿问题,但是这些措施只能从表面上缓解失绿黄化症,无法从根本上解决植物的缺铁状况[5–6]。砧木是果树的基础,选育铁高效基因型砧木是提高果树耐缺铁的重要途径[7]。苹果砧木中的山定子Malus baccata (Linn.) Borkh.和小金海棠Malus xiaojinensis被认为是不耐缺铁和抗缺铁的砧木品种[8–9]。而在梨树栽培中,木梨[10]和新疆杜梨[11]被认为有较高的耐缺铁性。
高等植物为防止缺铁,产生了两种不同的机制 (机理Ⅰ和机理Ⅱ)[12–13]活化根际中的铁并由根吸收。果树属于机理I植物,在应对缺铁环境时,果树的根系Fe3+ 还原酶活性增强,使介质中的Fe3+ 被还原为Fe2+ 供根系吸收,同时产生有机酸及酚类物质的分泌增加及根系构型的改变[14–15]等生理、生态变化。Li等[16]研究表明植物根系在某些逆境胁迫下,向根际分泌有机酸以减轻胁迫。Olsen等[17]发现在缺铁胁迫下,番茄分泌的咖啡酸能溶解土壤中的难溶性铁,从而提高铁吸收利用效率。李振侠等[18]研究发现,草酸和柠檬酸分泌量增加可能是苹果砧木SH40和八棱海棠耐缺铁胁迫的原因之一。这些研究表明根系中分泌的有机酸对于研究植物抗逆境胁迫具有重要意义。但是已有的关于梨树有机酸种类及含量特性的研究主要关注果实[19–20],而对砧木中有机酸含量的差异还少有涉及。基于此,本研究以三种不同梨砧木幼苗为试材,利用水培法研究缺铁胁迫下不同梨砧木幼苗体内铁分配规律、根系生长特性及有机酸含量的差异,旨在为选育铁高效梨砧木品种、解决石灰性土壤上梨树缺铁提供理论依据。
1 材料与方法 1.1 试验材料供试材料为杜梨Ⅰ(湖北杜梨HB-Pyrus betulaefolia)、杜梨Ⅱ(郑州杜梨ZZ-Pyrus betulaefolia) 和黑龙江山梨 (HS-Pyrus ussuriensis) 种子。
1.2 试验方法试验于2016年7月至12月在南京农业大学资源与环境科学学院温室进行。2016年7月,选择适量充分成熟饱满的各品种种子,消毒后置于经过高温灭菌的河沙中,在4℃的冰箱中层积催芽。待种子露白,播种在铺有蛭石的72孔穴盘里,置于温室中培养。试验选取长势均匀一致、长有4~6片真叶的幼苗,移栽至1/2剂量的营养液中培养2周,再转至完全营养液中培养1周,然后开始不同铁浓度处理的溶液培养。营养液配方[21]为 (mol/L):K2SO4 7.5 × 10–4,Ca(NO3)2·4H2O 2.0 × 10–3,MgSO4·7H2O 6.5 × 10–4,KH2PO4 2.5 × 10–4,KCl 1.0 × 10–3,FeNa-EDTA 1.0 × 10–4,H3BO31.0 × 10–5, MnSO4 1.0 × 10–6,CuSO4 5.0 × 10–7,ZnSO4 1.0 × 10–6,(NH4)6Mo7O24 5.0 × 10–8。对3种试验材料设置以下2个处理,即缺铁胁迫 (1 μmol/L FeNa-EDTA处理) 和正常供铁 (40 μmol/L FeNa-EDTA处理);每周更换一次营养液,培养期间每天定时通气2小时。初始营养液的pH用NaOH或HCl调至6.0 ± 0.1。培养21 d后进行以下指标的测定。
1.3 指标测定生物量的测定是将幼苗地上部和地下部分开,用去离子水冲洗干净,105℃杀青30 min后70℃下烘至恒重,称重,活性铁含量测定方法参照王爱斌[22]方法并修改后测定:采收根、茎、叶样品,称取鲜样0.2~0.3 g,放入50 mL离心管,加入10 mL 1 mol/L HCl连续振荡5 h,浸提后过滤,并用容量瓶定容至50 mL,用ICP-AES(电感耦合等离子体发射光谱仪) 法测定。全铁含量采用ICP-AES测定[23]。
组织活性铁/全铁=组织活性铁含量/组织全铁含量;
活性铁积累量 (mg) = 组织活性铁含量 × 组织生物量;
全铁积累量 (mg) = 组织全铁含量 × 组织生物量;
活性铁分配比例=组织活性铁积累量/整株活性铁积累量 × 100%。
采用手持SPAD-502叶绿素仪对梨幼苗倒一叶、倒二叶、倒三叶进行测定。
用根系分析软件 (WinRHIZO 2007版) 对根总长、根表面积、根体积、根直径及根尖数进行分析。参照王学奎[24]的TTC染色法进行根系活力测定。根系Fe3+ 还原酶活性参考许良政等[25]的方法进行测定,重复6次,取其平均值作为处理的还原酶活性值。
采用高效液相色谱方法 (HPLC) 测定三种梨砧木中各器官的有机酸含量。参考Melgarejo等[26]的方法进行修改后测定:称取根、茎、叶样品0.5 g,加入10 mL超纯水研磨,转至50 mL离心管,于4℃,12000 g离心15 min,取上清,用0.22 μm微孔水系滤膜过滤后上机。高效液相色谱条件参照Karkacier等[27]方法并修改,PurospherSTARRP-18endcapped (4.6 mm, 250 mm, 5 μm) 色谱柱,柱温45℃,流动相为乙腈∶水 (体积比10∶90) 溶液,流速0.5 mL/min,蒸发光散射检测器 (ELSD),自配缓冲液H3PO4 [0.1%(NH4)2HPO4-H3PO4,pH 2.5] 流速为0.8~1.0 mL/min,进样量10 μL。以草酸、莽草酸、苹果酸、柠檬酸 (Sigma公司) 标准样品作内参。
1.4 数据分析采用SPSS 20统计分析软件对数据进行分析,Origin 9.1进行图表制作。
2 结果与分析 2.1 不同铁浓度处理对三种梨砧木幼苗生长的影响由图1所示,缺铁胁迫不同程度地促进了各品种各器官干物质量的积累。与正常供铁相比,杜梨Ⅱ根和茎生物量增加最大,分别增加了42.3%、65.1%,显著高于杜梨Ⅰ(11.1%、18.9%) 和山梨 (34.8%、13.4%)。而杜梨Ⅱ叶中积累的生物量仅增加了2.4%,显著低于杜梨Ⅰ(11.8%) 和山梨 (20.3%),两个不同来源杜梨整株干重积累量无明显差异但均显著高于山梨,且杜梨Ⅰ处理间差异显著,而杜梨Ⅱ和山梨品种处理间没有明显差异。
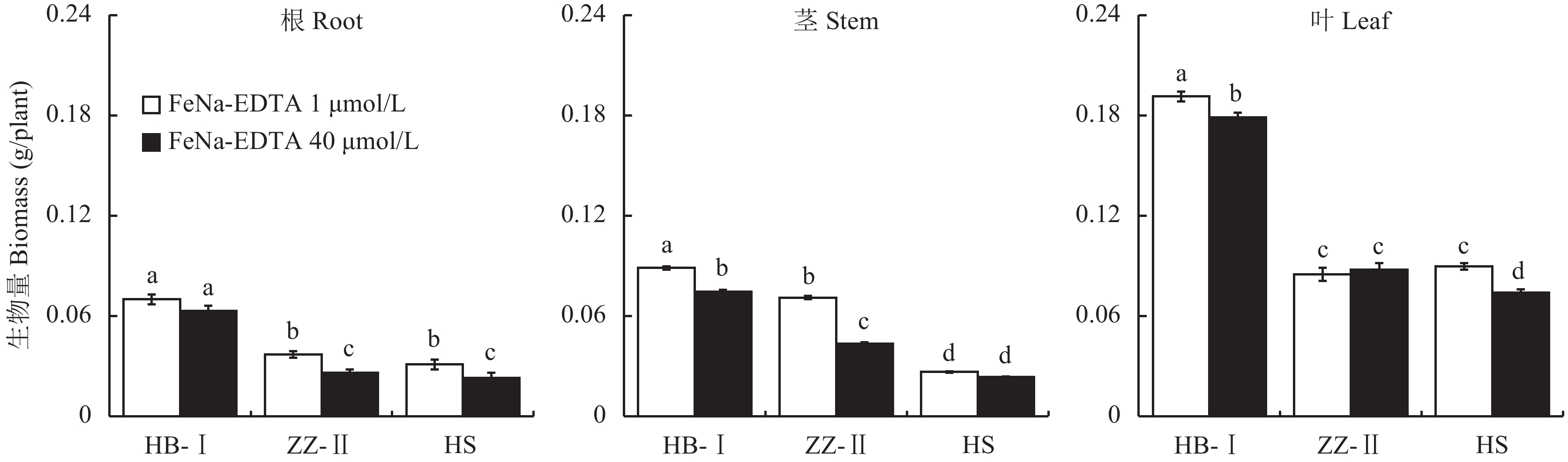 |
| 图1 不同梨砧木在两个供铁水平下的生物量 Fig. 1 Biomass of pear rootstocks affected by the two iron supply concentrations [注(Note):HB-I—湖北杜梨HB-Pyrus betulaefolia; ZZ-Ⅱ—郑州杜梨ZZ-Pyrus betulaefolia; HS—黑龙江山梨HS-Pyrus ussuriensis; FeNa-EDTA 1 μmol/L—缺铁胁迫Iron deficiency stress; FeNa-EDTA 40 μmol/L—正常供铁Normal iron supply; 柱上不同小写字母表示三个品种在不同铁供应水平下差异达5%显著水平Different small letters above the bars indicate significant differences among the two Fe levels and three cultivars at the 0.05 level.] |
由图2可见,与正常供铁相比,缺铁胁迫下各梨砧木幼苗的倒一叶、倒二叶、倒三叶叶片相对叶绿素含量 (SPAD值) 均呈现下降趋势。与正常供铁处理相比,缺铁胁迫21 d三个品种的倒一叶SPAD均显著下降,下降幅度分别为35.4%、43.6%和45.1%;杜梨Ⅱ倒二叶SPAD值比对照减少了47.8%,显著高于杜梨Ⅰ(26.8%) 和山梨 (44.8%);杜梨Ⅱ的倒三叶叶绿素含量与正常铁处理相比降低16.7%,显著高于杜梨I (6.0%) 和山梨。由此可见,缺铁胁迫对叶片相对叶绿素含量的影响有显著差异,以杜梨Ⅱ最为敏感,黄化程度最高,山梨次之,而杜梨Ⅰ黄化程度最低。
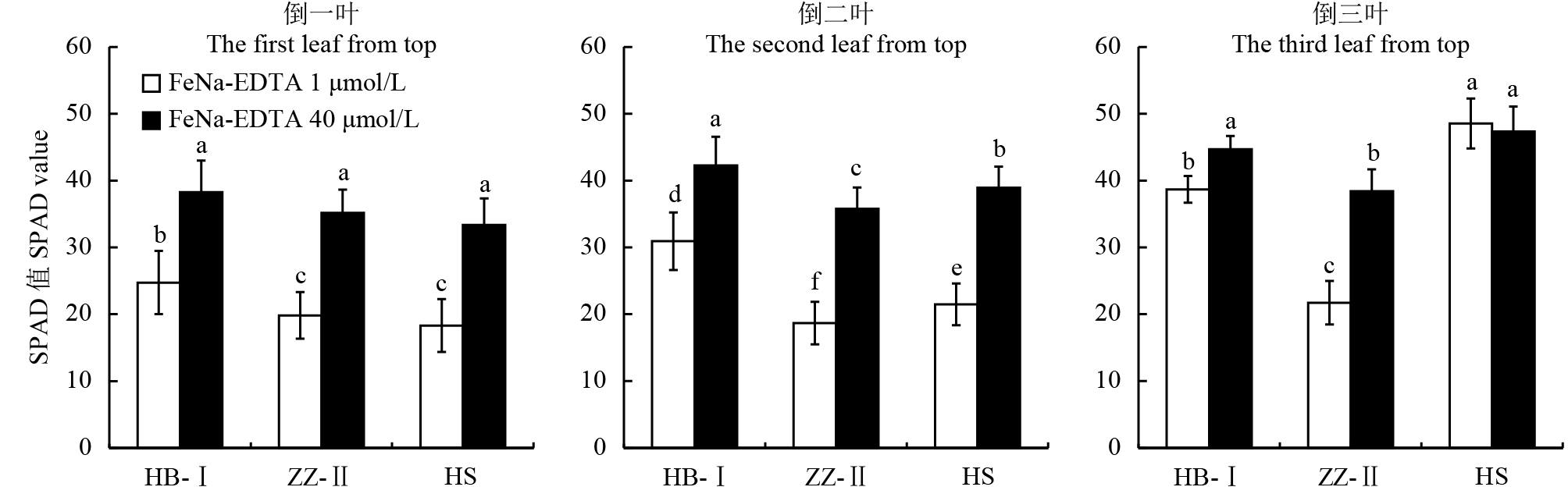 |
| 图2 不同铁浓度处理对不同梨砧木叶片相对叶绿素含量的影响 Fig. 2 Effect of different iron concentrations on chlorophyll contents in leaves of different pear rootstocks [注(Note):HB-I—湖北杜梨HB-Pyrus betulaefolia; ZZ-Ⅱ—郑州杜梨ZZ-Pyrus betulaefolia; HS—黑龙江山梨HS-Pyrus ussuriensis; FeNa-EDTA 1 μmol/L—缺铁胁迫Iron deficiency stress; FeNa-EDTA 40 μmol/L—正常供铁Normal iron supply; 柱上不同小写字母表示三个品种在不同铁供应水平下差异达5%显著水平Different small letters above the bars indicate significant differences among the two Fe levels and three cultivars for the same leaf at the 0.05 level.] |
由图3可见,缺铁胁迫显著增加了各品种梨砧木幼苗的根系总长、表面积、根平均直径、体积和根尖数。其中,杜梨Ⅰ和山梨的总根长比对照分别增长了14.2%和39.5%;根表面积比对照分别增加了34.1%、15.5%。根平均直径比正常铁处理分别升高了12.5%、6.1%、6.7%;与正常供铁相比,缺铁胁迫下杜梨Ⅱ品种的根体积增加了56.7%,显著高于杜梨Ⅰ和山梨 (分别为37.1%和14.2%)。缺铁胁迫下杜梨Ⅱ根尖数增加了1倍,而杜梨Ⅰ和山梨无明显差异。
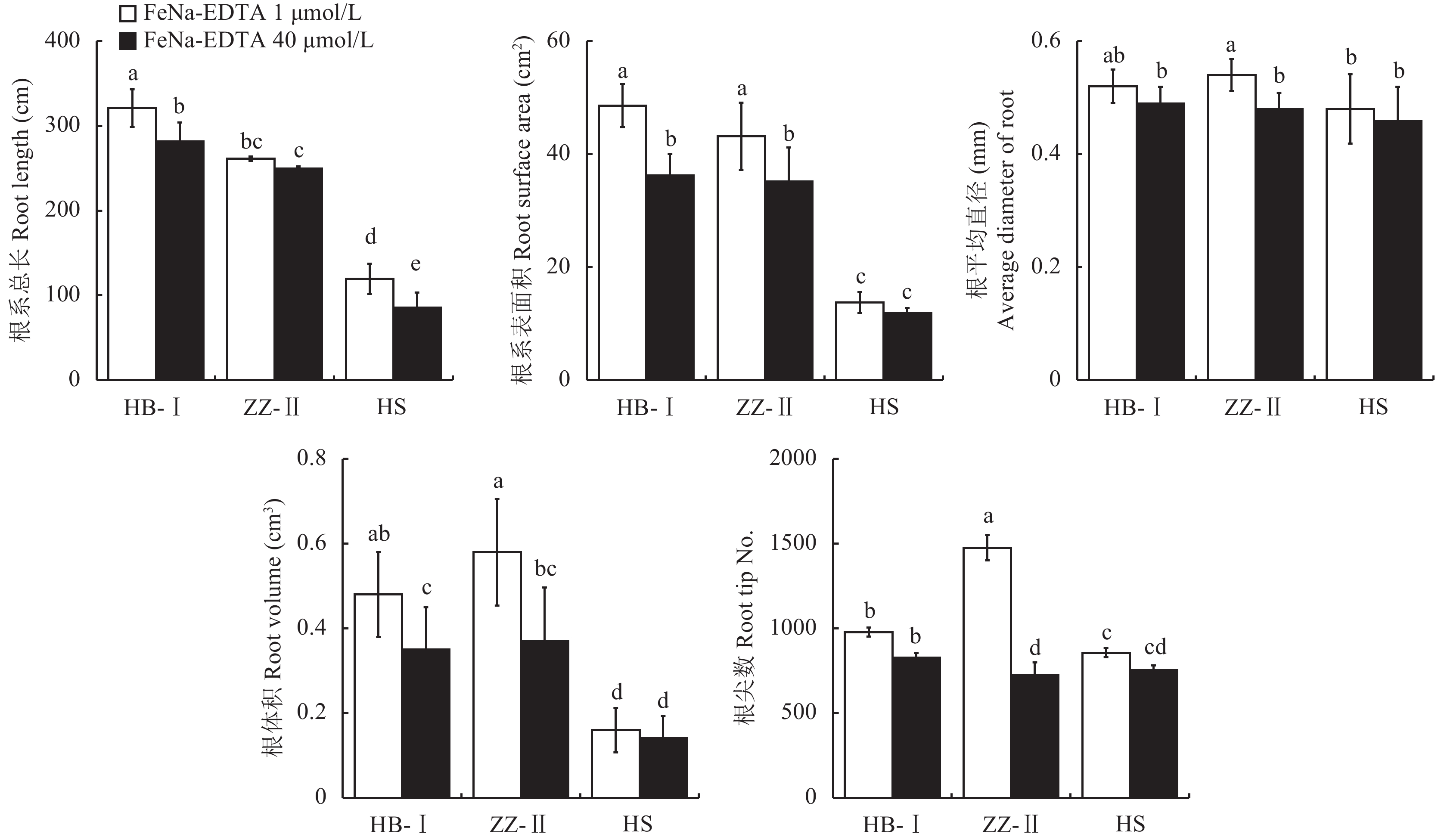 |
| 图3 不同铁浓度处理对不同梨砧木根系生长的影响 Fig. 3 Effect of different iron concentration treatments on root growth of different pear rootstocks [注(Note):HB-I—湖北杜梨HB-Pyrus betulaefolia; ZZ-Ⅱ—郑州杜梨ZZ-Pyrus betulaefolia; HS—黑龙江山梨HS-Pyrus ussuriensis; FeNa-EDTA 1 μmol/L—缺铁胁迫Iron deficiency stress; FeNa-EDTA 40 μmol/L—正常供铁Normal iron supply; 柱上不同小写字母表示三个品种在不同铁供应水平下差异达5%显著水平Different small letters above the bars indicate significant differences among the two Fe levels and three cultivars at the 0.05 level.] |
由图4可见,与正常供铁相比,缺铁胁迫下各品种的根系活力均有不同程度的升高,杜梨Ⅱ、杜梨Ⅰ、山梨品种分别上升了177.2%、4.1%、18.1%。杜梨Ⅱ和山梨在正常供铁与缺铁胁迫下的根系活力差异显著,而杜梨Ⅰ在不同处理间差异不显著。缺铁胁迫下各品种根系活力受影响程度为杜梨Ⅰ < 山梨 < 杜梨Ⅱ。在正常铁处理下,各品种的根系Fe 3+ 还原酶活性差异不显著,而在缺铁下各品种根系Fe3+ 还原酶活性均显著增加,增加的比例分别为24.6%、50.5%和33.0%,各品种根系Fe3+ 还原酶活性上升程度为杜梨Ⅰ < 山梨 < 杜梨Ⅱ。
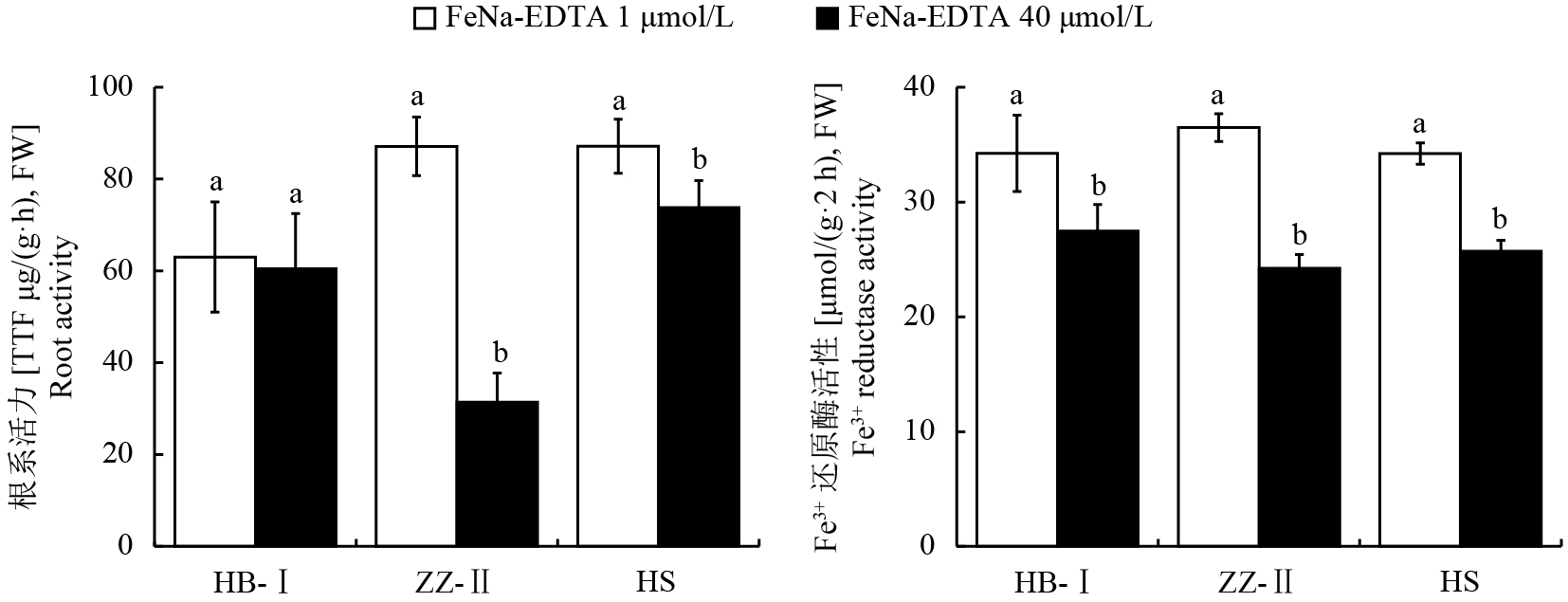 |
| 图4 不同铁浓度处理对不同梨砧木根系活力及Fe3+ 还原酶活性的影响 Fig. 4 Effect of different iron concentration treatments on root activity and Fe3+ reductase activity in root system of different pear rootstocks [注(Note):HB-I—湖北杜梨HB-Pyrus betulaefolia; ZZ-Ⅱ—郑州杜梨ZZ-Pyrus betulaefolia; HS—黑龙江山梨HS-Pyrus ussuriensis; FeNa-EDTA 1 μmol/L—缺铁胁迫Iron deficiency stress; FeNa-EDTA 40 μmol/L—正常供铁Normal iron supply; 柱上不同小写字母表示三个品种在不同铁供应水平下差异达5%显著水平Different small letters above the bars indicate significant differences among the two Fe levels and three cultivars at the 0.05 level.] |
活性铁及全铁在梨幼苗各器官中的分布有较大差异 (图5),根系中活性铁及全铁含量均显著高于茎叶,叶片中活性铁和全铁含量均显著高于茎 (杜梨Ⅱ茎除外);就品种而言,杜梨I根茎叶中活性铁含量均显著高于其他两个品种。与正常供铁相比,缺铁胁迫下不同梨砧木幼苗各器官活性铁含量均有不同程度降低,其中山梨根系活性铁含量比对照下降63.0%,杜梨I和杜梨Ⅱ分别比对照下降51.1%和28.8%;在茎叶中,虽然杜梨Ⅰ活性铁含量下降程度较大,分别为13.1%和39.5%,显著高于其余两个品种,但杜梨I茎叶中仍然保持较高的活性铁含量。缺铁胁迫对根系全铁含量有较大影响,杜梨Ⅰ根系全铁含量下降55.0%,杜梨Ⅱ和山梨分别下降12.0%和53.9%,对茎叶全铁含量影响较小。缺铁胁迫下,杜梨Ⅰ茎、叶活性铁/全铁之比显著高于杜梨Ⅱ和山梨,分别是杜梨Ⅱ的2.80倍和2.94倍, 是山梨的3.29倍和2.05倍,表明杜梨I可能具有较高的铁利用能力。
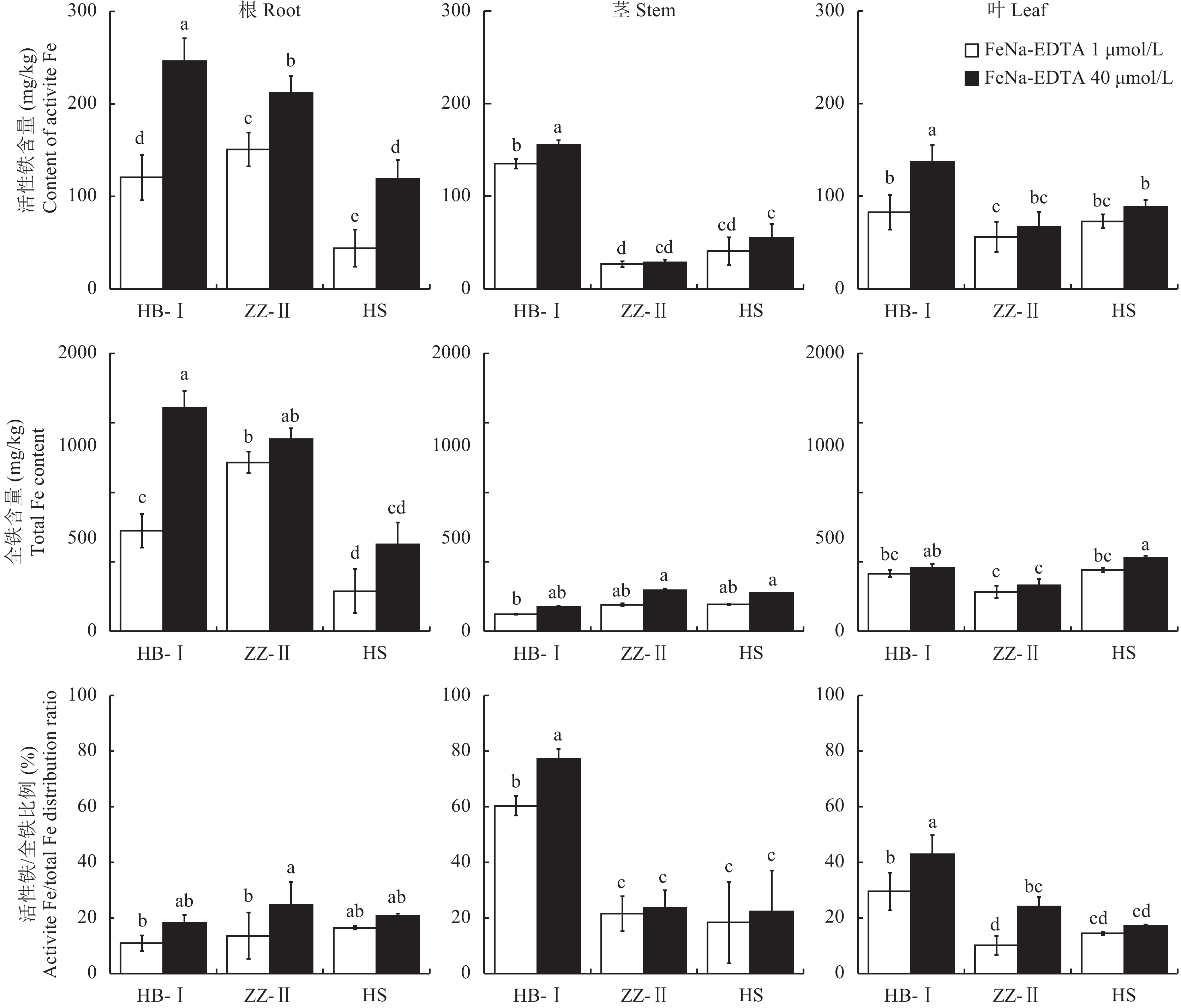 |
| 图5 不同梨砧木器官中活性铁和全铁的含量及活性铁/全铁比例 Fig. 5 Active and total iron contents and active iron/total iron ratios in organs of different pear rootstocks [注(Note):HB-I—湖北杜梨HB-Pyrus betulaefolia; ZZ-Ⅱ—郑州杜梨ZZ-Pyrus betulaefolia; HS—黑龙江山梨HS-Pyrus ussuriensis; FeNa-EDTA 1 μmol/L—缺铁胁迫Iron deficiency stress; FeNa-EDTA 40 μmol/L—正常供铁Normal iron supply; 柱上不同小写字母表示三个品种在不同铁供应水平下差异达5%显著水平Different small letters above the bars indicate significant differences among the two Fe levels and three cultivars at the 0.05 level.] |
不同梨砧木幼苗各器官活性铁及全铁积累量在品种间有较大差异 (图6),正常供铁下,杜梨I根、茎、叶活性铁与全铁积累量均显著高于杜梨Ⅱ和山梨 (茎全铁除外);缺铁胁迫下,杜梨Ⅰ叶中的活性铁和全铁积累量分别达到15.71 mg/plant和78.82 mg/plant,分别是杜梨Ⅱ的3.23、3.21倍、山梨的2.42和2.01倍。从活性铁在各器官中的分配比例来看,缺铁下杜梨I茎中活性铁积累量与整株活性铁之比显著提高。虽然山梨叶片中活性铁积累量与整株活性铁之比有所提高,但山梨植株总活性铁积累量远低于其他两个品种。
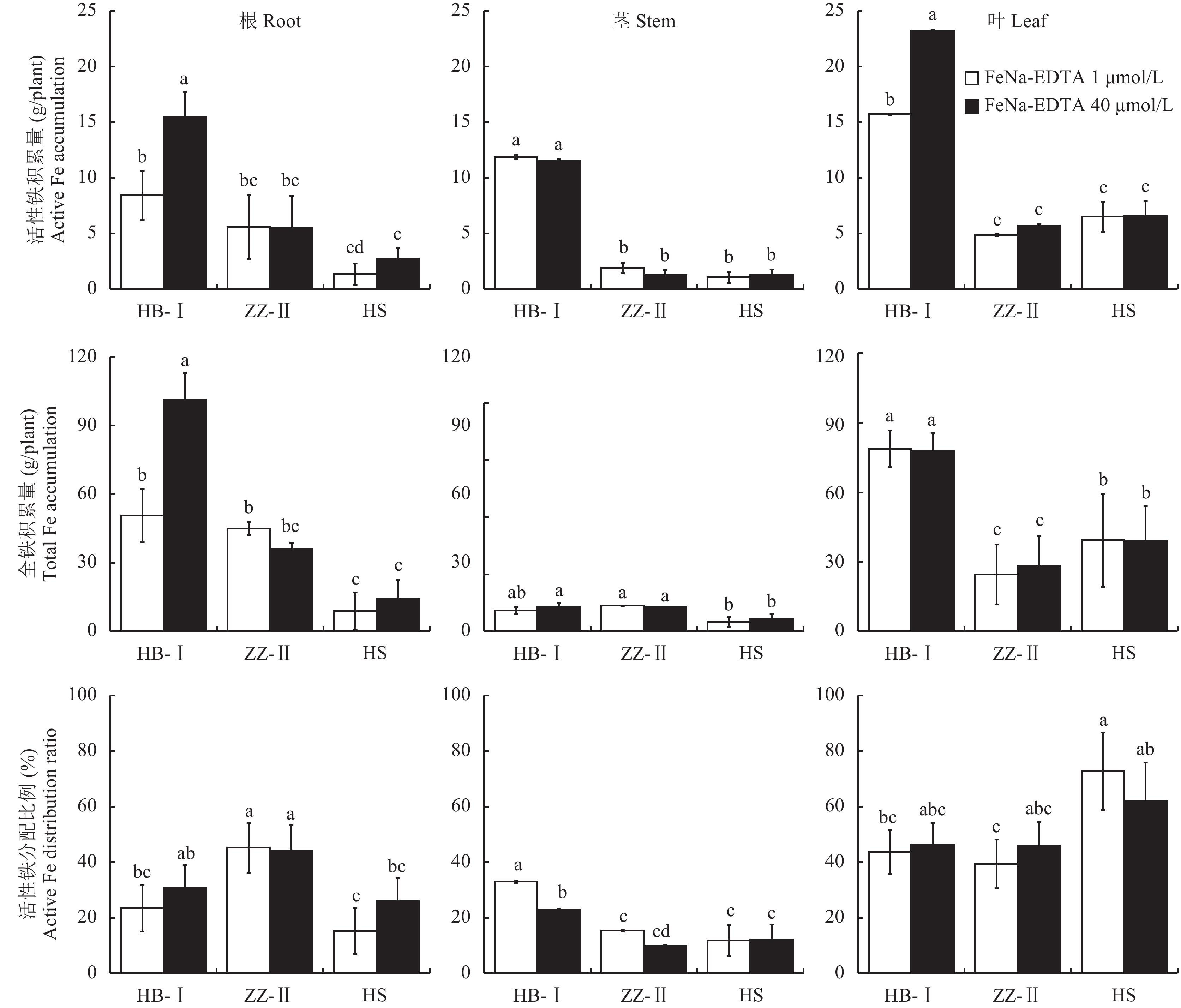 |
| 图6 不同梨砧木器官中活性铁和全铁的积累量及活性铁分配比例 Fig. 6 Active and total iron accumulation and active iron distribution ratios in organs of different pear rootstocks [注(Note):HB-I—湖北杜梨HB-Pyrus betulaefolia; ZZ-Ⅱ—郑州杜梨ZZ-Pyrus betulaefolia; HS—黑龙江山梨HS-Pyrus ussuriensis; FeNa-EDTA 1 μmol/L—缺铁胁迫Iron deficiency stress; FeNa-EDTA 40 μmol/L—正常供铁Normal iron supply; 柱上不同小写字母表示三个品种在不同铁供应水平下差异达5%显著水平Different small letters above the bars indicate significant differences among the two Fe levels and three cultivars at the 0.05 level.] |
如图7所示,不同品种各器官中有机酸含量有较大差异,杜梨Ⅰ和杜梨Ⅱ根、茎、叶中柠檬酸含量显著高于山梨,而山梨叶片中苹果酸和莽草酸含量显著高于杜梨Ⅰ和Ⅱ。从总量看,正常供铁下杜梨Ⅰ和杜梨Ⅱ体内总有机酸含量接近,平均含量比山梨提高83.4%;各品种有机酸含量最高的是柠檬酸,其次是苹果酸,这两种酸占总有机酸含量的74.8%以上;两个杜梨品种各部位柠檬酸含量的平均值分别占各部位有机酸总量的79.0%、55.3%和71.6%,远高于山梨;而其苹果酸比例远低于山梨 (杜梨Ⅰ茎除外)。缺铁处理下三个品种各部位柠檬酸含量均有不同程度上升,其所占比例表现为杜梨上升而山梨下降;相反,山梨中苹果酸含量及比例均显著上升,与正常供铁相比,缺铁下山梨根和叶中苹果酸含量提高了4.70和1.69倍,显著高于杜梨Ⅰ和杜梨Ⅱ,分别达到0.96 mg/g和4.80 mg/g。缺铁下杜梨根和叶中的柠檬酸含量较高,尤其是杜梨Ⅰ品种,达到4.02 mg/g和11.98 mg/g。莽草酸在山梨茎叶及杜梨Ⅱ茎中含量及比例均较高。另外,缺铁胁迫下山梨根系草酸含量显著增加,比正常供铁下提高28.8倍。
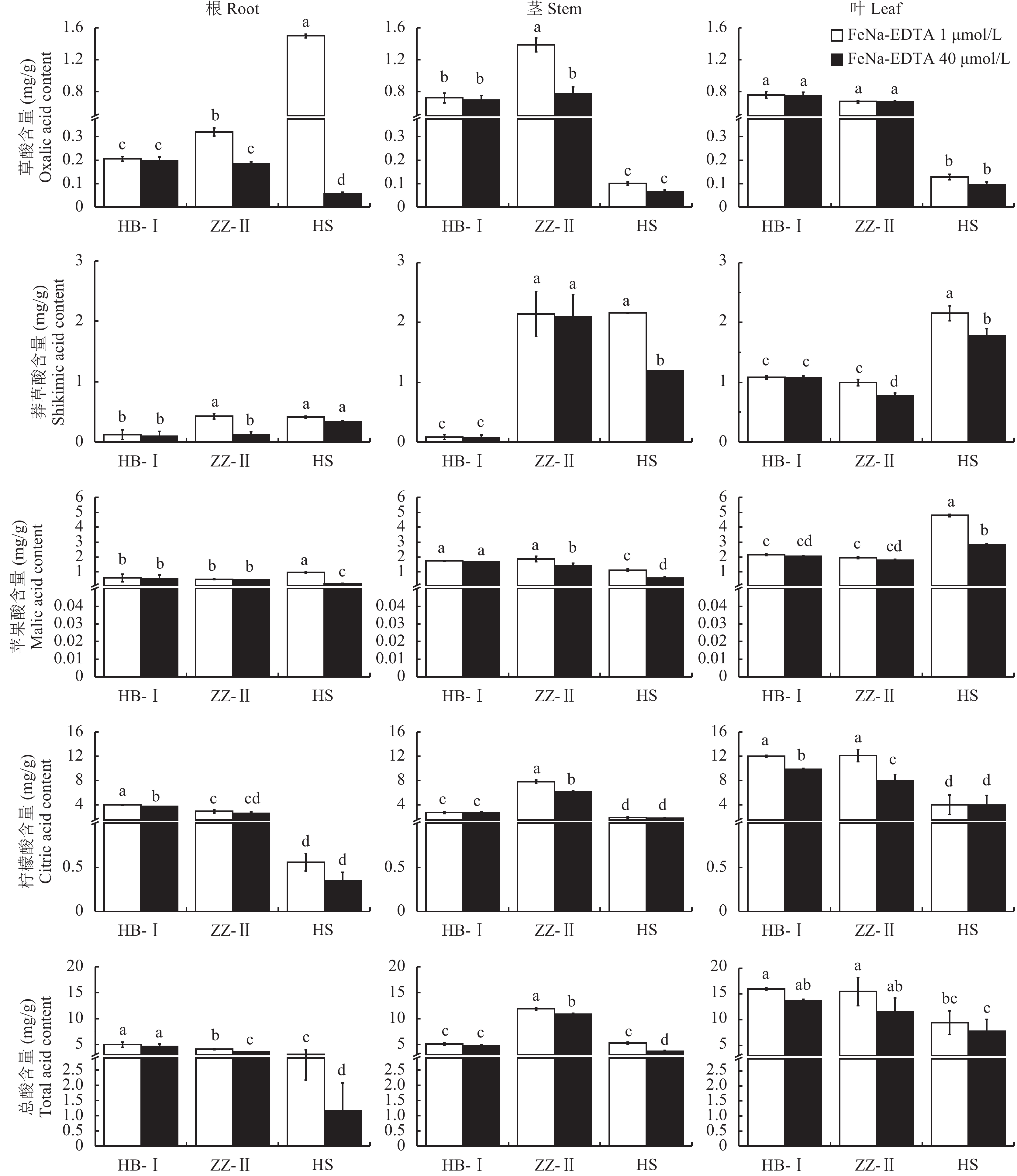 |
| 图7 不同铁浓度处理对不同梨砧木幼苗有机酸含量的影响 Fig. 7 Effect of different iron concentration treatments on organic acid content of different pear rootstocks [注(Note):HB-I—湖北杜梨HB-Pyrus betulaefolia; ZZ-Ⅱ—郑州杜梨ZZ-Pyrus betulaefolia; 山梨—黑龙江山梨HS-Pyrus ussuriensis; FeNa-EDTA 1 μmol/L—缺铁胁迫 Iron deficiency stress; FeNa-EDTA 40 μmol/L—正常供铁 Normal iron supply; 不同小写字母表示不同品种在不同铁供应水平下差异在5%水平显著Different small letters indicate significant differences among two Fe levels and three cultivars at the 0.05 level.] |
和其他元素相比,铁在植物中的移动性较差,因此在植物体内铁的利用和再利用率很低[28]。已有研究表明,随着铁浓度的升高,枳、酸橙、红橘三种柑橘砧木铁的叶/根、茎/根转运系数都逐渐降低,而叶/茎转运系数无明显差异,说明高铁浓度下铁易在根系中积累[29],而李振侠等[18]指出, 苹果砧木SH40在缺铁情况下叶片中铁含量与对照相比偏小,铁由根系转运到叶枝比较困难,也容易在根系中滞留积累。本研究结果表明,与正常供铁相比,缺铁胁迫下不同梨砧木各器官的活性铁和全铁含量都显著降低。且在不同铁处理水平条件下,根系中的活性铁/全铁分配比例最高 (图5),这也进一步印证了铁在梨体内再移动性差的观点,与王爱斌[22]在杜梨上、Krouma等[30]在豆科植物上的研究结果一致。董慕新等[31]和王翠玲等[32]认为,相对于全铁含量,活性铁含量和活性铁/全铁的比值都可有效诊断植物的耐缺铁程度。本文中在缺铁胁迫下,与杜梨Ⅱ和山梨相比较,杜梨Ⅰ叶中的活性铁含量和积累量均较高 (图5,图6),且其倒一叶和倒二叶SPAD值均最高 (图2);该品种在缺铁下茎叶中活性铁/全铁比例都明显高于其余两个品种 (图5),表明杜梨Ⅰ可能由于具有较强的铁利用能力,不易发生黄化现象。
3.2 缺铁对不同品种根系形态的影响根系是植物吸收养分和水分的主要器官,在植物生长发育过程中起重要作用。缺铁会导致植株形态变化影响根系的生长[33]。根系活力既能反映植株根系代谢能力的强弱,也能反映根系对养分的吸收和耐逆境能力。根系表面积能较好地反映根系被动吸收养分的能力[34]。本研究中与正常供铁相比,缺铁胁迫下三个品种梨总根长、根系表面积、根系体积和根尖数均显著增加 (图3),与根系的生物量增加 (图1) 相一致,表明缺铁胁迫可以使根系形态发生改变,以有利于对铁的吸收。在三个品种中,虽然缺铁下杜梨Ⅱ的根尖数显著增加了1倍 (图3),但由于其叶片内活性铁含量较低 (图5),因而地上部表现出叶片SPAD值显著降低 (图2)、叶片严重黄化,这表明虽然植物根系表现出较强的缺铁应激反应,但由于营养液中缺乏铁的供应,加上体内铁的移动性差,因而产生严重的缺铁黄化现象。笔者推测可能是由于地上部存在某些信号物质将缺铁信息传导至根部,刺激根系发生形态改变及促进生长,这与本实验室通过分根试验获得的信息一致 (未发表资料)。王爱斌[22]发现不同来源杜梨的根系活力在缺铁下均表现出升高趋势,品种间受影响程度不同,其中来源于新疆阿拉尔 (XA) 和山西 (SX) 杜梨的根系活力上升幅度较大,而对库尔勒 (XK) 和甘肃 (GS) 杜梨受影响程度较小。本研究中采用的来自湖北 (杜梨Ⅰ) 和河南 (杜梨Ⅱ) 的两个杜梨品种在缺铁胁迫下根系活力也呈升高趋势,其中杜梨Ⅰ相对于杜梨Ⅱ和山梨 (来自黑龙江) 而言受影响程度最小 (图4)。Fe3+ 还原酶通常被认为是一种缺铁性诱导酶,在缺铁下该酶被诱导活性增强,是双子叶植物适应缺铁的主要表现[35]。本研究结果中,缺铁胁迫下3种梨砧木幼苗根系Fe3+ 还原酶活性均高于正常铁处理中的活性,但增长幅度存在差异 (图4),表明缺铁胁迫下不同梨砧木幼苗将Fe3+ 还原成Fe2+ 的能力不同,不同程度地增加根系对铁的利用,从而缓解缺铁带来的影响。上述分析还表明,根系可能只是梨幼苗对缺铁做出的初级响应,而这种响应如何在体内进行传输还有待进一步研究。
3.3 不同品种有机酸含量的差异及其在缺铁胁迫下的响应在缺铁胁迫下植物根系通常增加某些有机酸的分泌以活化土壤铁, 提高铁的有效性[36]。根中有机酸含量的增加可以降低根际pH值,增加难溶性铁的溶解,提高植物耐缺铁能力[37]。李振侠等[18]研究表明,不同苹果砧木根系分泌有机酸种类基本相同但分泌量差异明显,这种差异可能是基因型差异造成的。本文中三种梨砧木体内主要是柠檬酸,其次是苹果酸,其中两个杜梨品种柠檬酸含量显著高于其他种类的有机酸,约占总有机酸含量的67.9%。柠檬酸作为铁素的主要运输载体[37],柠檬酸含量高可能有利于促进铁在体内的运输,从而使杜梨品种具有较高的铁利用能力,这与缺铁下杜梨I根茎叶中保持较高的活性铁含量、叶片具有较高的SPAD值一致 (图5和图2);相较于杜梨,山梨体内有机酸总量较低,其柠檬酸和苹果酸含量所占比例接近,分别约为31.2%和39.2%,莽草酸的比例为24.4%,显著高于杜梨。这些数据表明,杜梨和山梨体内可能存在不同的有机酸代谢途径。各品种不同器官间有机酸含量在缺铁胁迫下的响应程度也不同:缺铁胁迫下杜梨Ⅰ根系和叶片中柠檬酸含量显著增加,而杜梨Ⅱ则表现为茎中柠檬酸含量显著增加;山梨根系中草酸和叶片中莽草酸和苹果酸含量都显著上升。有机酸种类和含量的差异可能是缺铁下不同梨砧木活性铁、叶绿素含量及根系形态等存在变化差异的原因之一,有机酸代谢途径的差异表明不同品种可能存在不同的耐缺铁机制。
| [1] | Guerinot M L, Yi Y. Iron: nutritious, noxious, and not readily available[J]. Plant Physiology, 1994, 104: 815–820. DOI:10.1104/pp.104.3.815 |
| [2] | Christin H, Petty P, Ouertani K, et al. Influence of iron, potassium, magnesium and nitrogen deficiencies on the growth and development of sorghum(Sorghum bicolor L.) seedlings [J]. Journal of Biotech Research, 2009, 28(3): 154–156. |
| [3] | Niebur W S, Fehr W R. Agronomic evaluation of soybean genotypes resistant to iron deficiency chlorosis[J]. CropScience, 1981, 21: 551–554. |
| [4] |
石荣丽, 张福锁, 邹春琴. 不同基因型小麦铁营养效率差异及其可能机制[J].
植物营养与肥料学报, 2010, 16(6): 1306–1311.
Shi R L, Zhang F S, Zou C Q. Iron efficiency of different wheat genotypes and its main contributed factors[J]. Plant Nutrition and Fertilizer Science, 2010, 16(6): 1306–1311. DOI:10.11674/zwyf.2010.0602 |
| [5] |
韩振海, 王永章, 孙文彬. 铁高效及低效苹果基因型的铁离子吸收动力学研究[J].
园艺学报, 1995, 22(4): 313–317.
Han Z H, Wang Y Z, Sun W B. Iron absorption kinetics for Fe-efficient vs.-inefficient species in Malus [J]. Acta Horticultulturae Sinica, 1995, 22(4): 313–317. |
| [6] |
苏律, 宋俊霞, 胡同乐, 等. 铁肥不同施用方式对苹果缺铁黄化病的矫正效果[J].
江苏农业科学, 2016, 44(1): 188–189.
Su L, Song J X, Hu T L, et al. Effect of different application methods of iron fertilizer on iron deficiency chlorosis of apple[J]. Journal of Jiangsu Agricultural Science, 2016, 44(1): 188–189. |
| [7] |
韩振海, 沈隽. 果树的缺铁失绿症[J].
园艺学报, 1991, 18(4): 323–328.
Han Z H, Shen J. Iron chlorosis of fruit trees[J]. Acta Horticulturae Sinica, 1991, 18(4): 323–328. |
| [8] | Han Z H, Wang Q, Chen L. Root and rhizosphere responses of iron-efficient or-inefficient apple genotypes to solution pH[J]. Plant Nutrition, 1997, 20(11): 1517–1525. DOI:10.1080/01904169709365353 |
| [9] | Zha Q, Wang Y, Zhang X Z, Han Z H. Both immanently high activite iron contents and increased root ferrous uptake in response to low iron stress contribute to the iron deficiency tolerance in Malus Xiaojinensis [J]. Plant Science, 2014, 214(1): 47–56. |
| [10] | Ma C H, Tanabe K, Itai A, et al. Tolerance to lime-induced iron chlorosis of Asian pear rootstocks(Pyrus spp.) [J]. Japan Society of Horticultural Science, 2006, 74(6): 419–423. |
| [11] |
殷文娟, 吴玉霞, 何天明, 等. 缺铁胁迫对3种梨砧木幼苗生理特性的影响[J].
经济林研究, 2015, 33(2): 124–128.
Yin W J, Wu Y X, He T M, et al. Effects of iron deficiency stress on physiological characteristics of three cultivars of pear rootstock seedings[J]. Nonwood Forest Research, 2015, 33(2): 124–128. |
| [12] |
张恒涛, 许雪峰, 王忆, 等. 半根供铁对苹果砧木幼苗生长的影响[J].
果树学报, 2009, 26(5): 710–713.
Zhang H T, Xu X F, Wang Y, et al. Effects of the half root supply on the growth of apple trees[J]. Journal of Fruit Science, 2009, 26(5): 710–713. |
| [13] | Kobayashi T, Nishizawa N K. Iron uptake, translocation, and regulation in higher plants[J]. FEBS Letters, 2007, 581: 2273–2280. DOI:10.1016/j.febslet.2007.04.043 |
| [14] |
申红芸, 熊宏春, 郭笑彤, 左元梅. 植物吸收和转运铁的分子生理机制研究进展[J].
植物营养与肥料学报, 2011, 17(6): 1522–1530.
Shen H Y, Xiong H C, Guo X T, Zuo Y M. Progress of molecular and physiological mechanism of iron uptake and translocation in plants[J]. Plant Nutrition and Fertilizer Science, 2011, 17(6): 1522–1530. DOI:10.11674/zwyf.2011.1057 |
| [15] | Takagi S C. Production of phytosiderophores[A]. Barton L L, Hemming B C. Iron chelation in plants and soil microorganisms[M]. San Diego: Academic Press, 1993. 111–130. |
| [16] | Li X F, Ma J F, Matsmoto H. Patten of a luminum-induced secretion of organic acids differs between rye and wheat[J]. Plant Physiology, 2000, 123: 1537–1543. DOI:10.1104/pp.123.4.1537 |
| [17] | Olsen R A, Bennett J H, Blume D, Brown J C. Chemical aspects of Fe stress response mechanism in tomatoes[J]. Journal of Plant Nutrition, 1981, 3(6): 905–921. DOI:10.1080/01904168109362887 |
| [18] |
李振侠, 徐继忠, 高仪, 等. 苹果砧木SH40和八棱海棠缺铁胁迫下根系有机酸分泌的差异
[J].
园艺学报, 2007, 34(2): 279–282.
Li Z X, Xu J Z, Gao Y, et al. Difference of organic acid exudation from roots of SH40 and Balenghaitang under iron deficiency stress [J]. Acta Horticulturae Sinica, 2007, 34(2): 279–282. |
| [19] |
姚改芳, 杨志军, 张绍玲, 等. 梨不同栽培种果实有机酸组分及含量特征分析[J].
园艺学报, 2014, 41(4): 755–764.
Yao G F, Yang Z J, Zhang S L, et al. Characteristics of components and contents of organic acid in pear fruits from different cultivated species[J]. Acta Horticulturae Sinica, 2014, 41(4): 755–764. |
| [20] |
李甲明, 杨志军, 乐文全, 等. ‘鸭梨’ב京白梨’杂交后代果实有机酸积累差异及相关酶活性的研究[J].
西北植物学报, 2014, 34(2): 318–324.
Li J M, Yang Z J, Yue W Q, et al. Difference of acidity accumulation and related enzyme activities of pear from hybrid offspring of ‘Yali’×Jingbaili’[J]. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(2): 318–324. |
| [21] | Han Z H, Wang Q, Shen T. Comparison of some physiological and biochemical characteristics between iron efficient and iron-inefficient species in genus Malus [J]. Plant Nutrition, 1994, 17: 1257–1264. DOI:10.1080/01904169409364803 |
| [22] |
王爱斌. 杜梨缺铁胁迫的生理响应及耐缺铁性资源筛选[D]. 石家庄: 河北农业大学硕士学位论文, 2015.
Wang A B. Effect of iron-deficiency stress on physiological characters and screening out iron tolerance of Pyrus betulifolia Bge [D]. Shijiazhuang: MS Thesis of Hebei Agricultural University, 2015. |
| [23] |
司跃腾. 冀中黄冠梨主栽区果园营养状况分析[D]. 石家庄: 河北农业大学硕士学位论文, 2014.
Si Y T. Orchard nutritional status analysis of Huangguan pear main area in Hebei central [D]. Shijiazhuang: MS Thesis of Hebei Agricultural University, 2014. |
| [24] |
王学奎. 植物生理生化实验原理与技术[M]. 北京: 高等教育出版社, 2006.
Wang X K. Principles and techniques of plant physiological biochemical experiment[M]. Beijing: Higher Education Press, 2006. |
| [25] |
许良政, 张福锁, 李春俭. 双子叶植物根系Fe3+还原酶活性的2,2'-联吡啶比色测定法
[J].
植物营养与肥料学报, 1998, 4(1): 63–66.
Xu L Z, Zhang F S, Li C J. 2,2'-bipyridyl-colorimetric method for measurement of Fe(Ⅲ) reductase activity in roots of dicotyls[J]. Plant Nutrition and Fertilizer Science, 1998, 4(1): 63–66. DOI:10.11674/zwyf.1998.0110 |
| [26] | Melgarejo P, Salazar D M, Artes F. Organic acid and sugars composition of harvested pomegranate fruits[J]. European Food Research and Technology, 2000, 211(3): 185–190. DOI:10.1007/s002170050021 |
| [27] | Karkacier M, Erbas M, Uslu M K, et al. Comparison of different extraction and detection methods for sugars using amino-bonded phase HPLC[J]. Journal of Chromatographic Science, 2003, 41(6): 331–333. DOI:10.1093/chromsci/41.6.331 |
| [28] |
焦晓峰. 缺铁胁迫对5种苹果砧木幼苗生理特性的影响[D]. 乌鲁木齐: 新疆农业大学硕士学位论文, 2015.
Jiao X F. Effect of iron deficiency stress on physiological characteristics of five kinds of apple rootstock seedlings [D]. Urumchi: MS Thesis of Xinjiang Agricultural University, 2015. |
| [29] |
齐笑笑. 三种柑橘砧木对锌、铁胁迫的响应及其生理机制[D]. 合肥: 安徽师范大学硕士学位论文, 2010.
Qi X X. Response and its physiological mechanism of the three citrus rootstocks to zinc stress [D]. Hefei: MS Thesis of Anhui Agricultural University, 2010. |
| [30] | Krouma A, Drevon J J, Abdelly C. Genotypic variation of N2-fixing common bean (Phaseolus vulgaris L.) in response to iron deficiency [J]. Journal of Plant Physiology, 2006, 163(11): 1094–1100. DOI:10.1016/j.jplph.2005.08.013 |
| [31] |
董慕新, 张辉. 果树叶盐酸提取铁与叶失绿关系的研究[J].
中国农业科学, 1988, 21(5): 85–89.
Dong M X, Zhang H. The relationship between HCl extractable iron and chlorosis in fruit plant leaves[J]. Scientia Agricultura Sinica, 1988, 21(5): 85–89. |
| [32] |
王翠玲, 周卫东, 杨晓明, 等. 石灰性土壤上不同葡萄品种叶片的铁含量与其黄化的关系[J].
园艺学报, 2007, (4): 829–834.
Wang C L, Zhou W D, Yang X M, et al. Studies on chlorosis and iron contents of leaves from different grapevine cultivars on calcareous soil[J]. Acta Horticulturae Sinica, 2007, (4): 829–834. |
| [33] |
陆海峰, 潘英华, 卿冬进. 缺水和缺铁胁迫对玉米光合作用特性和根生长的影响[J].
广西农业生物科学, 2007, 26(1): 44–49.
Lu H F, Pan Y H, Qing D J. Effects of water deficit and iron deficit on photosynthetic characteristics and root growth of maize[J]. Journal of Guangxi Agricultural and Biological Science, 2007, 26(1): 44–49. |
| [34] |
乔海涛, 杨洪强, 申为宝, 等. 缺氮和缺铁对平邑甜茶幼苗根系构型的影响[J].
园艺学报, 2009, 36(3): 321–326.
Qiao H T, Yang H Q, Shen W B, et al. Effect of nitrogen deficient and iron-deficient on root architecture of young seedings of Malus hupehensis (Pamp) Rehd [J]. Acta Horticulturae Sinica, 2009, 36(3): 321–326. |
| [35] |
殷文娟. 3种梨砧木幼苗对缺铁胁迫的生理响应[D]. 乌鲁木齐: 新疆农业大学硕士学位论文, 2014.
Yin W J. Physiological response of three pear rootstocks to iron deficient sress [D]. Urumchi: MS Thesis of Xinjiang Agricultural University, 2014. |
| [36] |
周丽, 黄文斌, 王煜婷, 等. 养分缺乏下外源有机酸对落叶松幼苗吸收Fe的影响[J].
国土与自然资源研究, 2012, 6(32): 86–88.
Zhou L, Huang W B, Wang Y T, et al. Effect of exogenous organic acids on Fe absorption of larix olgensis seedlings with nutrient deficiency[J]. Territory and Natural Resources Study, 2012, 6(32): 86–88. |
| [37] | Kabir A H, Paltridge H G, Able A J, et al. Natural variation for Fe-efficiency is associated with upregulation of strategy I mechanisms and enhanced citrate and ethylene synthesis in Pisum sativum L [J]. Planta, 2012, 235(6): 1409–1419. DOI:10.1007/s00425-011-1583-9 |
 2018, Vol. 24
2018, Vol. 24  doi:
doi: 

