2. 中国农业科学院农业资源与农业区划研究所/农业部植物营养与肥料重点实验室,北京 100081
2. Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences/Ministry of Agriculture Key Laboratory of Plant Nutrition and Fertilizer, Beijing 100081, China
近年来,抗生素在畜禽及水产养殖中的过量使用,导致环境中耐药菌的产生和食品中药物的残留,已引起社会各界广泛关注[1–3]。我国是抗生素生产和使用大国,每年抗生素生产量达21万吨,使用量达18.9万吨,其中兽用抗生素占到一半以上[4],主要应用于畜禽养殖中的抗生素主要有四环素类、青霉素类、大环内酯类等,其中,四环素类抗生素 (土霉素、四环素、金霉素等) 由于其具有质优价廉、广谱性的特点,因而在畜禽养殖中被广泛使用[5–7]。长期以来,抗生素的广泛使用,取得了良好的效果。然而,滥用抗生素逐渐成为人们关注的热点问题[8–9]。据报道,进入动物体内的抗生素约有60%~90%会随着粪便、尿液等排泄物排出[10],进而作为有机肥施入农田,这会对土壤、水体等环境产生不利影响。土壤中土霉素的主要来源为含有土霉素的畜禽粪便、污泥和废弃物[11]。有研究表明,我国土壤、水产养殖场沉积物中可检测到的土霉素含量高达200 mg/kg[12]、285 mg/kg[1]。因此,开展残留土霉素的高效降解等研究很有必要。
环境中残留抗生素的处理方法大致分为物理、化学和生物降解三种,其中,生物降解具有成本低廉、方法简单、微生物处理高效、环境修复好等优点[13–14],是治理环境污染的有效手段。微生物作为生物降解的主体[15],对抗生素残留的降解起关键作用。对于抗生素的微生物降解,主要是具有降解功能的抗生素的耐药菌,因为这些耐药菌能够产生相应的降解酶,这些酶类进一步通过修饰或水解作用破坏抗生素的分子结构而导致抗生素降解[16]。目前已有一些和抗生素降解菌相关的研究,例如,碳角菌属 (Xylaria digitata) 能通过使碳核结构中间的两个环裂开从而降解四环素,最终导致四环素失效[17],土壤中分离到能够高效降解泰乐菌素的无丙二酸柠檬酸杆菌[18],猪粪中四环素类抗生素在土壤中能随微生物降解等作用而逐渐减少[19],生产四环素的药渣中存在可降解四环素的酵母菌[20],还有研究表明,在堆肥中添加外源菌剂可以有效去除四环素类抗生素的残留[21]。对于土霉素降解菌的研究也有所报道,例如,从某土霉素生产厂污水池底泥中分离出一株以土霉素为唯一碳源的菌株[22],从堆肥体系中分离到一株以土霉素为唯一碳源的降解菌[23]。总体来说,相关的研究还较少,自然界中大部分的微生物并不具有降解土霉素的能力,有研究表明,褐土和红壤中的土著微生物对四环素和土霉素的降解均无显著影响[24],因此,对于土霉素降解菌的筛选需要更深入地研究。本研究旨在从污泥、药渣和畜禽粪便中分离获得土霉素的降解菌,并研究其降解特性,为今后发展高效降解土霉素的环保工程菌制剂并建立固定化微生物技术奠定基础,并可减少土霉素在环境中的残留,保障人和动物的健康。
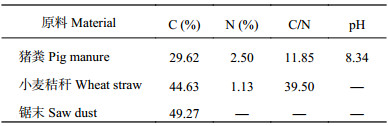
1 材料与方法 1.1 样品与试剂试验样品为菌肥、药渣、畜禽粪便;土霉素 (Oxytetracycline,OTC) 标准品购自德国Dr. Ehrenstorfer公司,其结构式见图1;甲醇、乙腈、正己烷 (色谱纯) 购自美国Fisher公司;磷酸为优级纯试剂;试验用水为娃哈哈纯净水;EDTA-McIlvaine缓冲液。猪粪、锯末、小麦秸秆的基本理化性质见表1。
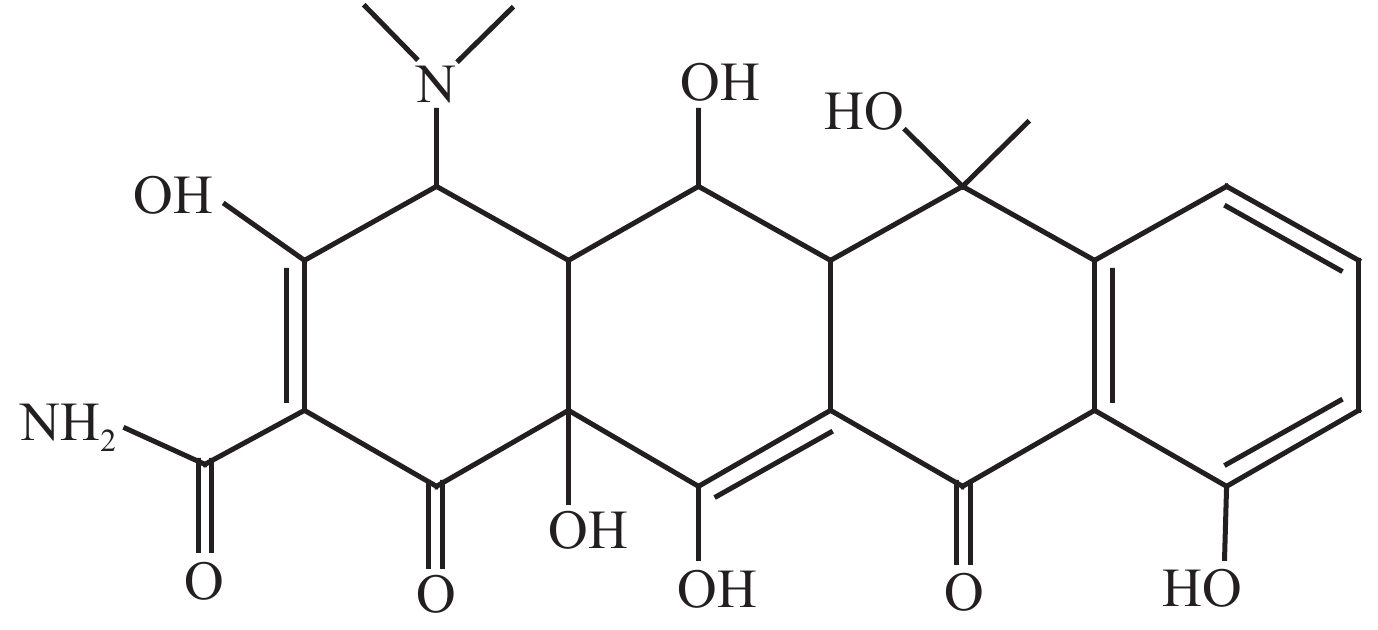 |
| 图1 土霉素的分子结构式 Fig. 1 Molecular structure of oxytetracycline |
| 表1 堆肥原料性质 Table 1 Properties of selected compost materials |
 |
土霉素标准储备液及标准溶液:准确称取土霉素标准品0.050 g,加入少量甲醇溶解,然后转移到10 mL棕色容量瓶中,用甲醇定容,配制成5 mg/mL的标准储备液。标准溶液 (3.125、6.25、12.5、25、50、100、200 mg/L) 均由储存标样加甲醇稀释配制而成。标准储备液和标准溶液保存在4 ℃冰箱内。
1.2 培养基制作牛肉膏蛋白胨培养基:用牛肉膏3 g、蛋白胨5 g、氯化钠5 g、琼脂18 g、蒸馏水定容至1000 mL,用1 mol/L氢氧化钠调节pH至7.0~7.2后灭菌;
无机盐培养基:氯化铵1 g、磷酸二氢钾0.5 g、磷酸氢二钾1.5 g、硫酸镁0.2 g、氯化钠1 g、琼脂20 g,蒸馏水1000 mL,调节pH至7.0,高压灭菌;
筛选培养基:在灭菌液体无机盐培养基中加入土霉素母液。
1.3 土霉素降解菌的筛选 1.3.1 菌株的分离与纯化称取10 g采集到的样品于90 mL灭菌蒸馏水的三角瓶中 (250 mL,内含玻璃珠),置于摇床中30℃、200 rpm振荡30 min,取出后静置。吸取100 μL上清液,涂布于牛肉膏蛋白胨固体培养基上,置于30℃条件下培养2 d。将得到的菌落,在牛肉膏蛋白胨固体培养基平板上划线,依据菌落形态进一步分离和纯化,重复多次,直至得到单一菌落;然后将单菌落分别接入牛肉膏蛋白胨液体培养基中,30℃、180 rpm下遮光震荡培养2 d,得到含有单一菌落的培养液。
1.3.2 菌株降解功能验证取100 μL上述培养液上清液,分别涂布于以土霉素为唯一碳源且土霉素浓度为25 mg/L的土霉素无机盐固体培养基平板上,30℃遮光培养2 d,按25 mg/L的梯度逐渐提高培养基中土霉素的浓度至100 mg/L,培养同上。经驯化最终得到生长快、菌落规则、耐高浓度土霉素的菌株,初步认定为对土霉素具有降解能力的优势菌株。划线培养,于4℃冰箱内保存。
将分离得到的菌株分别转接到牛肉膏蛋白胨液体培养基中进行活化,然后将活化的菌液按1%的接种量转接到以土霉素为唯一碳源的无机盐液体培养基中,30℃、180 rpm振荡条件下遮光培养7 d,最后用高效液相色谱法测定各菌株对土霉素的降解率。试管斜面保存土霉素降解率高的菌株,于4℃冰箱内保存。
1.3.3 生长曲线的测定降解菌株接种于100 mg/L土霉素的牛肉膏蛋白胨液体培养基中,30℃、180 rpm条件下培养,于不同时间取样,采用分光光度法检测样品的OD600值,以确定降解菌的生长量。
1.3.4 土霉素含量的测定采用Alliance 2695型高效液相色谱仪2998型PDA检测器 (美国Waters公司) 对土霉素含量进行测定。取培养液1 mL,加入5 mL甲醇,摇匀,10000 rpm离心15 min,取上清液,用0.22 μm针筒式微孔滤膜过滤得到滤液,待测。色谱条件为:色谱柱Sunfire C18(150 mm × 4.6 mm,3.5 μm,Waters,USA),流动相为0.05%磷酸水溶液 (A) 和乙腈 (B),流速为1.0 mL/min,柱温35℃,进样体积20 μL,检测波长为355 nm。洗脱程序为:0~17 min,93.2% A,6.8% B。根据线性回归方程计算出土霉素的含量,并采用以下公式计算降解率:
降解率=(对照样残量–实样残量)/对照样残量 × 100%
1.3.5 菌株降解条件优化选择温度、pH、转速、接种量为研究对象,将降解菌株培养活化后接入到100 mg/L的土霉素培养基中,装液量均为100 mL,在不同培养条件下培养7 d,测定土霉素降解率。每个处理设置三个重复,并设空白对照。
1) 温度:调节pH为7,接种量为1%,设置20、25、30、35、40、45℃ 6个温度梯度,180 rpm摇床培养7 d。
2) pH:调节pH分别为3、4、5、6、7、8、9、10,接种量为1%,30℃,180 rpm摇床培养7 d。
3) 转速:调节pH为7,接种量为1%,设置110、130、150、170、190、210 rpm 6个不同转速,30℃摇床培养7 d。
4) 接种量:调节pH为7,接种量分别为1%、2.5%、5%、10%,30℃,180 rpm摇床培养7 d。
1.4 土霉素降解菌堆肥试验共设置3个处理,具体为:1) 不加入土霉素,不加入T4菌株 (CK);2) 加入土霉素,不加入T4菌株 (OTC);3) 加入土霉素,加入菌株T4 (OTC + T4)。各处理碳氮比均为25,接种量为1 × 109 cfu/kg,含水率均为60%,土霉素的浓度为50 mg/kg,每个处理设置3次重复。把猪粪、锯末和小麦秸秆进行搅拌,将土霉素溶液和液体T4菌种均匀洒到其中,室温条件下发酵。第1、3、5、7、14、21、28、35、45 d取样,装于自封袋,在–20℃保存以备分析。用固相萃取进行提取,分析其中的土霉素含量。
数据分析、图表绘制采用Excel和Origin 8.5软件。
2 结果与分析 2.1 土霉素降解菌株的筛选经驯化、分离获得10株耐土霉素的菌株,编号分别为T1、T2、T3、T4、DX-1、DX-2、DX-3、ZC-1、ZC-2、ZC-3,其中T1、T2、T3、T4来源于菌肥,DX-1、DX-2、DX-3来源于畜禽粪便,ZC-1、ZC-2、ZC-3来源于药渣。各菌株在以土霉素为唯一碳源的无机盐培养基中生长情况见表2。其中T4菌的生长情况最好,因此,选取T4菌作为进一步研究的对象。
| 表2 微生物菌落的生长状况 Table 2 Growth condition of microbial colony |
 |
T4菌的16S rDNA基因测序所得序列提交NCBI后,通过BLAST程序与GenBank中核酸数据进行对比性分析。结果发现,T4菌与Pseudomonas sp.高度相似,在分子系统发育分类学上属于假单胞菌,挑选相似度相近序列用MEGA 6.0按邻接法构建系统发育树,得到T4 16S rDNA基因系统发育树 (图2)。
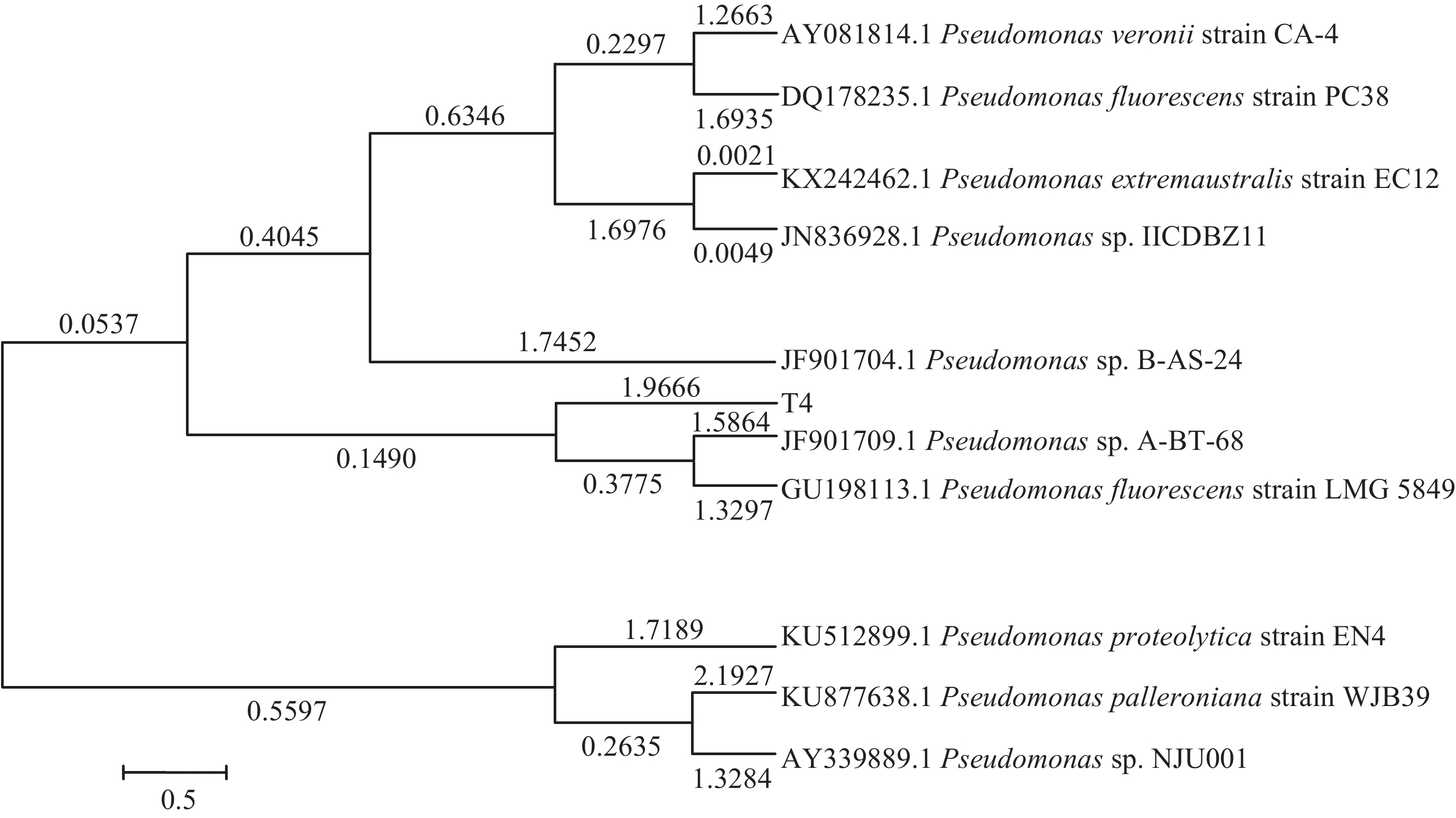 |
| 图2 T4菌16S rDNA基因系统发育树 Fig. 2 16S rDNA gene system development tree of T4 |
采用分光光度法对T4降解菌的生长曲线进行测定。由菌液光密度值 (OD600)(图3) 可见,0~6 h为T4菌的生长迟缓期,在6~32 h内菌株生产达到对数期,菌株个数呈对数增长,32 h之后菌体生长进入稳定期,菌数趋于饱和。
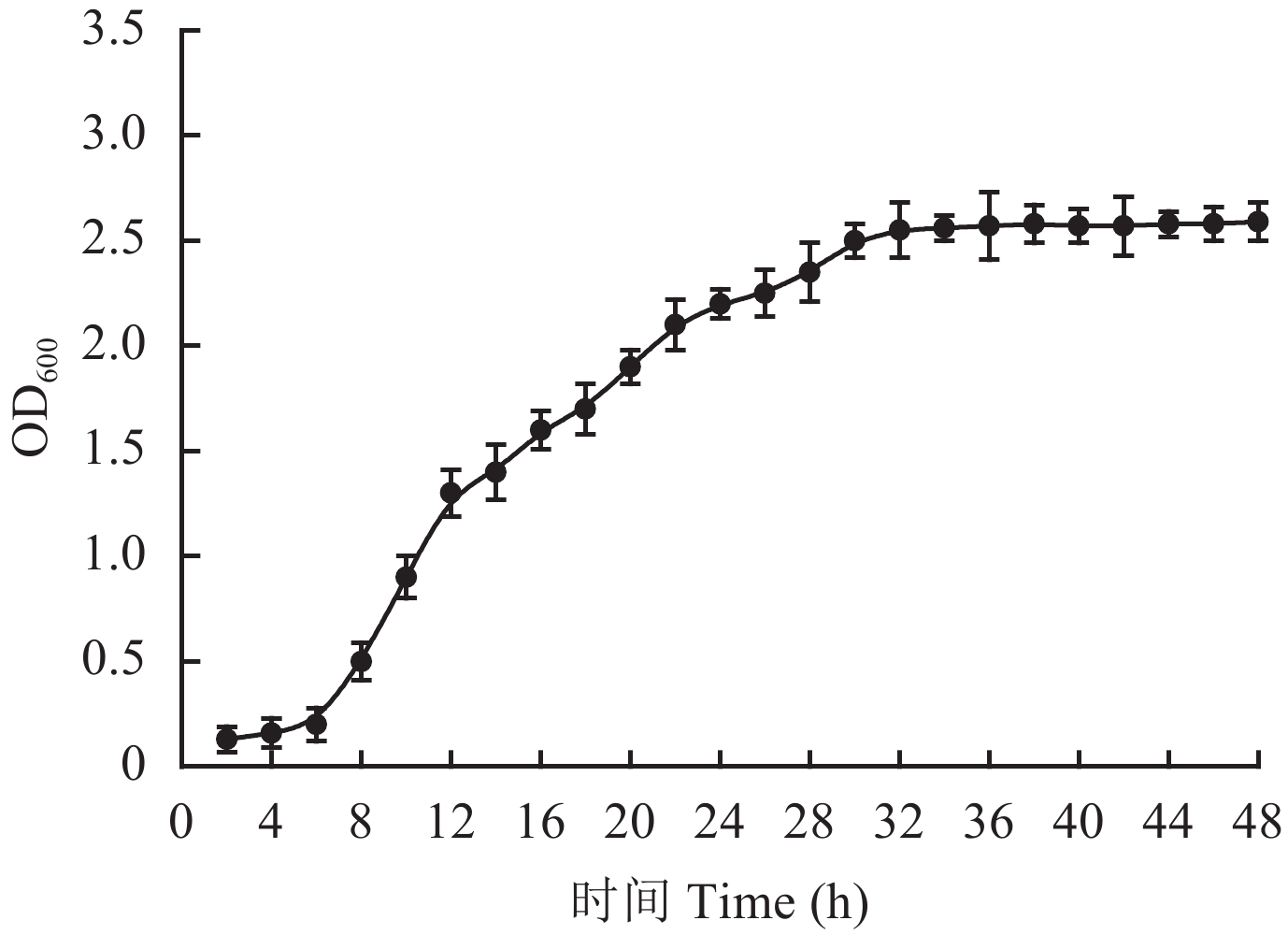 |
| 图3 T4生长曲线 Fig. 3 Growth curve of T4 |
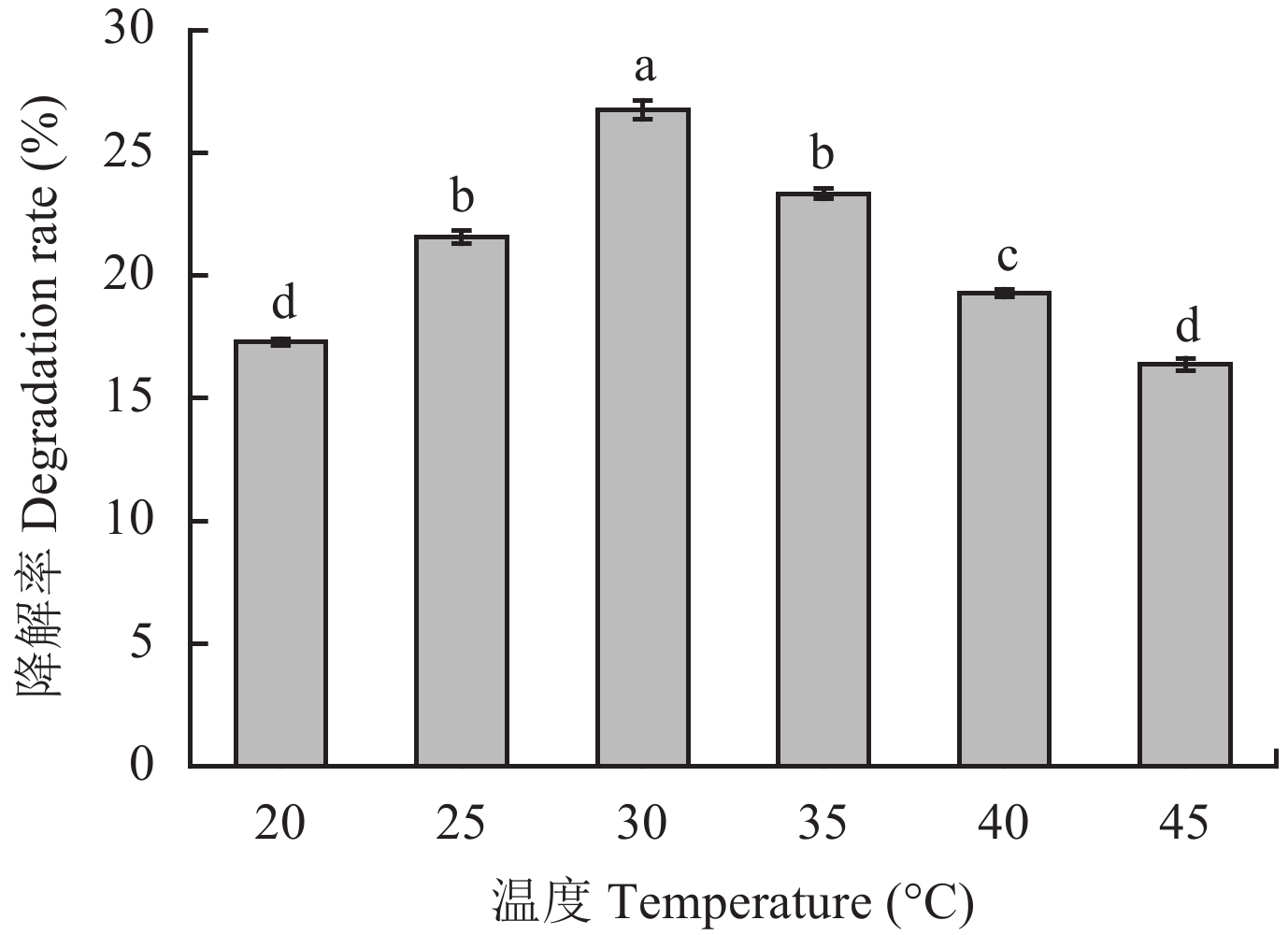 |
| 图4 温度对T4降解土霉素的影响 Fig. 4 Effect of temperature on the degradation of oxytetracycline by T4 [注(Note):柱上不同字母表示不同湿度间差异达5%显著水平 Different letters above the bars mean significant difference at the 5% level among different temperatures.] |
将T4菌接种于筛选培养基中,在不同的温度下遮光振荡培养7 d。由图4可知,T4菌对土霉素的降解率随温度的升高先增加后减小。20℃时降解率为17.29%,随着温度的上升,土霉素降解率逐渐升高,30℃时降解率最高,达到了26.75%,之后降解率随着温度的升高而下降,45℃时降解率下降到16.38%。因此适宜的培养温度是30℃。
2.4.2 pH对菌株降解土霉素效果的影响不同pH培养条件下,T4菌对土霉素的降解效果如图5所示。当培养基pH值较低时,随着pH值的升高,T4对土霉素的降解率也随之增加,pH值为3时降解率为13.68%,当pH上升至7.0时降解率增至27.03%;当培养基pH大于7.0时,菌株对土霉素的降解能力随pH的升高逐渐减小,pH为10.0时的降解率为21.66%,pH值为7.0时降解效果最佳,且与培养基的初始pH值相一致。
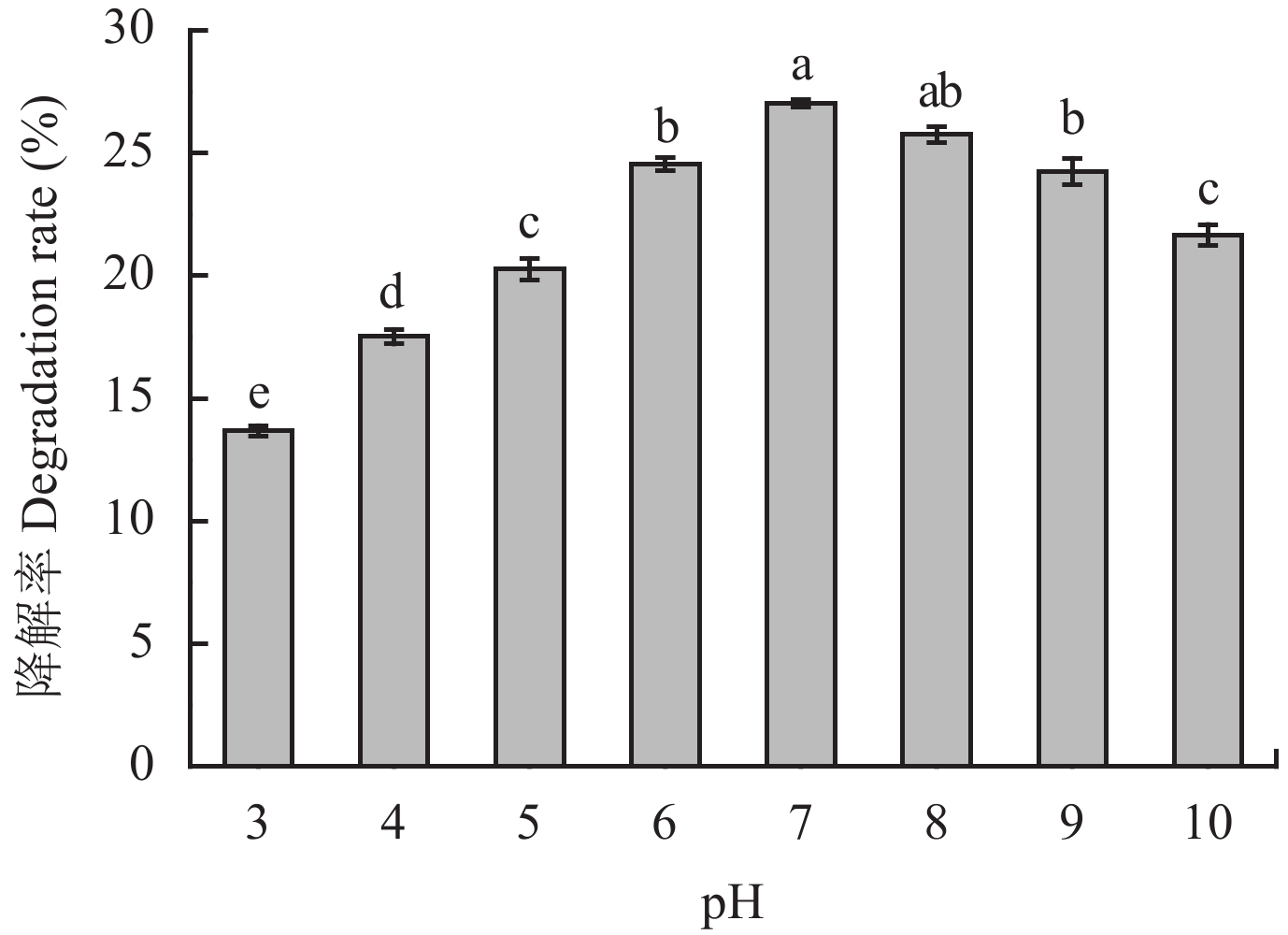 |
| 图5 pH对T4降解土霉素的影响 Fig. 5 Effect of pH on the degradation of oxytetracycline by T4 [注(Note):柱上不同字母表示不同pH值间差异达5%显著水平 Different letters above the bars mean significant differeace at the 5% level among different pH values.] |
由图6可知,T4菌对土霉素的降解效果随着转速的提高先增大后减小,所有处理中T4菌对土霉素的降解率均在20%以上。其中,当转速为150 rpm和170 rpm时T4菌对土霉素的降解率显著高于其他处理,分别为26.18%和25.59%。考虑到摇床高转速耗能高的限制,选择150 rpm作为优化的转速。
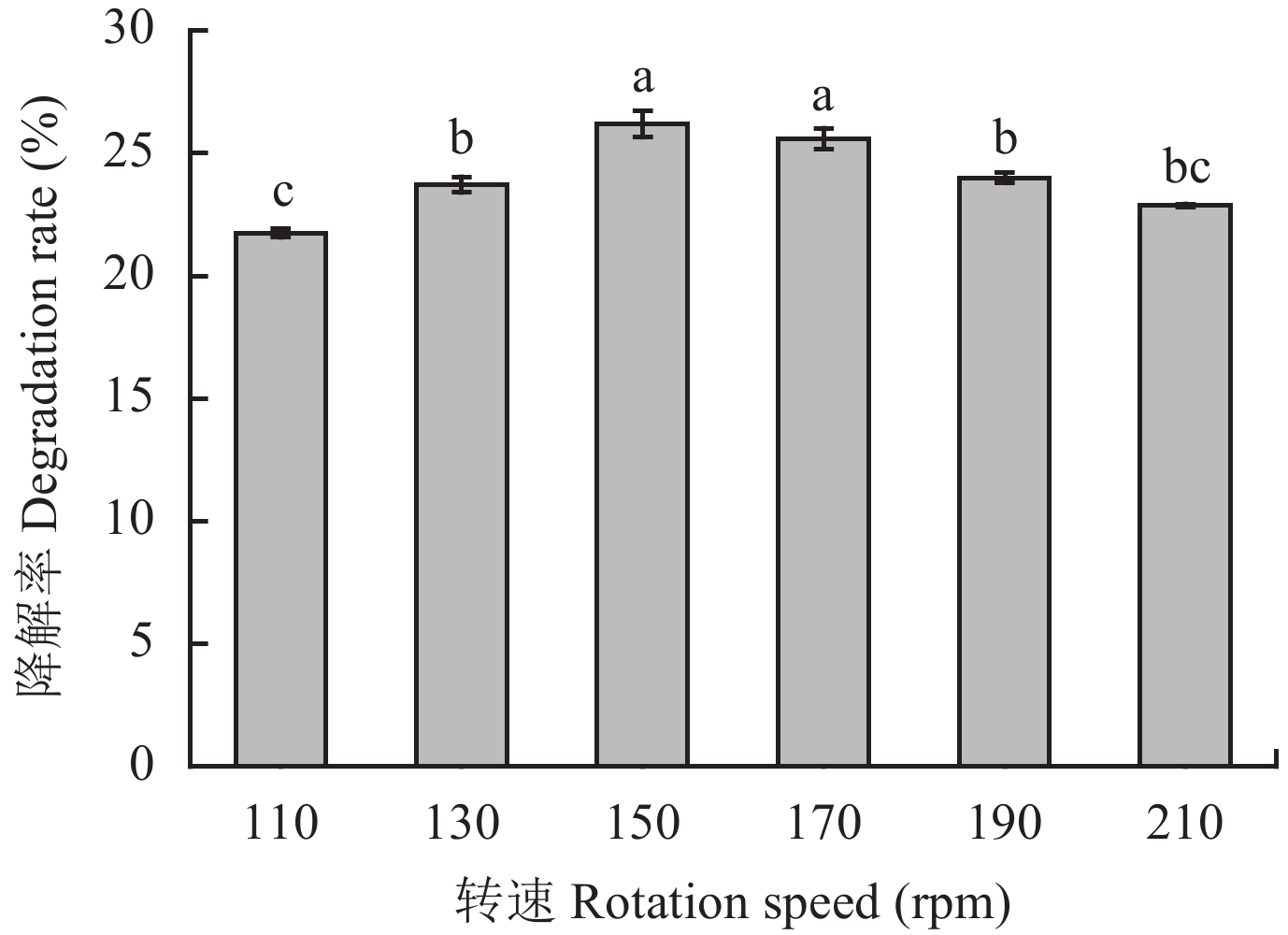 |
| 图6 转速对T4降解土霉素的影响 Fig. 6 Effect of rotation speed on the degradation of oxytetracycline by T4 [注(Note):柱上不同字母表示不同转速间差异达5%显著水平 Different letters above the bars mean significant difference at the 5% level among different rotation speed.] |
图7表明,接种量为1%时降解率为26.68%,随着接种量增加,T4菌对土霉素的降解率略有下降,当接种量增加至10%时降解率减小为23.83%。因此,综合去除率和时间成本,选择1%作为T4降解土霉素的适宜接种量。
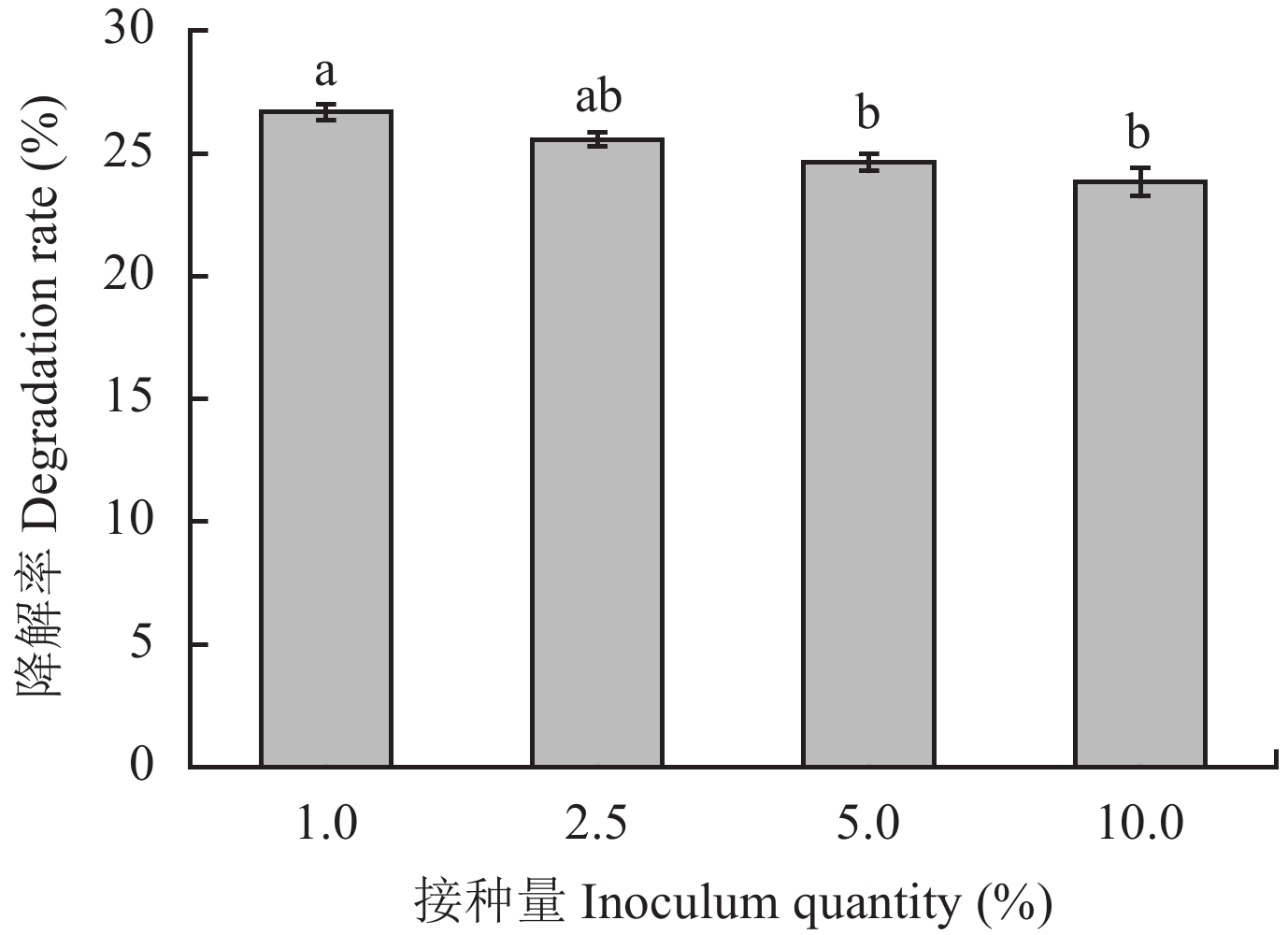 |
| 图7 接种量对T4降解土霉素的影响 Fig. 7 Effect of bacterium quantity on the degradation of oxytetracycline by T4 [注(Note):柱上不同字母表示不同接种量间差异达5%显著水平 Different letters above the bars mean significant difference at the 5% level among different inoculum quantities.] |
由前面的试验结果可知,T4菌对土霉素降解效果的优化条件为温度30 ℃、pH 7.0、转速150 rpm、接种量1%。在优化的条件下,添加100 mg/L土霉素培养T4降解菌7 d之后,测得T4菌对土霉素的降解率为26.29%。
2.4.6 土霉素降解菌堆肥试验结果由图8可知,在只加入了土霉素而没有加入T4菌的OTC处理中,试验结束土霉素的去除率为81.25%,而加入了T4菌的OTC + T4处理在试验结束之后,其土霉素的去除率达到了93.21%,与OTC处理相比增加了11.96个百分点。由此可见,加入了T4菌后,土霉素的去除率有所提高,说明T4菌对于土霉素的进一步去除能够起到促进作用,进而降低土霉素残留。
 |
| 图8 堆肥中土霉素随时间的降解率 Fig. 8 Degradation of oxytetracycline with composting time |
近年来,关于土霉素的研究报道越来越多。有报道称采用堆肥技术可以降解畜禽粪便中的土霉素,但其降解时间相对较长,而对土霉素微生物降解的研究报道比较少。有研究表明,通过添加芽孢杆菌复合制剂到畜禽粪便中可以有效促进四环素类抗生素的降解[25]。本研究分离筛选的T4菌,经鉴定为假单胞菌 (Pseudomonas sp.)。有报道显示,假单胞菌能够有效降解有机磷农药[26]、二氯酚[27]、毒死蜱[28–29]等有机污染物,而对土霉素的降解尚未见报道。有一些报道分离筛选得到部分土霉素降解菌,例如,从生产土霉素生产厂污水池底泥中分离得到一株能高效降解土霉素的蜡样芽孢杆菌 (Bacillus cereus),最高可降解200 mg/L土霉素[30];在之后进行的菌株降解功能验证以及菌株降解活性测定的试验中,进一步验证了之前的结论。从长期受四环素类抗生素污染的土壤中筛选获得一株高效降解菌Achromobacter xylosoxidans,对60 mg/L土霉素的降解率最高,达66.3%[14]。本研究筛选得到的土霉素降解菌对100 mg/L土霉素降解率相对较低,可能与土霉素添加量和菌株降解特性有关。
从本试验结果看,温度对微生物的新陈代谢有很明显的调控作用,温度过低或过高都会抑制微生物的生长,导致生长量较低,从而影响对土霉素的降解效果。pH也是影响微生物降解抗生素的主要因素之一。pH值太低或者太高都不利于T4菌对土霉素的降解,因为太酸性或太碱性的环境都对T4菌的新陈代谢产生了抑制,其内部的生化环境、菌体微观结构、酶的活性都会发生相应的改变以此来适应外部环境的改变,进而影响到T4菌菌体的生长,导致土霉素的降解受到影响。可以看到,当pH大于7.0并逐渐提高时,土霉素的降解率相对酸性条件下较低,这可能与土霉素在酸性条件下结构不稳定引起化学降解有关,此时部分土霉素C环破裂,形成内酯型异构体,无法被检测出[30]。转速对土霉素降解也会有影响。因为转速能够为T4菌在降解土霉素的过程中提供所需的氧气,促进T4菌的生长,从而促进其对土霉素的降解。转速太低或是太高都会产生不利的影响,转速太低可能无法为其提供充足的氧气;转速太高,可能又会导致菌体结构发生改变,影响其对土霉素的降解。接种量也是影响T4菌降解土霉素的一个因素,这可能是因为培养液里面的菌体之间会因为争夺营养物质而产生竞争关系,从而影响其对土霉素的降解。
土霉素微生物降解研究目前仍处于起步阶段,降解菌株缺乏,代谢机制以及实际应用的开展等方面都还有很多的工作需要去做。本研究筛选得到的T4菌株对土霉素有较好的降解作用,具有潜在的实际使用价值,为进一步找到土霉素生物降解酶打下了基础,此外,继续通过分子生物学方法探明菌株的降解基因,使其在微生物转录和翻译中进行表达,将成为降解环境中土霉素的新方向,具有很好的潜在开发利用价值。
4 结论1) 本研究得到一株能够较好降解土霉素的菌株T4,通过16S rDNA基因序列分析,鉴定属于假单胞菌 (Pseudomonas sp.)。
2) 实验室条件下,T4菌对土霉素降解效果最佳的生长条件为温度30℃、pH 7.0、转速150 rpm、接种量1%。在该条件下培养降解菌7 d,对100 mg/L土霉素的降解率为26.29%。
3) 堆肥试验表明,与对照相比,添加了T4菌的处理对土霉素去除有促进作用。
| [1] | Sassman S A, Lee L S. Sorption of three tetracyclines by several soils: Assessing the role of pH and cation exchange[J]. Environmental Science & Technology, 2005, 39(19): 7452–7459. |
| [2] | Kumar K, Gupta S C, Baidoo S K, et al. Antibiotic uptake by plants from soil fertilized with animal manure[J]. Journal of Environmental Quality, 2005, 34(6): 2082–2085. DOI:10.2134/jeq2005.0026 |
| [3] |
余伯良. 减少使用抗生索饲料添加剂的途径[J].
黑龙江畜牧兽医, 1998, (4): 21–22.
Yu B L. Pathways of reduce the use of antibiotics feed additive[J]. Heilongjiang Animal Science and Veterinary Medicine, 1998, (4): 21–22. |
| [4] | Zhou L J, Ying G G, Liu S, et al. Occurrence and fate of eleven classes of antibiotics in two typical wastewater treatment plants in South China[J]. Science of the Total Environment, 2013, 452–453(5): 365–376. |
| [5] | Pankaj K, Rossman F G, Diana S A. Investigating the molecular interactions of oxytetracycline in clay and organic matter: insights on factors affecting its mobility in soil[J]. Environmental Science & Technology, 2004, 38(15): 4097–4105. |
| [6] | Halling-Sørensen B. Algal toxicity of antibacterial agents used in intensive farming[J]. Chemosphere, 2000, 40(7): 731–739. DOI:10.1016/S0045-6535(99)00445-2 |
| [7] | Jjemba P K. The potential impact of veterinary and human therapeutic agents in manure and biosolids on plants grown on arable land: a review[J]. Agriculture, Ecosystems & Environment, 2002, 93(1): 267–278. |
| [8] |
赵红梅, 金升藻. 滥用抗生素对人畜的危害及对策研究[J].
国外医药抗生素分册, 2003, 24(4): 164–167.
Zhao H M, Jin S Z. The study of abuse of antibiotics and countermeasures to the harm of human and animal[J]. World Notes on Antibiotics, 2003, 24(4): 164–167. |
| [9] | Sims J T. Agricultural and environmental issues in the management of poultry wastes: recent innovations and long-term challenges[J]. Pediatric Research, 1997, 74(2): 163–169. |
| [10] | Halling-Sørensen B, Norsn S, Lanzky P F, et al. Occurrence, fate and effects of pharmaceutical substances in the environment-a review[J]. Chemosphere, 1998, 36(2): 357–393. DOI:10.1016/S0045-6535(97)00354-8 |
| [11] |
刘更另. 中国有机肥料[M]. 北京: 中国农业出版社, 1992.
Liu G L. Organic fertilizer in China[M]. Beijing: China Agriculture Press, 1992. |
| [12] |
周启星, 罗义, 王美娥. 抗生素的环境残留、生态毒性及抗性基因污染[J].
生态毒理学报, 2007, 2(3): 243–251.
Zhou Q X, Luo Y, Wang M E. Environment residue ecological toxicity and antibiotics resistance gene pollution of antibiotics[J]. Ecological Toxicology Report, 2007, 2(3): 243–251. |
| [13] |
王俊峰, 尹尧, 陈玉花, 等. 一株抗生素制药工业废水高效降解菌筛选及生物特性研究[J].
安徽农业科学, 2014, 42(31): 10851–10852.
Wang J F, Yin Y, Chen Y H, et al. Screening and its degrading properties of effective degradation strains for antibiotic production wastewater treatment[J]. Journal of Anhui Agricultural Science, 2014, 42(31): 10851–10852. |
| [14] |
赵永斌. 3种四环素类抗生素降解菌的筛选及降解特性的研究[D]. 太谷: 山西农业大学硕士学位论文, 2015.
Zhao Y B. The selection of 3 tetracycline to degrading bacteria and the character research of isolation and degrading[D]. Taigu, Shanxi: MS Thesis of Shanxi Agricultural University, 2015. |
| [15] |
刘婷婷, 董昆明, 缪莉, 等. 联苯菊酯降解菌的筛选、鉴定及降解特性研究[J].
农业环境科学学报, 2012, 31(6): 1147–1152.
Liu T T, Dong K M, Miu L, et al. Isolation, identification and biodegradation characteristics of a bacterial strain able to degrade Bifenthrin[J]. Journal of Agro-Environment Science, 2012, 31(6): 1147–1152. |
| [16] | Esiobu N, Arments L, Ike J. Antibiotic resistance in soil and water environments used for various activities[J]. International Journal of Environmental Research and Public Health, 2002, 12: 133–144. DOI:10.1080/09603120220129292 |
| [17] | Meyers E, Smith D A. Microbiological degradation of tetracyclines[J]. Journal of Bacteriology, 1962, 84(4): 797–802. |
| [18] |
刘力嘉, 谢丽, 张作义, 等. 泰乐菌素高效降解菌的筛选及降解特性研究[J].
农业环境科学学报, 2011, 30(5): 1027–1030.
Liu L J, Xie L, Zhang Z Y, et al. Isolation and degradation characteristics of a tylosin-degrading strain[J]. Journal of Agro-Environment Science, 2011, 30(5): 1027–1030. |
| [19] |
张健, 关连珠. 猪粪中3种四环素类抗生素在土壤中的动态变化及降解途径[J].
植物营养与肥料学报, 2013, 19(3): 727–732.
Zhang J, Guan L Z. Dynamics and mechanism of degradation of three tetracycline antibiotics from pig manures in soil[J]. Journal of Plant Nutrition and Fertilizer, 2013, 19(3): 727–732. |
| [20] |
冯福鑫, 许旭萍, 程群星, 等. 四环素高效降解酵母菌Trichosporon mycotoxinivorans XPY-10降解特性
[J].
环境工程学报, 2013, 7(12): 4779–4785.
Feng F X, Xu X P, Cheng Q X, et al. Degradation characteristics of tetracycline hydrochloride by Trichosporon mycotoxinivorans XPY-10 [J]. Chinese Journal of Environmental Engineering, 2013, 7(12): 4779–4785. |
| [21] | Arikan O A, Mulbry W, Rice C. Management of antibiotic residues from agricultural sources: Use of composting to reduce chlortetracycline residues in beef manure from treated animals[J]. Journal of Hazardous Materials, 2009, 164(2–3): 483–489. |
| [22] |
张长青. 土霉素高效降解菌的筛选及其降解特性研究[D]. 江苏扬州: 扬州大学硕士学位论文, 2009.
Zhang C Q. Isolation and degrading characteristics of oxytetracycline degrading bacteria[D]. Yangzhou, Jiangsu: MS Thesis of Yangzhou University, 2009. |
| [23] |
郭梦婷. 高土霉素残留猪粪的高效好氧堆肥技术研究[D]. 杭州: 浙江工商大学硕士学位论文, 2011.
Guo M T. The highly effective technology of aerobic compost of pig manure with high oxytetracycline[D]. Hangzhou: MS Thesis of Zhejiang Gongshang University, 2011. |
| [24] |
鲍艳宇. 四环素类抗生素在土壤中的环境行为及生态毒性研究[D]. 天津: 南开大学博士后出站报告, 2008.
Bao Y Y. Environmental behavior and eco-toxicity of tetracycline antibiotics in soils[D]. Tianjin: Postdoctoral Report of Nankai University, 2008. |
| [25] |
张树清, 张夫道, 刘秀梅, 等. 高温堆肥对畜禽粪中抗生素降解和重金属钝化的作用[J].
中国农业科学, 2006, 39(2): 337–343.
Zhang S Q, Zhang F D, Liu X M, et al. Degradation of antibiotics and passivation of heavy metals during thermophile composting process[J]. Scientia Agricultura Sinica, 2006, 39(2): 337–343. |
| [26] |
陈亚丽, 张先恩, 刘虹, 等. 甲基对硫磷降解菌假单胞菌WBC-3的筛选及其降解性能的研究[J].
微生物学报, 2002, 42(4): 490–497.
Chen Y L, Zhang X E, Liu H, et al. Study on Pseudomonas sp.WBC-3 capable of complete degradation of methylparathion [J]. Acta Microbiologica Sinica, 2002, 42(4): 490–497. |
| [27] |
戴树桂, 庄源益, 陈勇生, 等. 两种假单孢菌中二氯酚降解酶活性及其定域研究[J].
环境科学学报, 1996, 16(2): 173–178.
Dai S G, Zhuang Y Y, Chen Y S, et al. Study on enzyme activity and distribution in two strains of bacteria by dichlorophenol degradation[J]. Acta Scientiae Circumstantiae, 1996, 16(2): 173–178. |
| [28] |
吴祥为, 花日茂, 操海群, 等. 毒死蜱降解菌的分离鉴定与降解效能测定[J].
环境科学学报, 2006, 26(9): 1433–1439.
Wu X W, Hua R M, Cao H Q, et al. Isolation, identification and degradation-efficiency measurement of chlorpyrifos degrading bacteria[J]. Acta Scientiae Circumstantiae, 2006, 26(9): 1433–1439. |
| [29] |
周淑云. 毒死蜱高效降解菌的分离鉴定及其生物学特性研究[D]. 重庆: 西南大学硕士学位论文, 2006.
Zhou S Y. Isolation and identification of chlorpyrifos-degrading bacterium and its biological characters[D]. Chongqing: MS Thesis of Southwest University, 2006. |
| [30] |
王志强, 张长青, 王维新. 土霉素降解菌的筛选及其降解特性研究[J].
中国兽医科学, 2011, 41(5): 536–540.
Wang Z Q, Zhang C Q, Wang W X. Isolation and characterization of an oxytetracycline degrading bacterium[J]. Chinese Veterinary Science, 2011, 41(5): 536–540. |
 2018, Vol. 24
2018, Vol. 24  doi:
doi: 

