2. 中国农业大学农学与生物技术学院,北京 100193;
3. 新疆农业科学院哈密瓜研究中心, 乌鲁木齐 830091
2. College of Agronomy and Biotechnology, China Agricultural University, Beijing 100193, China;
3. Hami Melon Research Center, Xinjiang Academy of Agricultural Sciences, Urumqi 830091, China
氮素是作物生理代谢和生长的关键限制因子[1], 氮肥在提高粮食作物单产中发挥了极其重要的作用。氮肥的施用量约占总施肥量的2/3,但利用率不足40%。过量施用氮肥不仅加剧了氨挥发和反硝化产生的温室气体的排放,而且由于氮淋失加剧了富营养化[2-4]。禾本科‖豆科间作系统中,豆科作物能与根瘤菌 (Rhizobium) 形成根瘤固定大气氮而减少氮肥施入被认为是农业可持续发展的重要模式之一[5]。禾豆间作模式在我国广泛分布,如东北及华北的玉米‖大豆[6]、玉米‖花生[7],西北地区的小麦‖大豆[8]、小麦‖蚕豆[9]等。禾本科‖豆科间作系统有利于植株对氮素的合理利用,降低植株对土壤氮素的需求。同时,豆科作物可以向禾本科转移一定量的氮素,禾本科作物对氮的竞争作用使得豆科作物根瘤量得以增加,从而提高了豆科作物的固氮效率[10-11]。前人已从施氮水平[12]、作物密度[13]、种间根系的作用程度[14]等方面来研究和提高间作体系中豆科作物的固氮能力,且采用15N同位素技术直接测定间作系统中豆科作物的固氮特性及氮素转移规律。但此种受益程度在豆科作物品种间和作物组合间存在很大的差异。用15N叶片富积标记方法试验证明,大麦‖豌豆系统中,豌豆体内的氮素有11%转移到了大麦植株体内[11]。在不同氮肥施用处理下花生体内的氮素分别有9.93%、5.65%、4.22%转移到了水稻植株体内[14]。
花生作为重要的豆科作物之一,年固氮量为27~206 kg/hm2[15],近年来,关于花生的研究主要集中在水分养分高效利用[15]、光合特性[16]、铁营养[17]等方面,而关于花生固氮特征及其在间作系统中氮素利用和转移规律的研究甚少,且多集中于花生与玉米、水稻间作系统中[17-18]。吉林白城地区属于典型的农牧交错带,燕麦 (Avena L.) 的成功引入,可以发挥残茬优势,减少冬春季节因地表裸露导致的空气扬尘。但该区域对燕麦的研究主要集中在种质资源评价、光合特性、水肥生理、抗逆性及饲用价值等方面[19-21],有关燕麦能否通过对土壤氮的竞争影响花生的固氮作用,所固定的氮素能否向燕麦发生转移,进而提高资源利用效率等研究的报道甚少。为此,本文以燕麦‖花生间作系统为研究对象,在大田设计微区试验,利用15N同位素标记技术,研究单作和间作系统中花生的根瘤固氮酶活性和固氮量差异,及单作和间作对氮素吸收利用效率的影响。旨在阐明在不施用氮肥条件下,间作系统中花生的固氮能力与氮素吸收利用效率的关系,为充分挖掘豆科作物固氮潜力,评价间作体系中花生对燕麦氮营养的贡献,以及为优化间作系统的氮素营养调控提供理论依据及实践基础。
1 材料与方法 1.1 试验地概况田间试验位于吉林省白城市白城农业科学院 (45°37′N、122°48′E),所在区域属温带大陆性季风气候区,年均气温4.9℃,年均日照时数2919.4 h,年均降水量407.9 mm,无霜期157 d,供试土壤为砂壤土,pH值6.9,试验开始前测定的耕层 (0—20 cm) 土壤主要理化性质如下:有机质14.30 g/kg、全氮1.85 g/kg、碱解氮117.40 mg/kg、有效磷95.90 mg/kg、速效钾93.30 mg/kg。前茬作物为高粱。
1.2 试验设计本试验采用随机区组设计,共设3个处理,包括燕麦单作、花生单作、燕麦和花生间作,小区面积28 m2(4 m × 7 m),重复4次。为保证花生充分结瘤,将种子用根瘤菌拌种 (购自宁夏诺德曼公司)。各处理均不施用氮肥,基施P2O5 55 kg/hm2、K2O 45 kg/hm2、硫酸亚铁4.5 kg/hm2、硼酸1.0 kg/hm2、钼酸钠1.5 kg/hm2。单作燕麦条播,播种量为150 kg/hm2,播种行距30 cm。单作花生播种行距为60 cm,穴距为20 cm,穴留2株。间作体系中种植比例为2∶2,即2行燕麦和2行花生,燕麦和花生间距20 cm,间作燕麦、花生行距和播量同单作 (图1)。
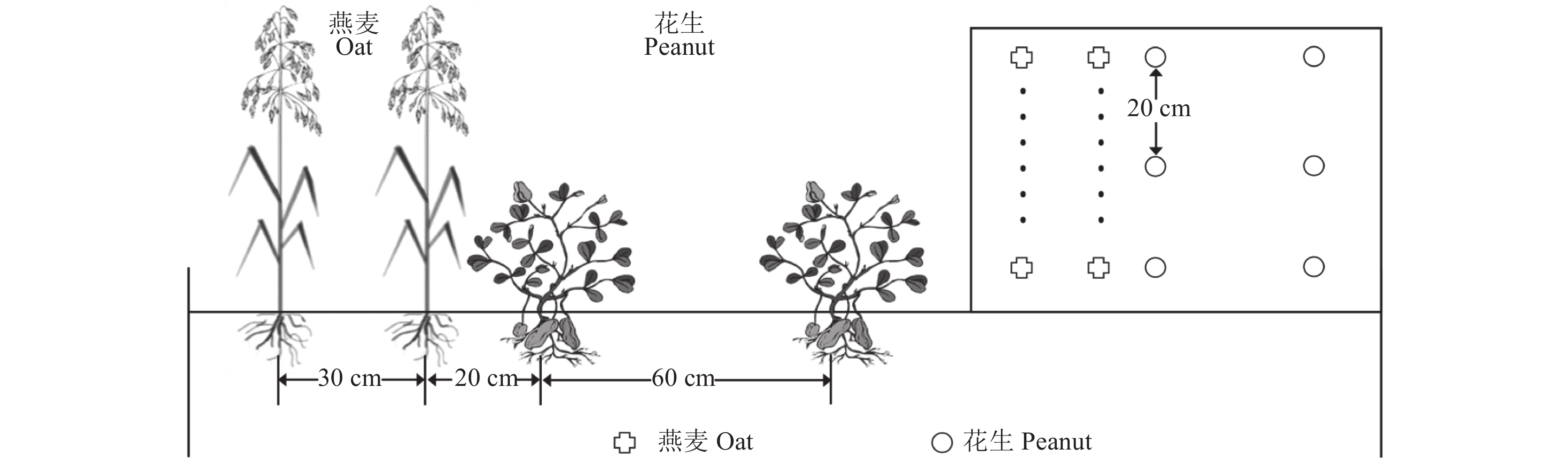 |
| 图1 燕麦花生间作田间示意图 Fig. 1 Oat and peanut intercropping in the field |
供试燕麦品种为白燕2号,花生为白院花1号,均由白城农业科学院提供。燕麦与花生同时播种,播期为2011年5月17日和2012年5月24日。燕麦收获时间分别为2011年8月12日和2012年8月14日;花生收获时间分别为2011年9月7日和2012年9月16日。田间管理按常规管理进行。
在每个小区设置一个微区,进行15N同位素标记,单作燕麦微区的面积为0.3 m2 (0.6 m × 0.5 m),其他处理的微区面积为0.96 m2 (1.2 m × 0.8 m),每个微区四周用塑料膜与周围隔离,深度为30 cm,利用15N同位素标记 (丰度10.02%),用量约为N 13.5 kg/hm2[22]。
1.3 采样与测定 1.3.1 植株生物量和吸氮量分别在燕麦的拔节期、抽穗期、灌浆期、成熟期,采集40 cm的燕麦样段,花生3穴即6株,去除根系及杂草,于105℃下杀青30 min,80℃烘干至恒重称取干物质重。样品粉碎后,采用H2SO4–H2O2消煮,凯氏定氮法测定样品氮浓度。
1.3.2 根瘤的数量和重量在花生的开花结荚期,各处理随机选取6株,分离地上部和地下部,掘取长30 cm × 宽30 cm × 深30 cm的土体,装入尼龙网袋,清洗根系、收集根瘤并计数,将根瘤表面水分用吸水纸吸干,称重。
1.3.3 根瘤固氮酶活性利用乙炔还原法测定[1],在开花结荚期,将采集、洗净并已称重的根瘤立即装入50 mL的三角瓶,加反口胶塞。用注射器注入5 mL乙炔,于27 ℃无光条件下反应1 h后,抽出5 mL反应后的气体注入1个25 mL真空玻璃瓶中,倒置,待测。抽取100 μL待测气体,用GC14B (FID) 型气相色谱仪测定乙烯含量。测定条件为:柱温80℃,进样口温度100℃,检测器温度150℃,载气 (氮气) 流量50 mL/min,氢气流量50 mL/min,空气流量500 mL/min。
1.3.4 植株15N分析茎叶和籽粒分别称取0.2 g,每个处理4次重复,将5 mL H2SO4、0.15 g CuSO4和1.5 g K2SO4加入到称好样品的消煮管中,摇匀后放置过夜,消煮至清亮,冷却后直接蒸馏;馏出液浓缩3 mL,用Isoprime100同位素质谱仪测定15N丰度。
1.3.5 计算方法植株atom%15N excess=标记植株atom15N% –对照植株atom 15N%
花生固氮% (%NDFA),即花生固定空气中氮素占植株全氮的百分数[18],单作花生:
| ${\rm{{{\%}}} NDFA} = \left( {1 - \frac{{{\rm{atom{{\%}} }}{}_{}^{15}{\rm{N}}\;{\rm{excess}}\;{\text{单作花生}}}}{{{\rm{atom{{\%}} }}{}_{}^{15}{\rm{N}}\;{\rm{excess}}\;{\text{单作燕麦}}}}} \right) \times 100$ |
间作花生:
| ${\rm{{{\%}} NDFA}} = \left( {1 - \frac{{{\rm{atom{{{\%}}} }}{}_{}^{15}{\rm{N}}\;{\rm{excess}}\;{\text{间作花生}}}}{{{\rm{atom{{\%}} }}{}_{}^{15}{\rm{N}}\;{\rm{excess}}\;{\text{单作燕麦}}}}} \right) \times 100$ |
花生固氮量=花生植株含氮量 × %NDFA
花生向燕麦的氮转移[10]:
| $\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!{\rm{{{\%}}NTFL}} = 1 - \frac{{{\rm{atom{{\%}} }}\;{}_{}^{15}{\rm{N}}\;{\rm{excess}}\;{\text{间作燕麦}}}}{{{\rm{atom{{\%}} }}\;{}_{}^{15}{\rm{N}}\;{\rm{excess}}\;{\text{单作燕麦}}}} \text{;}$ |
| ${\rm{{{\%}} N}}\;{\rm{transferred}} \!= \!\! \left( {1 \!\!-\! \frac{{{\rm{atom{{\%}}}}{}_{}^{15}{\rm{N}}\;{\rm{excess}}\;{\text{间作燕麦}}}}{{{\rm{atom{{\%}}}}{}_{}^{15}{\rm{N\;excess}}\;{\text{单作燕麦}}}}} \right)\\ \quad\quad\quad\quad\quad \times 100$ |
| $\begin{aligned}{\rm{N}}\;{\rm{transfer}}\left( {{\rm{g}}/{\rm{plant}}} \right) \!=\! & \frac{{{\rm{{{\%}} }}\;{\rm{N}}\;{\rm{transferred}}}}{{100}}{\rm{}} \!\! \times \!\!{\begin{array}{c} {{\rm{Total}}\;{\rm{N}}}\\{\left( {\text{间作燕麦}}\right)} \end{array}}\end{aligned}$ |
采用Microsoft Excel 2010 整理数据,用SPSS 13.0 软件进行数据的统计分析,利用单因素方差分析 (One-way ANOVA) 和最小显著性差异法 (Least Significant Difference, LSD) 检验样本平均数差异的显著性。
2 结果与分析 2.1 间作对作物干物质积累量的影响随着生育进程的推移,燕麦和花生的地上部干物质积累量呈现逐渐增加的趋势 (图2)。与单作燕麦相比,间作提高了燕麦的地上部干物质积累量,尤其在成熟期,间作燕麦地上部干物质积累量比单作两年分别提高40.2%和40.9%。然而间作对花生干物质积累的影响与燕麦有所不同,与单作相比,成熟期间作花生的干物质积累量与单作相比分别下降17.9%和23.3%,达到显著差异水平 (P < 0.05)。以上结果表明燕麦和花生间作能够促进燕麦生长,但在一定程度上抑制了花生的生长。
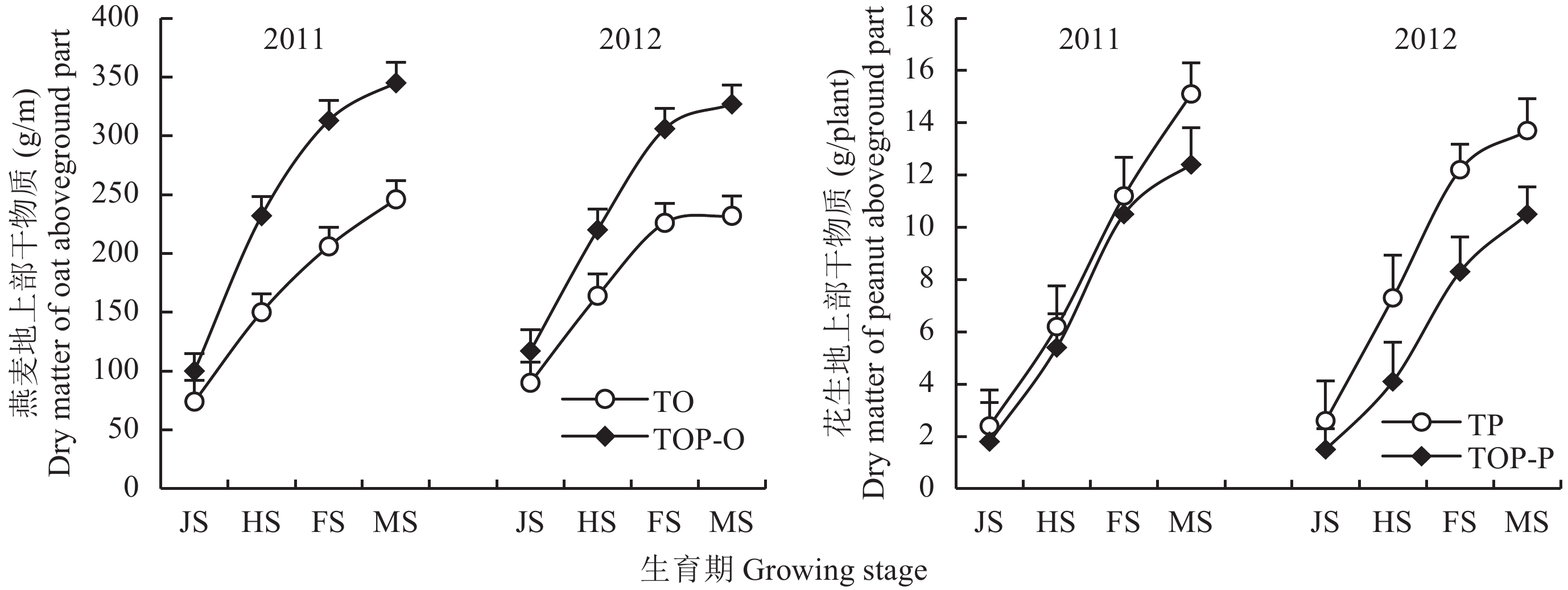 |
| 图2 不同种植方式作物各生育期地上部干物质积累量 Fig. 2 Dry matter accumulation amount of aboveground part in different growing stage under different cropping pattern [注(Note):TO—单作燕麦Oat monocropping; TP—单作花生Peanut monocropping; TOP-O—与花生间作的燕麦Oat intercropped with peanut; TOP-P—与燕麦间作的花生Peanut intercropped with oat; JS—拔节期Jointing stage; HS—抽穗期Heading stage; FS—灌浆期Filling stage; MS—成熟期Maturation stage.] |
随着生育进程的推移,燕麦和花生的地上部氮素积累量基本上表现为逐渐增加的趋势,在成熟期达到最大值 (图3)。与单作相比较,间作处理显著提高了成熟期燕麦的氮素积累量 (P < 0.05),2011年和2012年分别增加了53.1%和44.8%,但降低了花生的地上部氮素积累量。且在2012年抽穗期后表现出显著差异 ( P < 0.05)。
 |
| 图3 间作对作物地上部氮素积累量的影响 Fig. 3 Effect of the intercropping on nitrogen accumulation content of oat and peanut in aboveground part [注(Note):TO—单作燕麦Oat monocropping; TP—单作花生Peanut monocropping; TOP-O—与花生间作的燕麦Oat intercropped with peanut; TOP-P—与燕麦间作的花生Peanut intercropped with oat; JS—拔节期Jointing stage; HS—抽穗期Heading stage; FS—灌浆期Filling stage; MS—成熟期Maturation stage.] |
在花生开花结荚期,间作显著降低了花生的根瘤数,2011年和2012年分别降低23.8%和18.8%;间作也降低了花生的根瘤重,2011年和2012年分别降低19.6%和14.0%,且在2011年表现出显著差异 (P < 0.05)( 图4)。间作降低了花生根瘤的单位质量固氮酶活性,两年分别降低27.2%和25.1%,差异达显著水平 (P < 0.05)。此外,2012年花生的根瘤单位质量固氮酶活性高于2011年。
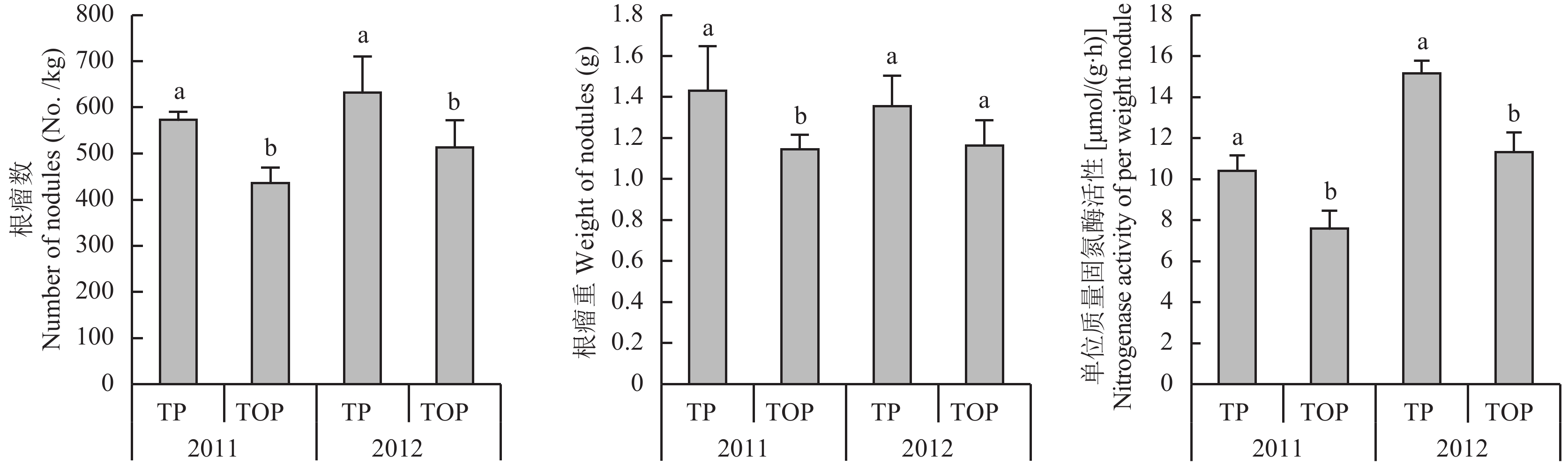 |
| 图4 间作对花生结瘤固氮的影响 Fig. 4 Effect of the intercropping on characters of nodulation and nitrogen-fixation of peanut [注(Note):TP—单作花生Peanut monocropping; TOP-P—与燕麦间作的花生Peanut intercropped with oat. 柱上不同字母表示同一年份不同处理间差异达显著水平Different letters above the bars indicate significant differences at the 0.05 probability level in the same year.] |
固氮酶活性只能反映植株根瘤某一时刻的状态,受环境因素影响较大。而同位素稀释法可以测定植株整个生育时期的表现。两年的数据均表明,花生成熟期,与单作相比,间作提高了花生的固氮效率,两年分别为10.3% 和37.1% (图5),且在2012年,与单作相比差异显著 (P < 0.05)。
在花生生理成熟期,利用15N同位素测定了花生的固氮量,结果表明,与单作相比,间作降低了花生的生物固氮量,两年分别降低了52.3%和26.3%,这是由于花生与燕麦间作模式下,花生的生长受到严重限制,光合作用受限,尽管较单作具有较高的固氮效率,但因其干物质及氮素积累远低于单作花生,使得其生物固氮量显著低于单作花生,另外,2012年单作花生的生物固氮量低于2011年。
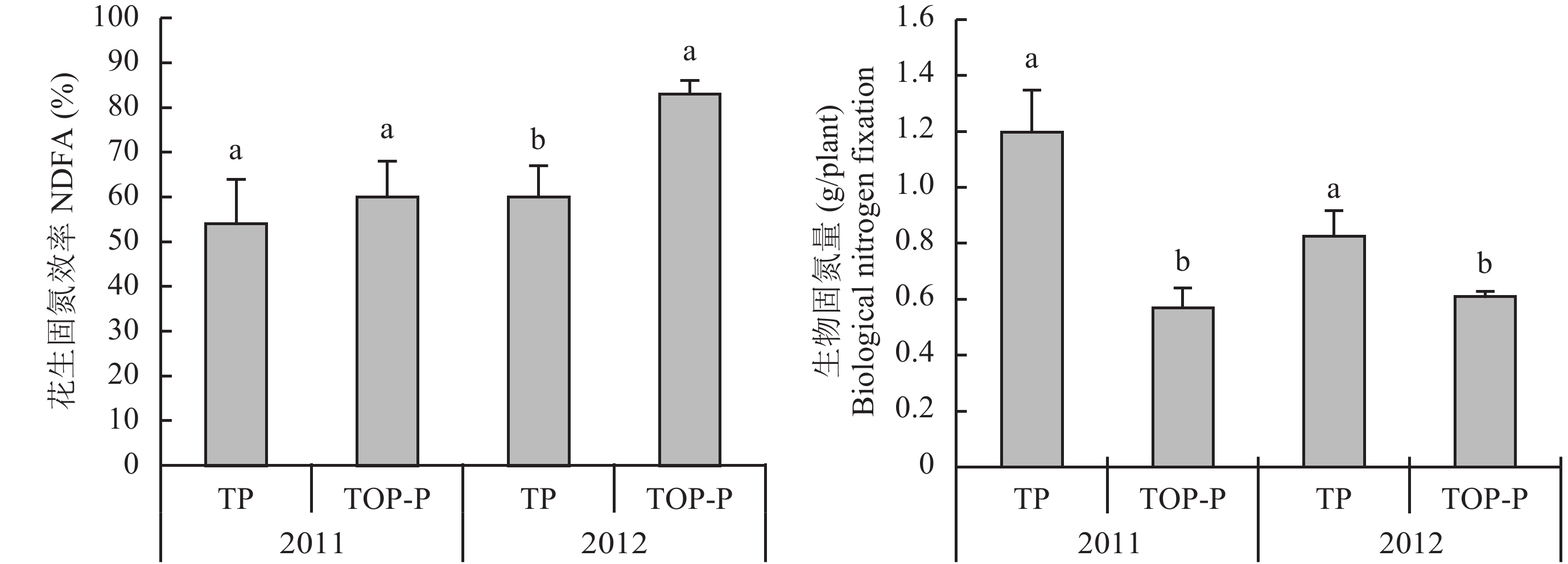 |
| 图5 间作对花生固氮效率和生物固氮量的影响 Fig. 5 Effect of the intercropping on NDFA and biological nitrogen fixation of peanut [注(Note):TP—单作花生Peanut monocropping; TOP-P—与燕麦间作的花生Peanut intercropped with oat. 柱上不同字母表示同一年份不同处理间差异达显著水平Different letters above the bars indicate significant differences at the 0.05 probability level in the same year.] |
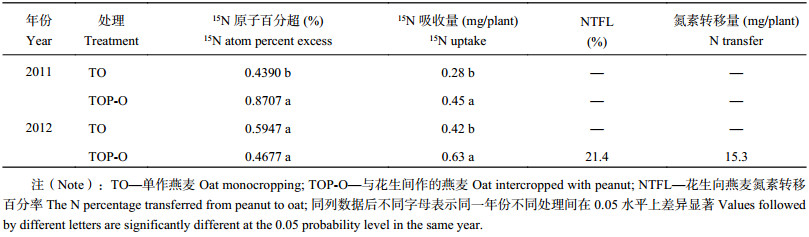
表1结果表明,2011年和2012年间作燕麦的15N吸收量均高于单作燕麦,因此未表现出豆科作物向燕麦的转移。这可能是由于氮转移及氮节约效应同时存在,相互抵消,15N同位素稀释法掩盖了真实的氮转移。而2012年间作燕麦从花生获得的氮量为15.3 mg/plant,约占单株花生固氮量的2.5%。此外,2012年间作燕麦从花生获得的氮量占其总氮积累量的21.4%,氮转移量可能来源于当季花生所固定的氮及上年花生残留于土壤中的氮。
| 表1 间作系统中花生向燕麦的转移 Table 1 Nitrogen transfer from peanut to oat in the intercropping system. |
 |
在燕麦和花生间作系统中,间作燕麦生物量和氮素积累量在整个生育期高于单作,表明燕麦-花生共生期间,燕麦对氮资源的利用始终处于优势地位,花生处于劣势地位,其原因可能是花生的根系死亡分解释放的养分被间作燕麦吸收利用[10]。另一方面,花生可利用自身的共生固氮作用,将固定的氮素直接传递给燕麦。前人在研究水稻‖花生和燕麦‖豌豆系统时也得出相同的结果[18, 23]。而间作花生的根瘤数、根瘤重、地上部生物量及氮素积累量表现出相反的趋势,这可能是由于间作条件下花生向地下部同化能力下降,向地上部输送的物质和能量减少导致的。前人研究表明,间作系统中由于高位作物燕麦的遮荫作用,花生在弱光环境下光合产物优先向地上部分分配,以获取更多的光能进行同化作用[24],这一结果与本研究结果一致。然而也有研究发现,在玉米‖蚕豆间作系统和玉米‖花生系统中,间作均增加了豆科作物的根瘤重[25-26],豆科作物与根瘤菌共生形成的根瘤能够固定大气中的氮素,这是一种经济有效的氮素获取方式。众多研究发现,间作促进了根瘤内固氮酶的合成和活性的发挥,使得单株的固氮酶活性增加[18, 27],本试验结论与之相反,间作降低了花生单位质量的根瘤固氮酶活性,在非豆科与豆科的间作系统中,由于非豆科作物较高,容易造成对豆科作物的遮荫作用,遮荫能降低光合速率,进而减少寄主向根瘤运输的碳水化合物数量,降低了根瘤固氮酶活性[28]。2012年间作系统中根瘤的固氮酶活性显著高于2011年,其原因可能与温度和土壤水分有关[28]。本研究结果也表明,间作提高了豆科的固氮效率,在其他系统中也证实了这一点,如玉米‖豌豆间作系统中豌豆的固氮效率提高了35%[29],玉米‖豇豆间作系统中,间作豇豆的固氮效率高于单作[30]。然而,由于花生植株矮小,长期受抑制得不到有效恢复,尽管具有较高的固氮效率,其固氮量依然低于单作花生。因此为了增加间作系统中豆科作物的固氮量,应采取一定措施避免豆科作物生长长期受抑制 (如选择耐荫的花生品种)。
3.2 间作系统中氮素的转移豆科固定的氮向禾本科的转移是豆禾间作系统中氮高效利用的一种重要机制[24]。一般认为,土壤肥力低时豆科作物的固氮效率较高[31],本研究结果也证实了这一点,由于本试验在不施用氮肥的条件下进行,同时本研究得出间作系统中花生的15N丰度高于单作系统,这与Ofosu-Budu等研究高梁间作系统的结果相反[32],其认为间作高粱的15N丰度值低于单作高粱,是由于豆科作物能够固定空气中氮并转移到高粱体内,15N稀释的原因造成的。2011年通过15N同位素稀释法未能测定出豆科作物向燕麦发生氮素转移,可能由于当季标记之后雨水大,土壤氮被淋溶了或是被豆科作物的氮节约效应所抵消造成的[10]。而且15N同位素稀释法是一种间接测定氮的表观转移的方法,得到的结果是一个时间精度较低的整体估计,其方法本身存在一定的局限性。2012年表现为花生向燕麦发生了氮素的转移,这是由于豆科通过根系分泌相当数量的氮转化物,这些化合物可能以NH4+、NO3–、氨基酸、细胞溶解物和脱落物形态在根际沉积。这些根际沉积物能够通过转移被禾本科吸收和利用。关于燕麦和花生与其他作物间作时氮素的转移规律前人也有研究,如用15N叶片标记的方法明确水稻与花生间作系统中存在着氮素的双向转移, 但主要表现为花生向水稻的氮素转移[14]。Zang等也用15N同位素茎秆示踪标记技术研究了燕麦–绿豆系统氮素的转移,发现绿豆向燕麦氮转移为81.7 mg/plant[33]。然而,豆科作物种类、不同物种之间的根系竞争能力,土壤特性及其环境因素均会对禾本科‖豆科间作的氮素营养特性产生影响,因此,用相同的处理在不同区域进行多年定点试验尚需进一步研究。此外,研究发现豆科与禾本科之间的氮转移主要是通过根系充分接触起作用的,因此大田研究中考虑燕麦与花生合适的行距是很有必要的。
4 结论燕麦花生间作提高了燕麦的生物量和氮素积累量,降低了花生的生物量,同时降低了开花结荚期的根瘤数和根瘤重,降低了花生的根瘤固氮酶活性,尽管间作花生较单作具有较高的固氮效率,但其生物固氮量显著降低。同时,在燕麦与花生间作系统中,由于作物种间根系相互作用,花生向燕麦发生氮素的转移,转移量约为15.3 mg/plant。因此,发挥豆科‖禾本科间作优势,充分挖掘豆科作物的生物固氮潜力,减少化肥施用,对于农业可持续发展具有重要的意义。
| [1] |
刘文钰, 雍太文, 刘小明, 等. 减量施氮对玉米–大豆套作体系中大豆根瘤固氮及氮素吸收利用的影响[J].
大豆科学, 2014, 33(5): 705–711.
Liu W Y, Yong T W, Liu X M, et al. Effect of reduced N application on nodule N fixation, N uptake and utilization of soybean in maize–soybean relay strip intercropping system[J]. Soybean Science, 2014, 33(5): 705–711. |
| [2] | Liu X J, Zhang Y, Han W X, et al. Enhanced nitrogen deposition over China[J]. Nature, 2013, 494(7438): 459–463. DOI:10.1038/nature11917 |
| [3] | Zhang F S, Chen X P, Vitousek P. An experiment for the world[J]. Nature, 2013, 497(7447): 33–35. DOI:10.1038/497033a |
| [4] | Liu X J, Zhang F S. Nitrogen fertilizer induced greenhouse gas emissions in China[J]. Current Opinion in Environmental Sustainability, 2011, 3(5): 407–413. DOI:10.1016/j.cosust.2011.08.006 |
| [5] |
郭丽琢, 张虎天, 何亚慧, 等. 根瘤菌接种对豌豆/玉米间作系统作物生长及氮素营养的影响[J].
草业学报, 2012, 21(1): 43–49.
Guo L Z, Zhang H T, He Y H, et al. Effects of rhizobium inoculation on crop growth nutrition of a pea/maize intercropping system[J]. Acta Prataculturae Sinica, 2012, 21(1): 43–49. DOI:10.11686/cyxb20120106 |
| [6] |
杨峰, 娄莹, 廖东平, 等. 玉米–大豆带状套作行距配置对作物生物量、根系形态及产量的影响[J].
作物学报, 2015, 41(4): 1–10.
Yang F, Lou Y, Liao D P, et al. Effects of row spacing on crop biomass, root morphology and yield in maize–soybean relay strip intercropping system[J]. Acta Agronomica Sinica, 2015, 41(4): 1–10. |
| [7] |
焦念元, 赵春, 宁堂原, 等. 玉米花生间作对作物产量和光合作用光响应的影响[J].
应用生态学报, 2008, 19(5): 981–985.
Jiao N Y, Zhao C, Ning T Y, et al. Effect of maize–peanut intercropping on economic yield and light response of photosynthesis[J]. Chinese Journal of Applied Ecology, 2008, 19(5): 981–985. |
| [8] |
李隆, 李晓林, 张福锁, 等. 小麦大豆间作条件下作物养分吸收利用对间作优势的贡献[J].
植物营养与肥料学报, 2000, 6(2): 140–146.
Li L, Li X L, Zhang F S, et al. Uptake and utilization of nitrogen, phosphorus and potassium as related to yield advantage in wheat/soybean intercropping[J]. Plant Nutrition and Fertilizer Science, 2000, 6(2): 140–146. |
| [9] |
肖焱波, 段宗颜, 金航, 等. 小麦–蚕豆间作体系中的氮节约效应及产量优势[J].
植物营养与肥料学报, 2007, 13(2): 267–271.
Xiao Y B, Duan Z Y, Jin H, et al. Spared N response and yields advantage of intercropped wheat and faba bean[J]. Plant Nutrition and Fertilizer Science, 2007, 13(2): 267–271. DOI:10.11674/zwyf.2007.0214 |
| [10] | Izaurralde R. Nitrogen fixation efficiency, interspecies N transfer, and root growth in barley–field pea intercrop on a black chernozemic soil[J]. Biology and Fertility of Soils, 1992, 13(1): 11–16. DOI:10.1007/BF00337231 |
| [11] | Chapagain T, Riseman A. Barley–pea intercropping: Effects on land productivity, carbon and nitrogen transformations[J]. Field Crops Research, 2014, 166(9): 18–25. |
| [12] | Madiama Cissé, PaulL G V. Influence of urea on biological N2 fixation and N transfer from Azolla intercropped with rice [J]. Plant and Soil, 2003, 250(1): 105–112. DOI:10.1023/A:1022830423154 |
| [13] | Hauggaard-Nielsen H, Andersen M K, Jornsgaard B, et al. Density and relative frequency effects on competitive interactions and resource use in pea–barley intercrops[J]. Field Crops Research, 2006, 95(2–3): 256–267. |
| [14] |
褚贵新, 沈其荣, 李奕林, 等. 用15N叶片标记法研究旱作水稻与花生间作系统中氮素的双向转移
[J].
生态学报, 2004, 24(2): 278–284.
Chu G X, Shen Q R, Li Y L, et al. Researches on bi-directional N transfer between the intercropping system of peanut with rice cultivated in aerobic soil using 15N foliar labelling method [J]. Acta Ecologica Sinica, 2004, 24(2): 278–284. |
| [15] |
冯良山, 孙占祥, 郑家明, 等. 不同水肥条件对间作花生和谷子水分养分利用的影响[J].
干旱地区农业研究, 2015, 33(5): 24–29.
Feng L S, Sun Z X, Zheng J M, et al. Effects of different water and nutrient conditions on water and nutrition use efficiencies in intercropped peanut and foxtail millet[J]. Agricultural Research in the Arid Areas, 2015, 33(5): 24–29. DOI:10.7606/j.issn.1000-7601.2015.05.05 |
| [16] | Xu Q, Hu F L, Qian Y. Researches on photosynthetic efficiency of cassava–peanut intercropping impacted by total solar eclipse[J]. Energy Procedia, 2011, (5): 152–157. |
| [17] |
房增国, 左元梅, 李隆, 等. 玉米–花生混作体系中不同施氮水平对花生铁营养及固氮的影响[J].
植物营养与肥料学报, 2004, 10(4): 386–390.
Fang Z G, Zuo Y M, Li L, et al. Effects of different nitrogen levels on iron nutrition and nitrogen fixation of peanut in maize–peanut mixed cropping system[J]. Plant Nutrition and Fertilizer Science, 2004, 10(4): 386–390. |
| [18] |
褚贵新, 沈其荣, 曹金留, 等. 旱作水稻与花生间作系统中的氮素固定与转移及其对土壤肥力的影响[J].
土壤学报, 2003, 40(5): 717–723.
Chu G X, Shen Q R, Cao J L, et al. Biological nitrogen fixation and nitrogen export of peanut intercropped with rice cultivated in aerobic soil and its effect on soil nitrogen fertility[J]. Acta Pedologica Sinica, 2003, 40(5): 717–723. |
| [19] |
王旭, 曾昭海, 朱波, 等. 燕麦与箭筈豌豆不同混作模式对根际土壤微生物数量的影响[J].
草业学报, 2009, 18(6): 151–157.
Wang X, Zeng Z H, Zhu B, et al. Effects of oat mixed with common vetch on the microorganism populations in rhizosphere soil[J]. Acta Prataculturae Sinica, 2009, 18(6): 151–157. |
| [20] |
冯晓敏, 杨永, 任长忠, 等. 豆科–燕麦间作对作物光合特性及籽粒产量的影响[J].
作物学报, 2015, 41(9): 1426–1434.
Feng X M, Yang Y, Ren C Z, et al. Effects of legumes intercropping with oat on photosynthesis characteristics of crop and grain yield[J]. Acta Agronomica Sinica, 2015, 41(9): 1426–1434. |
| [21] | Neugschwandtner R W, Kaul H P. Sowing ratio and N fertilization affect yield and yield components of oat and pea in intercrops[J]. Field Crops Research, 2014, 155: 159–163. DOI:10.1016/j.fcr.2013.09.010 |
| [22] | Carranca C, De Varennes A, Rolston D. Biological nitrogen fixation by fababean, pea and chickpea under field conditions estimated by the 15N isotope dilution technique [J]. European Journal of Agronomy, 1999, 10(1): 49–56. DOI:10.1016/S1161-0301(98)00049-5 |
| [23] | Neumann A, Schmidtke K, Rauber R. Effects of crop density and tillage system on grain yield and N uptake from soil and atmosphere of sole and intercropped pea and oat[J]. Field Crops Research, 2007, 100(2-3): 285–293. DOI:10.1016/j.fcr.2006.08.001 |
| [24] |
刘卫国, 蒋涛, 佘跃辉, 等. 大豆苗期茎秆对荫蔽胁迫响应的生理机制初探[J].
中国油料作物学报, 2011, 33(2): 141–146.
Liu W G, Jiang T, She Y H, et al. Preliminary study on physiological response mechanism of soybean (Glycine max) stem to shade stress at seedling stage [J]. Chinese Journal of Oil Crop Sciences, 2011, 33(2): 141–146. |
| [25] |
李玉英, 孙建好, 李春杰, 等. 施氮对蚕豆/玉米间作系统蚕豆农艺性状及结瘤特性的影响[J].
中国农业科学, 2009, 42(10): 3467–3474.
Li Y Y, Sun J H, Li C J, et al. Effects of interspecific interactions and nitrogen fertilization rates on the agronomic and nodulation characteristics of intercropped faba bean[J]. Scientia Agricultura Sinica, 2009, 42(10): 3467–3474. DOI:10.3864/j.issn.0578-1752.2009.10.0011 |
| [26] |
房增国, 左元梅, 李隆, 等. 玉米–花生混作对系统内氮营养的影响研究[J].
中国生态农业学报, 2005, 13(3): 63–64.
Fang Z G, Zuo Y M, Li L, et al. Effects of mixed cropping of maize and peanut on the N nutrition in cropping system[J]. Chinese Journal of Eco-Agriculture, 2005, 13(3): 63–64. |
| [27] |
左元梅, 刘永秀, 张福锁. 与玉米混作改善花生铁营养对其根瘤形态结构及豆血红蛋白含量的影响[J].
植物生理与分子生物学学报, 2003, 29(1): 33–38.
Zuo Y M, Liu Y X, Zhang F S. Effects of improvement of iron nutrition by mixed cropping with maize on nodule microstructure and leghaemoglobin content of peanut[J]. Journal of Plant Physiology and Molecular Biology, 2003, 29(1): 33–38. |
| [28] |
房增国. 豆科/禾本科间作的氮铁营养效应及对结瘤固氮的影响[D]. 北京: 中国农业大学博士学位论文, 2004.
Fang Z G. Effects of legume/cereal intercropping on N, Fe nutrition and biological nitrogen fixation[D]. Beijing: PhD Dissertation of China Agricultural University, 2004. |
| [29] | Hu F L, Zhao C, Feng F X, et al. Improving N management through intercropping alleviates the inhibitory effect of mineral N on nodulation in pea[J]. Plant and Soil, 2017, 412(1/2): 235–251. |
| [30] | Rusinamhodzi L, Murwira H K, Nyamangara J. Cotton-cowpea intercropping and its N2 fixation capacity improves yield of a subsequent maize crop under Zimbabwean rain-fed conditions [J]. Plant and Soil, 2006, 287(1/2): 327–336. |
| [31] | Chapagain T, Riseman A. Nitrogen and carbon transformations, water use efficiency and ecosystem productivity in monocultures and wheat-bean intercropping systems[J]. Nutrient Cycling in Agroecosystems, 2015, 101(1): 107–121. DOI:10.1007/s10705-014-9647-4 |
| [32] | Ofosu-Budu K G, Noumura K, Fujita K. N2 fixation, N transfer and biomass production of soybean cv. Bragg or its super-nodulating nts1007 and sorghum mixed-cropping at two rates of N fertilizer [J]. Soil Biology & Biochemistry, 1995, 27(3): 311–317. |
| [33] | Zang H D, Yang X C, Feng X M, et al. Rhizodeposition of nitrogen and carbon by mungbean (Vigna radiata L.) and its contribution to intercropped oats (Avena nuda L.) [J]. PLoS ONE, 2015, 10(3): e0121132. DOI:10.1371/journal.pone.0121132 |
 2018, Vol. 24
2018, Vol. 24  doi:
doi: 

