文章信息
- 消除子宫颈癌 关注一级预防
- Eliminat Cervical Cancer, Focusing on Primary Prevention
- 肿瘤防治研究, 2023, 50(11): 1039-1044
- Cancer Research on Prevention and Treatment, 2023, 50(11): 1039-1044
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.23.0691
- 收稿日期: 2023-06-29
- 修回日期: 2023-08-03
子宫颈癌是严重威胁女性生命健康的恶性肿瘤之一。2020年全球约有60.4万子宫颈癌新发病例,34.2万死亡病例,主要发生在中低收入国家[1]。我国子宫颈癌发病率和死亡率也呈上升趋势,中国国家癌症中心发布的《2022年全国癌症报告》显示[2]:2000—2016年间,中国子宫颈癌新发病例119 300例,因子宫颈癌死亡人数37 200例。在中国15~44岁女性中,子宫颈癌发病率高居恶性肿瘤第三位。WHO在2020年发布了《加速消除子宫颈癌全球战略》[3],2023年1月国家卫生健康委员会联合十部委印发了《加速消除宫颈癌行动计划(2023—2030年)》[卫妇幼发(2023)1号],提出了我国2025年及2030年消除宫颈癌的主要目标,即:到2025年,试点推广适龄女孩HPV疫苗接种服务;适龄妇女宫颈癌筛查率达到50%;宫颈癌及癌前病变患者治疗率达到90%。到2030年,持续推进适龄女孩HPV疫苗接种试点工作;适龄妇女宫颈癌筛查率达到70%;宫颈癌及癌前病变患者治疗率达到90%。这个文件的发布大大推动了我国宫颈癌防治工作。
1 我国宫颈癌防治现状在子宫颈癌的综合防控中我国实施三级预防策略[4-6]:一级预防是要加强对群众健康指导和推广宫颈癌疫苗的应用,特别对青少年女性接种HPV疫苗是重中之重,在发生性行为前接种HPV疫苗,可以有效地预防子宫颈癌;健康教育为一级预防重要的组成部分,临床医护人员可通过对疾病的健康宣教从而提高患者对疾病及治疗知识的了解,有利于满足患者的认知需求并提高其依从性。二级预防提出用细胞学及人乳头瘤病毒检测的筛查方法,筛查异常的管理,阴道镜检查要点及对宫颈癌前病变的管理。三级预防为宫颈癌的管理。
目前我国在宫颈癌防治上存在以下问题:疫苗接种率不高,适龄女性HPV疫苗接种率低和筛查覆盖率低、筛查诊治能力不齐,综合防控服务体系的整合受限于不同分管部门缺乏高效沟通机制,医疗保健人员对子宫颈癌综合防控理念重视不足,多途径子宫颈癌防控信息交流共享存在诸多困难等[7]。
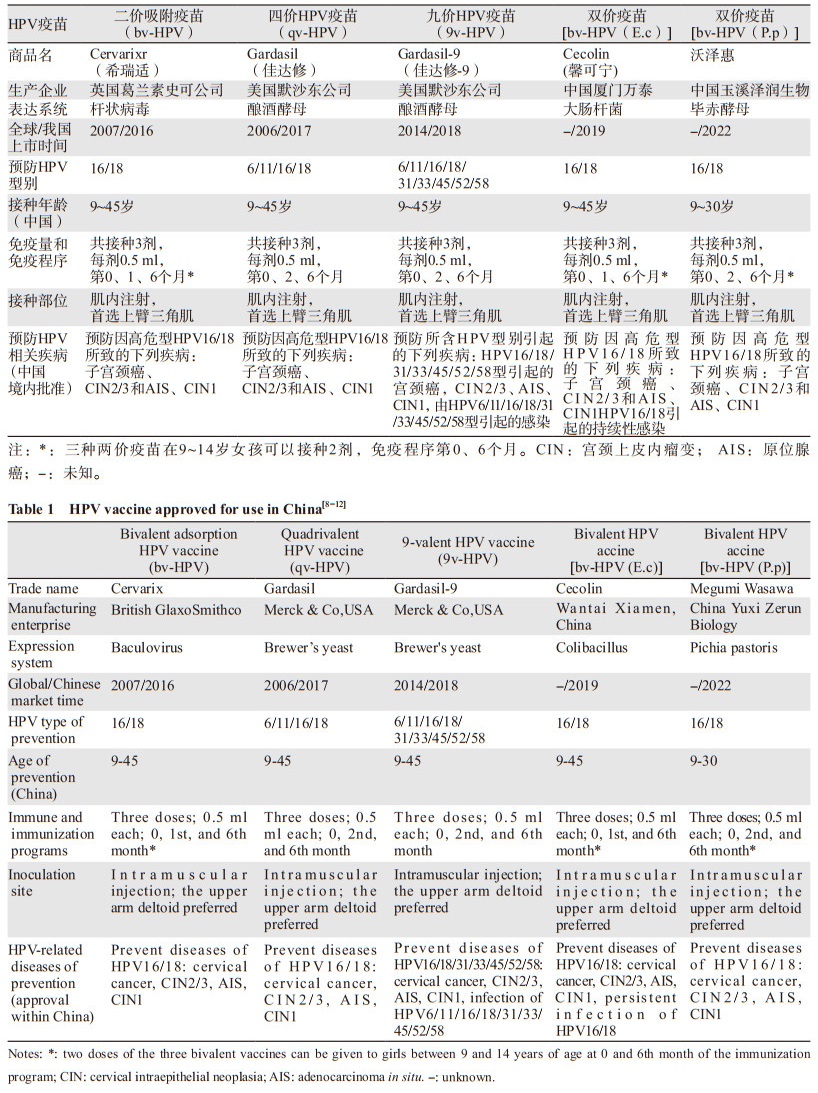
2 我国宫颈癌预防性疫苗的应用目前,全球已有三种HPV疫苗上市,分别是二价、四价和九价疫苗,均由美国食品和药物监督管理局(FDA)批准并获得世界卫生组织(WHO)的认可,先后被批准应用于我国女性人群。之后又有两个自主研发的二价疫苗获得我国国家药监局(NMPA)批准上市,故而我国市场可以用于女性人群中的HPV疫苗有五种,见表 1。
以上五种疫苗均在我国完成了相关临床试验。临床研究结果显示[13-15],9~45岁女性接种二价和四价HPV疫苗后免疫应答较强,阳转率96%~100%,血清学抗体滴度是18~26岁女性的1.42~3.00倍,而18~25岁女性与26~45岁女性抗体滴度相似。九价疫苗在中国女性的免疫原性试验结果[16]:9~19岁组女性产生的抗体滴度(抗HPV九价疫苗所包含的九种相关型别)不低于20~26岁组;抗九种HPV型别的血清阳转率在27~45岁年龄组中并不低于20~26岁年龄组的参与者,而且安全性良好。基于该临床试验结果,2022年8月我国NMPA批准九价疫苗扩龄应用于9~45岁女性。目前,九价疫苗尚未得出在中国人群中对HPV相关型别预防宫颈上皮内瘤变(cervical intraepithelial neoplasia, CIN)的效果。希瑞适、佳达修及馨可宁对CIN2的保护效力从87.3%到100%不等,12个月时对HPV相关型别感染的预防达到96%~97%。临床试验表明,五种疫苗对9~45岁的妇女也是安全的。国外的研究显示,在接种四价疫苗后,对CIN2及以上病变可以保持14年100%的预防效果[17],这是迄今为止对HPV疫苗最长随访时间观察到的效果。我们对368名20~45岁完成三剂qv-HPV疫苗接种后的女性进行了长期随访[18],中位随访时间为94个月,最长达125个月,观察qv-HPV疫苗对HPV相关癌前病变的保护作用,结果在接种疫苗的妇女中未发现与HPV16/18相关的CIN、外阴上皮内瘤变(vulva intraepithelial neoplasia, VIN)和阴道上皮内瘤变(vaginal intraepithelial neoplasia, VaIN),达到100%的预防效果;安慰剂组中发现了2例HPV16相关病例(CIN3、CIN1/VaIN3),另外还发现2例非疫苗型HPV,1例58型相关VaIN2、1例HPV52型相关CIN1。以上研究表明qv-HPV疫苗对中国女性HPV相关型别的上皮内病变有11年长期保护效果。
目前,HPV疫苗在我国属于非免疫规划疫苗[19],也是第二类疫苗,尚未纳入国家计划免疫,按照知情同意、自愿自费原则接种。HPV疫苗是由中国疾病预防控制中心(CDC)和各地的CDC管理,并在已取得疫苗注射资质的医疗机构注射。具体注射地点和管理办法需要按照当地卫生行政部门规定办法执行。具体接种地点,可向当地卫生行政部门和医疗机构咨询,接种年龄要按照疫苗使用说明书。为了更好指导临床专家对HPV疫苗的应用,我国专家提出《人乳头瘤病毒疫苗临床应用中国专家共识》(共识)[20]。共识除提出对一般人群应用HPV疫苗的原则外,还提出了对特殊人群应用HPV疫苗的问题,并制定HPV疫苗接种临床推荐原则:9~26岁女性、遗传易感人群和宫颈癌发病高危因素者优先推荐;27~45岁女性、HPV感染/细胞学异常者、HPV相关病变治疗史者、免疫功能低下女性推荐接种;妊娠期女性不推荐;哺乳期女性谨慎推荐接种HPV疫苗。共识中明确HPV疫苗接种注意事项,除超敏体质者外,急性病或发热者痊愈后接种,并建议在非月经期接种。该共识还强调即使接种了HPV疫苗,也必须定期接受宫颈癌筛查。当前我国开展HPV疫苗接种流程主要参照《中华人民共和国疫苗管理法》[21]及《预防接种工作规范》[22]等执行。
目前我国HPV疫苗接种率还很低,2019年的调查资料表明[23],接种HPV疫苗的中国女性比例仅有3%,9~14岁女孩HPV疫苗接种率仅为1.9%[24]。国家卫生健康委提出鼓励先行,探索将HPV疫苗纳入医保[25]。目前各地结合实施《“健康中国2030”规划纲要》和《加速消除宫颈癌行动计划(2023—2030年)》精神,积极推进HPV疫苗接种,特别是推进9~14岁女孩疫苗接种。
3 HPV疫苗应用中关注的问题 3.1 9~14岁的女孩是HPV疫苗接种的主要目标人群2022年WHO发布的人乳头瘤病毒疫苗的立场文件[26]强调HPV疫苗接种的主要目标人群是性活跃前9~14岁的女孩。人乳头瘤病毒免疫规划从引进之日起就应优先考虑高覆盖率。研究表明,在女孩中实现80%以上的覆盖率也降低了男孩感染HPV的风险[27]。在真实世界的研究中,瑞典一项对2006—2017年近170万名10~39岁女性接种HPV疫苗前后进行比较,在接种疫苗5~8年后,HPV16和HPV18引起的宫颈癌在17岁前接种HPV疫苗的女性中下降了88%,17~30岁接种HPV疫苗的女性中下降了53%[28]。13~19岁和20~24岁女性接种HPV疫苗后,宫颈癌发病率分别下降了83%和66%[29]。也有证据表明,未接种HPV疫苗的女性可通过群体效应获得间接保护[30]。在一项人群研究中,二价(希瑞适)疫苗预防CIN3+的有效率在12~13岁女性为86%,在17岁女性接种疫苗后51%有效[31]。
3.2 HPV疫苗接种剂次HPV疫苗按3剂次接种,具有高度的免疫原性,特别在9~15岁女孩免疫反应最高[32]。我国二价疫苗(馨可宁)研究也显示18~45岁女性在接种疫苗三剂次66个月后HPV16和HPV18血清学阳性率分别为100%和98%[33]。四价疫苗(佳达修)接种三剂14年后,HPV6、11、16、18各型别血清学阳性率分别为98%、98%、100%和94%[17]。二价疫苗(希瑞适)接种三剂后HPV16和HPV18中和抗体稳定长达12年[34]。因此,目前接种三剂次疫苗为完成HPV疫苗免疫接种。
HPV疫苗2剂次接种,是基于在免疫桥接试验中证实9~14岁女孩与成年女性接种3剂次疫苗后的免疫反应呈非劣效性[35],在此基础上,进行了9~14岁小年龄组2剂次接种与大年龄组接种3剂次的免疫比较,证实接受少于三次剂量疫苗的女性可预防HPV16/18相关宫颈癌[36]。我国二价(馨可宁)的研究也证实9~14岁接种2剂次疫苗与18~26岁接种3剂次疫苗比较,其抗体水平是大年龄组的2倍[37]。
单剂次疫苗接种,根据免疫原性试验、疗效试验中看到单剂量的HPV疫苗足以引起免疫反应,可以提供类似多剂量方案对初始和持续性HPV感染的保护作用。在一项免疫原性研究研究中显示2 250名性活跃的15~20岁女性,随机分别接种二价(希瑞适)或九价(佳达修-9)HPV疫苗,接种疫苗18个月后,单剂量HPV九价和二价疫苗对持续性高危型(HPV16/18)感染的有效性均为97.5%[38]。另一项研究显示对930名9~14岁的女性随机接受1、2或3剂量的二价疫苗(希瑞适)或九价(佳达修-9)疫苗接种。在接种疫苗24个月后,两种疫苗所有不同剂次接种组97.5%以上接种者血清学呈阳性。系统性回顾显示接受单剂量HPV疫苗受试者的血清学阳性不低于两剂次或更多剂次受试者[39]。但目前对于单剂次HPV疫苗接种研究证据尚不充足。在我国缺乏单剂次接种的研究数据,我们仍推荐按照国家药监局批准的说明书进行HPV疫苗3剂次接种,9~14岁女孩接种二价疫苗时可接种2剂次。
4 展望及小结WHO立场文件还提到在接种HPV疫苗之前,没有必要筛查HPV或HIV感染和关注疫苗接种后的安全性。疫苗接种应与多种预防措施相结合,包括健康教育,以及关于癌前病变、癌症和危险因素的筛查、诊断和治疗。随着我国推进HPV疫苗的应用,需要我们积累更多的研究资料和真实事件的研究,进一步完善对HPV疫苗的管理。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
赵超:文献查找、论文撰写
李明珠:论文修改
魏丽惠:论文设计及修改
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Zheng R, Zhang S, Zeng H, et al. Cancer incidence and mortality in China, 2016[J]. J Natl Cancer Center, 2022, 2(1): 1-9. DOI:10.1016/j.jncc.2022.02.002 |
| [3] |
World Health Organization. Global strategy to accelerate the elimination of cervical cancer as a public problem[EB/OL]. [2020-11-17]. https://www.who.int/publications/i/item/9789240014107.
|
| [4] |
中华预防医学会妇女保健分会. 子宫颈癌综合防控指南[M]. 北京: 人民卫生出版社, 2017. [Chinese Preventive Medicine Association Women's Health Branch. Guidelines for comprehensive prevention and control of Cervical cancer[M]. Beijing: People's Medical Publishing House, 2017.]
|
| [5] |
魏丽惠, 赵昀, 沈丹华, 等. 中国子宫颈癌筛查及异常管理相关问题专家共识(一)[J]. 中国妇产科临床杂志, 2017, 18(2): 190-192. [Wei LH, Zhao Y, Shen DH, et al. Expert consensus on Cervical cancer screening and abnormal management in China[J]. Zhongguo Fu Chan Ke Lin Chuang Za Zhi, 2017, 18(2): 190-192. DOI:10.13390/j.issn.1672-1861.2017.02.032] |
| [6] |
魏丽惠, 沈丹华, 赵方辉, 等. 中国子宫颈癌筛查及异常管理相关问题专家共识(二)[J]. 中国妇产科临床杂志, 2017, 18(3): 286-288. [Wei LH, Shen DH, Zhao FH, et al. Expert consensus on Cervical cancer screening and abnormal management in China[J]. Zhongguo Fu Chan Ke Lin Chuang Za Zhi, 2017, 18(3): 286-288. DOI:10.13390/j.issn.1672-1861.2017.03.041] |
| [7] |
中国子宫颈癌综合防控路径建设专家共识编写组. 中国子宫颈癌综合防控路径建设专家共识[J]. 中国预防医学杂志, 2020, 23(10): 721-726. [Writing Group of Expert consensus on building a comprehensive prevention and control pathway for cervical cancer in China. Expert consensus on building a comprehensive prevention and control pathway for cervical cancer in China[J]. Zhongguo Yu Fang Yi Xue Za Zhi, 2020, 23(10): 721-726. DOI:10.16506/j.1009-6639.2022.10.001] |
| [8] |
上海葛兰素史克中国投资有限公司. 双价人乳头瘤病毒吸附疫苗说明书[Z/OL]. (2016-07-12)[2018-07-02]. https://www.gsk-china.com/zh-cn/vaccine-publicity/cervarix-pdf/. [Shanghai GlaxoSmithKline China Investment Co. LTD. Instructions for bivalent human papillomavirus adsorbed vaccine[Z/OL]. (2016-07-12)[2018-07-02]. https://www.gsk-china.com/zh-cn/vaccine-publicity/cervarix-pdf/.]
|
| [9] |
上海默沙东中国有限公司. 九价人乳头瘤病毒疫苗(酿酒酵母)说明书[Z]. 2018. https://www.msdchina.com.cn/product#p1J. [Shanghai MSD China Co., LTD. Instructions for the nine-valent human papillomavirus vaccine (Saccharomyces Cerevisiae)[Z]. 2018. https://www.msdchina.com.cn/product#p1J.]
|
| [10] |
上海默沙东中国有限公司. 四价人乳头瘤病毒疫苗说明书(酿酒酵母)说明书[Z]. 2020. https://www.msdchina.com.cn/product#p1J. [Shanghai MSD China Co., LTD. Instructions for quadrivalent human papillomavirus vaccine (Saccharomyces cerevisiae) Instructions[Z]. 2020. https://www.msdchina.com.cn/product#p1J.]
|
| [11] |
厦门万泰沧海生物技术有限公司. 双价人乳头瘤病毒疫苗(大肠杆菌)说明书[Z]. 2020. https://www.innovax.cn/information-disclosure/181.html. [Xiamen Wantai Canghai Biotechnology Co., LTD. Instructions for bivalent human papillomavirus vaccine (E. coli)[Z]. 2020. https://www.innovax.cn/information-disclosure/181.html.]
|
| [12] |
玉溪泽润生物技术有限公司. 双价人乳头瘤病毒疫苗(毕赤酵母)说明书[Z]. 2022. https://www.zerunbio.com/. [Yuxi Zerun Biotechnology Co., LTD. Instructions for bivalent human papillomavirus vaccine (Pichia Pastoris)[Z]. 2022. https://www.zerunbio.com/.]
|
| [13] |
Zhu F, Li J, Hu Y, et al. Immunogenicity and safety of the HPV-16/18 AS04-adjuvanted vaccine in healthy Chinese girls and women aged 9 to 45 years[J]. Hum Vaccin Immunother, 2014, 10(7): 1795-1806. |
| [14] |
Li R, Li Y, Radley D, et al. Safety and immunogenicity of a vaccine targeting human papillomavirus types 6, 11, 16 and 18: a randomized, double-blind, placebo-controlled trial in Chinese males and females[J]. Vaccine, 2012, 30(28): 4284-4291. DOI:10.1016/j.vaccine.2012.02.079 |
| [15] |
Hu YM, Guom M, Li CG, et al. Immunogenicity noninferiority study of 2 doses and 3 doses of an Escherichia coli-produced HPV bivalent vaccine in girls vs. 3 doses in young women[J]. Sci China Life Sci, 2020, 63(4): 582-591. DOI:10.1007/s11427-019-9547-7 |
| [16] |
Lv H, Wang S, Liang Z, et al. Immunogenicity and safety of the 9-valent human papillomavirus vaccine in Chinese females 9-45 years of age: A phase 3 open-label study[J]. Vaccine, 2022, 40(23): 3263-3271. DOI:10.1016/j.vaccine.2022.02.061 |
| [17] |
Kjaer SK, Nygård M, Sundström K, et al. Final analysis of a 14-year long-term follow-up study of the effectiveness and immunogenicity of the quadrivalent human papillomavirus vaccine in women from four nordic countries[J]. EClinicalMedicine, 2020, 23: 100401. DOI:10.1016/j.eclinm.2020.100401 |
| [18] |
Zhao C, Zhao Y, Li JR. The eight-year long-term follow-up on the effectiveness of the quadrivalent human papillomavirus vaccine in Chinese women 20-45 years of age[J]. Hum Vaccin Immunother, 2022, 18(5): 2052700. DOI:10.1080/21645515.2022.2052700 |
| [19] |
中华预防医学会疫苗与免疫分会. 子宫颈癌等人乳头瘤病毒相关疾病免疫预防专家共识(简版)[J]. 中华预防医学杂志, 2019, 53(12): 1218-1235. [Chinese Society of Preventive Medicine Vaccines and Immunizations. Expert consensus on immunoprophylaxis of human papillomavirus-associated diseases such as cervical cancer[J]. Zhonghua Yu Fang Yi Xue Za Zhi, 2019, 53(12): 1218-1235. DOI:10.3760/cma.j.issn.0253-9624.2019.12.006] |
| [20] |
李双, 李明珠, 丛青, 等. 人乳头瘤病毒疫苗临床应用中国专家共识[J]. 中国妇产科临床杂志, 2021, 22(2): 1-7. [Li S, Li MZ, Cong Q, et al. Consensus of Chinese experts on the clinical application of human papillomavirus vaccine[J]. Zhongguo Fu Chan Ke Lin Chuang Za Zhi, 2021, 22(2): 1-7.] |
| [21] |
全国人民代表大会. 《中华人民共和国疫苗管理法》(国家主席令30号)[S]. 北京: 全国人民代表大会2019. [National People's Congress. Vaccine Administration Law of the People's Republic of China (Order of the President No. 30)[S]. Beijing: National People's Congress, 2019.]
|
| [22] |
国家卫生健康委员会. 《预防接种异常反应鉴定办法》(卫生部令第60号)[S]. 北京: 国家卫生健康委员会2008. [National Health Commission. Measures for Identification of Abnormal Reactions to Preventive Vaccination (Order No. 60 of the Ministry of Health)[S]. Beijing: National Health Commission, 2008.]
|
| [23] |
Hu S, Xu X, Zhang Y, et al. A nationwide post-marketing survey of knowledge, attitude and practice toward human papillomavirus vaccine in general population: Implications for vaccine roll-out in mainland China[J]. Vaccine, 2021, 39(1): 35-44. DOI:10.1016/j.vaccine.2020.11.029 |
| [24] |
邱丽蓉, 牛战琴. 9~14岁女性人乳头瘤病毒疫苗接种现状及其影响因素分析[J]. 中国生育健康杂志, 2022, 33(3): 262-265. [Qiu LR, Niu ZQ. Analysis of the Current Situation and Influencing Factors of Human Papillomavirus Vaccination in Women Aged 9-14[J]. Zhongguo Sheng Yu Jian Kang Za Zhi, 2022, 33(3): 262-265.] |
| [25] |
中华人民共和国国家卫生健康委员会. 对十三届全国人大一次会议第5037号建议的答复[EB/OL]. (2019-01-03). http://www.nhc.gov.cn/wjw/jiany/201901/7bf778648b1b4aeab6d8ed6e2344743f.shtml. [National Health Commission of the People's Republic of China. Reply to Recommendation No. 5037 of the First Session of the 13th National People's Congress[EB/OL]. (2019-01-03). http://www.nhc.gov.cn/wjw/jiany/201901/7bf778648b1b4aeab6d8ed6e2344743f.shtml.]
|
| [26] |
WHO. Human papillomavirus vaccines: WHO position paper (December 2022)[EB/OL]. (2022-12-16). https://www.who.int/publications/i/item/who-wer9750-645-672.
|
| [27] |
WHO. SAGE evidence to recommendations framework[EB/OL]. 2022. https://cdn.who.int/media/docs/default-source/immunization/position_paper_documents/human-papillomavirus-(hpv)/hpv-gender-recommendation-table.pdf?sfvrsn=40027bd2_2, accessed August 2022.
|
| [28] |
Lei J, Ploner A, Elfström KM, et al. HPV Vaccination and the Risk of Invasive Cervical Cancer[J]. N Engl J Med, 2020, 383(14): 1340-1348. DOI:10.1056/NEJMoa1917338 |
| [29] |
Drolet M, Bénard É, Pérez N, et al. Population-level impact and herd effects following the introduction of human papillomavirus vaccination programmes: updated systematic review and meta-analysis[J]. Lancet, 2019, 394(10197): 497-509. DOI:10.1016/S0140-6736(19)30298-3 |
| [30] |
Rosenblum HG, Lewis RM, Gargano JW, et al. Declines in prevalence of human papillomavirus vaccine-type infection among females after introduction of vaccine-United States, 2003-2018[J]. MMWR Morb Mortal Wkly Rep, 2021, 70(12): 415-420. DOI:10.15585/mmwr.mm7012a2 |
| [31] |
Palmer T, Wallace L, Pollock KG, et al. Prevalence of cervical disease at age 20 after immunization with bivalent HPV vaccine at age 12-13 in Scotland: retrospective population study[J]. BMJ, 2019, 365: l1161. |
| [32] |
Schiller JT, Castellsagué X, Garland SM. A review of clinical trials of human papillomavirus prophylactic vaccines[J]. Vaccine, 2012, 30 Suppl 5(5): F123-F138. |
| [33] |
Qiao YL, Wu T, Li RC, et al. Efficacy, Safety, and Immunogenicity of an Escherichia coli-Produced Bivalent Human Papillomavirus Vacicine: An Interim Analysis of a Randomized Clinical Trial[J]. J Natl Cancer Inst, 2020, 112(2): 145-153. |
| [34] |
Mariz FC, Gray P, Bender N, et al. Sustainability of neutralising antibodies induced by bivalent or quadrivalent HPV vaccines and correlation with efficacy: a combined follow-up analysis of data from two randomised, double-blind, multicentre, phase 3 trials[J]. Lancet Infect Dis, 2021, 21(10): 1458-1468. |
| [35] |
D'Addario M. HPV vaccines: systematic review of literature on alternative vaccination schedules. Report to WHO. Institute of Social and Preventive Medicine (ISPM), University of Bern, Bern, Switzerland (24th June 2014). In: Evidence based recommendations on human papilloma virus (HPV) schedules: Background paper for SAGE discussions[Z]. Geneva: World Health Organization 2014: Annex 1.
|
| [36] |
Arbyn M, Xu L, Simoens C, et al. Prophylactic vaccination against human papillomaviruses to prevent cervical cancer and its precursors[J]. Cochrane Database Syst Rev, 2018, 5(5): CD009069. |
| [37] |
Hu YM, Guo M, Li CG, et al. Immunogenicity noninferiority study of 2 doses and 3 doses of an Escherichia coli-produced HPV bivalent vaccine in girls vs. 3 doses in young women[J]. Sci China Life Sci, 2020, 63(4): 582-591. |
| [38] |
Watson-Jones D, Changalucha J, Whitworth H, et al. Immunogenicity and safety of one-dose human papillomavirus vaccine compared with two or three doses in Tanzanian girls (DoRIS): an openlabel, randomised, non-inferiority trial[J]. Lancet Glob Health, 2022, 10(10): e1473-e1484. |
| [39] |
Whitworth HS, Gallagher KE, Howard N, et al. Efficacy and immunogenicity of a single dose of human papillomavirus vaccine compared to no vaccination or standard three and two-dose vaccination regimens: a systematic review of evidence from clinical trials[J]. Vaccine, 2020, 38(6): 1302-1314. |
 2023, Vol. 50
2023, Vol. 50