文章信息
- 临床预测模型在结直肠癌术后并发症中的应用现状
- Application of Clinical Prediction Models for Postoperative Complications of Colorectal Cancer
- 肿瘤防治研究, 2023, 50(9): 908-912
- Cancer Research on Prevention and Treatment, 2023, 50(9): 908-912
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.23.0293
- 收稿日期: 2023-03-22
- 修回日期: 2023-06-19
2. 730000 兰州, 兰州大学第一医院胃肠及疝与腹壁外科
2. Department of Gastrointestinal and Hernia and Abdominal Wall Surgery, The First Hospital of Lanzhou University, Lanzhou 730000, China
结直肠癌(colorectal cancer, CRC)是全球最常见的恶性肿瘤之一。2020年,全球报告了约190万新发CRC病例和93.5万CRC死亡病例,使其成为癌症发病率的第三大原因和癌症死亡的第二大原因[1]。目前,CRC的治疗主要包括手术、放疗、化疗和靶向治疗。随着手术和吻合技术的改进以及新器械的应用,外科医生在CRC的根治方面取得了重大进展[2-3]。然而,CRC手术治疗的并发症发生率约为10%~37%,严重影响患者预后[4]。通过构建CRC术后并发症临床预测模型,可为医务人员早期识别高危患者提供更为准确的风险信息,有助于指导合理的围手术期管理,降低术后并发症的发生率。因此,本研究通过综述近几年国内外相关文献,对不同结直肠癌术后并发症的危险因素分析和预测模型构建的相关研究进行总结与分析。
1 临床预测模型概述通过使用特定预测因子来预测个体患有某种疾病(诊断预测模型)或未来某时刻发生某一事件(预后预测模型)的发生概率或风险即为临床预测模型[5]。模型的开发通常仔细筛选需要分析的预测变量,并限制预测变量数以避免过度拟合[6]。预测模型的效能评价主要包括区分度和校准度两个方面[7]。区分度可通过受试者工作特征曲线下面积(area under the curve, AUC)、C-指数(C-index)及C-统计量(C-statistics)来显示模型的优劣程度。校准度一般是通过校准度曲线来直观评价,观察实际曲线与理想曲线的贴合程度。模型验证可分为内部和外部验证,内部验证通常将数据集拆分为两个子集来完成,可使用自助重抽样或交叉验证等方法,外部验证将通过不同数据集评估模型可传递性[8]。当模型在临床实际中难以理解和使用时,通过绘制列线图能将其进行可视化处理,更方便临床工作者对患者进行个体化评估,在向患者解释风险时也更容易让患者理解[9]。目前,临床预测模型越来越多地用于补充现代医学的临床推理和决策,对目标患者发生特定结果的概率或疾病预后进行评估[10-11]。
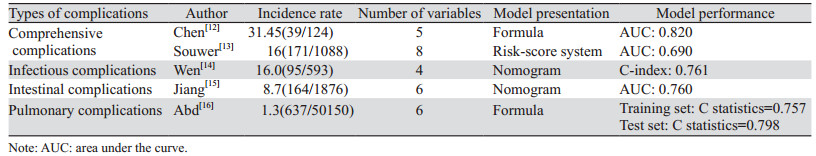
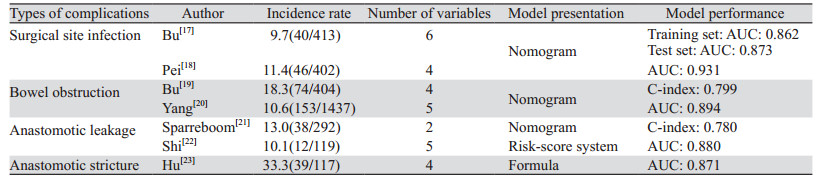
2 CRC术后并发症临床预测模型了解CRC术后常见并发症的临床预测模型,对于识别高风险人群十分重要。目前,有研究者将多种CRC术后并发症作为一个综合结果进行研究,包括感染并发症、肠道并发症及肺部并发症,见表 1;而部分研究者则对某个特定术后并发症进行研究,包括手术部位感染(surgical site infection, SSI)、术后肠梗阻、吻合口漏及吻合口狭窄等,见表 2。
|
|
将CRC术后并发症定义为一个综合结果进行研究,分析并建立风险评估模型。陈明芬等[12]对124例接受CRC根治术的老年患者进行回顾性分析,以CRC术后并发症有无作为观察结局进行Logistic多因素回归分析,开发了包含年龄 > 70岁、糖尿病、美国麻醉医师协会(American Society of Anesthesiologists, ASA)分级3~4级、血清白蛋白 < 40 g/L及术前衰弱5个风险因素的预测模型,其AUC为0.82。此外,Souwer等[13]纳入更多老年特征术前预测因子,收集荷兰结直肠癌数据库中Ⅰ~Ⅲ期CRC且年龄≥70岁的患者择期手术后出现严重并发症而转入重症监护室、再次手术干预、住院时间延长(超过14天)或死亡的情况,构建了包括性别、既往深静脉血栓或肺栓塞、慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)/哮喘/肺气肿、直肠癌、使用助行器、日常生活活动能力辅助、既往谵妄和多药治疗的老年CRC术后并发症预测模型,该模型的AUC为0.69。通过使用包含老年特征的术前预测因子计算患者的个体并发症风险,可以改善老年人群的结局预测,同时可用于多学科诊疗会议上进行手术前的临床决策,并制定个性化的手术方案。
2.1.2 感染并发症CRC术后感染并发症可导致院内死亡人数增加并降低长期生存率[24-26]。一项荟萃分析发现术后感染并发症会对CRC患者术后远期肿瘤学结局产生不利影响[27]。因此,术后感染并发症高危患者的早期识别和预防尤为重要。Wen等[14]将SSI、吻合口漏、腹腔脓肿、腹腔积液、胆囊炎、感染性腹泻和肺炎共同纳为CRC术后感染并发症并构建预测模型。研究共纳入593例接受原发性CRC手术治疗的患者,使用最小绝对收缩和选择算子回归(least absolute shrinkage and selection operator, LASSO)分析评估24个变量以筛选最优变量,然后采用多变量Logistic回归分析建立预测模型。结果显示:慢性肺部疾病、糖尿病、术前和(或)术中输血和手术时间较长是CRC术后感染并发症的独立危险因素。该列线图的C-index为0.761,校准曲线显示非常一致。临床决策曲线分析显示,当阈值概率 > 0.23时,使用列线图预测结直肠癌术后感染并发症增加了更多净获益。该研究纳入较为广泛的术后感染并发症的潜在风险因素,所构建的模型基于常规的围手术期信息,以最大限度提供模型的应用和推广性。
2.1.3 肠道并发症尽管近年的研究表明CRC手术的安全性有提高的趋势,但术后肠梗阻、吻合口漏及肠道出血等仍是手术后的常见并发症,同时这些肠道并发症相互关联,常合并发生。Jiang等[15]对1 876例接受CRC手术的患者进行回顾性分析,结果表明男性、腹部手术史、术前肠梗阻或穿孔、TNM分期Ⅳ期、血红蛋白水平 < 110 g/L是术后肠道并发症的独立危险因素。此外,与预后营养指数(prognostic nutrition index, PNI)≥45的患者相比,PNI35~45和PNI < 35的患者发生肠道并发症的风险分别增加了2.12倍和4.91倍。构建包含以上6个独立危险因素的列线图,用于评估术后肠道并发症的风险。经内部验证该列线图的整体预测精度AUC为0.76;校准曲线显示模型预测概率和观测概率之间无显著差异(Hosmer-Lemeshow拟合优度检验,P=0.358)。通过该模型临床医生可更精准地评估CRC手术后患者发生肠道并发症的风险,为需要重症监护的患者定制干预措施。
2.1.4 肺部并发症腹腔镜技术在CRC手术中的广泛应用和围术期加速康复外科理念的标准化,降低了术后发生呼吸系统及其他并发症的风险[28-29]。然而,仍有部分高危患者术后可能发生肺部并发症[30]。为明确腹腔镜下CRC术后原发性肺部并发症的独立危险因素,Abd等[16]通过定义肺炎、计划外插管和(或)未能脱离机械通气 > 48 h为原发性术后肺部并发症,基于美国国家外科医师质量改进计划(American College of Surgeons National Surgical Quality Improvement Program, ACS-NSQIP)数据库,收集行腹腔镜下CRC手术治疗的患者临床信息,最终纳入了慢性阻塞性肺疾病(COPD)、年龄、吸烟史、功能健康状况、术前30天内充血性心力衰竭和ASA分级≥3的危险因素用于预测术后肺部并发症的风险评估模型。该模型表现出良好的校准度(Hosmer-Lemeshow拟合优度检验,P=0.614)和区分度(C-statistics=0.757)。该研究进一步使用2018年ACS-NSQIP数据进行内部验证表现出类似的区分度(C-statistics=0.798)。该预测风险评分确定了更为广泛的术前潜在评估指标,有助于识别可能受益于围手术期优化的患者,通过术后医疗资源的合理分配促进肺功能恢复。
2.2 将某个特定术后并发症作为临床预测模型研究 2.2.1 SSI美国疾病控制中心将SSI分为切口感染、器官和(或)腔隙感染[31],器官和(或)腔隙感染常表现为腹腔感染。CRC手术患者术后SSI的发生率为5.0%~40.0%[32],因此探讨CRC术后SSI的风险因素对预防SSI有重要意义。卜宁等[17]基于术前实验室指标探讨CRC术后SSI的影响因素,使用术前中度贫血等6个独立危险因素来构建CRC术后发生SSI的列线图预测模型,该模型在建模组和验证组的AUC分别为0.862和0.873,并通过临床决策曲线分析显示建模组及验证组阈值概率分别在1%~74%和1%~80%时模型具有更好的临床实用性。Pei等[18]综合考虑术前营养和免疫状态,回顾性纳入402例接受CRC根治术患者的临床数据,基于术前白蛋白、淋巴细胞/白细胞 < 0.17、皮下脂肪含量低、骨骼肌含量低的独立危险因素构建腹腔感染的列线图模型,其AUC为0.931,校准曲线显示预测与实际观测的腹腔感染概率高度一致;此外,决策曲线分析也显示列线图有较高的临床使用价值。
2.2.2 术后肠梗阻无论是机械性还是功能性术后肠梗阻,都可能会影响肠道功能恢复。有研究[33]对CRC患者术后发生肠梗阻的危险因素进行荟萃分析,中等质量的证据表明开腹手术增加了术后肠梗阻的风险,低质量证据表明年龄、男性、心脏合并症和造口术是术后肠梗阻的重要危险因素,极低质量证据表明,既往开腹手术史也是风险因素。卜宁等[19]通过对404例CRC患者术后是否发生肠梗阻进行研究,结果显示开腹手术、术中未使用非甾体类抗炎药、术前白蛋白 < 37.55g/L和术前球蛋白≥28.35g/L是CRC术后肠梗阻的独立危险因素,并构建列线图临床预测模型。通过内部验证该模型的C-index为0.799,校正曲线显示较好的一致性。临床决策曲线表明当术后肠梗阻发生的风险阈值超过4%时,该模型具有临床应用价值。Yang等[20]纳入1 437例择期行CRC手术的患者,定义术后30天内出现的早期肠梗阻为研究结局,结果表明COPD、甲状腺功能减退、益生菌适应证、抗生素使用时间和术后首次进食时间是CRC术后早期肠梗阻的独立危险因素,基于筛选出的5个独立危险因素构建列线图来预测术后早期肠梗阻,AUC为0.894,且校准良好。预测术后肠梗阻的风险因素,有助于改善CRC手术患者的术后管理。
2.2.3 吻合口漏吻合口漏是CRC术后常见且严重的并发症,诸多吻合口漏相关并发症,如腹腔脓肿、SSI、弥漫性腹膜炎和脓毒症,可导致患者死亡率增加和生存结局恶化等[34];因此,CRC术后吻合口漏的早期识别仍然是一个值得研究的问题。目前,可通过测定腹腔/盆腔引流液中的生物标志物和炎性因子(inflammatory factors, IFs)诊断早期吻合口漏。例如,Sparreboom等[21]基于一项多中心前瞻性队列研究,纳入292例接受直肠癌手术的患者,在术后的前三天,每天测量C反应蛋白(C-reactive protein, CRP)并在引流液中检测基质金属蛋白酶(matrix metalloproteinase, MMP)2、MMP9、葡萄糖、乳酸、白细胞介素(interleukin, IL)-1β、IL-6等,并为每个术后日建立吻合口漏的预测模型。结果显示术后第3天(postoperative day 3, POD3)包括CRP和MMP9的预测模型的效能最佳,其C-index为0.78。全身炎性反应可引起血清CRP升高,而局部感染(如无症状吻合口瘘)早期的CRP水平通常无明显变化。相反,引流液中的IFs浓度易受腹腔内微环境的影响。Shi等[22]通过多重免疫测定法测定119例CRC患者术后引流液中的IFs,验证Sparreboom模型在POD3具有最佳的诊断效果,AUC为0.77;随后使用Lasso回归筛选具有高度预测性的IFs以优化模型并构建新的评分系统(AScore),POD3的AScore将AUC提到0.83,而POD1的AUC为0.88,诊断效能最高。因此,早期测定CRC手术患者腹腔引流液中的IFs可能有助于预测吻合口漏。
2.2.4 吻合口狭窄肠吻合术是CRC手术中不可或缺的一部分,尽管近年来吻合技术有所改进,但吻合口狭窄发生率高达8.7%~13%[35]。因此,确定CRC术后吻合口狭窄的危险因素对于改善手术结局有着实际意义。有研究[36]发现括约肌间切除术和造口是吻合口狭窄的危险因素,而机械吻合是防治狭窄的保护因素。Hu等[23]为进一步分析吻合口狭窄的危险因素并构建预测模型,纳入117例接受全直肠系膜切除术的患者,多因素分析确定了保留左结肠动脉(left colic artery, LCA)、保护性造口、吻合口漏和吻合口距离为吻合口狭窄的独立危险因素,并进一步推导以下预测模型公式=0.074×LCA+5.353×保护性造口+12.027×吻合口漏+7.578×吻合口距离。临床决策曲线显示,如果特定患者的阈值概率 > 0,使用该模型预测吻合口狭窄可提供更多益处;进一步ROC曲线分析评估模型的预测能力,AUC为0.871,临界值为15.444,灵敏度为64.1%,特异性为94.8%。此外,模型的校准曲线表明,列线图预测结果与直肠癌患者的实际情况吻合较好。
3 总结与展望CRC术后并发症是由围手术期多种因素共同作用所导致。临床预测模型的应用有助于医务人员早期识别高危人群,有针对性地加强预防措施来降低风险。随着国内外有关CRC术后并发症的危险因素的分析及预测模型的构建,模型的预测性能不断提高。部分模型仅包含术前预测因子,可在术前计算患者术后并发症风险,为其制定个性化的手术治疗方案。
然而,现有的模型研究还存在一些局限性:(1)大多数模型是建立在回顾性病例研究基础上,容易受样本特征、时期和区域的差异而发生偏倚;(2)基于单中心地区人群资料所建立的预测模型未评估模型的外部有效性;(3)部分研究样本量较小,所纳入预测因子的影响可能被高估。
尽管存在以上不足,但整合了多项风险因素的预测模型仍然是评估CRC术后并发症风险的可靠方式,具有重要的临床价值。因此,今后的模型研究可通过开展前瞻性、大样本、多中心的研究,选择外部数据进行模型验证以开发预测性能更高的风险评分模型,同时还可通过荟萃分析或文献筛选更多公认的预测因子提高预测模型的临床适用性和可推广性。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
林浩:论文的构思与撰写
胡婷:文献分析、协助论文撰写
王朝樣、张海宝、巨家华:文献收集、数据整理与分析
俞永江:论文审校
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Hashiguchi Y, Muro K, Saito Y, et al. Japanese society for cancer of the colon and rectum (JSCCR) guidelines 2019 for the treatment of colorectal cancer[J]. Int J Clin Oncol, 2020, 25(1): 1-42. DOI:10.1007/s10147-019-01485-z |
| [3] |
Kazama K, Numata M, Aoyama T, et al. Does the endoscopic surgical skill qualification system improve patients' outcome following laparoscopic surgery for colon cancer? a multicentre, retrospective analysis with propensity score matching[J]. World J Surg Oncol, 2021, 19(1): 53. DOI:10.1186/s12957-021-02155-z |
| [4] |
Arnarson Ö, Butt-Tuna S, Syk I. Postoperative complications following colonic resection for cancer are associated with impaired long-term survival[J]. Colorectal Dis, 2019, 21(7): 805-815. DOI:10.1111/codi.14613 |
| [5] |
Moons KG, Altman DG, Reitsma JB, et al. Transparent reporting of a multivariable prediction model for individual prognosis or diagnosis (TRIPOD): explanation and elaboration[J]. Ann Intern Med, 2015, 162(1): W1-W73. DOI:10.7326/M14-0698 |
| [6] |
谷鸿秋, 王俊峰, 章仲恒, 等. 临床预测模型: 模型的建立[J]. 中国循证心血管医学杂志, 2019, 11(1): 14-16. [Gu HQ, Wang JF, Zhang ZH, et al. Clinical prediction models: model development[J]. Zhongguo Xun Zheng Xin Xue Guan Yi Xue Za Zhi, 2019, 11(1): 14-16.] |
| [7] |
Alba AC, Agoritsas T, Walsh M, et al. Discrimination and calibration of clinical prediction models: users' guides to the medical literature[J]. JAMA, 2017, 318(14): 1377-1384. DOI:10.1001/jama.2017.12126 |
| [8] |
Moons KG, Kengne AP, Woodward M, et al. Risk prediction models: I. development, internal validation, and assessing the incremental value of a new (bio) marker[J]. Heart, 2012, 98(9): 683-690. DOI:10.1136/heartjnl-2011-301246 |
| [9] |
史可为, 吴亚飞, 方亚. 临床预测模型的可解释性及应用进展[J]. 现代预防医学, 2023, 50(6): 1122-1127. [Shi KW, Wu YF, Fang Y. Interpretability and application progress of clinical prediction models[J]. Xian Dai Yu Fang Yi Xue, 2023, 50(06): 1122-1127. DOI:10.20043/j.cnki.MPM.202208083] |
| [10] |
王磊, 韩晖琼, 秦艳茹. 基于SEER数据库的转移性结肠癌患者早期死亡预测列线图模型构建[J]. 肿瘤防治研究, 2023, 50(2): 126-131. [Wang L, Han HQ, Qin YR. Nomogram for predicting early death in patients with metastatic colon cancer based on SEER database[J]. Zhong Liu Fang Zhi Yan Jiu, 2023, 50(2): 126-131. DOI:10.3971/j.issn.1000-8578.2023.22.0884] |
| [11] |
张秀强, 杨涛. 基于列线图模型对肺癌胸腔镜术后并发肺部感染的临床预测[J]. 肿瘤防治研究, 2023, 50(1): 52-57. [Zhang XQ, Yang T. Clinical prediction of lung cancer complicated with pulmonary infection after thoracoscopic surgery based on nomogram model[J]. Zhong Liu Fang Zhi Yan Jiu, 2023, 50(1): 52-57.] |
| [12] |
陈明芬, 范雪梅, 刘颖, 等. 术前衰弱评估与老年结直肠癌患者术后并发症相关性[J]. 中国老年学杂志, 2022, 42(20): 5133-5136. [Chen MF, Fan XM, Liu Y, et al. Preoperative frailty assessment is associated with postoperative complications in elderly patients with colorectal cancer[J]. Zhongguo Lao Nian Xue Za Zhi, 2022, 42(20): 5133-5136.] |
| [13] |
Souwer E, Bastiaannet E, Steyerberg EW, et al. A prediction model for severe complications after elective colorectal cancer surgery in patients of 70 years and older[J]. Cancers (Basel), 2021, 13(13): 3110. DOI:10.3390/cancers13133110 |
| [14] |
Wen J, Pan T, Yuan YC, et al. Nomogram to predict postoperative infectious complications after surgery for colorectal cancer: a retrospective cohort study in China[J]. World J Surg Oncol, 2021, 19(1): 204. DOI:10.1186/s12957-021-02323-1 |
| [15] |
Jiang HH, Dong XL, Tang X, et al. Nomogram for predicting risk of intestinal complications after colorectal cancer surgery[J]. Med Sci Monit, 2019, 25: 2104-2111. DOI:10.12659/MSM.915692 |
| [16] |
Abd EI Aziz MA, Perry WR, Grass F, et al. Predicting primary postoperative pulmonary complications in patients undergoing minimallyinvasive surgery for colorectal cancer[J]. Updates Surg, 2020, 72(4): 977-983. |
| [17] |
卜宁, 赵莎, 汪博, 等. 基于术前血红蛋白浓度构建列线图模型预测结直肠癌术后手术部位感染的研究[J]. 国际麻醉学与复苏杂志, 2022, 43(2): 151-158. [Bu N, Zhao S, Wang B, et al. A nomogram based on preoperative hemoglobin levels for the prediction of postoperative surgical site infection in patients with colorectal cancer[J]. Guo Ji Ma Zui Xue Yu Fu Su Za Zhi, 2022, 43(2): 151-158.] |
| [18] |
Pei G, Zhen S, Zhang B. A novel nomogram based on nutritional and immune status predicting postoperative intra-abdominal infection in colorectal cancer[J]. Asia Pac J Clin Nutr, 2022, 31(4): 626-635. |
| [19] |
卜宁, 赵敏, 赵莎, 等. 结直肠癌术后肠梗阻的危险因素分析及预测模型建立[J]. 临床麻醉学杂志, 2021, 37(7): 677-683. [Bu N, Zhao M, Zhao S, et al. Establishment of a nomogram model predicting risk of postoperative ileus after colorectal cancer surgery[J]. Lin Chuang Ma Zui Xue Za Zhi, 2021, 37(7): 677-683.] |
| [20] |
Yang S, Zhao H, Yang J, et al. Risk factors of early postoperative bowel obstruction for patients undergoing selective colorectal surgeries[J]. BMC Gastroenterol, 2021, 21(1): 480. |
| [21] |
Sparreboom CL, Komen N, Rizopoulos D, et al. A multicentre cohort study of serum and peritoneal biomarkers to predict anastomotic leakage after rectal cancer resection[J]. Colorectal Dis, 2020, 22(1): 36-45. |
| [22] |
Shi J, Wu Z, Wu X, et al. Early diagnosis of anastomotic leakage after colorectal cancer surgery using an inflammatory factors-based score system[J]. BJS Open, 2022, 6(3): zrac069. |
| [23] |
Hu X, Guo P, Zhang N, et al. Nomogram for benign anastomotic stricture after surgery for rectal cancer[J]. Asian J Surg, 2023, 46(1): 111-119. |
| [24] |
Artiles-Armas M, Roque-Castellano C, Fariña-Castro R, et al. Impact of frailty on 5-year survival in patients older than 70 years undergoing colorectal surgery for cancer[J]. World J Surg Oncol, 2021, 19(1): 106. |
| [25] |
Koo CY, Tai BC, Chan DKH, et al. Chemotherapy and adverse cardiovascular events in colorectal cancer patients undergoing surgical resection[J]. World J Surg Oncol, 2021, 19(1): 21. |
| [26] |
Ide S, Okugawa Y, Omura Y, et al. Geriatric nutritional risk index predicts cancer prognosis in patients with local advanced rectal cancer undergoing chemoradiotherapy followed by curative surgery[J]. World J Surg Oncol, 2021, 19(1): 34. |
| [27] |
Lawler J, Choynowski M, Bailey K, et al. Meta-analysis of the impact of postoperative infective complications on oncological outcomes in colorectal cancer surgery[J]. BJS Open, 2020, 4(5): 737-747. |
| [28] |
Balvardi S, Pecorelli N, Castelino T, et al. Impact of facilitation of early mobilization on postoperative pulmonary outcomes after colorectal surgery: a randomized controlled trial[J]. Ann Surg, 2021, 273(5): 868-875. |
| [29] |
Qin PP, Jin JY, Wang WJ, et al. Perioperative breathing training to prevent postoperative pulmonary complications in patients undergoing laparoscopic colorectal surgery: a randomized controlled trial[J]. Clin Rehabil, 2021, 35(5): 692-702. |
| [30] |
Dai Y, Sun G, Hu H, et al. Risk factors for postoperative pulmonary complications in elderly patients receiving elective colorectal surgery: a retrospective study[J]. Front Oncol, 2022, 12: 1002025. |
| [31] |
Horan TC, Andrus M, Dudeck MA. CDC/NHSN surveillance definition of health care-associated infection and criteria for specific types of infections in the acute care setting[J]. Am J Infect Control, 2008, 36(5): 309-332. |
| [32] |
Huh JW, Lee WY, Park YA, et al. Oncological outcome of surgical site infection after colorectal cancer surgery[J]. Int J Colorectal Dis, 2019, 34(2): 277-283. |
| [33] |
Quiroga-Centeno AC, Jerez-Torra KA, Martin-Mojica PA, et al. Risk factors for prolonged postoperative ileus in colorectal surgery: a systematic review and meta-analysis[J]. World J Surg, 2020, 44(5): 1612-1626. |
| [34] |
Rahbari NN, Weitz J, Hohenberger W, et al. Definition and grading of anastomotic leakage following anterior resection of the rectum: a proposal by the International Study Group of Rectal Cancer[J]. Surgery, 2010, 147(3): 339-351. |
| [35] |
Clifford RE, Fowler H, Manu N, et al. Management of benign anastomotic strictures following rectal resection: a systematic review[J]. Colorectal Dis, 2021, 23(12): 3090-3100. |
| [36] |
Picazo-Ferrera K, Jaurrieta-Rico C, Manzano-Robleda M, et al. Risk factors and endoscopic treatment for anastomotic stricture after resection in patients with colorectal cancer[J]. Rev Gastroenterol Mex (Engl Ed), 2021, 86(1): 44-50. |
 2023, Vol. 50
2023, Vol. 50


