文章信息
- 卵巢癌一级预防研究进展
- Primary Prevention of Ovarian Cancer
- 肿瘤防治研究, 2023, 50(3): 224-228
- Cancer Research on Prevention and Treatment, 2023, 50(3): 224-228
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1176
- 收稿日期: 2022-10-09
- 修回日期: 2022-12-24
一级预防又称病因预防,多数肿瘤的病因往往还不清楚。就风险可归因的癌症而言,欧美国家癌症发病率处于下降趋势,而我国仍然处于上升趋势。生活方式(吸烟、酒精摄入等)、职业环境因素和代谢因素是癌症发生的主要相关因素。目前,以生活方式、职业环境为主要风险的癌症,中国人群发病风险要比欧美国家高;而代谢相关的癌症,美国比中国高。但值得警惕的是,随着城市化进程加速,工作节奏加快,未来中国代谢相关类癌症有上升趋势[1]。
癌症已成为我国一个重大的公共卫生问题,肿瘤预防需要多省份,尤其是经济欠发达地区的重视和长期合作,以帮助减轻癌症带来的经济及医疗负担。国家癌症预防体系,尤其高校公共卫生学院癌症预防学科的建立,显得尤为重要。目前我国公共卫生与预防医学专业,主要负责包括传染病、慢性病等在内的相关疾病控制。然而疾病的预防,尤其是肿瘤的预防,起步较晚,相关杂志影响力也不足,公众普遍对肿瘤预防的意识度不够。
2016年我国卵巢癌新发病例数为5.72万例,年龄标化发病率5.59/105(以下均为年龄标准化率);死亡病例2.72万例,死亡率2.45/105。据美国SEER数据库统计,发达国家卵巢癌的发病率为每年10.6/105,平均每年下降2.8%,死亡率为6.3/105。人群中卵巢癌的终生发病风险为1.1%~2.0%。卵巢癌病死率高,发病率因国家而异。由于缺乏有效的筛查手段、症状不典型,大多数患者发现时即为晚期,疾病的治疗给个人、社会和国家均增加了沉重的经济负担。因此,更深入地了解卵巢癌,寻找其可能存在的高危因素,减少卵巢癌的发生,是非常有必要的。
目前对卵巢癌的病因认识非常有限。卵巢癌发生可能的因素有卵巢癌/乳腺癌家族史、BRCA基因突变、肥胖、绝经后激素替代治疗、不孕不育等。针对不同卵巢癌风险人群,建议选择不同的筛查策略和干预措施。
1 卵巢癌发生的可能因素 1.1 遗传因素15%~20%的卵巢癌发病归因于乳腺癌易感基因(BRCA)突变,包括BRCA1及BRCA2基因。携带BRCA1或BRCA2致病突变的女性面临着极高的终生卵巢癌发病风险。其中,BRCA1突变携带者的卵巢癌终生发病风险率约为44%,BRCA2突变携带者终生发病风险率为17%[2],远高于普通人群患病风险。此外,其他一些基因的突变(包括RAD51C、RAD51D、BRIP1、STK11等)也与卵巢癌的发病相关,可导致5%~15%或更高的卵巢癌终生发病风险率[3]。高达25%的卵巢癌由家族癌症综合征引起,其中包括遗传性非息肉性结肠癌(HNPCC)、PJS综合征等。即使没有明确基因突变,有一个一级亲属患卵巢癌的人群罹患卵巢癌风险为普通人群的3倍。
1.2 生活方式与其他国家相比,中国的饮食相关癌症死亡率(42/105)和伤残调整寿命年(889/105)最高[4]。卵巢癌风险随着体重指数的增加而增加[5]。糖尿病患者卵巢癌发病率轻度升高。吸烟会增加黏液性卵巢癌的发病风险,但不增加浆液性癌的风险[6]。目前暂无研究表明饮食、酒精摄入与卵巢癌发病风险之间的关联。
绝经期激素替代治疗(hormone replacement therapy, HRT)与卵巢癌发病风险增加有关[7]。激素替代治疗10年以上的女性,即使停药后,仍将面临29年的卵巢癌高发病风险。即使使用激素替代疗法不到5年也会增加卵巢癌发病风险,停止HRT后风险降低,其致病风险不会因制剂类型、年龄而有所差别。
1.3 职业和环境因素2017年,石棉暴露导致的卵巢癌在德国被指定为首个新的妇科职业病[8]。职业性接触石棉的女性患卵巢癌的风险成倍增加。与工作相关的石棉暴露人群死于卵巢癌的风险增加2.25倍。因此,妇科肿瘤医生须全面了解患者的职业是否有石棉接触史。此外,滑石粉与卵巢癌风险之间的关系存在争议。对16项研究的荟萃分析观察到使用滑石粉的人群卵巢癌风险增加,但并未发现剂量反应关系[9]。上海肿瘤研究所进行的一项关于卵巢癌危险因素的病例对照研究显示,职业性油漆接触史可增加卵巢癌发病风险[10]。
1.4 疾病和生殖相关因素子宫内膜异位症是一种常见的妇科良性疾病,5%~10%的绝经前妇女患有该病,是不孕不育的原因之一,也被认为是一些特定类型卵巢癌的前驱——子宫内膜异位症相关的卵巢癌,主要包括卵巢透明细胞癌和子宫内膜样腺癌[11]。
女性35岁后首次足月妊娠或从未足月妊娠的女性患卵巢癌的风险更高。不孕症与卵巢癌风险增加相关。关于卵巢过度刺激与卵巢癌之间的关联仍存争议。一项纳入9项队列研究的荟萃分析显示[12],因不孕症接受体外受精而导致卵巢过度刺激的109 969例女性,其中76例发生卵巢癌。与普通人群比较,卵巢癌发病风险增加,差异有统计学意义;与未暴露的不孕女性比较,卵巢癌发病风险差异无统计学意义。
2 卵巢癌不同风险等级的人群分层根据卵巢癌的终生发病风险大小,可将人群分为卵巢癌高风险人群和普通人群。普通人群中卵巢癌的终生发病风险为1.1%~2.0%,而高风险人群一般认为是卵巢癌终生发病风险高于10%的人群[13],包括胚系BRCA突变、其他相关基因突变(RAD51C、RAD51D等)或有乳腺癌/卵巢癌家族史的人群。针对不同卵巢癌风险人群,建议不同的筛查策略和干预措施,见图 1。
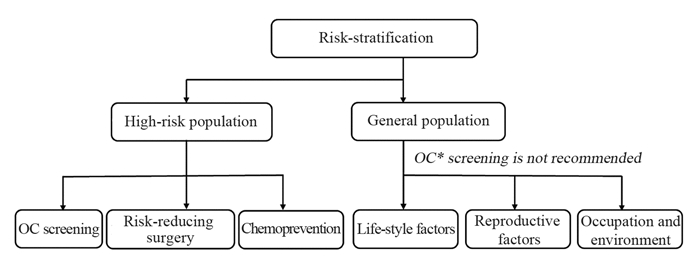
|
| 图 1 卵巢癌风险分层的一级预防 Figure 1 Primary prevention for ovarian cancer (OC) in accordance with risk stratification |
普通人群是否可以通过卵巢癌筛查降低卵巢癌的死亡率?2011年PLCO试验指出:在美国普通人群中,血液检测CA125联合经阴道超声的卵巢癌筛查并不能降低其死亡率,其带来的假阳性结果不但给患者带来沉重的心理负担,还会导致过度医疗和并发症的发生[14]。长期随访跟踪也证实了这一点。
2016年,一项在20多万名女性中开展的为期20年的UKCTOCS研究也呈现出类似结果[15]。尽管年度多模式筛查(血液检测CA125联合经阴道超声)可以提前发现卵巢癌,但并未降低卵巢癌整体死亡率。鉴于普通人群筛查并不能显著减少卵巢癌的死亡,研究不建议通过血清CA125联合经阴道超声或单纯经阴道超声对普通人群进行卵巢癌筛查。
与高风险人群不同,建议针对普通人群进行生活方式方面的干预,有条件的情况下,提出生育、哺乳等方面的合理建议,包括维持正常体重、适当运动、增加生育次数,增加母乳喂养时间等。与未生育女性相比,经产妇卵巢癌风险可降低30%~60%,每增加一次生育,对卵巢就有一次额外的保护。也有研究指出,生育4个或更多子女才能降低卵巢癌的发生风险。母乳喂养超过12个月与BRCA1突变携带者卵巢癌发病风险降低有关[16]。也有研究支持任何时间长度的母乳喂养都与卵巢癌发病风险降低相关。
3.2 高风险人群筛查及干预 3.2.1 高风险人群筛查美国PLCO研究表明,CA125联合经阴道超声可提高卵巢癌高风险人群的早期诊断,改善预后[14]。CA125是一种用于卵巢肿瘤监测的标志物,对卵巢癌的诊断敏感度高,但特异性较低。Skates等[17]提出,每位女性CA125基准水平可能不一致,正常水平会在基准水平上下波动,临床应用中CA125的变化幅度相对其绝对值更为重要,据此提出了卵巢癌风险算法。
降风险的输卵管卵巢切除术(risk-reducing salpingo-oophoretomy, RRSO)可以降低乳腺癌、卵巢癌、输卵管癌和原发性腹膜癌的发病可能性,效果优于筛查。对于选择推迟或拒绝RRSO的高风险人群患者,尤其在病理专科医生不足,无法行连续切片的情况下,选择CA125监测和经阴道超声的可行性比较好,但还缺乏高级别的证据支持。
我国对基因突变人群或有家族史人群的管理,不少医院设有专门的遗传咨询门诊。但大多是单兵作战,缺乏公共卫生决策的科学依据。因此,公共卫生经费支持的高危人群筛查、长期随访和人群管理亟待解决。
3.2.2 手术干预理论上RRSO是降低卵巢癌风险的最有效的选择[18],预防性卵巢切除可降低80%的BRCA1和BRCA2携带者的卵巢癌、输卵管癌和腹膜癌的发病风险。RRSO适用人群不仅包括BRCA1/BRCA2携带者,还包括处于中等风险(≥4%~5%的终生卵巢癌发病风险)的女性,可降低卵巢癌发病风险的80%~96%。目前,NCCN指南推荐携带BRCA1突变的女性在35~40岁进行RRSO;推荐携带BRCA2突变患者在40~45岁进行RRSO,以最大限度预防和减少不良反应。
然而,RRSO的并发症发生率为1.5%~5%,包括增加冠心病、中风、骨质疏松等患病风险,或引起严重的更年期症状。为此,很多女性会将RRSO延迟到绝经后。单纯的输卵管切除术并不是治疗的标准,但仍可作为降低普通人群卵巢癌风险的有效措施。根据现有研究,单纯输卵管切除术适用于终生患卵巢癌风险低于5%的女性。降低风险的早期输卵管切除术和延迟卵巢切除术也已成为越来越多卵巢癌高风险、要求延迟绝经患者的选择,但该方法的安全性和有效性还有待进一步临床研究。也有研究指出,输卵管结扎是预防卵巢癌的有效手段,可降低携带BRCA1突变人群22%~80%的卵巢癌患病风险。
3.2.3 化学预防近年来,卵巢癌的化学预防为所有女性、尤其是卵巢癌患病高风险女性提供了更多新的预防手段。这些化学预防手段包括口服避孕药、非甾体类抗炎药、类维生素A、抗血管生成药物等。
口服避孕药5年或更长时间已被证明可降低约50%的BRCA1和BRCA2突变携带者发生卵巢癌的风险。最新的一项国际队列研究[19]显示,口服避孕药使用时间越长,卵巢癌发生风险越低。在停止口服避孕药治疗后,观察到的保护效应持续存在,但会随着时间的推移而减弱。流行病学证据强烈支持口服避孕药对具有BRCA1或BRCA2突变的女性患卵巢癌风险具有显著保护作用。
炎性反应相关暴露因素,如子宫内膜异位症、盆腔炎、炎性反应循环生物标志物水平较高等均与卵巢癌的发病风险升高有关。慢性炎性反应作为排卵过程中卵巢上皮破坏的相关因素,可能在卵巢癌的发生过程中起到关键作用。最近的一项荟萃分析[20]显示,高频率服用阿司匹林(用药≥6天/周或≥28天/月,至少持续6个月)与卵巢癌风险降低13%相关。除子宫内膜异位症外,具有其他卵巢癌风险因素的女性高频率使用阿司匹林,卵巢癌发病风险降低最高可达21%。
4 我国卵巢癌人群筛查状况评估癌症发生趋势对未来癌症的防控至关重要,但由于缺乏队列随访数据,我国的相关研究较少。上海市疾控中心评估了过去四十年(1973—2012年)上海城市女性妇科癌症发病率和死亡率的长期趋势[21],该研究不仅为上海未来的妇科癌症防治工作奠定了基础,也为国内其他同样快速发展的地区提供了参考依据。研究显示,过去40年来,随着经济发展、生育政策、生活方式的变化,宫颈癌发病率及死亡率大幅下降,子宫癌发病率有所增加,其中子宫癌死亡率明显下降。与前两者不同,卵巢癌的发病率每年增加1.8%,而由于医疗水平,特别是上海外科技术的快速进步,每年的死亡率增加0.6%,较前相对稳定。该长期趋势反映,随着时间的推移,社会经济的快速发展和城市化进程的加快,中国女性妇科癌症的风险和预后因素也在不断变化,有向发达国家转变的趋势。促进健康生活方式的选择、高危人群的科学管理、疾病危害科普宣传的加强是目前预防卵巢癌的最佳方法。
5 总结卵巢癌除了遗传因素外,没有明确病因,因而缺乏有效的筛查手段。对于卵巢癌高风险人群,建议加强肿瘤预防意识和科学管理,减少单兵作战。对普通人群,建议加强对疾病症状的科普宣传,促进健康的生活方式。目前我国肿瘤的预防,包括卵巢癌的一级预防仍处于初级阶段,如何提高对卵巢癌危险因素的认识、识别卵巢癌的高危人群、采用有效的筛查手段,从源头上降低卵巢癌的发生,需公众、政府及医疗行业的共同努力。相比于医保基金大量投入晚期患者的治疗,政府投入致死率高的肿瘤预防将事半功倍。
作者贡献:
沈丽娜:论文撰写
臧荣余:论文审校
| [1] |
GBD 2019 Cancer Risk Factors Collaborators. The global burden of cancer attributable to risk factors, 2010-19: a systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet, 2022, 400(10352): 563-591. DOI:10.1016/S0140-6736(22)01438-6 |
| [2] |
Kuchenbaecker KB, Hopper JL, Barnes DR, et al. Risks of Breast, Ovarian, and Contralateral Breast Cancer for BRCA1 and BRCA2 Mutation Carriers[J]. JAMA, 2017, 317(23): 2402-2416. DOI:10.1001/jama.2017.7112 |
| [3] |
Norquist BM, Harrell MI, Brady MF, et al. Inherited Mutations in Women With Ovarian Carcinoma[J]. JAMA Oncol, 2016, 2(4): 482-490. DOI:10.1001/jamaoncol.2015.5495 |
| [4] |
GBD 2017 Diet Collaborators. Health effects of dietary risks in 195 countries, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2019, 393(10184): 1958-1972. DOI:10.1016/S0140-6736(19)30041-8 |
| [5] |
Bhaskaran K, Douglas I, Forbes H, et al. Body-mass index and risk of 22 specific cancers: a population-based cohort study of 5·24 million UK adults[J]. Lancet, 2014, 384(9945): 755-765. DOI:10.1016/S0140-6736(14)60892-8 |
| [6] |
Collaborative Group on Epidemiological Studies of Ovarian Cancer, Beral V, Gaitskell K, et al. Cancer CGoESoO. Ovarian cancer and smoking: individual participant meta-analysis including 28 114 women with ovarian cancer from 51 epidemiological studies[J]. Lancet Oncol, 2012, 13(9): 946-956. DOI:10.1016/S1470-2045(12)70322-4 |
| [7] |
Rodriguez C, Patel AV, Calle EE, et al. Estrogen Replacement Therapy and Ovarian Cancer Mortality in a Large Prospective Study of US Women[J]. JAMA, 2001, 285(11): 1460-1465. DOI:10.1001/jama.285.11.1460 |
| [8] |
Nowak D, Schmalfeldt B, Tannapfel A, et al. Asbestos Exposure and Ovarian Cancer- a Gynaecological Occupational Disease. Background, Mandatory Notification, Practical Approach[J]. Geburtshilfe Frauenheilkd, 2021, 81(5): 555-561. DOI:10.1055/a-1361-1715 |
| [9] |
Huncharek M, Geschwind JF, Kupelnick B. Perineal application of cosmetic talc and risk of invasive epithelial ovarian cancer: a meta-analysis of 11, 933 subjects from sixteen observational studies[J]. Anticancer Res, 2003, 23(2Cc): 1955-1960. |
| [10] |
Shu XO, Brinton LA, Gao YT, et al. Population-based Case-Control Study of Ovarian Cancer in Shanghai[J]. Cancer Res, 1989, 49(13): 3670-3674. |
| [11] |
Pearce CL, Templeman C, Rossing MA, et al. Association between endometriosis and risk of histological subtypes of ovarian cancer: a pooled analysis of case-control studies[J]. Lancet Oncol, 2012, 13(4): 385-394. DOI:10.1016/S1470-2045(11)70404-1 |
| [12] |
Siristatidis C, Sergentanis TN, Kanavidis P, et al. Controlled ovarian hyperstimulation for IVF: impact on ovarian, endometrial and cervical cancer-a systematic review and meta-analysis[J]. Hum Reprod Update, 2013, 19(2): 105-123. DOI:10.1093/humupd/dms051 |
| [13] |
Menon U, Karpinskyj C, Gentry-Maharaj A. Ovarian Cancer Prevention and Screening[J]. Obstet Gynecol, 2018, 131(5): 909-927. DOI:10.1097/AOG.0000000000002580 |
| [14] |
Buys SS, Partridge E, Black A, et al. Effect of screening on ovarian cancer mortality: the Prostate, Lung, Colorectal and Ovarian (PLCO) Cancer Screening Randomized Controlled Trial[J]. JAMA, 2011, 305(22): 2295-2303. DOI:10.1001/jama.2011.766 |
| [15] |
Jacobs IJ, Menon U, Ryan A, et al. Ovarian cancer screening and mortality in the UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS): a randomised controlled trial[J]. Lancet, 2016, 387(10022): 945-956. DOI:10.1016/S0140-6736(15)01224-6 |
| [16] |
Friebel TM, Domchek SM, Rebbeck TR. Modifiers of cancer risk in BRCA1 and BRCA2 mutation carriers: systematic review and meta-analysis[J]. J Natl Cancer Inst, 2014, 106(6): dju091. |
| [17] |
Skates SJ, Greene MH, Buys SS, et al. Early Detection of Ovarian Cancer using the Risk of Ovarian Cancer Algorithm with Frequent CA125 Testing in Women at Increased Familial Risk-Combined Results from Two Screening Trials[J]. Clin Cancer Res, 2017, 23(14): 3628-3637. DOI:10.1158/1078-0432.CCR-15-2750 |
| [18] |
Finch AP, Lubinski J, Møller Moller P, et al. Impact of oophorectomy on cancer incidence and mortality in women with a BRCA1 or BRCA2 mutation[J]. J Clin Oncol, 2014, 32(15): 1547-1553. DOI:10.1200/JCO.2013.53.2820 |
| [19] |
Schrijver LH, Antoniou AC, Olsson H, et al. Oral contraceptive use and ovarian cancer risk for BRCA1/2 mutation carriers: an international cohort study[J]. Am J Obstet Gynecol, 2021, 225(1): 51. e1-51. e17. DOI:10.1016/j.ajog.2021.01.014 |
| [20] |
Hurwitz LM, Townsend MK, Jordan SJ, et al. Modification of the Association Between Frequent Aspirin Use and Ovarian Cancer Risk: A Meta-Analysis Using Individual-Level Data From Two Ovarian Cancer Consortia[J]. J Clin Oncol, 2022, 22: JCO2101900. |
| [21] |
Huang Z, Zheng Y, Wen W, et al. Incidence and mortality of gynaecological cancers: Secular trends in urban Shanghai, China over 40 years[J]. Eur J Cancer, 2016, 63: 1-10. DOI:10.1016/j.ejca.2016.04.016 |
 2023, Vol. 50
2023, Vol. 50


