文章信息
- 基于术前FAR和SII的预后模型与TNM分期系统在评估胰腺癌根治术患者预后中的比较
- Prognostic Model Based on Preoperative FAR and SII Versus TNM Staging System in Evaluating Prognosis of Patients with Pancreatic Cancer After Radical Resection
- 肿瘤防治研究, 2023, 50(3): 264-270
- Cancer Research on Prevention and Treatment, 2023, 50(3): 264-270
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1090
- 收稿日期: 2022-09-19
- 修回日期: 2022-11-22
胰腺癌是一种高度致命的疾病,预后较差,其中95%的胰腺癌是导管腺癌[1-3]。5年生存率为8%~9%[4-5]。目前,手术切除仍是胰腺癌的唯一根治方法。然而,早期胰腺癌患者体征及临床症状较为隐匿,大多数患者在初步诊断时已经转移,这意味着只有少部分患者适合手术治疗[6]。此外,即使进行完全切除,胰腺癌的预后也很差。在临床实践过程中通常使用肿瘤淋巴结转移(TNM)分期系统评估癌症患者预后,但是由于同一疾病阶段患者的遗传和生物学特征的差异,导致TNM分期系统的预测准确性有限[7]。目前,多种临床指标用于预测肿瘤的预后,如凝血、炎症和营养状况等[8]。多项研究发现,纤维蛋白原/白蛋白比值(FAR)与多种恶性肿瘤的预后有关,如胰腺癌、结直肠癌、肝内胆管癌、膀胱癌、乳腺癌等[9-13],FAR升高常提示恶性肿瘤预后不良。多项研究发现SII是胰腺癌患者术后的独立预测因子[14-15]。因此,本研究基于胰腺癌病例资料数据库,分析影响胰腺癌根治术后的独立预后因素,建立新的预测模型并进行评价,以期为临床医生个体化治疗提供方案,使患者获益。
1 资料与方法 1.1 研究对象回顾性分析2016年1月至2019年12月在兰州大学第二医院行胰腺癌根治术的102例胰腺导管腺癌患者的临床病理资料。纳入标准:(1)符合根治性手术指征;(2)病理诊断为胰腺导管腺癌;(3)无其他恶性肿瘤病史;(4)临床病理资料完整。排除标准:(1)组织学诊断为非胰腺导管腺癌;(2)术后因严重并发症致生存期 < 30 d;(3)患有影响血细胞分析的疾病,如血液系统疾病、急性或慢性感染性疾病等;(4)患者接受过新辅助放化疗;(5)临床病理资料缺失。本研究通过兰州大学第二医院伦理委员会审批(批号:2022A-237)。
1.2 资料收集通过本院电子病历系统于术前1周收集患者的一般资料和临床资料,包括性别、年龄、血常规(血小板、中性粒细胞和淋巴细胞绝对值计数)、纤维蛋白原、血清白蛋白及肿瘤标志物结果(CEA、CA125、CA199);通过本院电子病历系统收集术后病理报告(含肿瘤大小、肿瘤位置、肿瘤分期(依据美国联合癌症委员会第8版肿瘤分期)、肿瘤分化程度、手术切缘、有无脉管和神经侵犯等)、术后有无化疗等资料。
1.3 术后随访采用门诊、电话及复查病例方式进行随访,术后3个月内每月随访1次,之后每3个月随访1次,2年后半年随访1次。随访内容包括进行临床及实验室检查、了解患者术后生存情况等。随访时间截至2022年3月。总生存期(OS)定义为自手术日期至末次有效随访日期或患者死亡日期。
1.4 统计学方法SPSS26.0统计软件对数据进行分析,Kaplan-Meier法进行生存分析,生存率差异比较采用Log rank检验,R4.2.0软件绘制生存曲线。X-tile软件确定CEA、CA125及CA199预测胰腺癌根治术后患者OS的最佳截断值。ROC曲线分析FAR和SII预测胰腺癌根治术后患者OS的最佳截断值(由约登指数确定,约登指数=敏感度+特异度-1,约登指数最大处取最佳截断值),根据FAR和SII的最佳截断值将患者分为低FAR组和高FAR组、低SII组和高SII组。计数资料采用卡方检验,部分理论频数较小的变量采用连续性校正卡方检验。Cox风险比例回归模型进行单因素及多因素分析,筛选出影响预后的独立危险因素,计算风险比(HR),并根据多因素分析中的独立预后影响因素通过R4.2.0软件包建立Nomogram预后模型。一致性指数(C-index)评价该模型的区分度,C-index在0.50~0.70为准确度较低,0.71~0.90为准确度中等,高于0.90则为准确度高[16];校准曲线评价该模型一致性,预测模型对应曲线与校准图中45°对角线贴合度越高表明模型预测结果与实际情况一致性越好,计算方法采用Bootstrap法,重复抽样次数为500次。绘制列线图预测模型的ROC曲线并计算其曲线下面积(AUC)。通过决策曲线分析(DCA)评价其临床获益度。使用同样方法验证并评价TNM分期模型,比较两个模型预测效能。所有构建方法均在R4.2.0中使用多个包完成。以双侧P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料共纳入102例胰腺导管腺癌患者。截至随访时间,死亡81例,存活21例。中位随访时间为16个月,术后1、2、3年生存率分别为52.0%、39.2%、22.2%。FAR和SII预测胰腺癌根治术后患者OS的ROC曲线,见图 1,其AUC分别为0.596和0.715,最佳截断值分别为0.095和532.945。

|
| 图 1 FAR(A)、SII(B)预测胰腺癌根治术后患者总生存期的ROC曲线 Figure 1 The ROC curves of FAR(A) and SII(B) predicting OS of pancreatic cancer patients after radical resection |
根据FAR、SII的最佳截断值将患者分为低FAR组(< 0.095)与高FAR组(≥ 0.095)、低SII组(< 532.945)与高SII组(≥ 532.945)。高FAR组与低FAR组患者术前CEA水平比较,差异有统计学意义(P=0.006);高SII组与低SII组患者术前CEA水平、术前CA199水平、脉管侵犯、化疗状态比较,差异具有统计学意义(均P < 0.05),见表 1。
|
随访时间为2~62个月,中位随访时间为16个月。Kaplan-Meier法和Log rank检验结果显示,高FAR组和高SII组患者的OS明显短于低FAR组(P=0.0024)和低SII组(P < 0.0001),见图 2。

|
| 图 2 不同FAR(A)、SII(B)患者的总生存曲线图 Figure 2 Survival curves of OS of patients with different FAR(A) and SII(B) |
单因素分析结果显示,FAR、SII、CEA、CA199、肿瘤最大径、化疗状态与胰腺癌根治术后患者OS有关(均P < 0.05),而性别、年龄、肿瘤位置、CA125、TNM分期、分化程度、手术切缘、脉管侵犯、神经侵犯与胰腺癌根治术后患者OS无关。将单因素分析中P < 0.05的因素纳入多因素Cox回归分析,结果显示,FAR≥ 0.095、SII ≥ 532.945、CA199≥450.9 u/ml、肿瘤最大径≥4 cm、术后未进行化疗是影响胰腺癌根治术后患者OS的独立危险因素(均P < 0.05),见表 2。

|
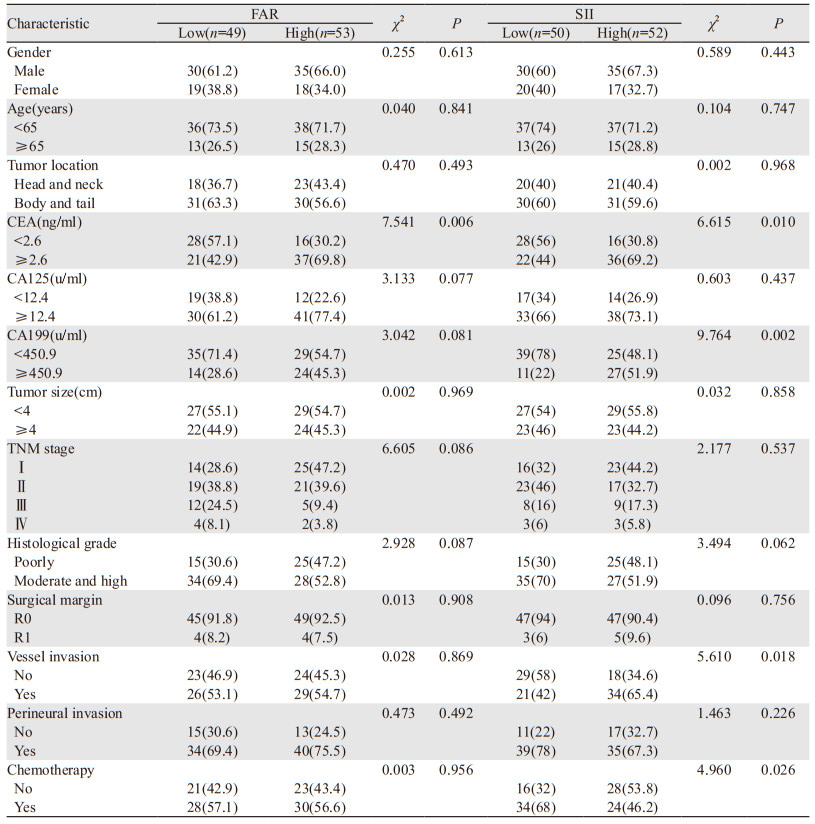
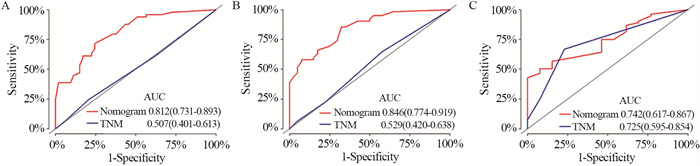
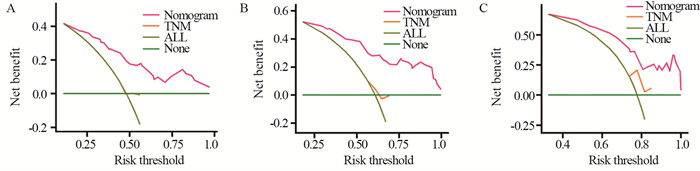
基于上述独立预后影响因素,应用R语言软件建立胰腺癌根治术后总生存率的Nomogram预后模型,见图 3。Nomogram可将各个变量Cox比例风险模型相关系数转化为0~100分,将各变量分值相加即为总分值,从总分值标尺向下画直线可得出特定患者的1、2、3年总生存率。基于Bootstrap重采样法,Nomogram预后模型内部验证的C-index为0.727(95%CI: 0.675~0.779),高于TNM系统分期(C-index=0.502, 95%CI: 0.433~0.571)。两种模型预测总生存率的ROC曲线结果显示,术后1年Nomogram预测ROC的AUC为0.812,TNM系统分期AUC为0.507;术后2年Nomogram预测ROC的AUC为0.846,TNM系统分期AUC为0.529;术后3年Nomogram预测ROC的AUC为0.742,TNM系统分期AUC为0.725,表明该Nomogram预测模型较TNM系统分期具有更好的精准度和区分度,见图 4。两种模型预测1、2、3年总生存率的校准曲线结果显示,预测模型对应曲线与校准图中45°对角线贴合度较高,表明实际观察到的术后1、2、3年生存率与预测所得生存率有较好的一致性,见图 5。决策曲线分析评估1、2、3年总生存率的Nomogram预后模型对于不同风险阈值的净收益均高于TNM系统分期的预测线,见图 6。

|
| 图 3 预测胰腺癌根治术后患者1、2、3年总生存期的列线图 Figure 3 Nomogram for predicting 1-, 2-, and 3-year OS of pancreatic cancer patients after radical resection |
|
| 图 4 Nomogram预后模型和TNM分期预后模型1(A)、2(B)、3(C)年总生存率ROC曲线 Figure 4 ROC curves of 1-year(A), 2-year(B), and 3-year(C) overall survival of Nomogram prognostic model and TNM staging prognostic model |

|
| 图 5 Nomogram预后模型(A)和TNM分期预后模型(B)1、2、3年总生存率校准曲线图 Figure 5 Calibration curves of 1-, 2-, and 3-year overall survival rates of Nomogram prognostic model(A) and TNM staging prognostic model(B) |
|
| 图 6 Nomogram预后模型和TNM分期预后模型1(A)、2(B)、3(C)年总生存率临床决策曲线 Figure 6 Clinical decision curves of 1-year(A), 2-year(B), and 3-year(C) overall survival rate of the Nomogram and TNM staging prognostic models |
研究表明,凝血功能异常和营养状况不良与恶性肿瘤的发生、发展和肿瘤患者的预后密切相关[17-19]。FAR在许多恶性肿瘤的预后评估中显示出重要的价值[9-13]。纤维蛋白原又称凝血因子Ⅰ,是血液中含量最高的凝血因子,它由肝脏、肺和肠上皮合成[20]。Liu等的研究指出,纤维蛋白原作为一种细胞外蛋白基质,不仅能促进肿瘤细胞的增殖和迁移,还可以产生分裂产物和在肿瘤细胞周围形成致密的纤维蛋白层来免受先天免疫监视系统的影响[21]。而白蛋白作为血浆中最主要的蛋白质,不仅可以反映癌症患者的营养状况,而且低水平的白蛋白还可降低机体免疫系统作用[22]。近年有研究证实,系统免疫炎症指数(SII)是评估胰腺癌预后的一项新的血液学指标[14-15]。SII影响胰腺癌患者预后可能包括以下几个方面:(1)中性粒细胞不仅通过外在途径改变肿瘤微环境,而且通过内在途径分泌一些炎症介质(如血管内皮生长因子、表皮生长因子、颗粒蛋白等)促进肿瘤细胞增殖、侵袭、淋巴结或远处器官转移[23-24];(2)淋巴细胞是机体免疫系统的重要组成成分,其主要作用为抑制肿瘤细胞增殖、转移和诱导肿瘤细胞凋亡[25]。淋巴细胞减少常伴有白细胞增多和血小板增多,这可能有助于肿瘤细胞逃避免疫监视[26];(3)血小板将肿瘤细胞包裹在血栓中来保护它们免受自然杀伤细胞的细胞溶解,此外肿瘤细胞还可通过不同的机制激活血小板[27]。活化的血小板可以产生多种生长因子(如血管内皮生长因子、血小板衍生生长因子等)促进肿瘤生长[28]。
单因素、多因素分析结果显示,FAR、SII、CA199、肿瘤最大径和化疗状态是胰腺癌根治术后患者OS的独立预后因素。其中CA199是胰腺癌的特异性标志物,可用于评估肿瘤分期和肿瘤负荷的严重程度,也是胰腺癌诊断及预后预测的指标[29]。化疗是多模式治疗胰腺癌的重要组成部分,辅助化疗可显著提高患者术后的无病生存期和总生存期[30]。而肿瘤最大径也是影响胰腺癌预后的因素[31]。此外,我们根据FAR和SII的最佳截断值对胰腺癌患者进行分组,结果表明,高FAR组胰腺癌患者OS时间明显缩短,显著低于低FAR组(P=0.0024),与既往结果一致[9, 32-33];高SII组胰腺癌患者OS时间明显缩短,显著低于低SII组(P < 0.0001),与既往结果一致[14-15, 34-35]。综上认为本研究基于以上因素构建的预后模型具有一定的临床可解释性。建立可视化预后模型能更好地发挥上述独立预后影响因素的作用,为临床决策提供帮助。Nomogram能够通过整合不同的预后和决定性变量对预后进行预测,减少单一变量评价的不确定性[36]。尽管TNM分期系统仍然是肿瘤学预后的金标准,但未包含如肿瘤大小和是否采取辅助治疗等重要影响因素,故将TNM分期相同的患者列为一组,则可能无法更好地预测患者的预后。而Nomogram预后模型弥补TNM分期预后模型的不足,其在预测总生存期方面表现出更好的准确性和更高的临床获益。
本研究中,我们根据影响胰腺癌根治术后的独立预后因素建立Nomogram预后模型,并进行评价。此外,为了确定我们的预后模型是否优于TNM分期系统,我们使用C-index、AUC、校准图和DCA来评价预后模型的性能。(1)使用C-index和AUC评价预后模型的辨别性:模型的C-index和AUC值远大于TNM分期系统,表明预后模型比TNM分期系统具有更好的辨别能力;(2)通过分析校准图来评估预后模型的准确性:图 4中的灰线代表实际情况。对于1年、2年和3年的预测,模型的线与灰线非常接近,预测点分布均匀,表明模型具有良好的准确性;(3)使用DCA来评估模型的临床有效性:结果表明,1年、2年和3年总生存率的预后模型对于不同风险阈值的净收益均高于TNM系统分期的预测线。综合以上证据,我们建立的预后模型可较好的评估胰腺癌根治术后患者预后,且在一定程度上优于TNM分期预后模型,有助于推动个体化治疗。
本研究也存在局限性:(1)本研究为回顾性研究,无法避免回顾性偏倚及随访依从性等造成的偏倚;(2)本研究没有纳入关于基因突变或缺失、肥胖、糖尿病和饮食习惯等几个因素的数据。因此,需要更广泛的研究来阐明这些因素与预后之间的关系,从而建立一个更好的预后模型;(3)本研究仅采用内部验证,可能导致模型过度拟合。需进一步的外部验证以对模型的有效性进行更准确的评估。
综上所述,本研究发现FAR≥ 0.095、SII≥ 532.945、CA199≥450.9 u/ml、肿瘤最大径≥4 cm、术后未进行化疗是影响胰腺癌根治术后患者OS的独立危险因素,基于这些因素构建的Nomogram模型是一种良好的预后模型,有助于推动个体化治疗。
作者贡献:
刘旭东:设计研究方案并实施、撰写文章
赵斌、杜鹏:修改论文并提供指导性支持
张国强、郑强、赖佳敏:采集整理数据并提供统计学指导
程志斌:设计研究方案、修改论文并提供指导性支持
| [1] |
Zhu H, Wei M, Xu J, et al. PARP inhibitors in pancreatic cancer: molecular mechanisms and clinical applications[J]. Mol Cancer, 2020, 19(1): 49. DOI:10.1186/s12943-020-01167-9 |
| [2] |
Zhang L, Sanagapalli S, Stoita A. Challenges in diagnosis of pancreatic cancer[J]. World J Gastroenterol, 2018, 24(19): 2047-2060. DOI:10.3748/wjg.v24.i19.2047 |
| [3] |
Loveday BPT, Lipton L, Thomson BN. Pancreatic cancer: An update on diagnosis and management[J]. Aust J Gen Pract, 2019, 48(12): 826-831. DOI:10.31128/AJGP-06-19-4957 |
| [4] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [5] |
Gupta R, Amanam I, Chung V. Current and future therapies for advanced pancreatic cancer[J]. J Surg Oncol, 2017, 116(1): 25-34. DOI:10.1002/jso.24623 |
| [6] |
Vincent A, Herman J, Schulick R, et al. Pancreatic cancer[J]. Lancet, 2011, 378(9791): 607-620. DOI:10.1016/S0140-6736(10)62307-0 |
| [7] |
Xie T, Wang X, Li M, et al. Pancreatic ductal adenocarcinoma: a radiomics nomogram outperforms clinical model and TNM staging for survival estimation after curative resection[J]. Eur Radiol, 2020, 30(5): 2513-2524. DOI:10.1007/s00330-019-06600-2 |
| [8] |
Wang YY, Liu ZZ, Xu D, et al. Fibrinogen-Albumin Ratio Index (FARI): A More Promising Inflammation-Based Prognostic Marker for Patients Undergoing Hepatectomy for Colorectal Liver Metastases[J]. Ann Surg Oncol, 2019, 26(11): 3682-3692. DOI:10.1245/s10434-019-07586-3 |
| [9] |
Tomita K, Ochiai S, Gunji T, et al. Prognostic Significance of Plasma Fibrinogen/Serum Albumin Ratio in the Postoperative Outcome of Pancreatic Ductal Adenocarcinoma[J]. Anticancer Res, 2020, 40(12): 7017-7023. DOI:10.21873/anticanres.14727 |
| [10] |
Liao YC, Fu M, Wang XF, et al. Combined fibrinogen-to-prealbumin ratio and carbohydrate antigen 19-9 score is a promising metric to predict progression of metastatic colorectal mucinous adenocarcinoma[J]. J Clin Lab Anal, 2021, 35(5): e23757. |
| [11] |
Liu H, Qiu G, Hu F, et al. Fibrinogen/albumin ratio index is an independent predictor of recurrence-free survival in patients with intrahepatic cholangiocarcinoma following surgical resection[J]. World J Surg Oncol, 2021, 19(1): 218. DOI:10.1186/s12957-021-02330-2 |
| [12] |
Chen J, Hao L, Zhang S, et al. Preoperative Fibrinogen-Albumin Ratio, Potential Prognostic Factors for Bladder Cancer Patients Undergoing Radical Cystectomy: A Two-Center Study[J]. Cancer Manag Res, 2021, 13: 3181-3192. DOI:10.2147/CMAR.S300574 |
| [13] |
Zheng Y, Wu C, Yan H, et al. Prognostic value of combined preoperative fibrinogen-albumin ratio and platelet-lymphocyte ratio score in patients with breast cancer: A prognostic nomogram study[J]. Clin Chim Acta, 2020, 506: 110-121. DOI:10.1016/j.cca.2020.03.011 |
| [14] |
Aziz MH, Sideras K, Aziz NA, et al. The Systemic-immuneinflammation Index Independently Predicts Survival and Recurrence in Resectable Pancreatic Cancer and its Prognostic Value Depends on Bilirubin Levels: A Retrospective Multicenter Cohort Study[J]. Ann Surg, 2019, 270(1): 139-146. DOI:10.1097/SLA.0000000000002660 |
| [15] |
Jomrich G, Gruber ES, Winkler D, et al. Systemic ImmuneInflammation Index (SⅡ) Predicts Poor Survival in Pancreatic Cancer Patients Undergoing Resection[J]. J Gastrointest Surg, 2020, 24(3): 610-618. DOI:10.1007/s11605-019-04187-z |
| [16] |
Ren J, Sun P, Wang Y, et al. Construction and validation of a nomogram for patients with skin cancer[J]. Medicine (Baltimore), 2021, 100(4): e24489. DOI:10.1097/MD.0000000000024489 |
| [17] |
Lu S, Liu Z, Zhou X, et al. Preoperative FibrinogenAlbumin Ratio Index (FARI) is a Reliable Prognosis and Chemoradiotherapy Sensitivity Predictor in Locally Advanced Rectal Cancer Patients Undergoing Radical Surgery Following Neoadjuvant Chemoradiotherapy[J]. Cancer Manag Res, 2020, 12: 8555-8568. DOI:10.2147/CMAR.S273065 |
| [18] |
Miura K, Hamanaka K, Koizumi T, et al. Clinical significance of preoperative serum albumin level for prognosis in surgically resected patients with non-small cell lung cancer: Comparative study of normal lung, emphysema, and pulmonary fibrosis[J]. Lung Cancer, 2017, 111: 88-95. DOI:10.1016/j.lungcan.2017.07.003 |
| [19] |
Huang W, Wang S, Zhang H, et al. Prognostic significance of combined fibrinogen concentration and neutrophil-to-lymphocyte ratio in patients with resectable non-small cell lung cancer[J]. Cancer Biol Med, 2018, 15(1): 88-96. DOI:10.20892/j.issn.2095-3941.2017.0124 |
| [20] |
Chung KH, Lee JC, Lee J, et al. Serum fibrinogen as a diagnostic and prognostic biomarker for pancreatic ductal adenocarcinoma[J]. Pancreatology, 2020, 20(7): 1465-1471. DOI:10.1016/j.pan.2020.06.010 |
| [21] |
Liu X, Shi B. Progress in research on the role of fibrinogen in lung cancer[J]. Open Life Sci, 2020, 15(1): 326-330. DOI:10.1515/biol-2020-0035 |
| [22] |
Virizuela JA, Camblor-álvarez M, Luengo-pérez LM, et al. Nutritional support and parenteral nutrition in cancer patients: an expert consensus report[J]. Clin Transl Oncol, 2018, 20(5): 619-629. DOI:10.1007/s12094-017-1757-4 |
| [23] |
Xiong S, Dong L, Cheng L. Neutrophils in cancer carcinogenesis and metastasis[J]. J Hematol Oncol, 2021, 14(1): 173. DOI:10.1186/s13045-021-01187-y |
| [24] |
Chen JH, Zhai ET, Yuan YJ, et al. Systemic immune-inflammation index for predicting prognosis of colorectal cancer[J]. World J Gastroenterol, 2017, 23(34): 6261-6272. DOI:10.3748/wjg.v23.i34.6261 |
| [25] |
Ogiya R, Niikura N, Kumaki N, et al. Comparison of tumorinfiltrating lymphocytes between primary and metastatic tumors in breast cancer patients[J]. Cancer Sci, 2016, 107(12): 1730-1735. DOI:10.1111/cas.13101 |
| [26] |
Quigley DA, Kristensen V. Predicting prognosis and therapeutic response from interactions between lymphocytes and tumor cells[J]. Mol Oncol, 2015, 9(10): 2054-2062. DOI:10.1016/j.molonc.2015.10.003 |
| [27] |
Schlesinger M. Role of platelets and platelet receptors in cancer metastasis[J]. J Hematol Oncol, 2018, 11(1): 125. DOI:10.1186/s13045-018-0669-2 |
| [28] |
Cedervall J, Hamidi A, Olsson AK. Platelets, NETs and cancer[J]. Thromb Res, 2018, 164(Suppl 1): S148-S152. DOI:10.1016/j.thromres.2018.01.049 |
| [29] |
Luo G, Jin K, Deng S, et al. Roles of CA19-9 in pancreatic cancer: Biomarker, predictor and promoter[J]. Biochim Biophys Acta Rev Cancer, 2021, 1875(2): 188409. DOI:10.1016/j.bbcan.2020.188409 |
| [30] |
Springfeld C, Jäger D, Büchler MW, et al. Chemotherapy for pancreatic cancer[J]. Presse Med, 2019, 48(3 Pt 2): e159-e174. DOI:10.1016/j.lpm.2019.02.025 |
| [31] |
Yang YF, Zhao S, Zhai BY, et al. Relationship between clinicopathological features and prognosis of pancreatic ductal adenocarcinoma[J]. Zhonghua Bing Li Xue Za Zhi, 2021, 50(8): 924-928. |
| [32] |
Fang L, Yan FH, Liu C, et al. Systemic Inflammatory Biomarkers, Especially Fibrinogen to Albumin Ratio, Predict Prognosis in Patients with Pancreatic Cancer[J]. Cancer Res Treat, 2021, 53(1): 131-139. DOI:10.4143/crt.2020.330 |
| [33] |
Zhang LP, Ren H, Du YX, et al. Prognostic value of the preoperative fibrinogen-to-albumin ratio in pancreatic ductal adenocarcinoma patients undergoing R0 resection[J]. World J Gastroenterol, 2020, 26(46): 7382-7404. DOI:10.3748/wjg.v26.i46.7382 |
| [34] |
Bittoni A, Pecci F, Mentrasti G, et al. Systemic immuneinflammation index: a prognostic tiebreaker among all in advanced pancreatic cancer[J]. Ann Transl Med, 2021, 9(3): 251. DOI:10.21037/atm-20-3499 |
| [35] |
Zhang K, Hua YQ, Wang D, et al. Systemic immune-inflammation index predicts prognosis of patients with advanced pancreatic cancer[J]. J Transl Med, 2019, 17(1): 30. DOI:10.1186/s12967-019-1782-x |
| [36] |
Balachandran VP, Gonen M, Smith JJ, et al. Nomograms in oncology: more than meets the eye[J]. Lancet Oncol, 2015, 16(4): e173-e180. DOI:10.1016/S1470-2045(14)71116-7 |
 2023, Vol. 50
2023, Vol. 50


