文章信息
- 巨胞饮在消化系统肿瘤中的研究进展
- Research Progress of Macropinocytosis in Digestive System Tumors
- 肿瘤防治研究, 2023, 50(4): 401-407
- Cancer Research on Prevention and Treatment, 2023, 50(4): 401-407
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1079
- 收稿日期: 2022-09-16
- 修回日期: 2023-01-06
2. 712046 咸阳,陕西省胃肠病证方药重点研究室;
3. 712046 咸阳,陕西中医药大学附属医院肝病一科;
4. 712046 咸阳,陕西中医药大学附属医院普外一科
2. Shaanxi Provincial Key Laboratory of Gastrointestinal Disease and Syndrome Formulae, Xianyang 712046, China;
3. First Department of Hepatology, The Affiliated Hospital of Shaanxi University of Chinese Medicine, Xianyang 712046, China;
4. First Departments of General Surgery, The Affiliated Hospital of Shaanxi University of Chinese Medicine, Xianyang 712046, China
消化系统肿瘤目前发病率和死亡率高居不下。消化系统肿瘤通过肿瘤细胞基因突变和表观遗传改变的积累而发展起来,这些改变受到宿主遗传变异、微生物组、免疫和环境暴露的影响[1]。近年来,许多新型分子靶向单药或联合放化疗的方案越来越多地应用于消化系统肿瘤的临床治疗,但大多数靶向药物对改善肿瘤患者的预后疗效有限,且价格昂贵,因此开发新的治疗模式显得尤为必要。目前,多项研究表明,巨胞饮可作为肿瘤细胞的营养输送途径,通过增强巨胞饮活性,来实现肿瘤的转移、代谢和信号转导,参与肿瘤的生长发展[2],阻断肿瘤细胞中的巨胞饮作用可干预肿瘤的进展,在消化系统肿瘤中起到重要作用。本文综述了调控巨胞饮的相关信号通路,以及巨胞饮在结直肠癌、胰腺导管腺癌、肝癌等消化系统肿瘤中的研究进展。
1 巨胞饮概述巨胞饮(macropinocytosis)也称为“细胞饮用”,始于肌动蛋白的起皱和质膜的内陷,该过程包括巨胞饮杯形成、巨胞饮关闭、巨胞饮成熟[3]。巨胞饮是一种高度保守的内吞过程,且不依赖网格蛋白的胞外液内吞,巨胞饮将细胞外液及其内容物非特异性摄取到大的细胞质囊泡中,这些囊泡被酸化并与溶酶体融合,它们的内容物被消化降解用于提取有用的化合物, 而难以消化的内容物则被胞吐[4]。在生理过程中巨胞饮进行抗原呈递、营养感应、血浆蛋白的回收、迁移和信号转导[5]。机体运用巨胞饮将内化的大分子解析为离散的氨基酸、糖、脂质和核苷酸,然后被细胞用来维持合成代谢以支持生长和体内平衡[6]。此外,巨胞饮还具有清除凋亡细胞和参与免疫反应的功能[6]。肿瘤的生长依赖葡萄糖、谷氨酰胺和氨基酸,当这些营养物质有限时,癌细胞则依靠巨胞饮来清除细胞外营养物质,为肿瘤提供燃料[7]。巨胞饮通过称为巨胞饮体的离散内吞囊泡触发细胞外蛋白的内化,传入的蛋白质货物在溶酶体中被降解,导致氨基酸在细胞内释放,这些蛋白质衍生的氨基酸通过促进细胞内氨基酸库以及中心碳代谢物的生物合成来支持肿瘤的代谢适应性[8]。巨胞饮代表了一种新的氨基酸供应途径,使肿瘤细胞即使在肿瘤微环境营养不良的条件下也能满足其增加的营养需求并维持细胞存活和增殖。巨胞饮还可以通过营养供应、质膜和受体的循环利用以及外泌体内化促进肿瘤的侵袭性[9]。有研究显示,癌细胞可以用巨胞饮来吸收坏死的细胞碎片,并在营养供应不足时重新利用垂死细胞中的蛋白质、脂质和核苷酸作为营养来源[10]。因此,巨胞饮在肿瘤的生长、增殖和侵袭中扮演着重要角色。此外,巨胞饮也成为各种纳米药物的进入机制,这表明调节肿瘤环境中的巨胞饮可作为抗癌治疗靶点[8]。巨胞饮在机体中的作用,见图 1。
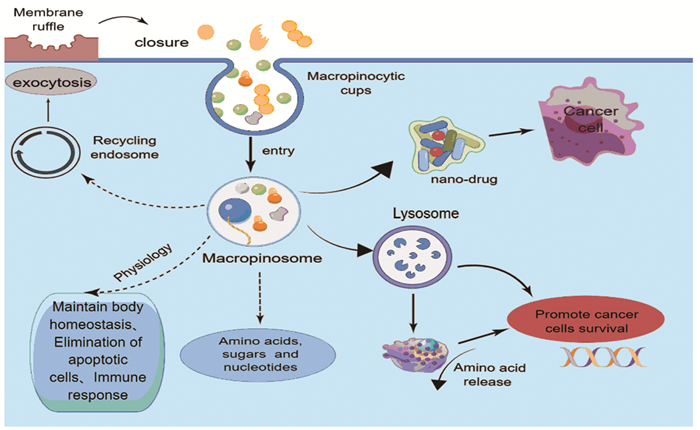
|
| 图 1 巨胞饮在机体中的作用示意图 Figure 1 Schematic diagram of macropinocytosis in the body |
巨胞饮诱导与癌细胞中癌基因(如RAS或EGFR)的激活或肿瘤抑制基因(如PTEN)的失活有关[11-12]。RAS基因家族目前已知的成员包括KRAS、NRAS和HRAS,其中KRAS突变最为常见,巨胞饮通常发生在含有致癌Ras等位基因的肿瘤细胞系以及体内模型中,将活化致癌的Ras注射到成纤维细胞中会刺激膜起皱和巨胞饮的发生[13]。重要的是K-Ras、H-Ras和N-Ras发生突变的小鼠胚胎成纤维细胞仍然可以进行巨胞饮作用[14],将致癌H-Ras蛋白显微注射到大鼠胚胎成纤维细胞中,在30 min至1 h内可以观察到细胞表面皱褶和巨胞饮作用的增强[15]。Ras还可以通过磷脂酰肌醇-3激酶(PI3K)和磷脂酶C依赖性方式诱导膜褶皱,上调巨胞饮作用来增加肿瘤的营养吸收[16]。PI3K通过Rac1调节肌动蛋白细胞骨架并通过磷酸肌醇信号转导促进巨胞饮体关闭,以及PLC信号转导[17]。KRAS敲低导致巨胞饮作用的抑制和Pak1活化的减少[18]。原致癌HRAS蛋白和致癌HRAS蛋白均可诱导细胞膜褶皱和胞饮作用的快速增强,与野生型KRAS胰腺癌细胞系BxPC-3相比,具有突变KRAS的人胰腺细胞系MIA PaCa-2表现出明显升高的巨胞饮作用[19]。因此,靶向KRAS调节巨胞饮作用,干预肿瘤进展具有重要意义。
2.2 EGFR信号通路EGFR在谷氨酰胺饥饿时被充分激活,通过磷酸化EGFR和激活下游效应通路(Erk和Akt)的信号转导来实现,药理学抑制或敲低EGFR可减弱EGFR信号转导,导致巨胞饮作用的消失,EGFR配体在营养充足的培养基中具有刺激巨胞饮作用[18]。此外,EGFR信号转导通过p21活化激酶(p21-activated kinase 1, Pak1)调节膜起皱和细胞骨架动力学来提高巨胞饮能力[20],吉非替尼作为EGFR的酪氨酸激酶抑制剂,通过降低FITC-葡聚糖的细胞摄取,进而抑制EGFR突变HCC827细胞中的巨胞饮作用[21]。因此,进一步探究巨胞饮作用的EGFR反应是未来研究的热点。
2.3 PTEN信号通路磷酸酯酶与张力蛋白同源物(phosphatase and tensin homolog,PTEN)的低表达可显著增加肿瘤易感性,PTEN磷酸酶通过将PI(3, 4, 5)P3转化为PI(4, 5)P2来拮抗PI3K信号通路,从而发挥肿瘤抑制作用。PTEN丢失激活PI3K通路,在营养限制条件下选择性地促进巨胞质体形成,PTEN缺陷和AMPK的失活联合导致前列腺癌细胞中巨胞饮作用的增强。缺乏PTEN的前列腺癌细胞利用巨胞饮作用来吞噬坏死的细胞碎片,然后在溶酶体中消化这些碎片以产生氨基酸、脂肪酸和胆固醇,维持肿瘤的生长。此外,PTEN的缺失也会刺激成纤维细胞中的巨胞饮作用[14]。因此,调控PTEN也可作为干预巨胞饮的靶点。
2.4 AXL信号通路AXL是TAM(TYRO3、AXL、MER)受体酪氨酸激酶家族的成员,其配体GAS6与许多肿瘤的发生和转移相关。GAS6介导的AXL激活触发了肌动蛋白重塑,引发外周膜褶皱和圆形背褶皱,GAS6-AXL的信号转导刺激下游PI3K-AKT和RAS的激活,诱导肌动蛋白驱动的细胞骨架重排和巨胞饮作用[22]。上调的巨胞饮作用使癌细胞能够获得细胞外大分子,这些大分子在溶酶体降解后为新陈代谢和细胞生长提供营养[13]。
2.5 Wnt信号通路Wnt信号通路通过Wnt靶基因的β-连环蛋白结合在胚胎发育、稳态过程、细胞分化、细胞极性、细胞增殖和细胞迁移中发挥重要作用。Wnt通路的不当激活也是肿瘤发生的主要因素。Redelman-Sidi等[23]通过对巨胞饮激活剂进行全基因组shRNA筛选,确定Wnt通路激活是巨胞饮作用的强大驱动力。Wnt通过Pak1激活巨胞饮,而抑制具有Ras激活突变肿瘤中的Wnt通路会导致巨胞饮作用的下调。Wnt驱动的巨胞饮作用位于β-连环蛋白依赖性经典Wnt途径的下游。Wnt通路的激活,显著增加了巨胞饮指数,驱动巨胞饮对细胞外蛋白质的摄取,为肿瘤生长提供所需的氨基酸。此外,Wnt通路的激活也会刺激巨胞饮将细菌及其产物吸收到结肠壁中,诱发结直肠癌的发生。
2.6 PI3K信号通路PI3K信号转导是巨胞饮作用的关键调节因子,抑制这一家族的PI3Kβ可阻断许多细胞类型和组织中的巨胞饮作用。Ghoshal等[24]研究发现,Nox2衍生的活性氧通过抑制磷酸酶和张力蛋白同源物以及激活PI3K/Akt途径导致肌动蛋白结合蛋白cofilin去磷酸化、膜起皱和巨胞饮作用的激活。此外,研究人员确定了转录共激活因子Yap和Taz激活TEAD转录因子家族,该家族促进Axl受体酪氨酸激酶的转录激活,进而激活PI3K/Akt信号通路,上调巨胞饮作用[25]。
2.7 mTOR信号通路mTOR通路在调节细胞生长、新陈代谢和营养感应方面发挥核心作用,mTOR作为合成代谢的主要生长调节剂,抑制mTOR促进蛋白质清除,减少生物合成。5~25 µmol/L剂量内的mTORC1/2抑制剂可在肿瘤细胞中诱发灾难性的巨胞饮作用[26],Dai等[27]发现torin1介导的mTORC1/2的抑制可促进巨胞饮作用,从而增强维替泊芬在肿瘤细胞中的促凋亡作用。mTORC1的抑制增强巨胞饮蛋白的溶酶体分解代谢,这大大增加依赖细胞外蛋白作为氨基酸来源癌细胞的增殖[28]。
3 巨胞饮与消化系统肿瘤 3.1 巨胞饮与结直肠癌结直肠癌(colorectal cancer, CRC)是人类消化道最常见的恶性肿瘤之一。CRC的发展由多个阶段组成,从大肠和直肠内壁的良性腺瘤性息肉开始,逐渐发展为晚期腺瘤原位癌和浸润性癌。KRAS是CRC中常见的突变癌基因,大约40%的CRC病例发生KRAS基因突变;导致KRAS蛋白的结构性激活,该蛋白作为分子开关持续刺激下游信号通路,促进细胞增殖和存活,诱导肿瘤的发生[29]。Hanada等[30]研究发现,KRAS突变会加速CRC的巨胞饮作用,从而在营养耗尽的条件下赋予肿瘤细胞生长优势,而通过巨胞饮抑制剂和天冬酰胺耗竭的组合可显著抑制体内KRAS突变CRC细胞的肿瘤生长,表明巨胞饮作用和天冬酰胺生物利用度的双重阻断可能是KRAS突变CRC的新治疗策略。在FDA批准的药物中,没有针对治疗KRAS突变CRC的分子靶向药物。而巨胞饮作用作为一种摄取外泌体的内吞系统[31],若成为新的药物递送途径,对KRAS激活突变的癌细胞具有重要意义。Takakura等[32]研究表明,柠檬属衍生的纳米囊泡通过巨胞饮作用被吸收到细胞中,有效抑制了p53失活的CRC细胞生长,提高了药物在癌细胞中的生物利用度,这为治疗CRC提供了一种新的思路。
3.2 巨胞饮与胰腺导管腺癌大约90%的胰腺癌可归类为胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC),PDAC是一种高度侵袭性肿瘤,其5年内生存率低于10%。这种不良预后与KRAS的致癌激活,以及肿瘤抑制基因TP53、SMAD4和CDKN2A的失活密切相关[33]。PDAC的肿瘤微环境(tumour microenvironment, TME)特点是过度纤维化和细胞外基质沉积,这种独特的TME导致高间质压力、血管塌陷以及低营养和氧气扩散,促成了PDAC独特的生物学和治疗抗性。为了适应恶劣的TME,PDAC细胞利用巨胞饮作为营养吸收的首选模式来支持肿瘤的生长和存活[34]。它通过巨胞饮作用将蛋白质内化以适应肿瘤微环境中的低氨基酸水平[35]。因此,确定调节癌细胞中巨胞饮作用的新分子机制对于了解PDAC的进展和转移至关重要,Xiong等[36]研究发现巨胞饮作用支持RAS转化的PDAC细胞代谢需求,胰腺癌细胞系和PDAC患者的肿瘤组织中都高度表达泛素相关蛋白样因子2(ubiquitin binding associated protein 2, UBAP2),UBAP2通过激活KRAS调节巨胞饮,而UBAP2的沉默则会降低激活的KRAS水平,并抑制巨胞饮作用和体内的肿瘤生长。因此,UBAP2可作为一种新的治疗靶点来抑制巨胞饮作用从而阻断癌细胞的营养来源。
巨胞饮在PDAC的持续增殖中也起到关键作用。巨胞饮在KRAS突变的PDAC细胞中被激活,并提供细胞增殖所需的氨基酸。Thu等[37]研究发现,从黄柏中提取的氯化黄柏以剂量依赖性方式抑制巨胞饮作用,降低了细胞内谷氨酰胺水平,进一步抑制KRAS突变胰腺癌细胞(PANC-1)的增殖,有效减缓PANC-1异种移植肿瘤的生长。因此,通过抑制巨胞饮作用减少氨基酸供应可作为治疗PDAC的一种潜在策略。
PDAC细胞具有通过增强EGFR/Pak1信号转导来启动巨胞饮作用的能力,以补偿肿瘤微环境的营养不良情况[18]。FGD6基因被确定为巨胞饮作用的关键调节因子。FGD6在体外和体内均促进PDAC细胞增殖、巨胞饮作用和肿瘤生长。在PDAC细胞系中,随着FGD6敲低,巨胞饮作用水平降低。此外,FGD6通过参与反式高尔基网络和增强生长因子受体的膜定位来促进巨胞饮作用。基于TCGA和GEO数据集的临床数据分析表明,PDAC组织中FGD6表达上调,且FGD6高表达与PDAC患者不良预后也密切相关[38]。因此,针对FGD6来调节巨胞饮,以此来开发新的治疗策略对于PDAC也具有重要意义。
3.3 巨胞饮与肝癌肝细胞癌(hepatocellular carcinoma, HCC)是一种由肝细胞发生的恶性肿瘤,是全球第二大致命癌症,占原发性肝癌病例的90%。由于早期无明显症状,在确诊时多为晚期,因此常常错过最佳治疗时机。对于晚期HCC,两种酪氨酸激酶抑制剂(TKI)索拉非尼和乐伐替尼是主要的一线靶向治疗药物,但它们的生存期获益有限,仅为3个月[39]。因此,确定新的HCC细胞存活分子级联反应,对探索更有效的治疗靶点至关重要。肝癌细胞常伴有缺氧的发生,缺氧诱导因子(HIF-1)激活膜起皱蛋白EH结构域含蛋白2(EHD2)的转录,以启动巨胞饮作用[40]。索拉非尼作为治疗HCC最有效的药物[41],可诱导PI3K的激活,进而激活HCC细胞和HCC组织中的RAC1-PAK1信号转导以响应索拉非尼治疗,并驱动巨胞饮作用,上调的巨胞饮作用在HCC营养不良的条件下补偿细胞内氨基酸缺乏,使HCC细胞对索拉非尼产生抗性,在索拉非尼治疗中添加巨胞饮抑制剂阿米洛利,可限制索拉非尼耐药性的发展并提高索拉非尼在HCC中的治疗效果[42]。因此调控HCC中的巨胞饮作用有望成为今后的研究热点。
3.4 巨胞饮与其他消化系统肿瘤食管癌(esophageal cancer, EC)是最具侵袭性的胃肠道肿瘤之一,主要包括食管鳞状细胞癌(ESCC)和食管腺癌(EAC), 全球总体5年生存率为15%~25%[43]。重组体融合蛋白(Fv-LDP-D3)作为一种新型治疗EC的药物,通过巨胞饮作用被EC细胞摄取,抑制癌细胞增殖,诱导癌细胞的凋亡[44]。口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)作为一种侵袭性的恶性肿瘤,五年存活率只有50%,常规抗癌药物因缺乏癌细胞的靶向性及耐药的增加,疗效大大降低[45]。巨胞饮作为胞外物质摄取的内吞机制,已被证明有助于抗癌药物的细胞内摄取。Song等[46]研究发现利用巨胞饮作用可增强OSCC细胞对小分子药物顺铂的敏感度,促进癌细胞凋亡,降低顺铂的全身毒性,提高药物疗效。肿瘤来源的外泌体通过表现出免疫抑制特性,促进肿瘤侵袭和转移,刺激肿瘤细胞增殖或诱导耐药[47-48]。EGF/EGFR信号通路可通过诱导巨胞饮作用促进OSCC细胞摄取自身来源的外泌体,促进肿瘤的增殖、迁移和侵袭,通过阻断EGF/EGFR下游信号级联,可抑制巨胞饮作用,减少OSCC细胞对自身外泌体的摄取,降低肿瘤的恶性潜能[49]。巨胞饮在消化系统肿瘤中的作用及调控因素,见表 1。

|
巨胞饮已经成为癌症代谢的关键因素之一,使癌细胞能够在恶劣的肿瘤微环境中存活。抑制巨胞饮作用可切断癌细胞代谢的替代途径,逆转肿瘤耐药性,并增加肿瘤对抗癌药物的敏感度。阐明驱动巨胞饮作用的分子机制以及了解特定的肿瘤细胞是如何调节巨胞饮,可为专门针对这些肿瘤类型的新疗法铺平道路。巨胞饮作为一种能量通道,可以影响肿瘤的增殖、转移和代谢。当巨胞饮抑制剂与抗癌药联合使用时,可产生协同抗肿瘤作用,提高肿瘤患者的存活率。巨胞饮作为药物的传输途径,被用来增加癌细胞对抗癌药物的吸收,增强抗癌药物的靶向性。然而,由于缺乏巨胞饮特异性标志物和特异性调节体外和体内巨胞饮作用的药物,因此,这也将是今后的研究重点,以便为设计更特异和有效的抑制剂提供准确的信息。此外,巨胞饮抑制剂作用的靶点多聚焦在调节巨胞饮作用的相关通路上,对巨胞饮作用的相关因子研究较少,今后还需进一步探索。调节巨胞饮有望成为干预肿瘤进展的重要靶点。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
陈 婷:资料收集与分析,论文设计与撰写
闫曙光:协助论文撰写
李京涛:论文修改
魏海梁:文献收集
周永学:指导论文撰写
| [1] |
Mima K, Kosumi K, Baba Y, et al. The microbiome, genetics, and gastrointestinal neoplasms: the evolving field of molecular pathological epidemiology to analyze the tumor-immune-microbiome interaction[J]. Hum Genet, 2021, 140(5): 725-746. DOI:10.1007/s00439-020-02235-2 |
| [2] |
Ha KD, Bidlingmaier SM, Liu B. Macropinocytosis Exploitation by Cancers and Cancer Therapeutics[J]. Front Physiol, 2016, 7: 381. |
| [3] |
Kerr MC, Teasdale RD. Defining macropinocytosis[J]. Traffic, 2009, 10(4): 364-371. DOI:10.1111/j.1600-0854.2009.00878.x |
| [4] |
Palm W. Metabolic functions of macropinocytosis[J]. Philos Trans R Soc Lond B Biol Sci, 2019, 374(1765): 20180285. DOI:10.1098/rstb.2018.0285 |
| [5] |
Lin XP, Mintern JD, Gleeson PA. Macropinocytosis in Different Cell Types: Similarities and Differences[J]. Membranes (Basel), 2020, 10(8): 177. DOI:10.3390/membranes10080177 |
| [6] |
姜萱璟, 张伟晴, 贺丽娜, 等. 巨胞饮作用及其对脑胶质瘤的影响[J]. 现代肿瘤医学, 2021, 29(20): 3668-3672. [Jiang XJ, Zhang WQ, He LN, et al. Macropinocytosis and its influence on glioblastoma[J]. Xian Dai Zhong Liu Yi Xue, 2021, 29(20): 3668-3672. DOI:10.3969/j.issn.1672-4992.2021.20.034] |
| [7] |
Finicle BT, Jayashankar V, Edinger AL. Nutrient scavenging in cancer[J]. Nat Rev Cancer, 2018, 18(10): 619-633. DOI:10.1038/s41568-018-0048-x |
| [8] |
Commisso C. The pervasiveness of macropinocytosis in oncological malignancies[J]. Philos Trans R Soc Lond B Biol Sci, 2019, 374(1765): 20180153. DOI:10.1098/rstb.2018.0153 |
| [9] |
Colin M, Delporte C, Janky R, et al. Dysregulation of Macropinocytosis Processes in Glioblastomas May Be Exploited to Increase Intracellular Anti-Cancer Drug Levels: The Example of Temozolomide[J]. Cancers (Basel), 2019, 11(3): 411. DOI:10.3390/cancers11030411 |
| [10] |
Jayashankar V, Edinger AL. Macropinocytosis confers resistance to therapies targeting cancer anabolism[J]. Nat Commun, 2020, 11(1): 1121. DOI:10.1038/s41467-020-14928-3 |
| [11] |
Ramirez C, Hauser AD, Vucic EA, et al. Plasma membrane V-ATPase controls oncogenic RAS-induced macropinocytosis[J]. Nature, 2019, 576(7787): 477-481. DOI:10.1038/s41586-019-1831-x |
| [12] |
Unni AM, Lockwood WW, Zejnullahu K, et al. Evidence that synthetic lethality underlies the mutual exclusivity of oncogenic KRAS and EGFR mutations in lung adenocarcinoma[J]. Elife, 2015, 4: e06907. DOI:10.7554/eLife.06907 |
| [13] |
Commisso C, Davidson SM, Soydaner-Azeloglu RG, et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells[J]. Nature, 2013, 497(7451): 633-637. DOI:10.1038/nature12138 |
| [14] |
Palm W, Araki J, King B, et al. Critical role for PI3-kinase in regulating the use of proteins as an amino acid source[J]. Proc Natl Acad Sci U S A, 2017, 114(41): E8628-E8636. |
| [15] |
Bar-Sagi D, Feramisco JR. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins[J]. Science, 1986, 233(4768): 1061-1068. DOI:10.1126/science.3090687 |
| [16] |
Zwartkruis FJT, Burgering BMT. Ras and macropinocytosis: trick and treat[J]. Cell Res, 2013, 23(8): 982-983. DOI:10.1038/cr.2013.79 |
| [17] |
Amyere M, Payrastre B, Krause U, et al. Constitutive macropinocytosis in oncogene-transformed fibroblasts depends on sequential permanent activation of phosphoinositide 3-kinase and phospholipase C[J]. Mol Biol Cell, 2000, 11(10): 3453-3467. DOI:10.1091/mbc.11.10.3453 |
| [18] |
Lee SW, Zhang Y, Jung M, et al. EGFR-Pak Signaling Selectively Regulates Glutamine Deprivation-Induced Macropinocytosis[J]. Dev Cell, 2019, 50(3): 381-392.e5. DOI:10.1016/j.devcel.2019.05.043 |
| [19] |
Liu H, Sun M, Liu Z, et al. KRAS-enhanced macropinocytosis and reduced FcRn-mediated recycling sensitize pancreatic cancer to albumin-conjugated drugs[J]. J Control Release, 2019, 296: 40-53. DOI:10.1016/j.jconrel.2019.01.014 |
| [20] |
Redelman-Sidi G, Iyer G, Solit DB, et al. Oncogenic activation of Pak1-dependent pathway of macropinocytosis determines BCG entry into bladder cancer cells[J]. Cancer Res, 2013, 73(3): 1156-1167. DOI:10.1158/0008-5472.CAN-12-1882 |
| [21] |
Takenaka T, Nakai S, Katayama M, et al. Effects of gefitinib treatment on cellular uptake of extracellular vesicles in EGFR-mutant non-small cell lung cancer cells[J]. Int J Pharm, 2019, 572: 118762. DOI:10.1016/j.ijpharm.2019.118762 |
| [22] |
Zdżalik-Bielecka D, Poświata A, Kozik K, et al. The GAS6-AXL signaling pathway triggers actin remodeling that drives membrane ruffling, macropinocytosis, and cancer-cell invasion[J]. Proc Natl Acad Sci U S A, 2021, 118(28): e2024596118. DOI:10.1073/pnas.2024596118 |
| [23] |
Redelman-Sidi G, Binyamin A, Gaeta I, et al. The Canonical Wnt Pathway Drives Macropinocytosis in Cancer[J]. Cancer Res, 2018, 78(16): 4658-4670. DOI:10.1158/0008-5472.CAN-17-3199 |
| [24] |
Ghoshal P, Singla B, Lin H, et al. Nox2-Mediated PI3K and Cofilin Activation Confers Alternate Redox Control of Macrophage Pinocytosis[J]. Antioxid Redox Signal, 2017, 26(16): 902-916. DOI:10.1089/ars.2016.6639 |
| [25] |
Sivanand S, Vander Heiden MG. Transcriptional activation of macropinocytosis by the Hippo pathway following nutrient limitation[J]. Genes Dev, 2020, 34(19-20): 1253-1255. DOI:10.1101/gad.343632.120 |
| [26] |
Srivastava RK, Li C, Khan J, et al. Combined mTORC1/mTORC2 inhibition blocks growth and induces catastrophic macropinocytosis in cancer cells[J]. Proc Natl Acad Sci U S A, 2019, 116(49): 24583-24592. DOI:10.1073/pnas.1911393116 |
| [27] |
Dai M, Yan G, Wang N, et al. In vivo genome-wide CRISPR screen reveals breast cancer vulnerabilities and synergistic mTOR/Hippo targeted combination therapy[J]. Nat Commun, 2021, 12(1): 3055. DOI:10.1038/s41467-021-23316-4 |
| [28] |
Palm W, Park Y, Wright K, et al. The Utilization of Extracellular Proteins as Nutrients Is Suppressed by mTORC1[J]. Cell, 2015, 162(2): 259-270. DOI:10.1016/j.cell.2015.06.017 |
| [29] |
Zhu G, Pei L, Xia H, et al. Role of oncogenic KRAS in the prognosis, diagnosis and treatment of colorectal cancer[J]. Mol Cancer, 2021, 20(1): 143. DOI:10.1186/s12943-021-01441-4 |
| [30] |
Hanada K, Kawada K, Nishikawa G, et al. Dual blockade of macropinocytosis and asparagine bioavailability shows synergistic anti-tumor effects on KRAS-mutant colorectal cancer[J]. Cancer Lett, 2021, 522: 129-141. DOI:10.1016/j.canlet.2021.09.023 |
| [31] |
Costa Verdera H, Gitz-Francois JJ, Schiffelers RM, et al. Cellular uptake of extracellular vesicles is mediated by clathrin-independent endocytosis and macropinocytosis[J]. J Control Release, 2017, 266: 100-108. DOI:10.1016/j.jconrel.2017.09.019 |
| [32] |
Takakura H, Nakao T, Narita T, et al. Citrus limonL.-Derived Nanovesicles Show an Inhibitory Effect on Cell Growth in p53-Inactivated Colorectal Cancer Cells via the Macropinocytosis Pathway[J]. Biomedicines, 2022, 10(6): 1352. DOI:10.3390/biomedicines10061352 |
| [33] |
Cancer Genome Atlas Research Network. Electronic address: andrew_aguirre@dfci.harvard.edu; Cancer Genome Atlas Research Network. Integrated Genomic Characterization of Pancreatic Ductal Adenocarcinoma[J]. Cancer Cell, 2017, 32(2): 185-203.e13. DOI:10.1016/j.ccell.2017.07.007 |
| [34] |
Encarnación-Rosado J, Kimmelman AC. Harnessing metabolic dependencies in pancreatic cancers[J]. Nat Rev Gastroenterol Hepatol, 2021, 18(7): 482-492. DOI:10.1038/s41575-021-00431-7 |
| [35] |
Rai V, Agrawal S. Targets (Metabolic Mediators) of Therapeutic Importance in Pancreatic Ductal Adenocarcinoma[J]. Int J Mol Sci, 2020, 21(22): 8502. DOI:10.3390/ijms21228502 |
| [36] |
Xiong X, Rao G, Roy RV, et al. Ubiquitin-binding associated protein 2 regulates KRAS activation and macropinocytosis in pancreatic cancer[J]. FASEB J, 2020, 34(9): 12024-12039. DOI:10.1096/fj.201902826RR |
| [37] |
Thu PM, Zheng ZG, Zhou YP, et al. Phellodendrine chloride suppresses proliferation of KRAS mutated pancreatic cancer cells through inhibition of nutrients uptake via macropinocytosis[J]. Eur J Pharmacol, 2019, 850: 23-34. DOI:10.1016/j.ejphar.2019.01.060 |
| [38] |
Zhang YF, Li Q, Huang PQ, et al. A low amino acid environment promotes cell macropinocytosis through the YY1-FGD6 axis in Ras-mutant pancreatic ductal adenocarcinoma[J]. Oncogene, 2022, 41(8): 1203-1215. DOI:10.1038/s41388-021-02159-9 |
| [39] |
Ikeda M, Okusaka T, Mitsunaga S, et al. Safety and Pharmacokinetics of Lenvatinib in Patients with Advanced Hepatocellular Carcinoma[J]. Clin Cancer Res, 2016, 22(6): 1385-1394. DOI:10.1158/1078-0432.CCR-15-1354 |
| [40] |
Zhang MS, Cui JD, Lee D, et al. Hypoxia-induced macropinocytosis represents a metabolic route for liver cancer[J]. Nat Commun, 2022, 13(1): 954. DOI:10.1038/s41467-022-28618-9 |
| [41] |
Kulik L, El-Serag HB. Epidemiology and Management of Hepatocellular Carcinoma[J]. Gastro-enterology, 2019, 156(2): 477-491.e1. DOI:10.1053/j.gastro.2018.08.065 |
| [42] |
Byun JK, Lee S, Kang GW, et al. Macropinocytosis is an alternative pathway of cysteine acquisition and mitigates sorafenib-induced ferroptosis in hepatocellular carcinoma[J]. J Exp Clin Cancer Res, 2022, 41(1): 98. DOI:10.1186/s13046-022-02296-3 |
| [43] |
Demarest CT, Chang AC. The Landmark Series: Multimodal Therapy for Esophageal Cancer[J]. Ann Surg Oncol, 2021, 28(6): 3375-3382. DOI:10.1245/s10434-020-09565-5 |
| [44] |
He S, Zhao C, Tao H, et al. A recombinant scFv antibody-based fusion protein that targets EGFR associated with IMPDH2 downregulation and its drug conjugate show therapeutic efficacy against esophageal cancer[J]. Drug Deliv, 2022, 29(1): 1243-1256. DOI:10.1080/10717544.2022.2063454 |
| [45] |
Jiang Y, Guo H, Tong T, et al. lncRNA lnc-POP1-1 upregulated by VN1R5 promotes cisplatin resistance in head and neck squamous cell carcinoma through interaction with MCM5[J]. Mol Ther, 2022, 30(1): 448-467. DOI:10.1016/j.ymthe.2021.06.006 |
| [46] |
Song S, Xia X, Qi J, et al. Silmitasertib-induced macropinocytosis promoting DDP intracellular uptake to enhance cell apoptosis in oral squamous cell carcinoma[J]. Drug Deliv, 2021, 28(1): 2480-2494. DOI:10.1080/10717544.2021.2000677 |
| [47] |
Lu Y, Zheng Z, Yuan Y, et al. The Emerging Role of Exosomes in Oral Squamous Cell Carcinoma[J]. Front Cell Dev Biol, 2021, 9: 628103. DOI:10.3389/fcell.2021.628103 |
| [48] |
Cao J, Zhang M, Xie F, et al. Exosomes in head and neck cancer: Roles, mechanisms and applications[J]. Cancer Lett, 2020, 494: 7-16. DOI:10.1016/j.canlet.2020.07.005 |
| [49] |
Sasabe E, Tomomura A, Liu H, et al. Epidermal growth factor/epidermal growth factor receptor signaling blockage inhibits tumor cell-derived exosome uptake by oral squamous cell carcinoma through macropinocytosis[J]. Cancer Sci, 2022, 113(2): 609-621. DOI:10.1111/cas.15225 |
 2023, Vol. 50
2023, Vol. 50


