文章信息
- 基于SEER数据库的转移性结肠癌患者早期死亡预测列线图模型构建
- Nomogram for Predicting Early Death in Patients with Metastatic Colon Cancer Based on SEER Database
- 肿瘤防治研究, 2023, 50(2): 126-131
- Cancer Research on Prevention and Treatment, 2023, 50(2): 126-131
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.0884
- 收稿日期: 2022-08-05
- 修回日期: 2022-10-13
结肠癌(colon cancer, CC)是最常见的恶性肿瘤之一,居世界癌症死亡原因第五位[1]。结肠癌容易发生转移,大约有20%的患者在初始诊断时就已经发生肿瘤转移,并且超过50%的局部肿瘤患者最终会发生转移[2]。随着医疗技术的进步,转移性结肠癌(metastatic colon cancer, mCC)患者的预后得到了显著改善,但是在大多数情况下,mCC仍然是一种无法治愈的疾病[2]。肿瘤细胞基因的不稳定性以及微环境中的各种因素导致许多患者产生耐药性,这加速了癌症的进展[3]。对mCC进行深入研究是有必要的。早期死亡通常定义为初始诊断后3个月内死亡[4]。迄今为止,只有少数研究关注mCC患者的早期死亡。因此,迫切需要一种可以准确预测mCC患者早期死亡风险的可靠工具。我们从SEER数据库中提取mCC患者的临床病理学信息,构建一个可以准确预测mCC患者早期死亡的列线图模型,旨在帮助医生识别存在较高早期死亡风险的患者,从而制定更加个性化的治疗方案。
1 资料与方法 1.1 一般资料从SEER数据库中获取2010—2015年诊断为mCC患者的数据。纳入标准:(1)肿瘤原发部位位于结肠;(2)组织病理学为腺癌、黏液腺癌或印戒细胞癌;(3)有肿瘤转移(M1);(4)单原发癌患者。排除标准:(1)年龄小于18岁;(2)随访情况不明;(3)TNM分期未知;(4)转移情况未知;(5)含有其他未知的临床病理学信息;(6)人口学信息未知。筛选流程见图 1。最终共有6 669例患者被纳入到此研究,按照7:3的比例被随机分为训练集和验证集,训练集用来分析早期死亡相关的危险因素并构建列线图模型,验证集用来对模型进行验证从而评估模型的准确性。由于SEER数据库是公开匿名的,因此本研究无需获得伦理委员会批准。

|
| 图 1 患者纳入流程图 Figure 1 Flow chart for selection of patients |
收集患者的基本信息:性别、年龄、种族、婚姻状态、收入;临床病理学资料:原发肿瘤位置、组织病理学信息、肿瘤分化等级、TNM分期、骨转移、脑转移、肝转移、肺转移、肿瘤大小、CEA。随访包括患者生存时间及死亡原因。本研究将早期死亡定义为初次病理明确诊断后3个月内各种原因导致的死亡。
1.3 统计学方法采用SPSS软件(26.0)和R软件(4.1.2)进行统计学分析。P < 0.05为差异具有统计学意义。训练集和验证集各因素之间比较采用卡方检验。受试者工作特征(ROC)曲线用于确定连续变量阈值。采用单因素和多因素Logistic回归分析筛选早期死亡的独立危险因素,用于构建列线图。一致性指数(C-index)和校准曲线用于评价预测图的准确性和判别能力。C-index范围为0.5~1,> 0.7表示出色的辨别力。校准曲线用于衡量预测风险与实际风险的接近程度,曲线越靠近对角线,模型的预测能力就越高。决策曲线分析(DCA)用于评估模型的临床可用性,量化不同阈值概率下的净收益。列线图的预测准确性分别在训练集和验证集上进行评估。
2 结果 2.1 研究对象的基本情况根据纳入和排除标准,最终从SEER数据库中提取6 669例mCC患者。其中4 668例患者被随机分配为训练集,2 001例患者被随机分配为验证集。986例患者早期死亡(因癌症死亡903例,其他原因死亡83例),早期死亡率为14.8%。卡方检验结果显示验证集和训练集之间无统计学差异,见表 1。
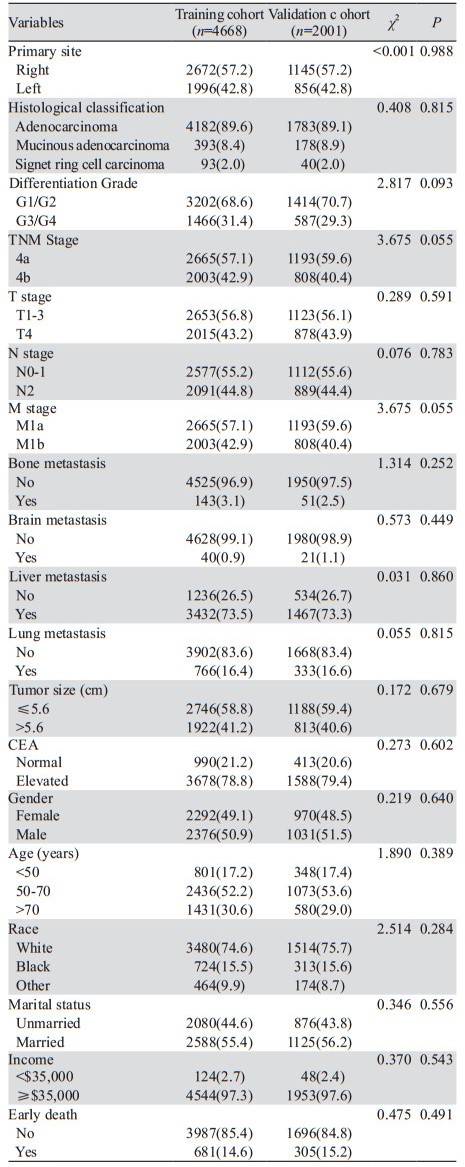
训练组的多因素Logistic回归结果显示,原发肿瘤位于右侧结肠、较差的分化、较高的T分期、较高的M分期、骨转移、脑转移、肿瘤直径大于5.6 cm,CEA升高、高龄和未婚是mCC患者早期死亡的独立危险因素,见表 2。
|
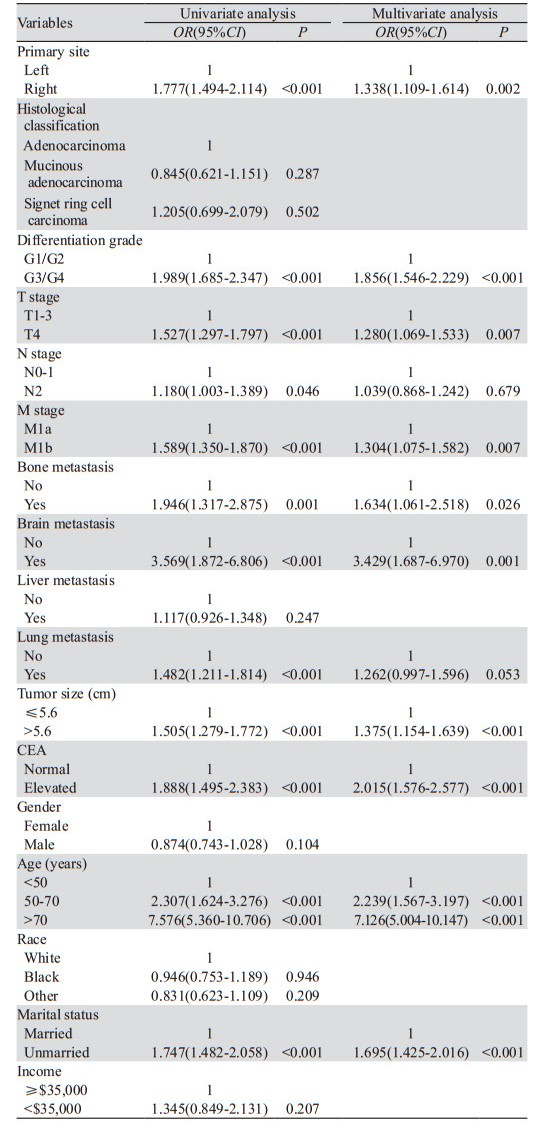
基于多因素Logistic回归的结果,我们构建一个列线图来预测mCC患者的早期死亡。列线图显示年龄是mCC患者早期死亡最重要的影响因素,其次是肿瘤脑转移。列线图将每一个影响因素量化为具体的分值,每个变量分值相加就可以计算出患者的总分, 对应下方可以得到早期死亡的概率,见图 2。
|
| 图 2 预测mCC患者早期死亡风险的模型 Figure 2 Models to predicting the risk for early death in patients with metastatic colon cancer |
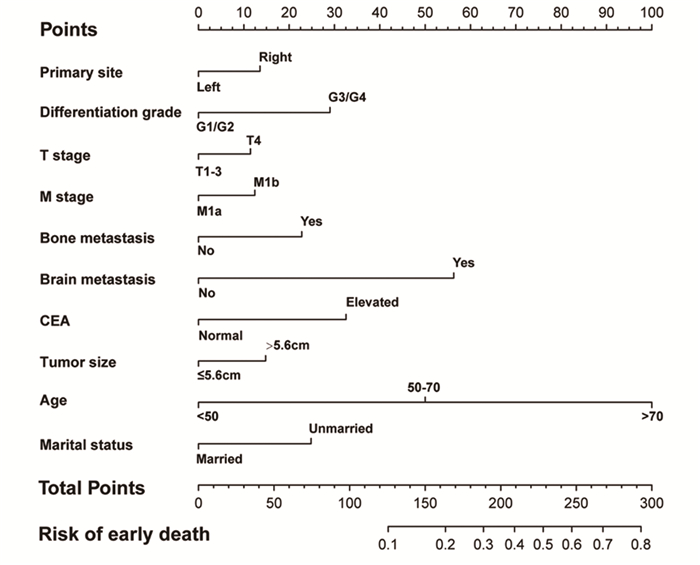
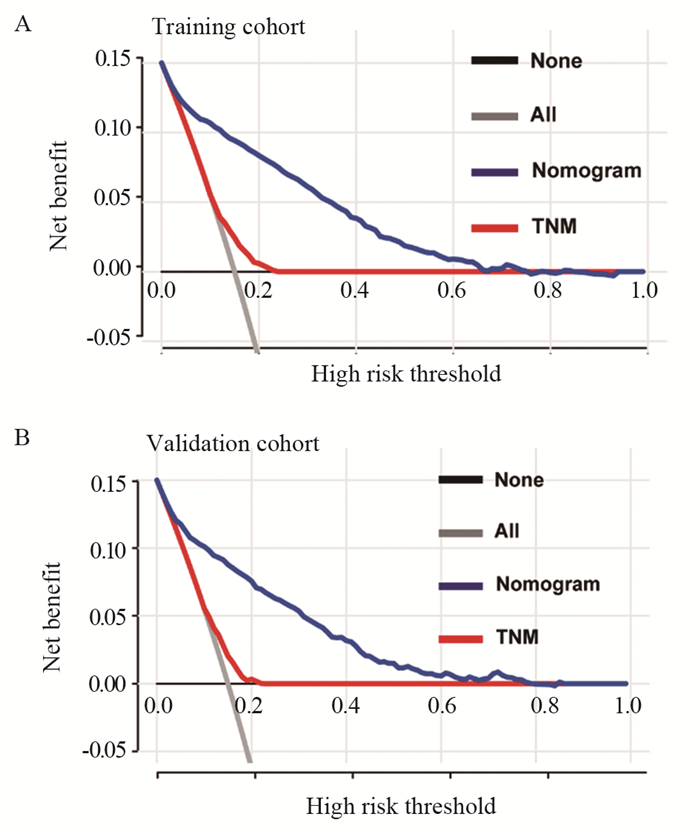
本研究中,训练集中列线图的C-index为0.751(95%CI: 0.714~0.788),验证集中的C-index为0.760(95%CI: 0.702~0.818),说明列线图具有良好的区分能力与预测准确性,校准曲线表明,训练集和验证集结果均显示预测点落在曲线的对角线上,说明预测结果和观察结果高度一致,见图 3。此外,DCA曲线显示,与TNM分期相比,列线图在预测早期死亡方面显示出更高的净收益,见图 4。
|
| 图 3 训练集(A)和验证集(B)列线图准确性的校准曲线 Figure 3 Calibration curves for evaluating prediction accuracy of nomogram on training(A) and validation(B) sets |
|
| 图 4 训练集(A)和验证集(B)列线图临床净效益的决策曲线分析曲线 Figure 4 Decision curve analysis for evaluating clinical net benefits of nomograms on training(A) and validation(B) sets |
结肠癌是一种死亡率很高的恶性肿瘤,2020年全球新发结肠癌病例超过110万例,约有57万例患者因此死亡[1]。早期筛查有助于结肠癌的治疗,但是目前筛查采用率并不理想。一项调查显示,遵循指南进行早期筛查的人数不超过70%[5]。并且由于结肠癌易转移的特点,近年来,mCC患者数量有所增加[6]。对于mCC患者,进行综合临床管理包括全身药物治疗和营养支持等是目前主要的治疗方式[7],大多数mCC患者的OS已延长至24~36个月[2]。然而,尽管医疗技术取得了进步,但仍有一部分mCC患者在诊断后3个月内死亡, 这被定义为早期死亡。早期死亡作为肿瘤进展的不良事件,严重影响mCC患者的生存,所以,准确识别mCC患者早期死亡的危险因素有助于积极进行个体化治疗并提高生存率。列线图作为一个方便实用的数学模型相对于传统的TNM分期具有更高的适用性。因此,本研究的目的是通过分析mCC患者早期死亡的危险因素,构建并验证列线图预后模型。
本研究从SEER数据库中提取的6 669例mCC患者中,早期死亡率为14.8%。通过单因素和多因素Logistic回归发现,多种因素与mCC早期死亡正相关,包括肿瘤位于右侧结肠、较低分化、较高的T分期、较高的M分期、骨转移、脑转移、CEA升高、肿瘤直径大于5.6 cm、高龄和未婚状态。本研究结果与以往传统的TNM分期系统一致,表明肿瘤患者的预后与肿瘤浸润和远处转移的程度密切相关[8]。以往研究也显示,组织学分级与预后相关,低分化肿瘤通常代表生存率的减低[9]。本研究中,肝转移对于早期死亡的影响无统计学意义,这与Tai等[9]的研究结果不一致,可能是因为本研究主要关注早期死亡,而Tai等重点关注患者的OS。对于肝转移灶,可进行局部治疗,如动脉灌注化疗或局部消融治疗[7],从而延长生存期,避免早期死亡。这种差异还提供了进一步的证据,表明短期和长期生存相关的风险因素并不总是一致的。除此之外,出现骨转移和脑转移的患者有着更高的早期死亡风险。右侧结肠癌的预后较差,这已在多项研究中得到证实,左侧和右侧结肠癌患者生存率差异的原因尚不清楚,但推测与胚胎起源以及诊断时间的差异有关[10-12]。有研究得出,老年人患肿瘤后的生存期较短[13],我们的观察支持了这一观点。老年人往往伴随更多的慢性病,包括高血压、动脉粥样硬化、慢性阻塞性肺病和糖尿病等,并且年轻患者似乎更能耐受治疗的不良反应,例如化疗后的骨髓抑制[14],此外,老年人群的免疫系统较弱,这会加速病情恶化并导致生存时间减少[15]。本研究中,未婚人群的早期死亡风险较高,据报道,相对于已婚人群,未婚患者治疗依从性较差,接受治疗较晚,这可能是导致预后不良的主要原因之一[16]。
对于早期死亡风险较高的患者,积极的治疗是有效的干预方式。目前,全身化疗是mCC的主要治疗方式,主要包括两种以5-Fu为基础的方案,FOLFIRI(5-Fu、亚叶酸钙和伊立替康)和FOLFOX(5-Fu、亚叶酸钙和奥沙利铂)[17-18]。除化疗外,多种分子靶向药也已应用于临床,包括抗血管内皮生长因子(VEGF)单克隆抗体和抗表皮生长因子受体(EGFR)单克隆抗体[19-20]。此外,免疫治疗是最近研究的重点,两种抗PD-1单克隆抗体帕博利珠单抗和纳武单抗已被批准用于治疗MSI-H/dMMR结肠癌患者[2, 21]。最后,有研究结果显示,对于mCC患者进行原发肿瘤切除能够延长生存期[9, 22]。姑息性肠切除术在缓解症状方面仍然很重要,特别是在严重出血、肠梗阻或穿孔等紧急情况下[23],约有15%~30%的CC患者因症状严重,行急诊手术治疗[24]。截止目前,对于晚期癌症患者进行手术仍然存在争议,需要进一步的研究。
本研究构建了列线图模型,可以准确预测mCC患者的早期死亡。训练集和验证集的C-index分别为0.751和0.760,表明准确度好。DCA曲线显示,此模型相对于TNM分期能为患者带来更高的临床益处。然而,目前的研究仍然存在局限性:(1)一些已知的风险因素,如PS评分、体重指数、家族史、合并症等,没有记录在SEER数据库中,因此未进行研究;(2)手术和放化疗的执行具体时间、靶向和免疫治疗均未找到相关信息。这些指标将是我们进一步研究的重点;(3)这是一项回顾性研究,需要前瞻性研究进一步论证;(4)我们只对列线图进行内部验证,需要外部验证才能扩展模型的适用性。
综上,基于从SEER数据库中提取的mCC患者的临床数据,本研究确定了部分与早期死亡相关的因素,并构建了基于风险因素准确预测mCC患者早期死亡的列线图。此预测模型将有助于指导临床医生识别有较高早期死亡风险的mCC患者并进行个体化诊治。
作者贡献:
王磊:资料收集、文献查阅、数据分析及论文撰写
韩晖琼:文献查阅、资料收集审阅
秦艳茹:研究方案设计、审阅
| [1] |
Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. DOI:10.3322/caac.21708 |
| [2] |
Ciardiello F, Ciardiello D, Martini G, et al. Clinical management of metastatic colorectal cancer in the era of precision medicine[J]. CA Cancer J Clin, 2022, 72(4): 372-401. DOI:10.3322/caac.21728 |
| [3] |
Riedesser JE, Ebert MP, Betge J. Precision medicine for metastatic colorectal cancer in clinical practice[J]. Ther Adv Med Oncol, 2022, 14: 17588359211072703. |
| [4] |
Wang X, Mao M, Xu G, et al. The incidence, associated factors, and predictive nomogram for early death in stage Ⅳ colorectal cancer[J]. Int J Colorectal Dis, 2019, 34(7): 1189-1201. DOI:10.1007/s00384-019-03306-1 |
| [5] |
Kanth P, Inadomi JM. Screening and prevention of colorectal cancer[J]. BMJ, 2021, 374: n1855. |
| [6] |
Biller LH, Schrag D. Diagnosis and Treatment of Metastatic Colorectal Cancer: A Review[J]. JAMA, 2021, 325(7): 669-685. DOI:10.1001/jama.2021.0106 |
| [7] |
Datta J, Narayan RR, Kemeny NE, et al. Role of Hepatic Artery Infusion Chemotherapy in Treatment of Initially Unresectable Colorectal Liver Metastases: A Review[J]. JAMA Surg, 2019, 154(8): 768-776. DOI:10.1001/jamasurg.2019.1694 |
| [8] |
Hari DM, Leung AM, Lee JH, et al. AJCC Cancer Staging Manual 7th edition criteria for colon cancer: do the complex modifications improve prognostic assessment?[J]. J Am Coll Surg, 2013, 217(2): 181-190. DOI:10.1016/j.jamcollsurg.2013.04.018 |
| [9] |
Tai Q, Xue W, Li M, et al. Survival Nomogram for Metastasis Colon Cancer Patients Based on SEER Database[J]. Front Genet, 2022, 13: 832060. DOI:10.3389/fgene.2022.832060 |
| [10] |
Wang Y, Yang L, Zhou M, et al. Disparities in survival for right-sided vs. left-sided colon cancers in young patients: a study based on the Surveillance, Epidemiology, and End Results database (1990-2014)[J]. Cancer Manag Res, 2018, 10: 1735-1747. DOI:10.2147/CMAR.S163302 |
| [11] |
Meguid RA, Slidell MB, Wolfgang CL, et al. Is there a difference in survival between right- versus left-sided colon cancers?[J]. Ann Surg Oncol, 2008, 15(9): 2388-2394. DOI:10.1245/s10434-008-0015-y |
| [12] |
徐洪丽, 胡俊杰, 徐慧婷, 等. 不同原发部位结肠癌的临床病理及预后分析[J]. 肿瘤防治研究, 2018, 45(9): 672-675. [Xu HL, Hu JJ, Xu HT, et al. Clinicopathologic Characteristics and Prognosis of Colon Cancer Patients with Different Primary Locations[J]. Zhong Liu Fang Zhi Yan Jiu, 2018, 45(9): 672-675. DOI:10.3971/j.issn.1000-8578.2018.18.0017] |
| [13] |
Chen F, Wang F, Bailey CE, et al. Evaluation of determinants for age disparities in the survival improvement of colon cancer: results from a cohort of more than 486, 000 patients in the United States[J]. Am J Cancer Res, 2020, 10(10): 3395-3405. |
| [14] |
Patel SG, Ahnen DJ. Colorectal Cancer in the Young[J]. Curr Gastroenterol Rep, 2018, 20(4): 15. DOI:10.1007/s11894-018-0618-9 |
| [15] |
Tilg H, Adolph TE, Gerner RR, et al. The Intestinal Microbiota in Colorectal Cancer[J]. Cancer Cell, 2018, 33(6): 954-964. DOI:10.1016/j.ccell.2018.03.004 |
| [16] |
Krajc K, Miroševič Š, Sajovic J, et al. Marital status and survival in cancer patients: A systematic review and meta-analysis[J]. Cancer Med, 2022. Online ahead of print.
|
| [17] |
Goldberg RM, Sargent DJ, Morton RF, et al. A randomized controlled trial of fluorouracil plus leucovorin, irinotecan, and oxaliplatin combinations in patients with previously untreated metastatic colorectal cancer[J]. J Clin Oncol, 2004, 22(1): 23-30. DOI:10.1200/JCO.2004.09.046 |
| [18] |
Colucci G, Gebbia V, Paoletti G, et al. PhaseⅢ randomized trial of FOLFIRI versus FOLFOX4 in the treatment of advanced colorectal cancer: a multicenter study of the Gruppo Oncologico Dell'Italia Meridionale[J]. J Clin Oncol, 2005, 23(22): 4866-4875. DOI:10.1200/JCO.2005.07.113 |
| [19] |
Arnold D, Lueza B, Douillard JY, et al. Prognostic and predictive value of primary tumour side in patients with RAS wild-type metastatic colorectal cancer treated with chemotherapy and EGFR directed antibodies in six randomized trials[J]. Ann Oncol, 2017, 28(8): 1713-1729. DOI:10.1093/annonc/mdx175 |
| [20] |
Saltz LB, Clarke S, Díaz-Rubio E, et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase Ⅲstudy[J]. J Clin Oncol, 2008, 26(12): 2013-2019. DOI:10.1200/JCO.2007.14.9930 |
| [21] |
Overman MJ, McDermott R, Leach JL, et al. Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study[J]. Lancet Oncol, 2017, 18(9): 1182-1191. DOI:10.1016/S1470-2045(17)30422-9 |
| [22] |
Qiao Y, Qiao Y, Li H, et al. Survival benefit of primary and metastatic tumor resection for colon cancer with liver metastases: A population based, propensity score-matched study[J]. Front Surg, 2022, 9: 959826. DOI:10.3389/fsurg.2022.959826 |
| [23] |
Ruo L, Gougoutas C, Paty PB, et al. Elective bowel resection for incurable stage Ⅳ colorectal cancer: prognostic variables for asymptomatic patients[J]. J Am Coll Surg, 2003, 196(5): 722-728. DOI:10.1016/S1072-7515(03)00136-4 |
| [24] |
Decker KM, Lambert P, Nugent Z, et al. Time Trends in the Diagnosis of Colorectal Cancer With Obstruction, Perforation, and Emergency Admission After the Introduction of Population-Based Organized Screening[J]. JAMA Netw Open, 2020, 3(5): e205741. DOI:10.1001/jamanetworkopen.2020.5741 |
 2023, Vol. 50
2023, Vol. 50