文章信息
- 基于TCGA数据库构建肝癌铜死亡的预后模型
- Construction of Prognostic Model for Cuprotosis in Hepatocellular Carcinoma Based on TCGA Database
- 肿瘤防治研究, 2023, 50(3): 276-282
- Cancer Research on Prevention and Treatment, 2023, 50(3): 276-282
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.0875
- 收稿日期: 2022-08-04
- 修回日期: 2022-11-24
2. 400021 重庆,重庆市中医院肝病科
2. Department of Hepatic Diseases, Chongqing Hospital of Traditional Chinese Medicine, Chongqing 400021, China
肝细胞癌(HCC)主要由肝炎病毒感染、饮酒或其他肝脏疾病引起,是全球常见的恶性肿瘤之一。2018年全球癌症统计数据显示,全球每年新发HCC病例905 677例,在恶性肿瘤发病率谱中排名第七[1]。60%~70%的早期HCC患者通过手术切除可以获得5年生存率,口服靶向药物和免疫治疗可以延长生存时间[2]。近年研究表明,在HCC发生发展过程中存在多种信号通路调节异常,与HCC的分子特征有关[3]。虽然目前免疫检查点抑制剂的应用已成为调节肿瘤免疫和微环境的有效方法。然而,针对肝癌的转移和复发,上述治疗方法疗效仍不理想。
铜是生物过程中不可缺少的微量元素,并作为多种必需酶的辅助因子参与多种生理或病理过程。铜离子主要储存于线粒体中,当细胞内铜代谢失衡时,可产生细胞毒性作用,诱发Wilson’s病、Menkes病等[4-5]。铜稳态的失衡还与消化系统疾病、肿瘤等有关。然而,目前铜死亡相关基因(CRGs)在HCC中的影响尚不清楚。因此,本研究利用癌症基因组图谱(TCGA)数据集分析CRGs在肝癌组织和正常肝脏组织中的表达差异,分析CRGs表达与HCC预后、免疫细胞浸润等的相关性,并基于CRGs构建肝癌预后风险模型,为进一步探索CRGs在HCC中的意义提供线索。
1 资料与方法 1.1 数据来源从TCGA数据库(https://portal.gdc.cancer. gov/)下载肝癌TCGA-LIHC的RNA-Seq表达谱数据及相匹配的临床数据,共纳入374例HCC组织和50例正常肝脏组织。
1.2 表达与生存分析去除TCGA数据库中临床信息不完整的样本,采用R(3.6.3)软件预处理原始数据,进行标准化和差异性分析,比较TCGA数据库中CRGs在肝癌组织和正常肝脏组织中的表达差异。根据CRGs表达的中位数划分,将HCC样本分为高表达组和低表达组,R软件的“survival”软件包进行生存分析,并绘制Kaplan-Meier生存分析曲线。
1.3 GO和KEGG富集分析从STRING数据库(https://cn.string-db.org/)获取各个CRGs相关性较高的10个基因,筛选条件设置如下:物种:人;网络边的意义:证据;有效交互来源:所有;最小所需交互得分:中等置信度(0.400);显示的最大交互数量: 不大于10个交互。将CRGs及其相关基因汇总去重后进行GO和KEGG的富集分析。将基因输入DAVID(https://david.ncifcrf.gov/tools.jsp)在线分析网站,identifier选择“OFFICIAL_GENE_SYMBOL”,物种选择“人”,提交后获得富集分析结果。P < 0.05的基因集为显著富集的基因集。
1.4 免疫细胞浸润分析R软件的“GSVA”软件包单样本基因集富集分析(ssGSEA)量化24种免疫细胞的浸润情况,Spearman相关分析评估免疫细胞与CRGs基因的相关性。免疫细胞包括树突状细胞、B细胞、CD8+ T细胞、细胞毒性细胞、嗜酸性粒细胞、巨噬细胞、肥大细胞、中性粒细胞、自然杀伤细胞、T细胞、辅助T细胞、中央记忆型T细胞、效应记忆性T细胞、滤泡辅助性T细胞、γδT细胞、Th1细胞、Th17细胞、Th2细胞和调节性T细胞。
1.5 建立预后模型单因素Cox回归分析CRGs与HCC预后相关性,筛选出与生存相关的CRGs。Lasso回归分析过滤预后基因,多因素Cox回归分析进一步筛选并构建CRGs预后模型,风险评分为(铜死亡相关基因表达量×回归系数)+ …… +(铜死亡相关基因表达量×回归系数)。根据预后模型风险值的中位数划分,将HCC样本分为高风险组和低风险组,进行Kaplan-Meier生存分析,绘制ROC曲线以评估预测效能,单因素和多因素Cox回归分析对临床分期、TNM分期及风险模型进行分析,评估风险模型。P < 0.05为差异有统计学意义。
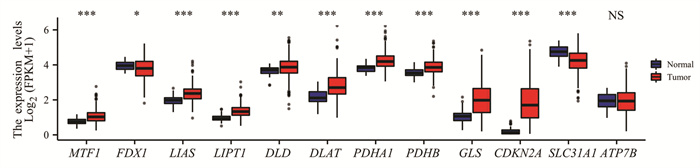
2 结果 2.1 CRGs在HCC中的表达TCGA数据库分析结果显示:FDX1(P=2.0e-02)和SLC31A1(P=1.3e-08)在HCC组织中呈低表达,LIAS(P=2.0e-11)、LIPT1(P=1.6e-14)、DLD(P= 2.5e-03)、DLAT(P=1.5e-10)、PDHA1(P=4.3e-11)、PDHB(P= 4.5e-09)、MTF1(P= 3.2e-09)、G LS(P=3.1e-12)和CDKN2A(P=1.2e-25)在HCC组织中呈高表达,见图 1。
|
| *: P < 0.05, **: P < 0.01, ***: P < 0.001, NS: no significance, compared between HCC and normal tissues. 图 1 铜死亡相关基因在肝癌和正常肝组织中的表达水平 Figure 1 Expression of cuprotosis-related genes in HCC and normal tissues |
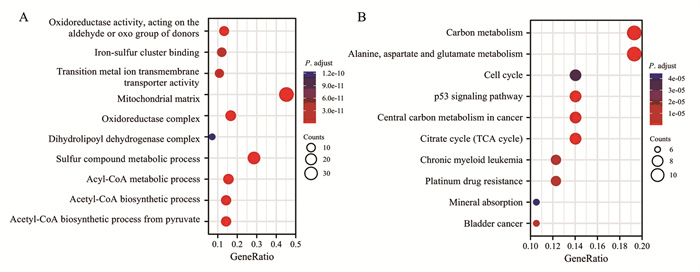
GO功能富集分析结果显示CRGs及其相关基因主要富集于氧化还原酶活性, 作用于供体的醛基或氧基、线粒体基质和硫化合物代谢过程等。KEGG信号通路富集分析结果显示CRGs及其相关基因主要富集于碳代谢、丙氨酸、天冬氨酸和谷氨酸代谢、细胞周期和p53信号通路等信号通路,见图 2。
|
| 图 2 铜死亡相关基因及其相关基因的GO(A)和KEGG(B)富集分析 Figure 2 GO(A) and KEGG(B) enrichment analyses for cuprotosis-related genes and their related genes |
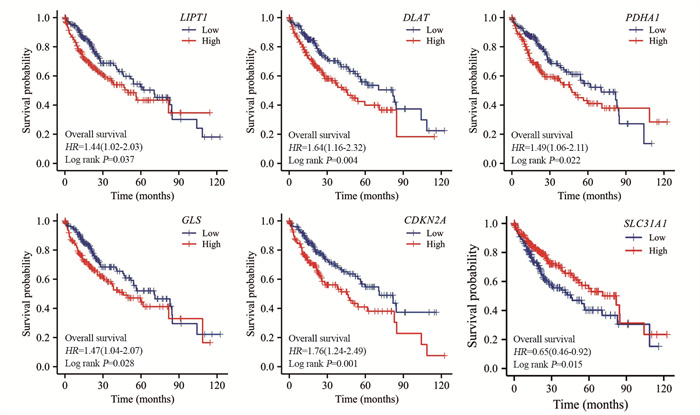
Kaplan-Meier生存分析结果显示,LIPT1(P=0.037)、DLAT(P=0.004)、PDHA1(P=0.022)、GLS(P=0.028)和CDKN2A(P=0.001)高表达组的总体生存率显著低于低表达组,SLC31A1(P=0.015)高表达组的总体生存率显著高于低表达组,见图 3。
|
| 图 3 铜死亡相关基因的表达与预后的关系 Figure 3 Correlation between the expression of cuprotosis-related genes and prognosis |
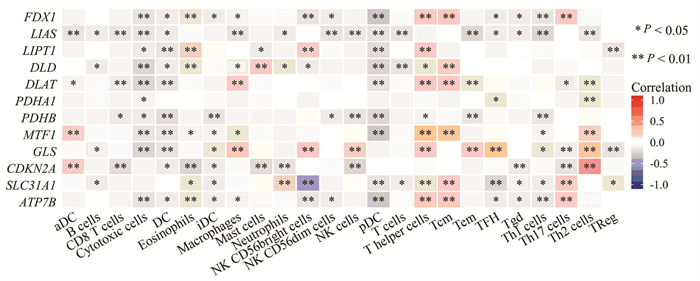
结果显示,部分CRGs如LIAS、GLS等的表达水平与免疫细胞细胞毒性细胞、滤泡树突细胞、浆细胞样滤泡树突细胞、T辅助细胞和T中央记忆细胞等免疫细胞的浸润呈显著相关(P < 0.05),其中细胞毒性细胞、滤泡树突细和浆细胞样滤泡树突细胞等免疫细胞与CRGs的表达呈负相关(r < 0),T辅助细胞和T中央记忆细胞等免疫细胞与CRGs的表达呈正相关(r > 0),见图 4。
|
| 图 4 铜死亡相关基因与免疫细胞浸润的相关性 Figure 4 Correlation between cuprotosis-related genes and immune cell infiltration |
对CRGs和HCC患者的生存时间、生存状态进行分析,单因素Cox回归分析得到与预后显著相关的CRGs(P < 0.05)。随后进行多因素Cox分析,见表 1,并基于多因素Cox分析构建CRGs预后模型,CRGs风险评分=0.32529×LIPT1的表达+0.42542×DLAT的表达+0.57518×CDKN2A的表达。
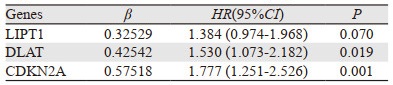
|
与高风险组相比,低风险组的风险评分较低。随着风险评分的升高,死亡患者增多,见图 5A。对CRGs预后模型分组,结果显示高风险组的HCC患者的预后更差(P < 0.001),见图 5B。ROC曲线评估CRGs预后模型,1、3、5年总生存率ROC曲线下面积分别为0.732、0.653和0.634,见图 5C。单因素和多因素Cox分析结果显示风险评分(P < 0.001)是独立预后因素,见表 2。以上结果表明该模型具有较好的预后预测能力。
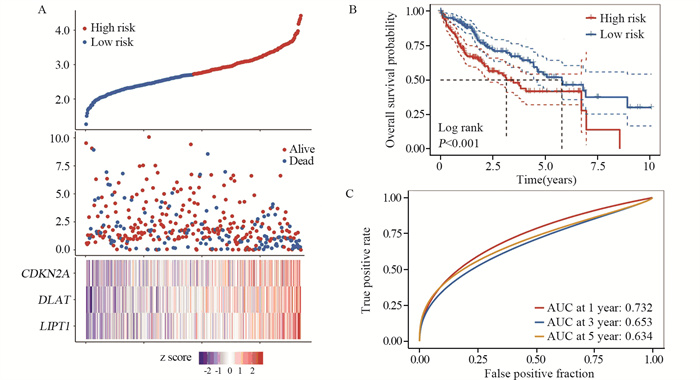
|
| 图 5 铜死亡相关基因预后模型的生存评估 Figure 5 Survival assessment of prognostic models for cuprotosis-related genes |
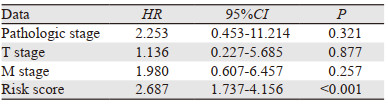
|
肝癌是常见的恶性肿瘤之一,目前,由于早期缺乏有效的诊断方法,多数肝癌患者确诊时已达疾病晚期[6-7]。因此,探索肝癌发生发展的分子机制、开发有效的诊断和治疗方法,具有重要的意义。有研究[8-10]表明,与健康对照者相比,多种肿瘤患者血清和肿瘤组织中的铜含量均明显升高,并与预后相关。目前靶向铜诱导凋亡的策略主要包括使用铜离子螯合剂、铜离子载体来调节体内铜的水平等方式,诱导肿瘤细胞凋亡,从而发挥抗肿瘤的作用[11-12]。细胞死亡方式包括细胞凋亡、铁死亡、焦亡和坏死性凋亡等,可通过诱导活性氧生成、调节蛋白泛素化、乙酰化等功能调节细胞死亡[13]。Tsvetkov等[14]报道了一种不同于已知细胞死亡的新机制,并将其命名为铜死亡。铜死亡过程包括体内出现铜离子的累积,铜离子与三羧酸循环中脂酰化修饰的蛋白结合,导致脂酰化蛋白异常聚集、铁硫簇蛋白丢失,从而导致蛋白毒性应激,最终导致细胞死亡。研究确定了铜死亡相关的关键基因包括铁氧化还原蛋白1(FDX1)、硫辛酸合成酶(LIAS)、二氢硫辛酰胺转乙酰基酶(DLAT)、二氢硫辛酰胺脱氢酶(DLD)、丙酮酸脱氢酶E1α亚单位(PDHA1)、丙酮酸脱氢酶β亚单位(PDHB)、金属转录调节因子1(MTF1)、谷氨酰胺酶1(GLS)、细胞周期依赖性蛋白激酶抑制因子2A(CDKN2A)、脂酰转移酶1(LIPT1)和P型铜转运ATP酶(ATPTB)。报道显示在人慢性粒细胞白血病细胞株K562中敲除FDX1可抑制三羧酸循环,铜死亡受到抑制。因此,开发能靶向调节体内铜稳态包括吸收、转运等过程的药物,如双硫仑、伊利司莫等[11, 15],可为提高抗癌药物敏感度等提供线索。本研究通过分析TCGA数据库中的LIHC数据集,分析CRGs与预后、免疫的相关性,建立并验证了基于CRGs的HCC预后模型。
近年来研究显示,铜离子载体双硫仑和伊利司莫通过螯合铜离子影响肿瘤细胞内蛋白质的降解,从而诱导铜依赖的肿瘤细胞死亡[16-17]。细胞色素C氧化酶是线粒体呼吸链上的重要酶,作为细胞色素C氧化酶的辅助因子,线粒体内铜离子水平可受伊利司莫调节,从而调节细胞色素C氧化酶活性,治疗人体铜代谢紊乱引起的疾病[18]。本研究发现大部分CRGs在HCC中呈现异常表达,部分CRGs包括DLAT、CDKN2A等还与HCC患者的预后相关。近期研究发现丙酮酸脱氢酶复合物的亚基DLAT可通过乙酰化6PGD增强酶活性,从而提高核酸合成,促进肺癌细胞株的增殖[19]。在肝癌组织中PDHA1的蛋白表达与肿瘤大小、TNM分期和预后相关,在肝癌细胞株中过表达PDHA1能够调控三羧酸循环酶的活性,抑制有氧糖酵解,增强线粒体调控的凋亡信号通路[20]。曹俊等[21]发现在肝内胆管细胞癌组织中GLS蛋白表达显著上调,干扰胆管癌细胞株中GLS基因的表达可提高细胞对5-氟尿嘧啶化疗的敏感度。CRGs不仅与HCC预后相关,还与HCC中免疫细胞的浸润相关。Lv等[22]分析公共数据库数据发现在黑色素瘤中,LIPT1的表达与预后、免疫细胞浸润相关,提示其可能作为黑色素瘤免疫治疗的潜在靶点。有研究[23]报道显示在CDKN2A缺失的黑色素瘤患者中,与肿瘤对免疫检查点抑制剂有较好反应有关的基因改变率较高,提示CDKN2A的改变可作为预测黑色素瘤免疫治疗反应的潜在标志物。
信号通路富集分析结果显示CRGs及其相关基因主要富集于丙氨酸、天冬氨酸和谷氨酸代谢、柠檬酸循环(TCA循环)、癌症中的中心碳代谢和p53信号通路等。其中,丙氨酸、天冬氨酸和谷氨酸代谢信号通路中的丙氨酸、谷氨酸和天冬氨酸均为糖代谢相关氨基酸[24],p53信号通路参与代谢重编程[25],癌症的中心碳代谢包括三羧酸循环、糖酵解等,以上信号通路均与细胞代谢密切相关。细胞代谢在肿瘤的发生和转移中起关键作用,并可能影响肿瘤细胞对治疗药物的敏感度,表明CRGs及其相关基因可能主要是通过调控肿瘤细胞代谢影响HCC的发生、发展。上述富集分析结果主要侧重于肿瘤微环境中的细胞代谢,研究表明代谢重编程还具有免疫调节作用[26],因此,我们还分析了肿瘤微环境中免疫细胞浸润情况与CRGs的关系。免疫细胞浸润分析表明,多种免疫细胞的浸润程度与CRGs的表达显著相关。其中,浆细胞样滤泡树突细胞与CRGs的表达呈负相关,T辅助细胞与CRGs的表达呈正相关。DLAT和戊二酸氧代脱氢酶形成的复合体是主要的线粒体自身抗原,可引起原发性胆汁性肝硬化患者中CD4+T细胞和CD8+T细胞的反应性增强[27]。在三阴性乳腺癌实验模型中,GLS肿瘤细胞特异性的丢失可引起T细胞的活化和效应能力的增加,表明肿瘤微环境中谷氨酰胺的减少具有免疫抑制作用,可能通过改变肿瘤微环境中代谢物利用率影响淋巴细胞发挥作用[28]。Wang等[29]运用生物信息学方法分析TCGA黑色素瘤样本,发现CDKN2A在基于ESTIMATE算法的肿瘤微环境高免疫得分组和低免疫得分组之间存在显著差异。在肝癌相关的生物信息学分析中,CDKN2A与免疫细胞浸润水平相关,并与免疫检查点PD1、PD-L1和CTLA-4的表达显著相关[30-31]。以上研究结果表明CRGs可能通过调控多种途径影响肿瘤微环境中细胞的代谢,不仅可影响肿瘤细胞增殖和凋亡,还可能调节非肿瘤细胞如免疫细胞的活性和比例,免疫细胞浸润作为肿瘤微环境的组成要素之一也可调节肿瘤的发展和转归。
本研究运用多因素Cox回归分析建立了CRGs的预后模型,预后模型中包括CDKN2A、DLAT和LIPT1。来自TCGA和GEO数据库的数据显示CDKN2A水平在HCC中明显升高,与HCC患者较差的整体生存和无病生存相关,并与多种免疫标志物相关[31]。肉瘤样肝细胞性肝癌患者肿瘤基因组谱显示CDKN2A突变率显著增高,CDKN2A的突变显著降低肉瘤样肝细胞性肝癌患者的无瘤生存率和总生存率[32]。肝内胆管细胞癌患者二代测序结果显示CDKN2A基因变异率为15%,并与患者总生存期显著相关。在肿瘤切除患者中,CDKN2A基因缺失是该部分患者总生存期较短、区域淋巴结转移等高风险临床变量的独立预测因素[33]。生物信息学分析显示DLAT在结直肠癌呈现高表达,DLAT低表达患者的预后较差,TNM分期较晚[34]。运用基于iTRAQ的串联质谱法检测胃癌细胞株,结果显示DLAT蛋白水平显著升高。敲减胃癌细胞株中的DLAT后,细胞增殖受到抑制,细胞内丙酮酸盐含量增加,其机制可能与DLAT敲减导致丙酮酸盐转化为乙酰辅酶A受阻,丙酮酸盐累积增加有关[35]。目前尚缺乏DLAT和LIPT1在肝细胞癌中的相关研究。
综上所述,本研究通过挖掘TCGA数据库中肝癌相关数据集,分析CRGs在肝癌组织中的表达水平及其与预后的关系,分析CRGs及相关基因涉及的信号通路、免疫细胞浸润等,并基于CRGs构建风险预后模型,该模型具有中等水平的预后预测能力。以上研究结果尚需进一步结合临床样本进行验证,证实CRGs在肝癌发生发展中的作用。
作者贡献:
雷青松:数据整理和分析、文献收集、撰写论文
李麟:数据下载、设计实验、论文审阅
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Moriguchi M, Aramaki T, Nishiofuku H, et al. Sorafenib versus hepatic arterial infusion chemotherapy as initial treatment for hepatocellular carcinoma with advanced portal vein tumor thrombosis[J]. Liver Cancer, 2017, 6(4): 275-286. DOI:10.1159/000473887 |
| [3] |
Yang JD, Hainaut P, Gores GJ, et al. A global view of hepatocellular carcinoma: trends, risk, prevention and management[J]. Nat Rev Gastroenterol Hepatol, 2019, 16(10): 589-604. DOI:10.1038/s41575-019-0186-y |
| [4] |
Yu M, Ren L, Zheng M, et al. Delayed Diagnosis of Wilson's disease report from 179 newly diagnosed cases in China[J]. Front Neurol, 2022, 13: 884840. DOI:10.3389/fneur.2022.884840 |
| [5] |
Guo Y, Xia W, Peng X, et al. Almost misdiagnosed Menkes disease: A case report[J]. Heliyon, 2022, 8(4): e09268. DOI:10.1016/j.heliyon.2022.e09268 |
| [6] |
李圣豪, 石新丽. 原发性肝癌中PD-L1表达的调控机制[J]. 肿瘤防治研究, 2021, 48(11): 1052-1058. [Li SH, Shi XL. Regulatory mechanism of PD-L1 expression in primary liver cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2021, 48(11): 1052-1058. DOI:10.3971/j.issn.1000-8578.2021.21.0397] |
| [7] |
黄乾荣, 张玲. 原发性肝癌治疗研究新进展[J]. 实用医学杂志, 2016, 32(14): 2275-2278. [Huang QR, Zhang L. Advances in the treatment of primary liver cancer[J]. Shi Yong Yi Xue Za Zhi, 2016, 32(14): 2275-2278. DOI:10.3969/j.issn.1006-5725.2016.14.008] |
| [8] |
Li Y. Copper homeostasis: Emerging target for cancer treatment[J]. IUBMB Life, 2020, 72(9): 1900-1908. DOI:10.1002/iub.2341 |
| [9] |
Shanbhag VC, Gudekar N, Jasmer K, et al. Copper metabolism as a unique vulnerability in cancer[J]. Biochim Biophys Acta Mol Cell Res, 2021, 1868(2): 118893. DOI:10.1016/j.bbamcr.2020.118893 |
| [10] |
Ge EJ, Bush AI, Casini A, et al. Connecting copper and cancer: from transition metal signalling to metalloplasia[J]. Nat Rev Cancer, 2022, 22(2): 102-113. DOI:10.1038/s41568-021-00417-2 |
| [11] |
Tawari PE, Wang Z, Najlah M, et al. The cytotoxic mechanisms of disulfiram and copper(ii) in cancer cells[J]. Toxicol Res (Camb), 2015, 4(6): 1439-1442. DOI:10.1039/c5tx00210a |
| [12] |
Li Y, Wang LH, Zhang HT, et al. Disulfiram combined with copper inhibits metastasis and epithelial-mesenchymal transition in hepatocellular carcinoma through the NF-κB and TGF-β pathways[J]. J Cell Mol Med, 2018, 22(1): 439-451. DOI:10.1111/jcmm.13334 |
| [13] |
Nirmala JG, Lopus M. Cell death mechanisms in eukaryotes[J]. Cell Biol Toxicol, 2020, 36(2): 145-164. DOI:10.1007/s10565-019-09496-2 |
| [14] |
Tsvetkov P, Coy S, Petrova B, et al. Copper induces cell death by targeting lipoylated TCA cycle proteins[J]. Science, 2022, 375(6586): 1254-1261. DOI:10.1126/science.abf0529 |
| [15] |
Gao W, Huang Z, Duan J, et al. Elesclomol induces copperdependent ferroptosis in colorectal cancer cells via degradation of ATP7A[J]. Mol Oncol, 2021, 15(12): 3527-3544. DOI:10.1002/1878-0261.13079 |
| [16] |
Skrott Z, Mistrik M, Andersen KK, et al. Alcohol-abuse drug disulfiram targets cancer via p97 segregase adaptor NPL4[J]. Nature, 2017, 552(7684): 194-199. DOI:10.1038/nature25016 |
| [17] |
Tsvetkov P, Detappe A, Cai K, et al. Mitochondrial metabolism promotes adaptation to proteotoxic stress[J]. Nat Chem Biol, 2019, 15(7): 681-689. DOI:10.1038/s41589-019-0291-9 |
| [18] |
Soma S, Latimer AJ, Chun H, et al. Elesclomol restores mitochondrial function in genetic models of copper deficiency[J]. Proc Natl Acad Sci U S A, 2018, 115(32): 8161-8166. DOI:10.1073/pnas.1806296115 |
| [19] |
孙明明, 乔亚亚, 李垒垒, 等. 二氢硫辛酰转乙酰基酶通过乙酰化磷酸葡糖酸脱氢酶促进核酸合成[J]. 中国生物化学与分子生物学报, 2021, 37(3): 339-346. [Sun MM, Qiao YY, Li LL, et al. Dihydrolipoamide acetyltransferase promotes nucleic acid synthesis by controlling phosphogluconate dehydrogenase acetylation[J]. Zhongguo Sheng Wu Hua Xue Yu Fen Zi Sheng Wu Xue Bao, 2021, 37(3): 339-346.] |
| [20] |
Sun J, Li J, Guo Z, et al. Overexpression of Pyruvate Dehydrogenase E1α Subunit Inhibits Warburg Effect and Induces Cell Apoptosis Through Mitochondria-Mediated Pathway in Hepatocellular Carcinoma[J]. Oncol Res, 2019, 27(4): 407-414. DOI:10.3727/096504018X15180451872087 |
| [21] |
曹俊, 柏斗胜, 金圣杰, 等. 谷氨酰胺酶1介导主穹隆蛋白表达调控肝内胆管癌细胞对5-氟尿嘧啶化疗敏感性的研究[J]. 中华普通外科杂志, 2019, 28(3): 248-252. [Cao J, Bai DS, Jin SJ, et al. Glutamine 1 regulates the chemosensitivity of intrahepatic cholangiocarcinoma cells to 5-FU by targeting major vault protein[J]. Zhonghua Pu Tong Wai Ke Za Zhi, 2019, 28(3): 248-252.] |
| [22] |
Lv H, Liu X, Zeng X, et al. Comprehensive Analysis of Cuproptosis-Related Genes in Immune Infiltration and Prognosis in Melanoma[J]. Front Pharmacol, 2022, 13: 930041. DOI:10.3389/fphar.2022.930041 |
| [23] |
Arnoff TE, El-Deiry WS. MDM2/MDM4 amplification and CDKN2A deletion in metastatic melanoma and glioblastoma multiforme may have implications for targeted therapeutics and immunotherapy[J]. Am J Cancer Res, 2022, 12(5): 2102-2117. |
| [24] |
Lee DY, Kim EH. Therapeutic Effects of Amino Acids in Liver Diseases: Current Studies and Future Perspectives[J]. J Cancer Prev, 2019, 24(2): 72-78. DOI:10.15430/JCP.2019.24.2.72 |
| [25] |
An J, Ha EM. Extracellular vesicles derived from Lactobacillus plantarum restore chemosensitivity through the PDK2-mediated glucose metabolic pathway in 5-FU-resistant colorectal cancer cells[J]. J Microbiol, 2022, 60(7): 735-745. DOI:10.1007/s12275-022-2201-1 |
| [26] |
尤晓昕, 张丹, 李尔广. 氨基酸代谢重编程在肿瘤发生发展及免疫治疗中的作用[J]. 中国细胞生物学学报, 2021, 43(9): 1846-1852. [You XX, Zhang D, Li EG. Amino acid metabolic reprogramming in tumorigenesis and development and its role in immunotherapy[J]. Zhongguo Xi Bao Sheng Wu Xue Xue Bao, 2021, 43(9): 1846-1852.] |
| [27] |
Hirschfield GM, Gershwin ME. The immunobiology and pathophysiology of primary biliary cirrhosis[J]. Annu Rev Pathol, 2013, 8: 303-330. DOI:10.1146/annurev-pathol-020712-164014 |
| [28] |
Edwards DN, Ngwa VM, Raybuck AL, et al. Selective glutamine metabolism inhibition in tumor cells improves antitumor T lymphocyte activity in triple-negative breast cancer[J]. J Clin Invest, 2021, 131(4): e140100. DOI:10.1172/JCI140100 |
| [29] |
Wang J, Peng C, Dai W, et al. Exploring Tumor Immune Microenvironment and Its Associations With Molecular Characteristics in Melanoma[J]. Front Oncol, 2022, 12: 821578. DOI:10.3389/fonc.2022.821578 |
| [30] |
Liu H, Jia S, Guo K, et al. INK4 cyclin-dependent kinase inhibitors as potential prognostic biomarkers and therapeutic targets in hepatocellular carcinoma[J]. Biosci Rep, 2022, 42(7): BSR20221082. DOI:10.1042/BSR20221082 |
| [31] |
Luo JP, Wang J, Huang JH. CDKN2A is a prognostic biomarker and correlated with immune infiltrates in hepatocellular carcinoma[J]. Biosci Rep, 2021, 41(10): BSR20211103. DOI:10.1042/BSR20211103 |
| [32] |
Zhang C, Feng S, Tu Z, et al. Sarcomatoid hepatocellular carcinoma: From clinical features to cancer genome[J]. Cancer Med, 2021, 10(18): 6227-6238. DOI:10.1002/cam4.4162 |
| [33] |
Boerner T, Drill E, Pak LM, et al. Genetic Determinants of Outcome in Intrahepatic Cholangiocarcinoma[J]. Hepatology, 2021, 74(3): 1429-1444. DOI:10.1002/hep.31829 |
| [34] |
王婷, 李春晓, 南鹏, 等. 基于多数据库分析代谢相关基因DLAT在结直肠癌中的表达及其临床意义[J]. 解放军医学杂志, 2019, 44(4): 311-317. [Wang T, Li CX, Nan P, et al. Analysis of metabolic associated gene DLAT expression in colorectal cancer based on multi-database and its clinical significance[J]. Jiefangjun Yi Xue Za Zhi, 2019, 44(4): 311-317.] |
| [35] |
Goh WQ, Ow GS, Kuznetsov VA, et al. DLAT subunit of the pyruvate dehydrogenase complex is upregulated in gastric cancerimplications in cancer therapy[J]. Am J Transl Res, 2015, 7(6): 1140-1151. |
 2023, Vol. 50
2023, Vol. 50
