文章信息
- MDM2抑制剂RG-7388诱导弥漫性大B淋巴瘤细胞凋亡和周期阻滞
- MDM2 Inhibitor RG-7388 Promotes Apoptosis and Cell Cycle Arrest of Diffuse Large B Cell Lymphoma
- 肿瘤防治研究, 2023, 50(3): 243-248
- Cancer Research on Prevention and Treatment, 2023, 50(3): 243-248
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.0873
- 收稿日期: 2022-08-04
- 修回日期: 2022-11-16
2. 221004 徐州,徐州医科大学血液病研究所;
3. 223300 淮安,江苏省淮安市第一人民医院肿瘤内科
2. Blood Diseases Institute of Xuzhou Medical University, Xuzhou 221004, China;
3. Department of Oncology, Huai'an First People's Hospital of Jiangsu Province, Huai'an 223300, China
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是一种异质性血液恶性肿瘤,是发病率最高的一种非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)亚型,其发病率占成人非霍奇金淋巴瘤的30%~40% [1]。虽然临床上多种化疗方案,如利妥昔单抗、长春新碱、多柔比星、环磷酰胺和泼尼松等,大大提高了DLBCL患者的生存率,但仍有一部分DLBCL患者无法治愈,且容易复发[1-2]。因此仍然需要进一步开发药物改善DLBCL预后,提高疗效。RG-7388,又称Idasanutlin,是由罗氏公司开发的全球首个口服的二代临床双微体2(murine double minute 2, MDM2)蛋白抑制剂[3]。在骨肉瘤[4]、急性髓系白血病[5]、神经母细胞瘤[6]等多种肿瘤中有抗肿瘤活性,但在DLBCL中的作用尚未见报道。为此,本研究探讨MDM2抑制剂RG-7388对DLBCL的抑制效应及其机制,为RG-7388在DLBCL中的临床运用奠定基础。
1 材料与方法 1.1 试剂与仪器药物RG7388购自美国CSNpharm公司。IMDM培养液、胎牛血清(FBS)购自美国Gibco公司。CCK8试剂盒购自于中国VICMED公司。PI/RNase Staining Buff er试剂购自美国BD公司。ClickiTplusEdU试剂盒购自美国ThermoFisher公司。Annexin V-FITC/PI细胞凋亡检测试剂盒购自中国索莱宝(Solarbio)公司。Caspase-Glo® 3/7酶活检测试剂盒购自Promega(北京)生物公司。抗体MDM2、p53、p27、p21、cdc25C、CDK6、cdc2、CyclinB1、PARP、Mcl-1、Bcl-xL、Vinculin购自美国CST公司,GAPDH购自中国武汉三鹰(Protein-tech)公司。流式细胞仪FACSCalibur购自美国Bio-Rad公司。Synergy Multi-Mode Reader购自美国BioTek公司。
1.2 细胞培养DLBCL细胞株SUDHL2和HBL1购自美国菌种保藏中心,由本实验室保存于含10%FBS的IMDM培养液,置于37℃、5%CO2培养箱中培养。
1.3 细胞增殖检测CCK8法检测细胞增殖:将SUDHL2和HBL1细胞(15 000个/孔)接种到96孔板中,待细胞丰度长至80%,弃去上清液,每组细胞分别用含0.5、1、2、5、10、20 μmol/L RG7388的10%FBS的IMDM培养液处理72 h,每孔加入10 μl CCK8,37℃、5% CO2培养箱中避光孵育3 h。酶标仪测定450 nm处吸光值。
EdU法检测细胞增殖:将SUDHL2和HBL1细胞接种于6孔板中,0、2、4、8 μmol/L RG7388处理细胞48 h后,加入0.1%的EdU,于37℃、5%CO2培养箱中孵育4 h。洗涤和收集细胞沉淀后用100 μl 1×iClick固定剂室温避光固定15 min。随后用100 μl 1×iClick渗透和洗涤试剂处理静置20 min。200 μl 1×iClick反应液孵育30 min,洗涤液洗涤2次后PBS重悬沉淀后检测。
1.4 细胞周期检测将SUDHL2和HBL1细胞接种于6孔板中,用0、2、4、8 μmol/L RG7388处理细胞12h后,收集细胞并固定在70%预冷乙醇中,4℃过夜。PBS洗涤细胞后,200 μl PI/RNase染色缓冲液避光染色30 min,PBS洗涤3次后,200 μl PBS重悬。流式细胞仪检测细胞周期变化,FlowJo10软件分析结果。
1.5 细胞凋亡检测Annexin V-FITC/PI法检测细胞凋亡。SUDHL2和HBL1细胞接种于6孔板中,用0、2、4、8 μmol/L RG7388处理细胞48 h后收集细胞,200 μl 1× Binding buffer重悬细胞,每管加入2.5 μl Annexin V-FITC和5 μl PI避光孵育20 min,使用流式细胞仪进行检测。FlowJo10软件分析结果。
Caspase-Glo® 3/7酶活法检测细胞凋亡:将SUDHL2和HBL1细胞接种于96孔板中,用0、2、4、8 μmol/L RG7388处理细胞48 h后,每孔细胞加入100 μl Caspase 3/7工作液,室温避光孵育1 h后,多功能酶标仪检测荧光强度。
1.6 蛋白表达检测用不同浓度的RG7388(2、4、8 μmol/L)处理细胞72 h后,细胞裂解液冰上裂解细胞,离心收集上清液。10%SDS-PAGE进行凝胶电泳,将蛋白电转于100 mA恒流转移到0.45 μmol/L PVDF膜上。封闭液室温封闭2 h,4℃摇床孵育各类一抗过夜。TBST洗三次,每次10 min。二抗室温孵育1 h。TBST洗三次,每次10 min。用ECL化学发光试剂和化学发光成像仪(型号:ImageQuant LAS 4000 mini)检测。
1.7 统计学方法运用SPSS27.0软件和GraphPad Prism 6软件统计分析和绘图。计量资料采用均数±标准差(x ±s)表示,两组以上均数比较采用单因素方差分析。P < 0.05表示差异有统计学意义。
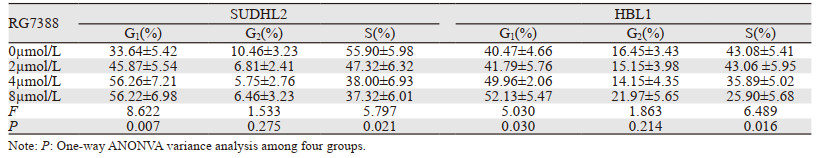
2 结果 2.1 RG7388抑制SUDHL2和HBL1细胞增殖CCK8法检测结果发现:在SUDHL2和HBL1细胞中,RG7388的IC50分别为3.36和3.76 µmol/L,其抑制作用呈剂量依赖性,见图 1。EdU法检测结果表明,RG7388处理的SUDHL2(图 2A)和HBL1(图 2B)EdU阳性细胞数显著低于对照组(P < 0.001),且呈剂量相关性。这些结果表明RG7388可有效抑制SUDHL2和HBL1细胞的增殖。

|
| 图 1 CCK8法检测RG7388对SUDHL2和HBL1细胞的增殖抑制作用 Figure 1 Inhibitory effect of RG7388 on the proliferation of SUDHL2 and HBL1 cells was detected by CCK8 assay |
|
| Compased with 0 μmol/L RG7388 group; **: P < 0.01; ***: P < 0.001, ****: P < 0.0001. 图 2 EdU法检测不同浓度RG7388对SUDHL2(A)和HBL1(B)细胞的增殖抑制作用 Figure 2 EdU assay was used to detect the inhibitory effects of different concentrations of RG7388 on SUDHL2(A) and HBL1(B) cells |
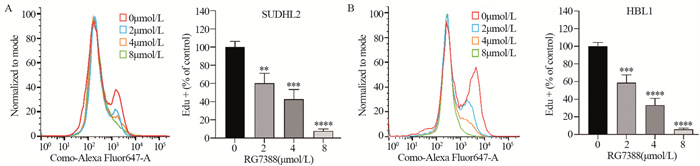
RG7388处理的SUDHL2和HBL1细胞中,随RG7388浓度的增加,G1期细胞比例显著增高。2、4、8 µmol/L RG7388处理SUDHL2细胞中,G1期细胞比例显著高于对照组(均P < 0.05)。与对照组相比,2、4、8 µmol/L RG7388处理HBL1细胞G1期细胞比例显著升高(t=2.448, P=0.019; t=2.776, P=0.012; t=2.776, P=0.011)。在两种DLBCL细胞中,S期细胞比例明显随药物处理浓度增高而下降。G2期细胞比例基本不变或只产生微弱变化。表明RG7388可诱导DLBCL细胞周期阻滞在G1期,从而抑制细胞增殖,见表 1。
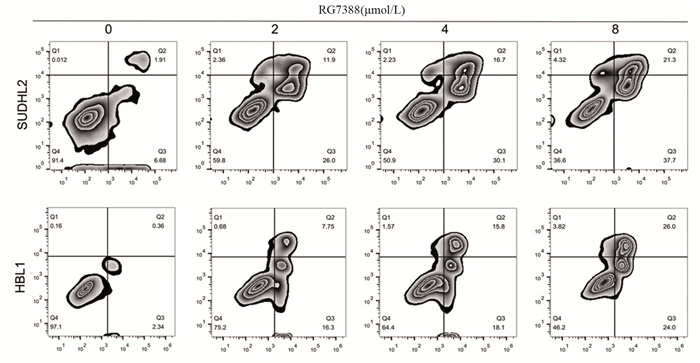
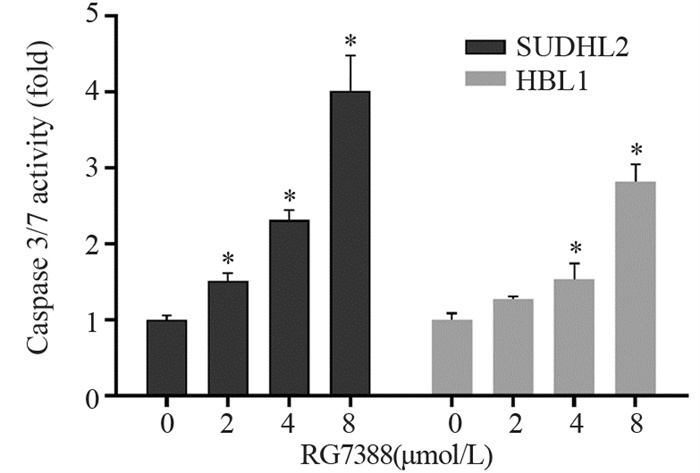
不同浓度RG7388处理48 h后,早期凋亡(Q2)和中晚期凋亡(Q3)细胞比例均显著增加。2、4、8 µmol/LRG7388处理的SUDHL2细胞中凋亡细胞比例分别为(37.9±5.46)%,(46.8 ±5.76)%和(59.0±5.32)%,显著高于对照组(8.59±2.63)%(F=56.34, P < 0.001)。HBL1细胞中,2、4、8 µmol/L RG7388处理组中凋亡细胞比例分别为(24.1±3.61)%,(33.9±4.29)% 和(50.0±4.57)%,也显著高于对照组(2.7± 0.93)%(F=89.21, P < 0.001),见图 3。与对照组比,随着RG7388浓度增高,Caspase3/7酶活性明显增高。其中在SUDHL2细胞中8 μmol/L RG7388处理组Caspase 3/7酶酶活性高达4倍,HBL1细胞中高达3倍,见图 4。表明RG7388促进了SUDHL2和HBL1细胞凋亡。
|
| 图 3 流式细胞术检测不同浓度RG7388对SUDHL2和HBL1细胞凋亡的影响 Figure 3 Effect of different concentrations of RG7388 on apoptosis of SUDHL2 and HBL1 cells detected by flow cytometry |
|
| *: compared with 0 μmol/L group, *: P < 0.05. 图 4 Caspase 3/7-GloTM酶活法检测RG7388对SUDHL2和HBL1细胞凋亡的影响 Figure 4 Effect of RG7388 on apoptosis of SUDHL2 and HBL1 cells detected by Caspase 3/7-GloTM enzyme activity method |
随药物浓度增高,p53蛋白表达水平增加;细胞周期负调控蛋白p27和p21表达水平增加;细胞凋亡相关蛋白PARP蛋白水平明显增高;细胞凋亡负调控蛋白Mcl-1、Bcl-xL表达水平则呈明显递减趋势,见图 5。由此可见,MDM2抑制剂RG7388能激活p53通路从而抑制细胞周期和诱导细胞凋亡。
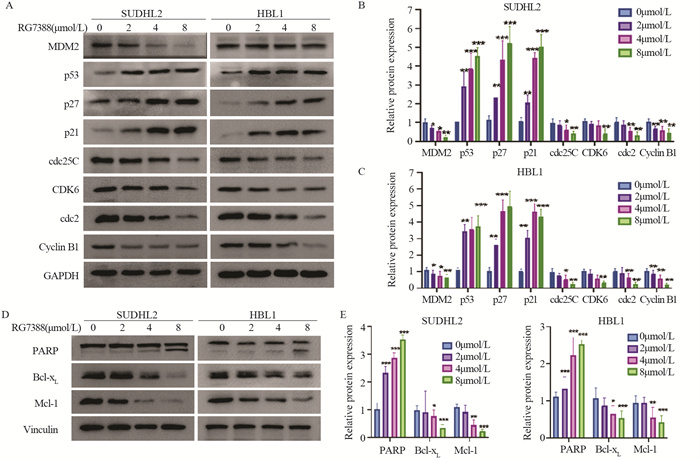
|
| Compared with 0 μmol/L RG7388 group, *: P < 0.05; **: P < 0.01; ***: P < 0.001. 图 5 蛋白免疫印迹法检测RG7388对SUDHL2和HBL1细胞周期和凋亡相关蛋白表达的调控作用 Figure 5 Western blot analysis of effect of RG7388 on the expression of SUDHL2 and HBL1 cell cycle and apoptosis-related proteins |
DLBCL是一种最常见的异质淋巴瘤类型,约占所有淋巴样恶性肿瘤的20%[7]。尽管大多数DLBCL患者对一线化疗疗法R-CHOP(利妥昔单抗、环磷酰胺、阿霉素、长春新碱、强的松)或类似方案有应答,但仍有约40%的患者会出现复发或转移[8]。开发新的精准分子靶向药物治疗DLBCL具有重要意义。本研究结果表明MDM2抑制剂RG7388可在体外有效抑制DLBCL细胞增殖。由此可见,RG7388可能是一种潜在的DLBCL治疗药物。
RG7388是一种可口服的小分子MDM2蛋白抑制剂。MDM2是p53抑癌基因的负调控因子。临床前研究证实,RG7388作为单一药物可导致p53基因活化增加、细胞周期阻滞和凋亡[9]。p53蛋白是一种肿瘤抑制因子,在正常情况下不表达或低表达。然而,在生理应激下,其半衰期延长,导致p53在细胞核中积累,在细胞核中高表达,发挥转录因子的作用。p53可以结合并激活多种靶基因的表达,发生不同的细胞反应,包括DNA修复、细胞周期阻滞、衰老或凋亡。在正常生理条件下,p53水平保持在较低水平,不断被MDM2降解。MDM2是一种E3泛素连接酶。MDM2n端与p53结合,泛素化c端结构域的几个赖氨酸残基则靶向p53,对p53进行蛋白酶体降解。随着MDM2与p53结合的结构细节的阐明,以及对这种相互作用的重要性的认识,阻止MDM2与p53结合成为一种积极的治疗策略[9-10]。抑制MDM2或恢复野生型p53蛋白的肿瘤抑制功能可有效抑制肿瘤形成。RG7388是p53-MDM2相互作用的第二代选择性抑制剂。与第一代抑制剂nutlins相比,其药理特性更佳,包括效力、生物利用度的提高以及对p53-MDM2结合位点的选择性。在临床前建模和模拟研究中,每日或间歇给药时RG7388均可有效激活p53通路,导致野生型p53细胞系周期阻滞或凋亡,最终实现肿瘤停滞[11]。本研究发现RG7388处理的DLBCL细胞中,随着RG7388浓度的增加,DLBCL细胞增殖明显受到抑制、细胞周期阻滞在G1期,细胞发生凋亡。RG7388对DLBCL细胞生长的抑制效应呈剂量依赖效应。这提示MDM2抑制剂RG7388也可能在DLBCL治疗中同样发挥重要作用。RG7388靶向抑制MDM2,负调控p53。本研究也发现RG7388处理的DLBCL细胞p53蛋白水平增加,可能就是由于MDM2被抑制,p53增加所致,与其机制作用相符。
本研究中RG7388处理后,p53蛋白稳定性增强,从而激活了p53下游相关通路。在细胞周期调控中,RG7388处理的DLBCL细胞中,细胞周期抑制蛋白p27、p21表达上调。与G2/M相关的周期蛋白有Cyclin B1、cdc2、cdc25C,这三个周期蛋白相互联系并促进真核细胞进入有丝分裂,在RG7388作用后随药物浓度明显递减,说明细胞未能进入细胞分裂。G1/G0期周期蛋白CDK6也递减,进而使细胞不能越过G1/S期发生细胞阻滞。在细胞凋亡调控中,RG7388处理后,细胞凋亡相关蛋白PARP水平明显增高;细胞凋亡负调控蛋白Mcl-1、Bcl-xL表达水平则呈明显递减趋势。这个结果与Vernooij等[6]在神经母细胞瘤中的结果一致。
本研究不足之处:仅通过体外细胞实验探讨了MDM2抑制剂RG-7388对DLBCL细胞生长的抑制效应,后续还需要动物体内实验进一步论证其抑制作用。在临床运用方面,目前RG7388已进入临床Ⅲ期研究,是临床试验研究进展最快的小分子p53激活剂。但是相对于p53突变细胞系,RG7388只有适度的选择性,且RG7388消除p53野生型癌细胞的能力有限,RG7388的使用可能还会产生p53突变的耐药细胞群体[12]。因此后续DLBCL治疗研究还可以联合其他靶向药物进一步精准治疗p53突变的耐药肿瘤。
总之,MDM2抑制剂RG7388抑制DLBCL细胞增殖,通过p53通路引起G1期细胞阻滞并诱导细胞凋亡。RG7388可能是一种潜在的DLBCL治疗药物。
作者贡献:
庄燕:实验设计、实施及数据整理,论文撰写
黄豪、周俊邑:数据统计与分析
潘婷:实验实施
丁晓蓉、袁颖:数据汇总与分析
仲小敏:实验设计与实验指导
| [1] |
陈丽玲, 崔东亚, 蔡少丽. 弥漫大B细胞淋巴瘤中CD30的表达及其作用的研究进展[J]. 中国细胞生物学学报, 2021, 43(12): 2490-2496. [Chen LL, Cui DY, Cai SL. The Expression and Role of CD30 in Diffuse Large B-cell Lymphoma[J]. Zhongguo Xi Bao Sheng Wu Xue Xue Bao, 2021, 43(12): 2490-2496.] |
| [2] |
Abramson JS, Palomba ML, Gordon LI, et al. Lisocabtagene maraleucel for patients with relapsed or refractory large B-cell lymphomas (TRANSCEND NHL 001): a multicentre seamless design study[J]. Lancet, 2020, 396(10254): 839-852. DOI:10.1016/S0140-6736(20)31366-0 |
| [3] |
王芳, 邓体瑛. 双微体2蛋白抑制药Idasanutlin概述[J]. 中国药师, 2018, 21(9): 1645-1647. [Wang F, Deng TY. Summary on Idasanutlin as an MDM2 Inhibitor[J]. Zhongguo Yao Shi, 2018, 21(9): 1645-1647. DOI:10.3969/j.issn.1008-049X.2018.09.037] |
| [4] |
Natarajan U, Venkatesan T, DhandayuthapaniS, et al. Differential mechanisms involved in RG-7388 and Nutlin-3 induced cell death in SJSA-1 osteosarcoma cells[J]. Cell Signal, 2020, 75: 109742. DOI:10.1016/j.cellsig.2020.109742 |
| [5] |
Khurana A, Shafer DA. MDM2 antagonists as a novel treatment option for acute myeloid leukemia: perspectives on the therapeutic potential of idasanutlin (RG7388)[J]. Onco Targets Ther, 2019, 12: 2903-2910. DOI:10.2147/OTT.S172315 |
| [6] |
Vernooij L, Bate-Eya LT, Alles LK, et al. High-Throughput Screening Identifies Idasanutlin as a Resensitizing Drug for Venetoclax-Resistant Neuroblastoma Cells[J]. Mol Cancer Ther, 2021, 20(6): 1161-1172. DOI:10.1158/1535-7163.MCT-20-0666 |
| [7] |
Teras LR, DeSantis CE, Cerhan JR, et al. 2016 US lymphoid malignancy statistics by World Health Organization subtypes[J]. CA Cancer J Clin, 2016, 66(6): 443-459. DOI:10.3322/caac.21357 |
| [8] |
Sawalha Y. Relapsed/refractory diffuse large B-cell lymphoma: A look at the approved and emerging therapies[J]. J Pers Med, 2021, 11(12): 1345. DOI:10.3390/jpm11121345 |
| [9] |
Konopleva M, Martinelli G, Daver N, et al. MDM2 inhibition: an important step forward in cancer therapy[J]. Leukemia, 2020, 34(11): 2858-2874. DOI:10.1038/s41375-020-0949-z |
| [10] |
Chamberlain V, Drew Y, Lunec J. Tipping Growth Inhibition into Apoptosis by Combining Treatment with MDM2 and WIP1 Inhibitors in p53WT Uterine Leiomyosarcoma[J]. Cancers (Basel), 2021, 14(1): 14. DOI:10.3390/cancers14010014 |
| [11] |
Italiano A, Miller WH, Blay Jean-Yves, et al. PhaseⅠ study of daily and weekly regimens of the orally administered MDM2 antagonist idasanutlin in patients with advanced tumors[J]. Invest New Drugs, 2021, 39(6): 1587-1597. DOI:10.1007/s10637-021-01141-2 |
| [12] |
Fang Y, Liao GC, Yu B. Small-molecule MDM2/X inhibitors and PROTAC degraders for cancer therapy: advances and perspectives[J]. Acta Pharm Sin B, 2020, 10(7): 1253-1278. DOI:10.1016/j.apsb.2020.01.003 |
 2023, Vol. 50
2023, Vol. 50