文章信息
- 敲低PRPF19对胰腺癌细胞增殖、迁移和侵袭的影响
- Effects of PRPF19 Knockdown on Proliferation, Migration and Invasion of Pancreatic Cancer Cells
- 肿瘤防治研究, 2023, 50(2): 119-125
- Cancer Research on Prevention and Treatment, 2023, 50(2): 119-125
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.0871
- 收稿日期: 2022-08-04
- 修回日期: 2022-10-28
胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)简称胰腺癌,是最常见的消化系统恶性肿瘤之一,其病情发展迅速,临床预后比较差,而其临床预后较差的原因主要是缺乏有效的治疗[1-2]、肿瘤转移、复发以及化疗耐药性[3-4]。因此寻找与胰腺癌发生有关的新的癌基因,掌握胰腺癌的具体分子调控机制,开发新的治疗靶点和药物迫在眉睫。
前RNA加工因子19(PRPF19)又称Pso4、SNEV或NMP200,位于染色体11q12.2,主要参与DNA损伤反应(DDR)和mRNA加工[5],是Prp19/19复合体(NTC)的重要组成之一,参与各种生理过程,包括mRNA剪接[6]、DDR和基因组维护[7]。同时,PRPF19可作为应激反应蛋白在提高细胞对氧化应激抵抗力[8-9]、降低细胞凋亡和DNA损伤程度[10]、抑制细胞衰老等方面发挥其功能[11]。除了在细胞基础生物进程中发挥作用外,PRPF19利用其多效能在肿瘤等诸多疾病中发挥重要的调控作用,有研究发现PRPF19的表达在肝细胞癌中升高,并与疾病的不良预后相关[12],而通过去泛素化PRPF19可促进肝癌细胞的迁移和侵袭[13];PRPF19是应激条件下p21表达所必需的[14],它可通过上调p21表达来抑制肺癌的生长和发展[5];在舌癌中,PRPF19被证实其表达与预后不良有关,可以促进舌癌细胞的增殖、迁移和肿瘤的发展,甚至促进舌癌细胞对放疗和顺铂的耐药[15]。但是,目前PRPF19在胰腺癌中的相关作用研究尚未见报道。PRPFs剪接因子普遍表达于体内的每一种细胞类型中,Zhen等[16]利用生物信息学方法和生物学验证,证实与PRPF19同属前mRNA加工因子的PRPF40A,在胰腺癌中显著上调并发挥癌基因的作用,与其不良预后显著相关,可以作为胰腺癌诊断和独立的预后生物标志物。本研究拟通过系列体外实验揭示PRPF19在胰腺癌发生发展中的调控作用,从而为胰腺癌的诊疗研究提供新的思路。
1 材料与方法 1.1 材料人胰腺癌细胞系MIA PaCa-2、ASPC-1和人正常胰腺导管细胞系HPNE为延安大学医学研究实验中心保存,其中HPNE为永生化上皮细胞作为正常对照细胞系。PANC-1和BXPC-3购于武汉博士德生物工程有限公司。胎牛血清(FBS,04-001-1ACS)、DMEM培养基(C3113-0500)、青霉素-链霉素双抗溶液(10 mg/ml)均购自以色列BI公司;反转录(AE311)、qPCR定量(AQ601)试剂盒购自北京全式金生物技术有限公司;转染试剂购于法国Polyplus公司;CCK-8试剂购于上海TargetMol公司;Transwell小室培养板购于美国Corning公司,基质胶(0827045)购于上海诺娃医药科技有限公司;siRNA序列设计及合成由上海吉玛公司完成;qRT-PCR相关引物均由北京奥科鼎盛生物技术公司合成。
1.2 方法 1.2.1 数据库分析通过GEPIA、TCGA和GTEx数据库筛选胰腺癌组织的相关资料,结合其他相关文献研究[17-18],分析PRPF19在胰腺癌组织及其癌旁组织中的表达差异,利用统计学软件进行数据处理,对PRPF19在胰腺癌中的表达差异预测结果进行描述,并绘制箱式图。
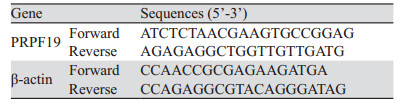
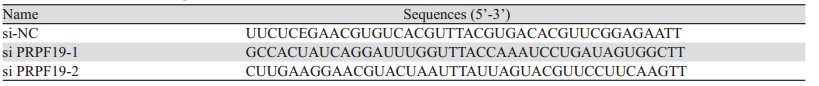
1.2.2 引物和siRNA的设计与合成从NCBI数据库查找PRPF19(Gene ID: 27339)mRNA的序列。依据Benjamin等[5]的研究设计合成其特异性检测引物,引物序列见表 1。结合目的基因CDS区域进行小干扰RNA设计并合成2条PRPF19 siRNA用于后续实验,siRNA及对照(si-NC)序列见表 2。
将液氮保存的MIA PaCa-2、PANC-1、BXPC-3、ASPC-1和HPNE细胞取出复苏后,加入含10%胎牛血清(FBS)和1%(10 mg/ml)青链霉素双抗的DMEM培养基,置于37℃、5%CO2环境中培养。期间使用胰酶消化传代,待细胞增殖状态良好时将其接种到6孔板,相同条件继续培养细胞生长至密度90%~95%时,分别进行处理、收集并进行mRNA及蛋白水平检测。将MIA PaCa-2细胞培养接种于6孔板,当细胞生长至密度达70%~80%时分别处理建立实验模型即对照组转染si-NC 75 μmol/L;实验组分别用siPRPF19-1和siPRPF19-2(均为75 μmol/L)处理6 h后进行换液,建立目的基因敲低细胞模型,继续培养24~48 h后进入后续实验。
1.2.4 总RNA提取及实时荧光定量PCR(qRT-PCR)采用TRIzo1法提取各组细胞总RNA,酶标仪检测RNA纯度和浓度,利用反转录试剂盒,以总RNA为模板,设置25℃ 10 min;42℃15 min;85℃ 5 s;16℃ 10 min条件进行反转录合成cDNA。以cDNA为模板,利用设计合成好的PRPF19 mRNA特异性检测引物,以β-actin作为内参进行实时荧光定量PCR,检测各细胞模型中PRPF19 mRNA表达水平。qRT-PCR反应体系为cDNA 2 μl,2×TransStart top Green qPCR Supermix 10 μl,上下游引物各1 μl,无酶水补充至20 μl体系。设置反应程序为:94℃预变性5 min;94℃ 30 s;58℃ 15 s;72℃ 30 s;循环扩增40次,每组设置3个平行复孔,计算平均值,采用相对定量法2-ΔΔCt分析PRPF19 mRNA的表达情况。
1.2.5 PRPF19蛋白表达水平的检测利用上述构建的细胞模型进行目的基因蛋白水平检测,培养48 h后收集各组细胞,将裂解液与蛋白酶抑制剂按100:1比例配置,加入到各组细胞中,置于冰上4 min,剧烈振荡30 s,重复5次,12 000 r/min离心20 min,收集上清液,BCA法检测各组蛋白浓度,调整各组上样量至30 μg。经高温变性,SDS-PAGE凝胶电泳、转膜、封闭后,进行PRPF19抗体孵育(1:1000),以β-actin作为内参,再经清洗、二抗结合孵育以及清洗后进行曝光显影,采用Image J软件分析免疫印迹条带。
1.2.6 CCK-8法检测细胞的增殖能力取各处理组细胞以1 500个/孔铺于96孔板,每组设置5个复孔,待细胞完全贴壁(0 h)后,每孔加入10 μl CCK-8试剂,在培养箱中避光孵育2 h后转移至酶标仪,在450 nm波长下测定其吸光度值,相同方式分别检测各处理组细胞培养至24 h、48 h和72 h的吸光度值,采用GraphPad 7.00软件绘制细胞增殖曲线。
1.2.7 克隆形成实验取生长状态良好的各处理组细胞,以1 000个/孔接种到12孔板中,每组3个复孔,置于5%CO2、37℃培养箱中培养,每隔3~4天换液,培养大约两周时间出现肉眼可见的细胞集落即形成克隆,此时开始收集细胞,使用4%多聚甲醛固定30 min后,0.1%结晶紫染色15 min,使用PBS缓冲液将染料等非特异性物质清洗晾干,采集图像并进行克隆计数。
1.2.8 Transwell实验检测细胞的迁移和侵袭能力细胞侵袭能力检测,先预处理培养小室,将Matrigel(基质胶)涂抹在上室底部(冰上操作)置于37℃培养箱孵育30 min使基质胶均匀覆盖。取各处理组细胞以50 000个/孔混悬于200 μl无血清DMEM中并全部转移至预处理的上室中,同时用600 μl DMEM(20%FBS)填充下室。培养48 h后,4%多聚甲醛室温下固定30 min,清洗,0.1%结晶紫染色15 min,擦除上室表面细胞,光学显微镜下观察(×10),并采集图片,进行计数分析。不使用Matrigel预处理小室,其余步骤与上述相同即可完成细胞迁移能力检测。
1.3 统计学方法采用SPSS23.0软件对获得数据进行统计学分析。各实验均独立重复三次,多组间比较采用单因素方差分析;胰腺癌组织与正常胰腺组织中PRPF19的表达差异分析采用t检验。P < 0.05为差异有统计学意义。
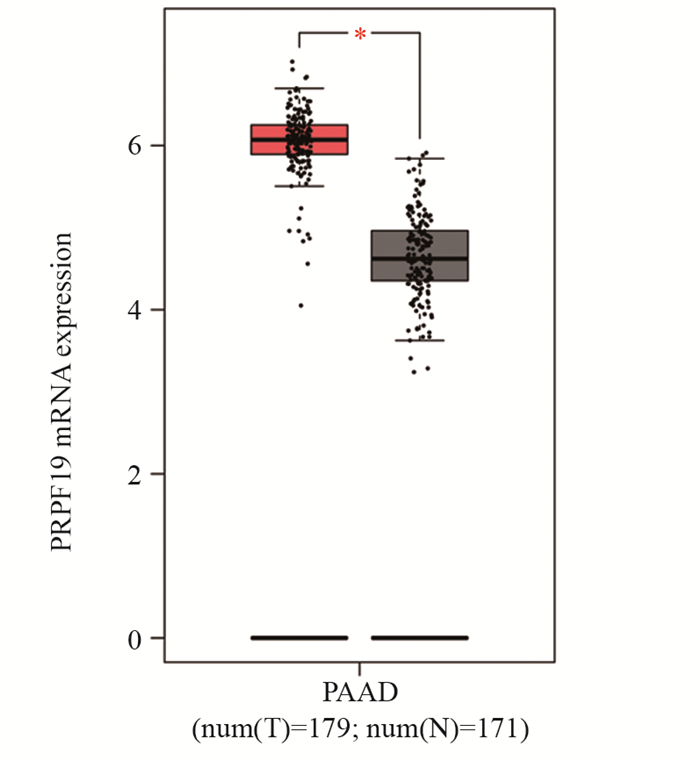
2 结果 2.1 PRPF19在胰腺癌组织和正常组织中的差异表达通过对GEPIA等数据库中胰腺癌相关数据进行分析,并对PRPF19在胰腺癌组织(179例)和正常胰腺组织(171例)中的mRNA水平的比较发现,PRPF19在胰腺癌组织中的表达量显著高于正常组织,见图 1,提示PRPF19或将作为癌基因在胰腺癌中发挥作用。
|
| T: pancreatic cancer tissue; N: normal pancreatic cancer tissue, *: P < 0.05. 图 1 PRPF19在胰腺癌组织及正常组织中的差异表达 Figure 1 Differential expression of PRPF19 in pancreatic cancer tissues and normal tissues |
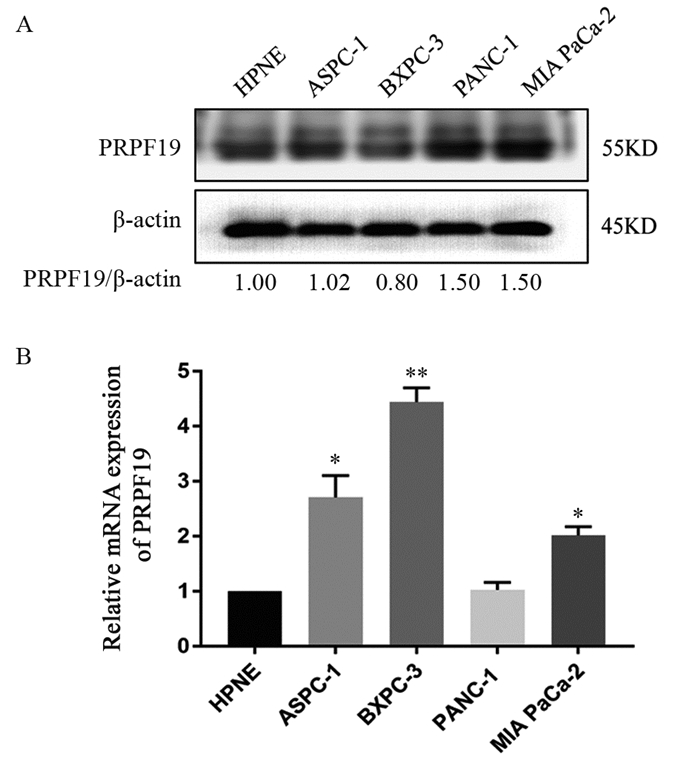
Western blot检测结果显示:与正常对照细胞系(HPNE)相比,PRPF19在MIA PaCa-2等胰腺癌细胞系中表达量明显升高(P=0.02),见图 2A。qRT-PCR检测结果显示:在MIA PaCa-2中PRPF19 mRNA的表达量显著高于正常对照细胞系(P=0.02),见图 2B。
|
| A: the protein expression level of PRPF19 in pancreatic cancer cell lines detected by Western blot; B: the mRNA expression level of PRPF19 in pancreatic cancer cell lines detected by qRT-PCR. *: P < 0.05, **: P < 0.01, compared with HPNE. 图 2 PRPF19在胰腺癌细胞系中蛋白和mRNA的表达水平 Figure 2 Protein and mRNA expression level of PRPF19 in pancreatic cancer cell lines |
利用siRNA技术设计合成si PRPF19-1和si PRPF19-2,转染入MIA PaCa-2细胞中,建立敲低PRPF19细胞模型,通过qRT-PCR和Western blot检测其敲低效率。实验结果显示,与对照组(si-NC)相比,转染si PRPF19-1和si PRPF19-2后,MIA PaCa-2细胞系中PRPF19蛋白和mRNA的表达水平均明显下调(均P=0.03),见图 3,表明成功构建敲低PRPF19细胞模型并可以进行后续功能实验。
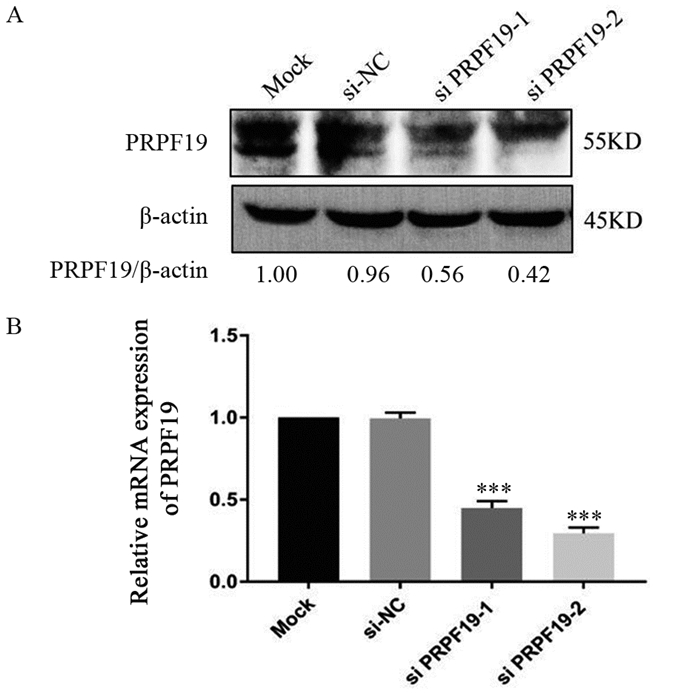
|
| A: verification of protein level of PRPF19 knockdown; B: verification of mRNA level of PRPF19 knockdown; ***: P < 0.001, compared with si-NC group. 图 3 敲低PRPF19细胞系的构建 Figure 3 Construction of MIA PaCa-2 cell lines with PRPF19 knockdown |
与对照组相比,敲低PRPF19后,细胞数量明显下降,见图 4A;与si-NC组相比,随着时间的增加,敲低PRPF19后,MIA PaCa-2细胞的增殖能力逐渐减弱,差异均有统计学意义(P=0.000),见图 4B。
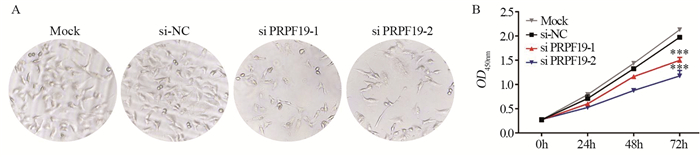
|
| A: the growth of MIA PaCa-2 cells after PRPF19 knockdown was observed under microscope (×10); B: effect of PRPF19 knockdown on the proliferation of MIA PaCa-2 cells, ***: P < 0.001, compared with si-NC group. 图 4 敲低PRPF19对胰腺癌细胞增殖的影响 Figure 4 Effect of knockdown of PRPF19 on proliferation of pancreatic cancer cells |
相较于si-NC组,敲低PRPF19后MIA PaCa-2细胞形成的克隆数量显著减少(P=0.000),见图 5。上述结果表明敲低PRPF19可以抑制胰腺癌细胞的增殖及后期的克隆形成能力。
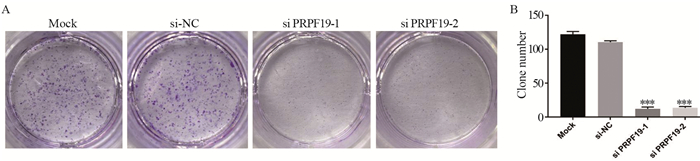
|
| A: clone formation of MIA PaCa-2 cells after PRPF19 knockdown; B: quantitative statistical analysis of clone formation ability; ***: P < 0.001, compared with si-NC group. 图 5 敲低PRPF19对胰腺癌细胞克隆形成能力的影响 Figure 5 Effect of knockdown of PRPF19 on colony formation ability of pancreatic cancer cells |
与对照组相比,敲低PRPF19后MIA PaCa-2细胞迁移数量减少,差异有统计学意义(P=0.005),见图 6。敲低PRPF19后MIA PaCa-2细胞穿过基质胶的数量明显下降,即侵袭能力减弱(P=0.004),见图 7。上述结果表明,敲低PRPF19可通过抑制胰腺癌细胞的迁移和侵袭能力从而参与肿瘤的生长调控。
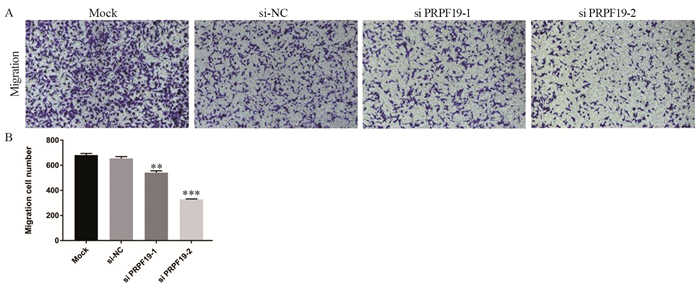
|
| A: vertical migration of MIA PaCa-2 cells after PRPF19 knockdown (×10); B: quantitative statistical analysis of migration ability; **: P < 0.01, ***: P < 0.001, compared with si-NC group. 图 6 敲低PRPF19对胰腺癌细胞迁移能力的影响 Figure 6 Effect of knockdown of PRPF19 on migration ability of pancreatic cancer cells |
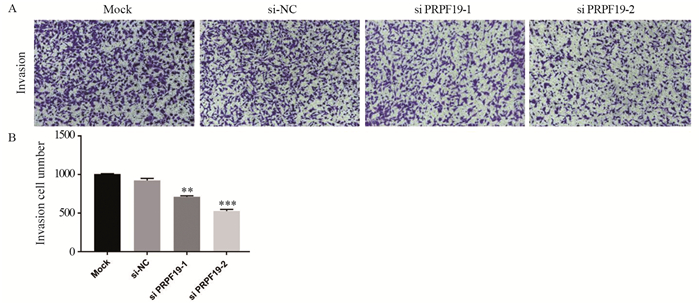
|
| A: invasion of MIA PaCa-2 cells after knockdown of PRPF19 (×10); B: quantitative statistical analysis of invasive ability; **: P < 0.01, ***: P < 0.001, compared with si-NC group. 图 7 敲低PRPF19对胰腺癌细胞侵袭能力的影响 Figure 7 Effect of knockdown of PRPF19 on invasion ability of pancreatic cancer cells |
胰腺癌因其侵袭性强、进展快、治疗耐药等特点在一众肿瘤中呈现出高度致命性[19]。尽管许多研究已经揭示了胰腺癌的一些相关基因表达等分子层面的异常变化,但其具体调控机制尚不明确,致使此类肿瘤治疗缺乏可用药的分子靶点。目前临床上,对于胰腺癌的治疗仍然只能依赖吉西他滨、NaB-紫杉醇[20-22]等常规细胞毒化疗药物,效果不佳。研究显示近5年胰腺癌患者的生存率仍然很低,不足9%[23]。因此,研究胰腺癌发生发展的分子机制以及开发有效的分子靶向药物来对抗胰腺癌是十分必要的。目前胰腺癌的分子调控机制研究主要聚焦在肿瘤常见信号通路,如AKT/mTOR、Wnt/β-catenin信号通路等,分子也属经典肿瘤调控基因,在胰腺癌中不具有特异性,使胰腺癌的诊疗机制研究处于困境。
以往研究发现PRPF19蛋白在人类诸多肿瘤中异常表达,可能作为一个潜在的癌基因发挥作用。Voglauer[11]通过使用博莱霉素或博莱霉素与BSO联合处理SNEV(PRPF19)过表达细胞,从而诱导DNA损伤以及活性氧物质,并使细胞凋亡水平降低,该研究证明PRPF19具有DNA损伤修复的能力,可通过上调其表达增强细胞的抗凋亡能力,使细胞寿命延长。此外有研究[24]显示PRPF19在肿瘤调控中可能是通过参与基因剪切来发挥作用的,而且是在mRNA剪切过程中发挥关键作用。众所周知,真核生物转录本的选择性剪接作为一种基本生理机制,它可极大地扩展基因的编码能力,以产生多样化的蛋白质。Inoue等[25]也发现纠正携带SF3B1突变的癌细胞当中的BRD9(一种抑癌基因)的错误剪接可有效抑制肿瘤生长,因此选择性剪接过程中的一些关键基因可以成为靶向癌症治疗的基础。结合当前胰腺癌的诊疗困境和PRPF19的异常表达可能会破坏人类的抗肿瘤机制,我们对胰腺癌中该分子相关的表达和功能影响进行了分析和初步探究。
本研究通过不同方法从增殖、迁移和侵袭等多个层面检测PRPF19对胰腺癌细胞的功能影响,结果显示敲低PRPF19可抑制胰腺癌细胞的增殖、克隆形成及迁移侵袭,因此明确PRPF19可能作为癌基因在胰腺癌的发生发展中发挥重要调控作用。当然,我们的研究仅仅揭示了PRPF19在胰腺癌中的角色,其具体调控的分子机制尚不可知,以后我们也将继续全面探究PRPF19调控胰腺癌的具体机制,以期为胰腺癌的临床诊断、分子治疗及预后监测等提供理论基础和新视角。
作者贡献:
侯丹阳:数据分析及文章撰写
黑钰:生物信息学分析
徐向荣:实验思路构思及文章修改
王逢会:实验指导及基金支持
| [1] |
Klompmaker S, de Rooij T, Korteweg JJ, et al. Systematic review of outcomes after distal pancreatectomy with coeliac axis resection for locally advanced pancreatic cancer[J]. Br J Surg, 2016, 103(8): 941-949. DOI:10.1002/bjs.10148 |
| [2] |
Lovecek M, Skalicky P, Chudacek J, et al. Different clinical presentations of metachronous pulmonary metastases after resection of pancreatic ductal adenocarcinoma: Retrospective study and review of the literature[J]. World J Gastroenterol, 2017, 23(35): 6420-6428. DOI:10.3748/wjg.v23.i35.6420 |
| [3] |
Xu XD, Zhao Y, Zhang M, et al. Inhibition of Autophagy by Deguelin Sensitizes Pancreatic Cancer Cells to Doxorubicin[J]. Int J Mol Sci, 2017, 18(2): 370. DOI:10.3390/ijms18020370 |
| [4] |
Ruscetti M, Morris JP 4th, Mezzadra R, et al. Senescence-Induced Vascular Remodeling Creates Therapeutic Vulnerabilities in Pancreas Cancer[J]. Cell, 2020, 181(2): 424-441. e21. DOI:10.1016/j.cell.2020.03.008 |
| [5] |
Benjamin AB, Zhou X, Isaac O, et al. PRP19 upregulation inhibits cell proliferation in lung adenocarcinomas by p21-mediated induction of cell cycle arrest[J]. Biomed Pharmacother, 2014, 68(4): 463-470. DOI:10.1016/j.biopha.2014.03.006 |
| [6] |
Chanarat S, Sträßer K. Splicing and beyond: the many faces of the Prp19 complex[J]. Biochim Biophys Acta, 2013, 1833(10): 2126-2134. DOI:10.1016/j.bbamcr.2013.05.023 |
| [7] |
de Moura TR, Mozaffari-Jovin S, Szabó CZK, et al. Prp19/Pso4 Is an Autoinhibited Ubiquitin Ligase Activated by Stepwise Assembly of Three Splicing Factors[J]. Mol Cell, 2018, 69(6): 979-992. e6. DOI:10.1016/j.molcel.2018.02.022 |
| [8] |
Chanarat S, Seizl M, Strasser K. The Prp19 complex is a novel transcription elongation factor required for TREX occupancy at transcribed genes[J]. Genes Dev, 2011, 25(11): 1147-1158. DOI:10.1101/gad.623411 |
| [9] |
Dellago H, Khan A, Nussbacher M, et al. ATM-dependent phosphorylation of SNEVhPrp1-9/hPso4 is involved in extending cellular life span and suppression of apoptosis[J]. Aging(Albany NY), 2012, 4(4): 290-304. |
| [10] |
Ohi MD, Vander Kooi CW, Rosenberg JA, et al. Structural and Functional Analysis of Essential pre-mRNA Splicing Factor Prp19p[J]. Mol Cell Biol, 2005, 25(1): 451-460. DOI:10.1128/MCB.25.1.451-460.2005 |
| [11] |
Voglauer R, Chang MW, Dampier B, et al. SNEV overexpression extends the life span of human endothelial cells[J]. Expe Cell Res, 2006, 312(6): 746-759. DOI:10.1016/j.yexcr.2005.11.025 |
| [12] |
Yin J, Wang L, Zhu JM, et al. Prp19 facilitates invasion of hepatocellular carcinoma via p38 mitogen-activated protein kinase/twist1 pathway[J]. Oncotarget, 2016, 7(16): 21939-21951. DOI:10.18632/oncotarget.7877 |
| [13] |
Frisan T, Coppotelli G, Dryselius R, et al. Ubiquitin C-terminal hydrolase-L1 interacts with adhesion complexes and promotes cell migration, survival, and anchorage independent growth[J]. FASEB J, 2012, 26(12): 5060-5070. DOI:10.1096/fj.12-211946 |
| [14] |
Chen Y, Zhang L, Jones KA. SKIP counteracts p53-mediated apoptosis via selective regulation of p21Cip1 mRNA splicing[J]. Genes Dev, 2011, 25(7): 701-716. DOI:10.1101/gad.2002611 |
| [15] |
He Y, Huang C, Cai K, et al. PRPF19 promotes tongue cancer growth and chemoradiotherapy resistance[J]. Acta Biochim Biophys Sin (Shanghai), 2021, 53(7): 893-902. DOI:10.1093/abbs/gmab059 |
| [16] |
Huo Z, Zhai S, Weng Y, et al. PRPF40A as a potential diagnostic and prognostic marker is upregulated in pancreatic cancer tissues and cell lines: an integrated bioinformatics data analysis[J]. Onco Targets Ther, 2019, 12: 5037-5051. DOI:10.2147/OTT.S206039 |
| [17] |
Li N, Yang G, Luo L, et al. lncRNA THAP9-AS1 Promotes Pancreatic Ductal Adenocarcinoma Growth and Leads to a Poor Clinical Outcome via Sponging miR-484 and Interacting with YAP[J]. Clin Cancer Res, 2020, 26(7): 1736-1748. DOI:10.1158/1078-0432.CCR-19-0674 |
| [18] |
Osei-Bordom DC, Serifis N, Brown ZJ, et al. Pancreatic ductal adenocarcinoma: Emerging therapeutic strategies[J]. Surg Oncol, 2022, 43: 101803. DOI:10.1016/j.suronc.2022.101803 |
| [19] |
Shin EJ, Canto MI. Pancreatic cancer screening[J]. Gastroenterol Clin North Am, 2012, 41(1): 143-157. DOI:10.1016/j.gtc.2011.12.001 |
| [20] |
Nebot-Villacampa MJ, Zafra-Morales R, Alfaro-Olea A, et al. Effectiveness and safety of nab-paclitaxel/gemcitabine in locally advanced or metastatic pancreaticade nocarcinoma[J]. J Oncol Pharm Pract, 2020, 26(3): 603-611. DOI:10.1177/1078155219862035 |
| [21] |
Jang SI, Fang S, Baek YY, et al. Local Delivery of Gemcitabine Inhibits Pancreatic and Cholangiocarcinoma Tumor Growth by Promoting Epidermal Growth Factor Receptor Degradation[J]. Int J Mol Sci, 2020, 21(5): 1605. DOI:10.3390/ijms21051605 |
| [22] |
Liu M, Zhang Y, Yang J, et al. ZIP4 Increases Expression of Transcription Factor ZEB1 to Promote Integrin α3β1 Signaling and Inhibit Expression of the Gemcitabine TransporterENT-1 in Pancreatic Cancer Cells[J]. Gastroenterology, 2020, 158(3): 679-692. DOI:10.1053/j.gastro.2019.10.038 |
| [23] |
时霄寒, 金钢. 胰腺癌精准医疗的实践与挑战[J]. 中华外科杂志, 2020, 58(1): 37-41. [Shi XH, Jin G. Practice and challenge of precision medicine for pancreatic cancer[J]. Zhonghua Wai Ke Za Zhi, 2020, 58(1): 37-41.] |
| [24] |
Mahajan K. hPso4/hPrp19: a critical component of DNA repair and DNA damage checkpoint complexes[J]. Oncogene, 2016, 35(18): 2279-2286. DOI:10.1038/onc.2015.321 |
| [25] |
Inoue D, Chew GL, Liu B, et al. Spliceosomal disruption of the non-canonical BAF complex in cancer[J]. Nature, 2019, 574(7778): 432-436. DOI:10.1038/s41586-019-1646-9 |
 2023, Vol. 50
2023, Vol. 50