文章信息
- 抗PD-1抗体联合治疗晚期肝细胞癌的真实世界研究
- A Real-world Study of Anti-PD-1 Antibody Combination Therapy in Advanced Hepatocellular Carcinoma
- 肿瘤防治研究, 2023, 50(3): 293-297
- Cancer Research on Prevention and Treatment, 2023, 50(3): 293-297
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.0852
- 收稿日期: 2022-08-01
- 修回日期: 2022-09-05
2. 450052 郑州,河南大学肿瘤医院肿瘤科;
3. 450052 郑州,郑州市颐和医院肿瘤科;
4. 450052 郑州,河南省肿瘤医院肿瘤科
2. Department of Oncology, Affiliated Cancer Hospital of Henan University, Zhengzhou 450052, China;
3. Department of Oncology, Zhengzhou Yihe Hospital, Zhengzhou 450052, China;
4. Department of Oncology, Henan Cancer Hospital, Zhengzhou 450052, China
2020年全球肝细胞肝癌(HCC)的新发病例占所有恶性肿瘤新发病例第六位,死亡人数占恶性肿瘤死亡人数的第三位[1],在中国HCC占恶性肿瘤新发病例的第四位,死亡人数占恶性肿瘤死亡人数的第二位[2]。中国大约80%的肝癌患者有慢性乙型肝炎或丙型肝炎病史,初诊时多数处于晚期,失去进行根治性手术的机会[3]。在抗PD-1抗体出现前,晚期HCC的一线治疗药物常用索拉菲尼,而接受索拉菲尼治疗患者的中位生存期也仅有6.5个月[4]。以抗PD-1抗体为代表的免疫检查点抑制剂的出现改变了晚期HCC治疗的格局,IM-brave150研究中,阿替利珠单抗联合贝伐单抗治疗晚期HCC患者的客观有效率(ORR)为27.3%,中位无进展生存期为6.8月[5],抗PD-1抗体在晚期HCC中显示了较好的疗效。然而临床研究中入组患者的肝功能和体力状态相对比较好,真实世界中抗PD-1抗体的疗效仍需进一步研究。本研究通过回顾性分析近年来接受抗PD-1抗体治疗的晚期HCC患者临床特点、疗效、不良反应发生率以及可能影响抗PD-1抗体疗效的临床因素,从而为临床实践过程中接受抗PD-1抗体治疗晚期HCC的方案选择提供参考。
1 资料与方法 1.1 一般资料选择2018年1月—2021年12月郑州大学第一附属医院肝胆胰外科收治的接受抗PD-1抗体治疗的55例晚期HCC患者为研究对象。病例纳入标准:(1)经病理诊断为HCC;(2)经影像学检查不能进行根治性切除或介入治疗;(3)具有影像学可测量病灶(按照RECIST1.1版标准的可评价病灶);(4)预期生存期超过3个月;(5)至少接受3次抗PD-1抗体治疗;(6)临床资料完整。根据患者年龄、体力状态(ECOG)评分、肝功能、抗PD-1抗体单药或联合、乙肝病史、治疗时机、疗前白蛋白(ALB)水平和乳酸脱氢酶(LDH)水平等进行亚组分析。所有患者均已签署知情同意书。
1.2 治疗方法患者均接受抗PD-1抗体治疗,部分患者接受化疗或者抗血管生成治疗。55例患者中有10例患者接受抗PD-1抗体单药治疗;另外45例患者接受联合治疗,其中联合仑伐替尼者12例,联合阿帕替尼者20例,联合贝伐单抗者9例,联合卡培他滨者4例。
1.3 疗效与安全性评价疗效评价标准按照RECIST1.1版标准进行,治疗过程中每1.5~3个月进行影像学检查评价疗效,根据治疗过程中肿瘤负荷的变化情况分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。治疗过程中出现的不良反应根据NCI-CTC 5.0进行分级。无进展生存期(PFS)定义为开始抗PD-1抗体治疗到首次影像学检查评价为疾病进展或末次随访时间,生存期(OS)定义为开始抗PD-1抗体治疗到患者死亡或末次随访时间。
1.4 随访随访分为患者就诊随访或者主动联系患者,末次随访时间为2022年4月。末次随访截止日期前3个月内未来院复诊患者通过电话或微信进行随访。
1.5 统计学方法应用SPSS22.0软件进行统计学分析,计数资料两组间比较应用t检验,计量资料以均数±标准差或中位数(95%CI)表示。应用Kaplan-Meier方法进行生存分析,两组间比较应用χ2检验,以双侧P≤0.05为差异有统计学意义。
2 结果 2.1 患者的基线特征55例患者中,男性50例,女性5例,中位年龄为55(33~82)岁。患者的基线特征见表 1,差异均无统计学意义(P>0.05)。
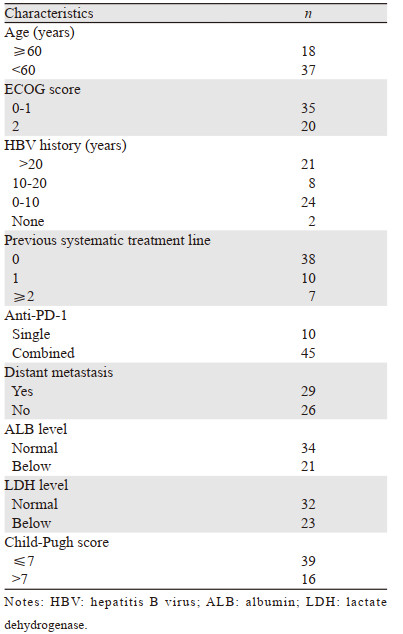
|
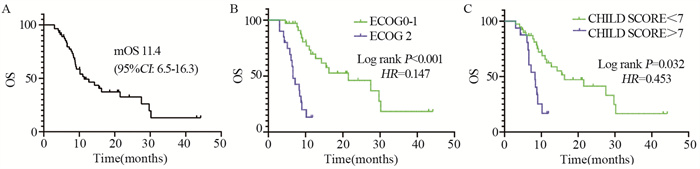
55例患者中,2例达到CR,10例达到PR,30例疾病稳定,13例疾病进展,整体ORR为21.8%,疾病控制率为76.4%。55例患者整体中位无进展生存期为5.0个月(95%CI: 3.9~6.1),中位生存期11.4个月(95%CI: 6.5~16.3)。
2.3 影响疗效的临床因素分析对患者的年龄、ECOG评分、既往乙肝病史、有无远处转移、肝功能Child-Pugh评分、抗PD-1抗体治疗时机、治疗方案(单用或联合)、治疗前ALB和LDH水平进行单因素和多因素分析,见表 2。结果表明ECOG评分和肝功能Child-Pugh评分是影响患者生存的独立预后因素。患者的OS曲线见图 1。
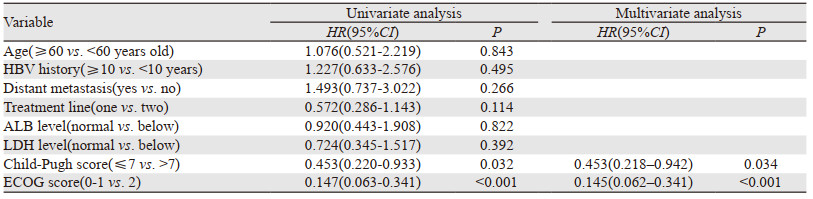
|
|
| A: OS of all patients; B: OS of different groups according to ECOG score; C: OS of different groups according to CHILD score. 图 1 55例晚期肝细胞肝癌患者OS曲线 Figure 1 OS of 55 patients with advanced hepatocellular carcinoma |
治疗过程中不良反应整体发生率为81.8%(45/55),其中3~4级不良反应发生率为14.5%(8/55),免疫相关不良反应发生率为58.2%(32/55),其中3~4级免疫相关不良反应发生率为3.6%(2/55),无治疗相关死亡。治疗过程中患者发生不良反应的详细情况见表 3。

|
肝癌在我国的发病率和死亡率均逐年上升,晚期HCC的治疗效果差。在抗PD-1抗体大规模临床应用之前,晚期HCC患者的中位生存期一直保持在6~9个月,以抗PD-1抗体为代表的免疫治疗改善了晚期HCC预后。近年来免疫治疗在晚期肝癌患者中开展了多项临床研究:Keynote-240是一项在既往治疗失败的晚期肝癌患者中二线接受帕博利珠单抗单药治疗的Ⅲ期临床研究,其结果显示一线治疗失败的晚期肝癌患者应用抗PD-1抗体之后,中位无疾病进展生存期可达3.8个月,中位生存期可达13.9个月[6];在ORIENTT-32研究中,信迪利单抗联合贝伐单抗一线治疗晚期肝细胞肝癌,中位无疾病进展生存期可达4.6个月[7];RESCUE研究是在晚期肝细胞肝癌患者中评价阿帕替尼联合卡瑞丽珠单抗治疗疗效与安全性的临床研究,其结果显示二者联合一线和二线治疗的客观缓解率分别为34.3%和22.5%,一线和二线治疗中位无疾病进展生存期分别为5.7个月和5.5个月,1年生存率分别为74.7%和68.2%[8]。然而在这些临床研究中,入组患者的一般状态通常比较好,纳入患者的肝功能Child-Pugh评分通常在7分以下,极个别研究会纳入7分患者,而7分以上及ECOG评分为1分以上的患者通常被排除在外[9-10]。因此本项研究开展了晚期肝癌患者真实世界的回顾性分析,以了解抗PD-1抗体在晚期肝细胞肝癌治疗中的疗效与安全性。结果显示抗PD-1抗体治疗晚期HCC是安全有效的,在55例患者中12例出现客观缓解,2例患者达到完全缓解。在对影响患者疗效的临床因素进行分析时发现,患者的一般状态评分和肝功能Child-Pugh评分影响PD-1抗体治疗的临床疗效,纳入的ECOG评分为2的20例患者中,中位生存期为6.6月;在肝功能Child-Pugh评分7以上的16例患者中,其中位生存期为8.8个月。这些结果优于既往报道的相关数据,且治疗过程中未出现治疗相关的死亡病例。本研究结果显示抗PD-1抗体对于肝功能较差和体力评分较差的患者也是有效的。
肝脏是合成白蛋白的主要场所,白蛋白可作为载体影响药物的疗效[11-12]。本研究对血清白蛋白水平是否会影响抗PD-1抗体的疗效进行了分析,结果显示,血清白蛋白水平降低的患者中,其中位生存期不劣于血清白蛋白水平正常的患者(两者的中位生存期分别为11.0月和10.2月,P=0.821),由此推测,对于低血清白蛋白水平的患者,间断补充白蛋白有助于改善免疫治疗的效果。LDH是反映体内肿瘤活性水平的指标之一,有相关研究表明LDH升高患者的预后差于LDH水平正常的患者[13-14],本研究也对此进行了分析,发现LDH水平正常和升高患者的中位OS差异无统计学意义(分别为11.4月和10.2月,P=0.389),考虑出现这种现象的主要原因是HCC患者绝大多数与慢性肝炎尤其是乙型/丙型肝炎病毒感染有关,本研究55例患者中有54例患者存在乙肝或丙肝病毒感染,机体慢性炎性反应状态也会导致LDH升高,与肿瘤增殖活跃所致的LDH升高不一致。
本研究的局限性在于所有患者均来自同一医疗中心,但是临床应用的抗PD-1抗体来自不同的生产厂家,联合的抗血管生成药物也来自不同厂家,回顾性分析收集到的不良反应发生率可能低于真实发生率,但正是由于这些药物的不均一性才可以反映真实世界中患者接受治疗的多样性和数据的真实性。
综上所述,以抗PD-1抗体为基础的治疗在晚期肝细胞肝癌的治疗过程是安全有效的,应用抗PD-1抗体治疗前患者的体能状态评分和肝功能的Child-Pugh评分是预测患者是否生存获益的指标。
作者贡献:
乔师师:研究设计、数据收集、论文撰写
孔天东:病例随访
于丹、潘延凤:参与研究设计
杨振:数据收集
赵玲娣:研究方法指导和文章审校
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Zhou M, Wang H, Zeng X, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2019, 394(10204): 1145-1158. DOI:10.1016/S0140-6736(19)30427-1 |
| [3] |
de Martel C, Maucort-Boulch D, Plummer M, et al. World-wide relative contribution of hepatitis B and C viruses in hepatocellular carcinoma[J]. Hepatology, 2015, 62(4): 1190-1200. DOI:10.1002/hep.27969 |
| [4] |
Cheng AL, Kang YK, Chen Z, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase Ⅲ randomised, double-blind, placebo-controlled trial[J]. Lancet Oncol, 2009, 10(1): 25-34. DOI:10.1016/S1470-2045(08)70285-7 |
| [5] |
Finn RS, Qin S, Ikeda M, et al. Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma[J]. N Engl J Med, 2020, 382(20): 1894-1905. DOI:10.1056/NEJMoa1915745 |
| [6] |
Finn RS, Edeline J, Bouattour M, et al. Pembrolizumab (pembro) versus placebo (pbo) in patients (pts) with advanced hepatocellular carcinoma (aHCC) previously treated with sorafenib: Updated data from the randomized, phase 3 KEYNOTE-240 study[J]. J Clin Oncol, 2021, 39(suppl 15): abstr 4072. |
| [7] |
Ren Z, Xu J, Bai Y, et al. Sintilimab plus a bevacizumab biosimilar (IBI305) versus sorafenib in unresectable hepatocellular carcinoma (ORIENT-32): a randomised, open-label, phase 2-3 study[J]. Lancet Oncol, 2021, 22(7): 977-990. DOI:10.1016/S1470-2045(21)00252-7 |
| [8] |
Xu J, Shen J, Gu S, et al. Camrelizumab in combination with apatinib in patients with advanced hepatocellular carcinoma (RESCU): a nonrandomized, open-label, phaseⅡ trial[J]. Clin Cancer Res, 2021, 27(4): 1003-1011. DOI:10.1158/1078-0432.CCR-20-2571 |
| [9] |
Yau T, Park JW, Finn RS, et al. Nivolumab versus sorafenib in advanced hepatocellular carcinoma (CheckMate 459): a randomised, multicentre, open-label, phase 3 trial[J]. Lancet Oncol, 2022, 23(1): 77-90. DOI:10.1016/S1470-2045(21)00604-5 |
| [10] |
Koeberle D, Dufour JF, Demeter G, et al. Sorafenib with or without everolimus in patients with advanced hepatocellular carcinoma (HCC): a randomized multicenter, multinational phase Ⅱ trial (SAKK/77/08 and SASL29)[J]. Ann Oncol, 2016, 27(5): 856-861. DOI:10.1093/annonc/mdw054 |
| [11] |
Yang G, Wang D, Fiona Phua SZ, et al. Albumin-based therapeutics capable of glutathione consumption and hydrogen peroxide generation for syner getic chemodynamic and chemotherapy of cancer[J]. ACS Nano, 2022, 16(2): 2319-2329. DOI:10.1021/acsnano.1c08536 |
| [12] |
Fokkink WR, Walgaard C, Kuitwaard K, et al. Association of Albumin Levels With Outcom in Intravenous Immunoglobulin-Treated Guilain-Barré Syndrome[J]. JAMA Neurol, 2017, 74(2): 189-196. DOI:10.1001/jamaneurol.2016.4480 |
| [13] |
Tang B, Mo J, Yan X, et al. Real-world efficacy and safety of axitinib in combination with anti-programmed cell death-1 antibody for advanced mucosal melanoma[J]. Eur J Cancer, 2021, 156: 83-92. DOI:10.1016/j.ejca.2021.07.018 |
| [14] |
Nakamura Y, Namikawa K, Yoshino K, et al. Anti-PD1 checkpoint inhibitor therapy in acral melanoma: a multicenter study of 193 Japanese patients[J]. Ann Oncol, 2020, 31(9): 1198-1206. DOI:10.1016/j.annonc.2020.05.031 |
 2023, Vol. 50
2023, Vol. 50

