文章信息
- 铁死亡相关复发风险模型预测胶质母细胞瘤患者的临床结局与免疫浸润
- Ferroptosis-related Recurrence Risk Model Predicts Clinical Outcomes and Immune Infiltration in Glioblastoma
- 肿瘤防治研究, 2023, 50(3): 249-257
- Cancer Research on Prevention and Treatment, 2023, 50(3): 249-257
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.0836
- 收稿日期: 2022-07-28
- 修回日期: 2022-11-21
2. 410013 长沙,湖南师范大学医学院
2. School of Medicine, Hunan Normal University, Changsha 410013, China
胶质母细胞瘤(glioblastoma, GBM)是中枢神经系统最常见的原发性恶性脑肿瘤[1]。尽管GBM的治疗在手术切除、精准放疗、靶向化疗等方面取得一定进展,但患者放化疗耐受性和免疫逃逸差异大,复发率较高[2]。诱导肿瘤细胞死亡是预防GBM进展的有效策略。铁死亡是以铁依赖性脂质过氧化物累积为特征的一种程序性细胞死亡,参与多种疾病的发生发展,如心血管系统疾病[3]、神经系统疾病[4]和肿瘤[5]。目前,铁死亡相关基因对GBM复发的影响及作用机制尚不清楚。随着高通量测序技术和基因信息数据库在肿瘤诊断、预后研究中的广泛应用,寻找铁死亡相关分子标志物,并针对靶点进行转化研究,成为最大限度发挥临床综合疗效的关键。本研究基于CGGA和TCGA数据库获取GBM患者临床数据及基因表达谱,利用生物信息学技术筛选铁死亡相关基因,构建、验证复发预后风险模型,探索关键风险基因的表达及预后价值,并识别不同免疫浸润和免疫检测点,为免疫逃逸所致GBM复发患者的诊断、治疗提供参考。
1 资料与方法 1.1 数据来源与处理从CGGA和TCGA数据库下载GBM患者的基因序列数据及临床资料,剔除缺失临床特征信息的患者后纳入236例CGGA样本为训练队列和160例TCGA样本为验证队列。通过FerrDb网站(http://www.zhounan.org/ferrdb/current/)获得486个铁死亡相关基因(ferroptosis related genes,FRGs)。
1.2 生存分析使用R软件包“maxstat”计算最佳截断值,设置最小分组样本数大于25%,最大分组样本数小于75%,基于最佳截断值将样本分为两组,然后使用R软件包“survival”中survfit函数分析两组的预后差异,利用Log rank检验评估组间差异显著性。
1.3 复发预后风险模型的构建与验证Lasso回归是一种基于惩罚的变量选择方法。在训练队列中,通过R软件包“glmnet”,采用Lasso回归分析对多变量进行降维处理,筛选影响GBM患者预后的风险因素,十折交叉验证确定最优参数(λ)。将复发风险因素进行tSNE降维可视化,并导入构建nomogram模型,分别绘制校正曲线和ROC曲线评估模型的区分度、预测性能及准确性。随后,在TCGA-GBM样本中验证模型。
1.4 基因功能及通路富集分析利用R软件包“org.Hs.eg.db”“clusterProfiler”和基因集数据库MSigDB(http://www.gsea-msigdb. org/gsea/msigdb/index.jsp)对差异表达基因进行基因本体(Gene Ontology, GO)、京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)信号通路及基因集富集分析(gene set enrichment analysis, GSEA)。通过GSEA发现高风险亚型的富集基因组,利用归一化富集评分对各表型富集通路进行排序,P < 0.05为显著富集。
1.5 免疫浸润分析ESTIMATE算法用于推断每个样本的浸润基质和免疫细胞水平,并估算肿瘤纯度,包括基质评分、免疫评分和ESTIMATE分数(https://cibersortx. stanford.edu/)。TIMER数据库(https://cistrome. shinyapps.io/timer/)用于对每个样本的复发风险评分和免疫细胞进行相关性分析。
1.6 统计学方法应用R4.0.2软件对数据进行统计分析,使用limma数据包中的Student t检验筛选差异表达基因,Spearman相关分析观察变量间的相关性。P < 0.05表示差异有统计学意义。
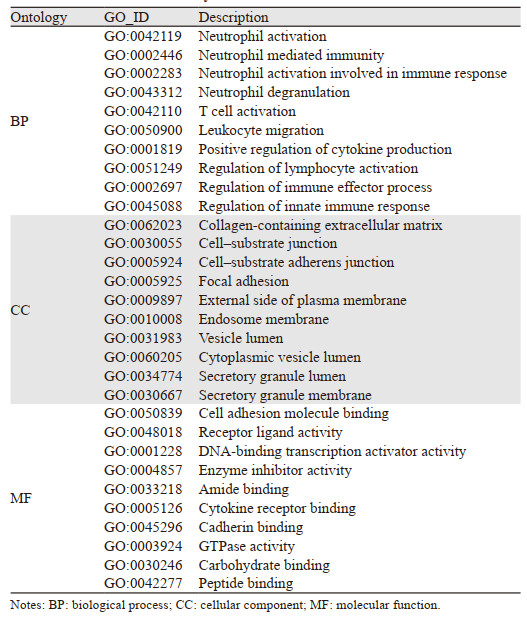
2 结果 2.1 铁死亡相关基因WWTR1、PLIN2和BID为GBM复发预后风险关键基因将CGGA数据库中236例患者分为复发GBM患者(103例)和未复发GBM患者(133例)进行差异表达基因分析,获得4 177个上调基因和402个下调基因(差异倍数 > 1.5倍,P < 0.05),见图 1A。通过Venn图进一步研究差异表达基因与铁死亡的关联,结果发现117个铁死亡相关基因与GBM复发有关,见图 1B。单因素Cox回归分析结果显示,AKR1C3、ARF6、BID、CD44、CP、GDF15、HSPA5、MGST1、MICU1、PLIN2、SCP2、TERT、WWTR1共13个mRNAs显著影响GBM患者预后(P < 0.05),Spearman相关分析结果显示,这些mRNAs之间存在一定相关性(P < 0.05),见图 1C。经Lasso回归分析筛选出WWTR1、PLIN2和BID基因为影响GBM患者复发预后的关键铁死亡相关基因,见图 1D,其中WWTR1和PLIN2为风险基因(HR > 1, P < 0.05),BID为保护基因(HR < 1, P < 0.05)。
|
| A: DEGs of recurrent and primary GBM in the CGGA database; B: Venn diagram of DEGs and ferroptosis-related genes; C: Spearman correlation analysis of 13 ferroptosis-related GBM recurrence risk genes; D: Lasso regression analysis and cross-validation. DEGs: differentially expressed genes, FRGs: ferroptosis-related genes. 图 1 筛选铁死亡相关GBM复发关键预后风险基因 Figure 1 Screening of key prognosis risk genes of ferroptosis-related GBM recurrence |
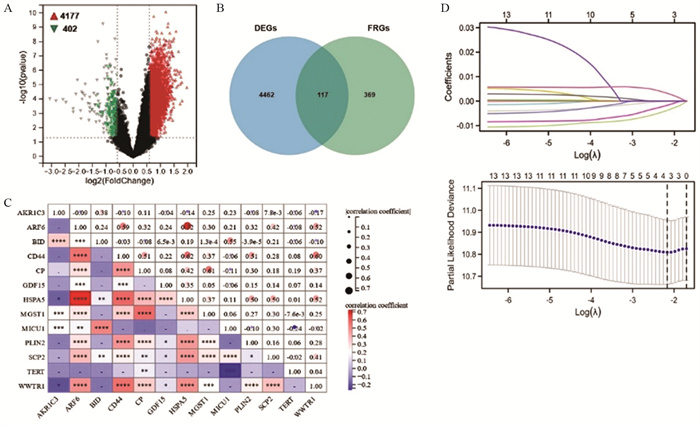
通过人类蛋白图谱数据库(The Human Protein Atlas,HPA)分析WWTR1、PLIN2、BID在复发和未复发GBM患者肿瘤组织中的蛋白表达情况。免疫组织化学染色结果显示,与未复发组相比,WWTR1和PLIN2在复发GBM肿瘤组织中表达上调,而BID表达下调,见图 2。这些结果表明,复发GBM患者肿瘤组织中WWTR1和PLIN2蛋白高表达,而BID蛋白低表达。
|
| 图 2 WWTR1、PLIN2、BID蛋白在复发和未复发GBM患者肿瘤组织中的表达 Figure 2 The expression of WWTR1, PLIN2 and BID proteins in patients with recurrent and primary GBM |
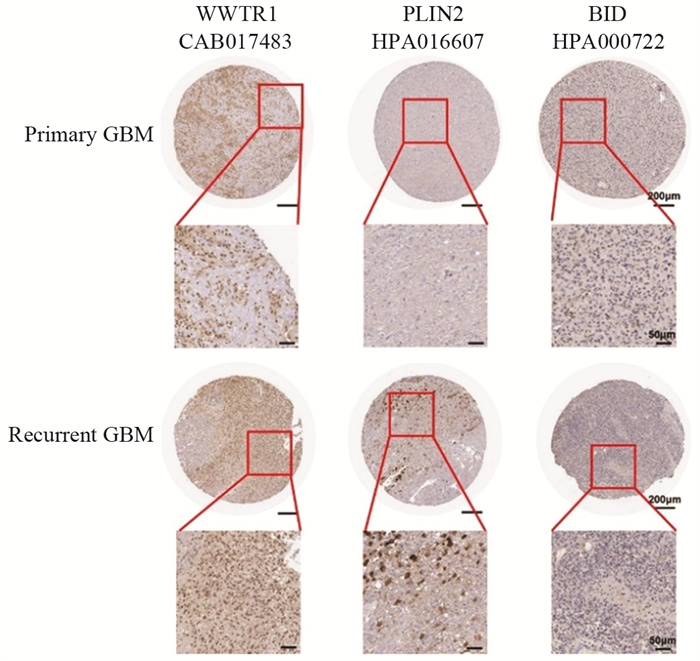
为进一步研究铁死亡相关基因在CGGA训练队列中对患者预后的影响,计算每个样本的风险评分=0.3158×WWTR1+0.37455×PLIN2-0.1683×BID,并以最佳截断值为分组依据,进行Kaplan-Meier生存分析。结果显示,与低表达组相比,WWTR1高表达和PLIN2高表达组患者的总生存期明显缩短,而BID高表达组患者的总生存期明显延长(P < 0.05),见图 3A。此外,风险评分越高,死亡例数越多,见图 3B,tSNE结果也支持根据铁死亡相关复发风险基因特征将GBM患者分为两个亚型,见图 3C,Kaplan-Meier曲线显示高风险亚型的总生存期明显缩短(P < 0.05),见图 3D,ROC曲线下面积为0.63(95%CI: 0.52~0.74),见图 3E,表明三基因风险预测模型具有较好的预测价值。基于WWTR1、PLIN2、BID、性别和年龄5个因素构建nomogram模型,见图 3F。检验结果显示,校正曲线与理想曲线拟合良好,见图 3G,1、3、5年ROC曲线下面积分别为0.65(95%CI: 0.58~0.72)、0.66(95%CI: 0.57~0.76)、0.63(95%CI: 0.50~0.75),见图 3H。以上结果表明基于训练队列构建的铁死亡相关GBM复发预后风险模型具有良好的预测价值和精准度。
|
| A: Kaplan–Meier survival analysis for WWTR1, PLIN2, and BID; B: distribution diagram of risk score and survival status; C: tSNE analysis; D: Kaplan–Meier survival curves for high-and low-risk scores; E: ROC curve of predicted survival based on WWTR1, PLIN2, and BID; F: nomogram of GBM patients; G: Calibration map for predicting survival; H: ROC curve of predicted survival based on clinical risk factors. 图 3 在CGGA队列中构建铁死亡相关GBM复发预后风险模型 Figure 3 Construction of ferroptosis-related GBM recurrence prognosis risk model in the CGGA cohort |
在TCGA数据集中验证上述复发预后风险模型。以最佳截断法分组,Kaplan-Meier生存分析结果显示,WWTR1高表达和PLIN2高表达患者的总生存期明显短于低表达者,而BID高表达者的总生存期明显延长(P < 0.05),见图 4A。风险评分越高,死亡例数越多,见图 4B,tSNE分析显示可根据铁死亡相关复发风险基因将GBM患者分为高、低风险两个亚型,见图 4C,Kaplan-Meier曲线表明低风险亚型患者的总生存期明显延长(P < 0.05),见图 4D,AUC为0.62(95%CI: 0.54~0.71),见图 4E,表明三基因风险预测模型具有较好的预测性。基于WWTR1、PLIN2、BID、性别和年龄构建nomogram模型并验证。结果表明校正曲线与理想曲线拟合良好,1、3、5年ROC曲线下面积分别为0.68(95%CI: 0.59~0.77)、0.76(95%CI: 0.61~0.90)、0.79(95%CI: 0.64~0.95),见图 4F~H。验证队列的结果表明铁死亡相关GBM复发预后风险模型具有良好的预测稳定性。
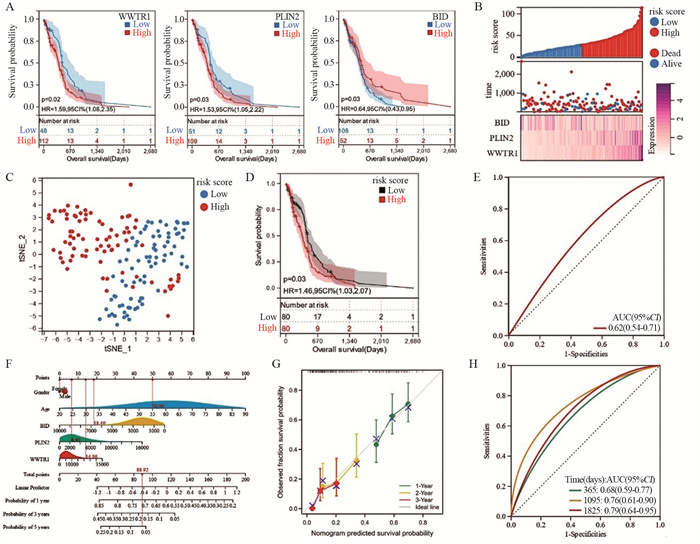
|
| A: Kaplan-Meier survival analysis for WWTR1, PLIN2, and BID; B: distribution diagram of risk score and survival status; C: tSNE analysis; D: Kaplan-Meier survival curves for high-and low-risk scores; E: ROC curve of predicted survival based on WWTR1, PLIN2, and BID; F: nomogram of GBM patients; G: calibration map for predicting survival; H: ROC curve of predicted survival based on clinical risk factors. 图 4 在TCGA队列中验证铁死亡相关GBM复发预后风险模型 Figure 4 Validation of ferroptosis-related GBM recurrence prognosis risk model in the TCGA cohort |
根据风险评分的中位值将CGGA数据集中236例GBM患者分为高风险亚型和低风险亚型,并进行差异表达基因分析(|差异倍数| > 2倍,P < 0.05),火山图和热图结果显示,3 915个基因高表达,648个基因低表达,见图 5A~B。GO基因功能注释结果提示,这些差异表达基因主要参与细胞黏附分子结合、受体-配体活性、细胞因子受体结合等生物学过程(P < 0.05),见图 5C、表 1;KEGG信号通路富集分析结果显示,高低风险亚型差异表达基因主要富集于细胞因子-细胞因子受体相互作用、PI3K-Akt、蛋白多糖等信号通路(P < 0.05),见图 5D。此外,以hallmark gene sets为分类标准,利用GSEA对各通路进行评分,结果表明高风险亚型上皮-间充质转化、KRAS通路和炎性反应通路活性上调(NES=4.130、3.328、3.296,P < 0.05),见图 5E。由此可见,铁死亡相关风险基因可能通过上皮-间充质转化、肿瘤免疫微环境等参与GBM复发过程。
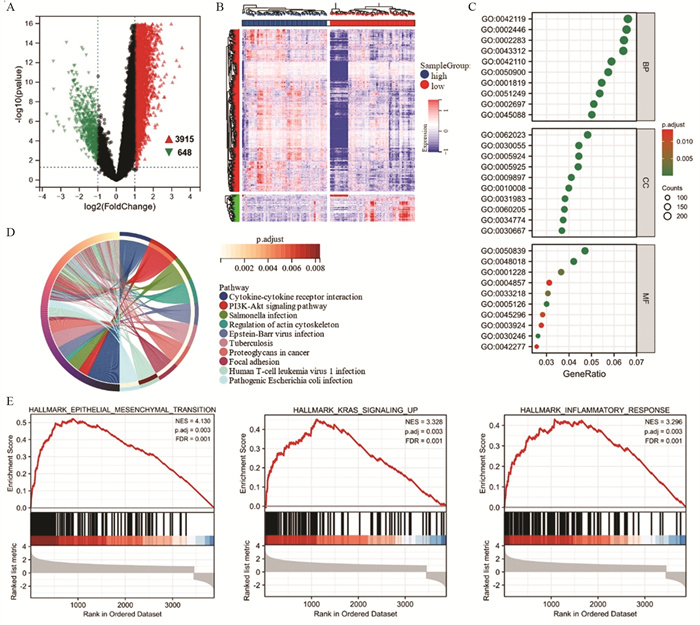
|
| A: DEGs of high-and low-risk subtypes in CGGA database; B: heat map of DEGs; C: GO analysis of DEGs; D: KEGG analysis of DEGs; E: GSEA analysis based on hallmark gene sets; BP: biological process; CC: cellular component; MF: molecular function; NES: normalized enrichment score. 图 5 高低风险亚型GBM患者差异表达基因的功能和通路富集分析 Figure 5 Function and pathway enrichment analysis of DEGs in patients with high- and low-risk subtypes in the CGGA database |
ESTIMATE算法分析显示,高风险亚型患者的基质评分、免疫评分和ESTIMATE评分均明显低于低风险亚型者(P < 0.05),见图 6A。TIMER分析结果表明,与低风险亚型相比,高风险亚型CD8+T细胞、中性粒细胞、巨噬细胞、树突状细胞和CD4+T细胞水平均较低(P < 0.05),见图 6B。相关分析散点图结果显示,风险评分与免疫抑制检测点基因CD274、HAVCR2、TGFB1、CSF1R的表达呈正相关(r=0.57、0.46、0.45、0.43,P < 0.05),见图 6C。这些结果提示,铁死亡相关复发风险基因可作为GBM免疫治疗的靶点。
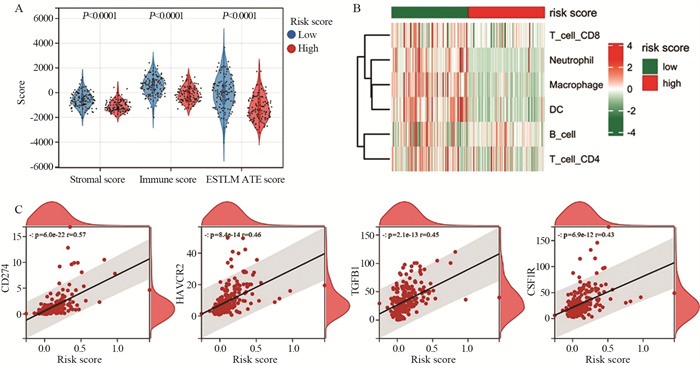
|
| A: ESTIMATE for evaluating the tumor microenvironment of GBM tissues with different subtypes; B: TIMER for evaluating the relationship between subtypes and immune cells; C: correlation analysis between risk score and gene expression of CD274, HAVCR2, TGFB1, and CSF1R. 图 6 高低风险亚型GBM患者肿瘤组织免疫浸润及免疫检测点分析 Figure 6 Immune infiltration and immune check point analysis of GBM tissues with high- and low-risk subtypes |
胶质母细胞瘤标准治疗方案(手术联合放疗和替莫唑胺化疗)可在一定程度上延长GBM患者生存时间,但复发率和死亡率依然较高,且复发GBM尚无标准治疗方案,总体预后差[6-7]。GBM具有高度异质性和分支化特征,按照进化速率和分支模式估算,往往在诊断前已存在与复发相关的克隆[7]。Jiang等[8]研究证实,复发GBM中存在异常基因表达,可通过免疫逃逸促进肿瘤的侵袭性生长。本研究显示,复发GBM患者中存在4 579个差异表达基因,与文献结果一致。目前临床医生通常根据年龄、病理分期、肿瘤类型等对GBM患者的生存率进行预测[9],尚未充分考虑基因检测在评估患者生存预后中的重要作用。进一步研究关键基因对GBM患者预后的影响,进而寻找复发风险生物标志物和治疗靶点有一定意义。
调节性细胞死亡在肿瘤发生发展中的作用已引起广泛关注,尤其是自噬[10]、焦亡[11]、铁死亡[12]等。铁死亡是一种由脂质过氧化引起的铁依赖性调节性细胞死亡,通过外源性途径抑制细胞膜转运体(如谷氨酸转运体)或激活铁转运体(如血清转铁蛋白和乳转铁蛋白),或内源性途径阻断细胞内抗氧化剂(如谷胱甘肽过氧化物酶),激活铁死亡通路[13-14]。多项研究表明,铁死亡是肿瘤学潜在的新靶点,与正常细胞相比,胃癌[15]、肺癌[16]等肿瘤细胞的铁含量均较高,而对传统化疗药物耐药或转移倾向高的肿瘤也特别容易发生铁死亡。Hassannia等[17]发现,withaferin A是一种天然铁死亡诱导剂,以剂量依赖的方式靶向激活KEAP1-Nrf2信号通路或抑制GPX4诱导铁死亡,杀死GBM细胞,或抑制其生长、复发。Yang等[18]研究证实,miR-18a通过直接靶向ALOXE3,抑制其介导的铁死亡和抗迁移活性,促进小鼠原位胶质母细胞瘤的生长并缩短小鼠寿命。de Souza等[19]研究提示,诱导铁死亡可能是逆转高水平NRF2通过铁蛋白前体靶点ABCC1/MRP1导致替莫唑胺耐药,促进谷胱甘肽消耗,改善GBM患者预后的重要治疗策略。这些体内外研究展示了铁死亡及相关基因在GBM诊断、治疗中的广阔应用前景,但调控机制及潜在预后价值尚未完全阐明。
本研究以实用先进的计算工具系统评估铁死亡相关基因在GBM复发预后风险中的意义。首先,利用CGGA数据库比较铁死亡相关基因在复发与未复发GBM中的表达谱差异,筛选出WWTR1、PLIN2和BID3个关键基因,并发现,WWTR1和PLIN2蛋白在复发GBM患者肿瘤组织中高表达,BID蛋白在复发GBM患者中低表达。WWTR1是Hippo信号通路下游的主要效应因子,全基因组分析表明,EGFRWWTR1激活多种致癌信号,在GBM干细胞样细胞中过表达WWTR1可促进肿瘤细胞侵袭、放射抗性和致瘤性[20]。PLIN2属于围脂滴蛋白家族,是脂质积聚的标志物,磷酸化PLIN2从脂滴分离后,通过HSC70介导的自噬降解,促进脂肪酸氧化和脑肿瘤生长,与GBM患者的不良预后相关[21]。BID是死亡调节因子BCL-2家族成员,与泛素蛋白连接酶和死亡受体紧密相关,上调BID能够诱导GBM细胞和横纹肌肉瘤细胞凋亡,具有抗癌特征[22]。由此可见,3个关键铁死亡相关基因均参与GBM发生发展,并影响其预后。通过我们构建的复发预后风险nomogram模型发现,风险评分、年龄与预后相关,符合临床实际情况,模型的预测价值也在TCGA数据库中得以验证。
功能富集分析表明,细胞因子-细胞因子受体相互作用、PI3K-Akt、蛋白多糖通路在GBM进展中发挥重要作用,可能是GBM复发的机制,这与既往研究结果一致[23-25]。GSEA算法是一种非参数、无监督的方法,可根据关键基因集对单样本评分,我们通过GSEA分析发现高风险亚型上皮- 间充质转化、KRAS通路和炎性反应通路的活性上调。上皮-间充质转化是GBM侵袭性增强和肿瘤复发的重要原因,视黄酸相关孤儿核受体RORα能够阻断上皮-间充质转化,抑制GBM细胞的迁移和侵袭[26]。全外显子测序数据显示未复发和复发胶质瘤之间存在多种复发选择基因的改变,如KRAS、PPFIBP1的扩增,TNFRSF14、DCC的缺失,以及ATRX、TP53的突变[27]。炎性反应微环境是肿瘤的特征,可加速表观遗传学变化,并帮助肿瘤细胞免疫逃逸,组蛋白脱乙酰酶抑制剂和DNA甲基转移酶抑制剂能够逆转炎性反应景观,抑制GBM生长和侵袭[28]。这些富集的信号通路为深入探讨铁死亡相关基因在GBM复发中的生物学功能和作用机制提供了新思路。
上述研究结果提示,铁死亡相关复发风险基因可能构成一个复合体,参与肿瘤免疫,影响GBM患者预后。于是,我们对高/低风险亚型与肿瘤免疫浸润的相关性进行了评估,结果显示,高风险亚型肿瘤微环境具有较低的免疫评分和基质评分;高风险亚型中多种免疫细胞评分较低,如CD8+T细胞、中性粒细胞、巨噬细胞、树突状细胞和CD4+T细胞。由此可见,肿瘤微环境尤其是肿瘤浸润性免疫细胞在GBM复发过程中发挥重要作用。免疫检测点抑制剂和药物联合使用已被证明是一种可靠的治疗方法,并与肿瘤患者更好的预后相关[29-30],通过免疫检测点抑制剂的共刺激和免疫抑制T细胞亚群的重编程增强抗肿瘤免疫反应[31]。本研究发现,在高低风险亚型中,免疫抑制检测点CD274、HAVCR2、TGFB1、CSF1R基因表达水平存在明显差异,且与风险评分呈正相关,即免疫疗法的敏感度与风险评分相关。将免疫治疗与铁死亡相结合可为解决当前免疫疗法的瓶颈提供新视角。
综上所述,我们分析复发和未复发GBM患者的差异表达基因,构建了铁死亡相关(WWTR1、PLIN2、BID)风险预后模型,生物信息学和真实世界研究结果表明,关键铁死亡相关基因的改变与GBM复发、预后有关,且与肿瘤细胞侵袭、发展及免疫浸润密切相关,可能成为鉴别复发GBM的标志物,也可用于指导免疫治疗策略。此外,本研究使用国内外公共数据库中GBM患者信息,结果表明nomogram模型无东西方人群差异,能够为GBM的复发诊断和生存预后提供线索。
作者贡献:
廖永珍:数据收集及分析,论文撰写及修改
梁禄:协助完成数据收集及分析
李意:协助完成数据分析与论文修改
丛丽:指导研究设计与论文修改
| [1] |
Ostrom QT, Cioffi G, Waite K, et al. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2014-2018[J]. Neuro Oncol, 2021, 23(12 Suppl 2): iii1-iii105. |
| [2] |
Xiao D, Zhou Y, Wang X, et al. A Ferroptosis-Related Prognostic Risk Score Model to Predict Clinical Significance and Immunogenic Characteristics in Glioblastoma Multiforme[J]. Oxid Med Cell Longev, 2021, 2021: 9107857. |
| [3] |
Ouyang S, You J, Zhi C, et al. Ferroptosis: the potential value target in atherosclerosis[J]. Cell Death Dis, 2021, 12(8): 782. DOI:10.1038/s41419-021-04054-3 |
| [4] |
Wang ZL, Yuan L, Li W, et al. Ferroptosis in Parkinson's disease: glia-neuron crosstalk[J]. Trends Mol Med, 2022, 28(4): 258-269. DOI:10.1016/j.molmed.2022.02.003 |
| [5] |
Liu T, Zhu C, Chen X, et al. Ferroptosis, as the most enriched programmed cell death process in glioma, induces immunosuppression and immunotherapy resistance[J]. Neuro Oncol, 2022, 24(7): 1113-1125. DOI:10.1093/neuonc/noac033 |
| [6] |
Daisy Precilla S, Kuduvalli SS, Thirugnanasambandhar Sivasubramanian A. Disentangling the therapeutic tactics in GBM: From bench to bedside and beyond[J]. Cell Biol Int, 2021, 45(1): 18-53. DOI:10.1002/cbin.11484 |
| [7] |
林艺, 王策, 康勋, 等. 胶质母细胞瘤复发相关基因的筛选、表达和临床预后分析[J]. 中国癌症杂志, 2022, 32(1): 13-23. [Lin Y, Wang C, Kang X, et al. Screening recurrent glioblastoma-related genes and analyzing their gene expressions in association with clinicopathological parameters and prognosis[J]. Zhongguo Ai Zheng Za Zhi, 2022, 32(1): 13-23.] |
| [8] |
Jiang N, Xie B, Xiao W, et al. Fatty acid oxidation fuels glioblastoma radioresistance with CD47-mediated immune evasion[J]. Nat Commun, 2022, 13(1): 1511. DOI:10.1038/s41467-022-29137-3 |
| [9] |
任晓梅, 张立, 辛宝, 等. 谷胱甘肽过氧化物酶在胶质瘤患者中的表达及对生存预后的影响[J]. 中国医学科学院学报, 2022, 44(2): 276-285. [Ren X, Zhang L, Xin B, et al. Expression of Glutathione Peroxidases and Its Effect on Clinical Prognosis in Glioma Patients[J]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao, 2022, 44(2): 276-285.] |
| [10] |
Ascenzi F, De Vitis C, Maugeri-Saccà M, et al. SCD1, autophagy and cancer: implications for therapy[J]. J Exp Clin Cancer Res, 2021, 40(1): 265. DOI:10.1186/s13046-021-02067-6 |
| [11] |
Hou J, Hsu JM, Hung MC. Molecular mechanisms and functions of pyroptosis in inflammation and antitumor immunity[J]. Mol Cell, 2021, 81(22): 4579-4590. DOI:10.1016/j.molcel.2021.09.003 |
| [12] |
Chen X, Li J, Kang R, et al. Ferroptosis: machinery and regulation[J]. Autophagy, 2021, 17(9): 2054-2081. DOI:10.1080/15548627.2020.1810918 |
| [13] |
Tang D, Kroemer G. Ferroptosis[J]. Curr Biol, 2020, 30(21): R1292-R1297. DOI:10.1016/j.cub.2020.09.068 |
| [14] |
Zhang X, Jin S, Shi X, et al. Modulation of Tumor Immune Microenvironment and Prognostic Value of FerroptosisRelated Genes, and Candidate Target Drugs in Glioblastoma Multiforme[J]. Front Pharmacol, 2022, 13: 898679. DOI:10.3389/fphar.2022.898679 |
| [15] |
Wei J, Gao X, Qin Y, et al. An Iron Metabolism-Related SLC22A17 for the Prognostic Value of Gastric Cancer[J]. Onco Targets Ther, 2020, 13: 12763-12775. DOI:10.2147/OTT.S287811 |
| [16] |
Li Y, Yang J, Gu G, et al. Pulmonary Delivery of Theranostic Nanoclusters for Lung Cancer Ferroptosis with Enhanced Chemodynamic/Radiation Synergistic Therapy[J]. Nano Lett, 2022, 22(3): 963-972. DOI:10.1021/acs.nanolett.1c03786 |
| [17] |
Hassannia B, Wiernicki B, Ingold I, et al. Nano-targeted induction of dual ferroptotic mechanisms eradicates high-risk neuroblastoma[J]. J Clin Invest, 2018, 128(8): 3341-3355. DOI:10.1172/JCI99032 |
| [18] |
Yang X, Liu J, Wang C, et al. miR-18a promotes glioblastoma development by down-regulating ALOXE3-mediated ferroptotic and anti-migration activities[J]. Oncogenesis, 2021, 10(2): 15. DOI:10.1038/s41389-021-00304-3 |
| [19] |
de Souza I, Monteiro LKS, Guedes CB, et al. High levels of NRF2 sensitize temozolomide-resistant glioblastoma cells to ferroptosis via ABCC1/MRP1 upregulation[J]. Cell Death Dis, 2022, 13(7): 591. DOI:10.1038/s41419-022-05044-9 |
| [20] |
Gao M, Fu Y, Zhou W, et al. EGFR Activates a TAZ-Driven Oncogenic Program in Glioblastoma[J]. Cancer Res, 2021, 81(13): 3580-3592. DOI:10.1158/0008-5472.CAN-20-2773 |
| [21] |
Liu R, Lee JH, Li J, et al. Choline kinase alpha 2 acts as a protein kinase to promote lipolysis of lipid droplets[J]. Mol Cell, 2021, 81(13): 2722-2735. DOI:10.1016/j.molcel.2021.05.005 |
| [22] |
Hatziagapiou K, Nikola O, Marka S, et al. An In Vitro Study of Saffron Carotenoids: The Effect of Crocin Extracts and Dimethylcrocetin on Cancer Cell Lines[J]. Antioxidants (Basel), 2022, 11(6): 1074. DOI:10.3390/antiox11061074 |
| [23] |
Chiocca EA, Yu JS, Lukas RV, et al. Regulatable interleukin-12 gene therapy in patients with recurrent high-grade glioma: Results of a phase 1 trial[J]. Sci Transl Med, 2019, 11(505): eaaw5680. DOI:10.1126/scitranslmed.aaw5680 |
| [24] |
Tachon G, Masliantsev K, Rivet P, et al. MEOX2 Transcription Factor Is Involved in Survival and Adhesion of Glioma Stem-like Cells[J]. Cancers (Basel), 2021, 13(23): 5943. DOI:10.3390/cancers13235943 |
| [25] |
Dzikowski L, Mirzaei R, Sarkar S, et al. Fibrinogen in the glioblastoma microenvironment contributes to the invasiveness of brain tumor-initiating cells[J]. Brain Pathol, 2021, 31(5): e12947. |
| [26] |
Zhao J, Jiang Y, Chen L, et al. The EIF4A3/CASC2/RORA Feedback Loop Regulates the Aggressive Phenotype in Glioblastomas[J]. Front Oncol, 2021, 11: 699933. |
| [27] |
Xu PF, Li C, Xi SY, et al. Whole exome sequencing reveals the genetic heterogeneity and evolutionary history of primary gliomas and matched recurrences[J]. Comput Struct Biotechnol J, 2022, 20: 2235-2246. |
| [28] |
Chen N, Peng C, Li D. Epigenetic Underpinnings of Inflammation: A Key to Unlock the Tumor Microenvironment in Glioblastoma[J]. Front Immunol, 2022, 13: 869307. |
| [29] |
Lynes JP, Nwankwo AK, Sur HP, et al. Biomarkers for immunotherapy for treatment of glioblastoma[J]. J Immunother Cancer, 2020, 8(1): e000348. |
| [30] |
Li L, Zhu X, Qian Y, et al. Chimeric Antigen Receptor T-Cell Therapy in Glioblastoma: Current and Future[J]. Front Immunol, 2020, 11: 594271. |
| [31] |
Quail DF, Joyce JA. The Microenvironmental Landscape of Brain Tumors[J]. Cancer Cell, 2017, 31(3): 326-341. |
 2023, Vol. 50
2023, Vol. 50