文章信息
- PD1-TCF1+CD8+干细胞样记忆T细胞对肿瘤患者免疫预后及三级淋巴结构的影响
- Effect of PD1-TCF1+CD8+ Stem-like Memory T Cells on Immunotherapy Prognosis and Tertiary Lymphoid Structures in Tumors
- 肿瘤防治研究, 2023, 50(2): 146-150
- Cancer Research on Prevention and Treatment, 2023, 50(2): 146-150
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.0815
- 收稿日期: 2022-07-21
- 修回日期: 2022-11-21
近年来,虽然抗PD-1/PD-L1抗体已成为应用最广泛的抗肿瘤免疫疗法,但只有少部分患者能从中获益,因此肿瘤微环境中免疫细胞的功能状态备受关注[1]。在抵抗慢性感染和恶性肿瘤的保护性免疫中,CD8+细胞毒性T细胞一直是一个非常重要的媒介,也是免疫治疗的关键因素。然而,在应对长期的高抗原负荷时,一些CD8+效应T细胞分泌细胞因子的能力下降,同时表达大量的抑制性受体,如PD1、T细胞免疫球蛋白及黏蛋白结构域分子3(T cell immunoglobulin and mucin-domain containing-3, Tim3)、淋巴细胞激活基因3(lymphocyte activation gene 3, LAG3)及CTLA4等,这些功能低下的效应T细胞被称为“T细胞衰竭”[2-3]。TCF1是由Tcf7基因编码的一种T细胞特异性转录因子,是经典Wnt信号通路下游效应分子,对早期T细胞发育至关重要[4]。最近的研究发现,在慢性感染及肿瘤微环境中,TCF1对CD8+干细胞样记忆T细胞的自我更新至关重要,并促进了肿瘤患者对免疫检查点抑制剂的应答反应[5-6]。有研究发现CD8+干细胞样记忆T细胞两个子集具有不同的命运,其中缺乏PD-1和TIGIT的祖细胞亚群主要分化为功能谱系,而表达PD-1和TIGIT的祖细胞亚群则分化为功能障碍、衰竭样谱系[7-8]。因此,PD1-TCF1+CD8+干细胞样记忆T细胞可能在抗肿瘤免疫中发挥着更重要的作用,这种T细胞将更有利于抗肿瘤免疫应答,并且有希望预测肿瘤患者的免疫治疗疗效及预后。
三级淋巴结构(tertiary lymphoid structures, TLSs)作为各种免疫成分聚集形成的异位淋巴组织,为免疫细胞的抗肿瘤免疫应答提供了重要场所[9]。在肿瘤微环境中,TLSs能提供足够的刺激信号诱发T细胞的抗肿瘤免疫应答。而许多研究已经证实肿瘤微环境中TLSs的形成与肿瘤的预后密切相关[10]。PD1-TCF1+CD8+干细胞样T细胞的形成是否与TLSs的存在有关值得探索。本研究通过多重免疫荧光(multiplex immunohistochemical, mIHC)技术[11]检测了在肿瘤微环境中PD1-TCF1+CD8+干细胞样记忆T细胞的表达情况,探讨了PD1-TCF1+CD8+T细胞的表达对肿瘤患者预后及免疫疗效的影响,并分析了其与TLSs的相关性,为临床上预测患者的预后及疗效提供新的方向。
1 资料与方法 1.1 临床资料回顾性收集武汉大学人民医院2018年1月—2021年12月收治的经病理学确诊的非小细胞肺癌(NSCLC)及食管鳞癌(ESCC)晚期患者临床资料及病理标本。纳入标准:(1)病理组织学明确诊断为NSCLC或ESCC;(2)TNM分期Ⅲb~Ⅳ期;(3)治疗方案必须包含免疫检查点抑制剂;(4)所有患者至少接受2个周期的药物治疗(21天为一个周期)。排除标准:(1)无明确病理诊断;(2)TNM分期为Ⅰ~Ⅲa期的NSCLC及ESCC患者;(3)未使用PD-1抑制剂治疗的晚期NSCLC及ESCC患者;(4)目标药物用药时间不足2周期。
由两位病理医生对HE切片进行病理阅片,找到对应的蜡块并切白片。最终在343例接受免疫治疗的肺癌和食管癌患者中,收集到满足实验条件的NSCLC组织标本18例、ESCC组织标本15例。
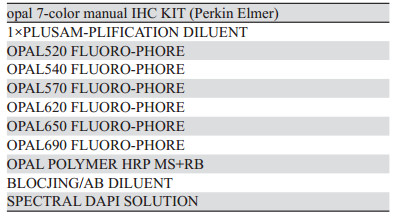
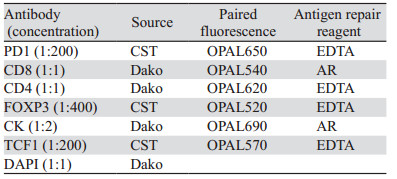
1.2 主要试剂本研究中多重免疫荧光染色(mIHC)使用的是PerkinElmer公司的7色试剂盒,包含试剂见表 1。染色切片扫描用到的病理成像系统是Vectra3.0,对应的图像分析处理软件为inFOrm 2.6。mIHC抗体顺序组合及修复条件,见表 2。
通过多重免疫荧光染色,同一组织中可以同时检测不同标记物的所有信号,结果可以用荧光信号或明场表示。多重免疫荧光染色主要步骤如下:将石蜡组织切片恒温65℃烤片1 h;在二甲苯溶液中脱蜡后乙醇中水化;用10%甲醛固定液固定后选择合适的修复液进行微波修复,100%微波火力150 s,30%火力12 min后冷却至室温。TBST清洗后加抗体封闭液湿盒室温封闭12 min。甩去封闭液,加提前稀释好的一抗,37℃孵育1 h或4℃过夜(过夜后取出室温静置30 min),TBST清洗3次后滴加二抗,湿盒37℃条件下孵育10 min,TBST清洗3次后加OPAL荧光:荧光稀释液1:10稀释且现用现配,湿盒37℃孵育10 min,TBST清洗后返回微波修复步骤孵育下一个抗体,循环至最后一个抗体孵育结束后滴加DAPI,湿盒室温孵育5 min,TBST清洗后流水清洗,自然晾干后加荧光防淬灭封片剂封片。用多光谱病理成像系统Vectra3.0对荧光染色切片进行全片扫描,选取感兴趣区域(ROI)拍取高倍图片,在inFOrm 2.6图像处理系统中对高倍镜下的图片进行分析。
1.4 随访通过门诊或住院定期复查或电话对患者进行定期随访至2022年5月,中位随访时间为12个月(1.5~30个月)。
1.5 统计学方法本研究通过Prism 9(Graphpad)对数据进行统计分析,结果以(x±s)表示;组间差异用非配对的双侧t检验;Kaplan-Meier法构建生存曲线对PFS进行生存分析,并通过Log rank检验生存曲线差异,组间的相关性分析利用Pearson相关检验来确定。P < 0.05为差异有统计学意义。
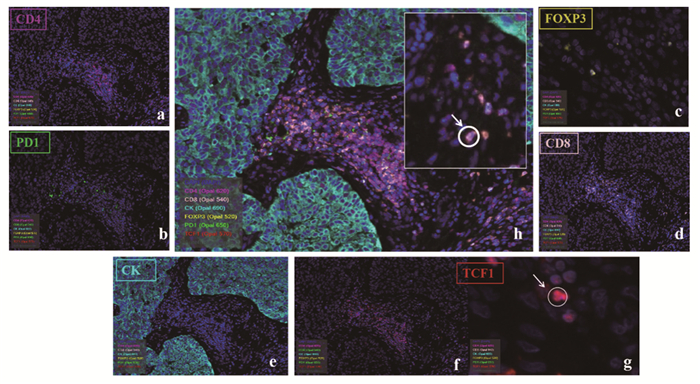
2 结果 2.1 mIHC中各分子指标的表达情况在组织样本上对CD4、PD1、FOXP3、CD8、Pan-CK和TCF1进行了染色。各个指标的解混图像和6个指标的混合图像见图 1。所有细胞核均用DAPI染色,图示蓝色。
|
| Cancer tissue was stained against CD4 (a), PD1 (b), FOXP3 (c), CD8 (d), PAN-CK (e), and TCF1 (f–g) using Opal 7-color kit. Image was captured using a Vectra 3.0 automated quantitative pathology imaging system, and the PD1-TCF1+CD8+ phenotype was marked with white circles and arrows (h). 图 1 肿瘤样本中淋巴细胞的多重免疫荧光染色示意图 Figure 1 Multiplex IHC staining of lymphocytes in cancer samples |
对33例组织标本中的PD1-TCF1+CD8+T细胞表型进行定量分析,分为高表达组(PD1-TCF1+CD8+T细胞密度≥32.88490284/mm2)及低表达组(PD1-TCF1+CD8+T细胞密度 < 32.88490284/mm2)。
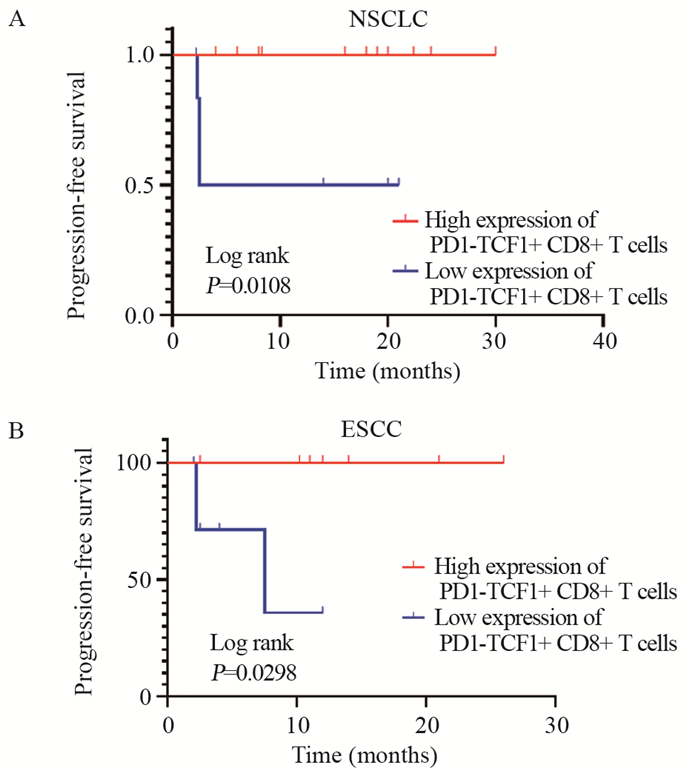
在18例NSCLC组织标本中,PD1-TCF1+CD8+ T细胞高表达组11例、低表达组7例。相较于低表达组,PD1-TCF1+CD8+ T细胞高表达组有着更好的PFS(HR=0.040, 95%CI: 0.003-0.476, P=0.0108),见图 2A。
|
| 图 2 接受免疫治疗后的NSCLC(A)和ESCC(B)患者生存曲线 Figure 2 Kaplan-Meier survival curves of NSCLC(A) and ESCC(B) patients after immunotherapy |
在15例ESCC组织标本中,PD1-TCF1+CD8+ T细胞高表达8例、低表达7例,结果同样表明PD1-TCF1+CD8+ T细胞高表达组有更好的PFS(HR=0.067, 95%CI: 0.006~0.768, P=0.0298),见图 2B。
2.3 PD1-TCF1+CD8+T细胞表达与胸部肿瘤患者免疫治疗疗效的关系免疫治疗有效定义为完全缓解/部分缓解+疾病稳定≥6个月的患者。当不满足此条件,即被定义为无效组。在NSCLC队列中,免疫治疗疗效与其病理分型无显著关联。
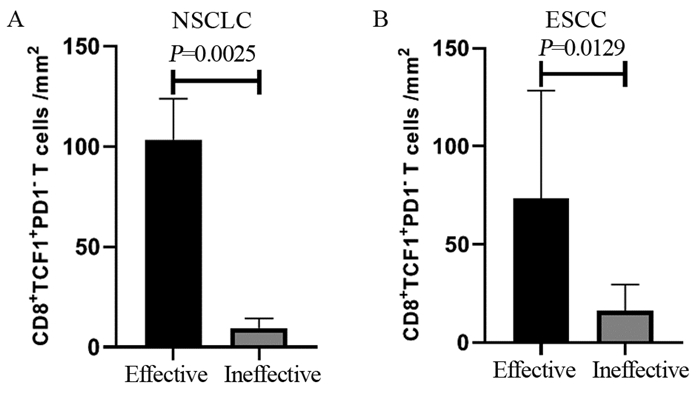
18例接受过免疫治疗的NSCLC患者按疗效评价被分为免疫治疗有效组(11例)和无效组(7例),发现免疫治疗有效组PD1-TCF1+CD8+T细胞表达水平显著高于免疫治疗无效组,差异有统计学意义(P=0.0025),见图 3A。
|
| Bars indicate x±s; two-tailed unpaired t-test for two-group comparisons. 图 3 PD1-TCF1+CD8+T细胞对NSCLC(A)患者及ESCC(B)患者免疫治疗疗效的影响 Figure 3 Influence of PD1-TCF1+CD8+ T cells on immune efficacy in patients with NSCLC(A) or ESCC(B) |
15例接受过免疫治疗的ESCC患者按疗效评价被分为免疫治疗有效组(7例)和无效组(8例),结果表明,免疫治疗有效组PD1-TCF1+CD8+T细胞表达水平也显著高于免疫治疗无效组,差异有统计学意义(P=0.0129),见图 3B。
本结果表明PD1-TCF1+CD8+干细胞样记忆T细胞高表达的NSCLC及ESCC患者也许更能从临床免疫治疗中获益。
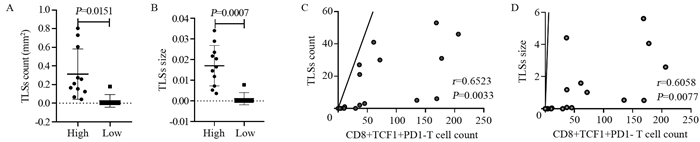
2.4 PD1-TCF1+CD8+T细胞的表达与TLSs的关系对上述病理组织切片中TLSs进行定量分析,在全片下计数并测量TLSs的面积。以相对面积(TLSs总测量面积/切片组织面积)来代表TLSs的大小,从而降低不同切片组织的大小误差。在18例NSCLC标本中发现PD1-TCF1+CD8+T细胞高表达组TLSs的数量显著高于低表达组(P=0.0151),见图 4A;TLSs的相对面积同样显著高于低表达组(P=0.0007),见图 4B。NSCLC中TLSs的数量与PD1-TCF1+CD8+T细胞的表达显著正相关(r=0.6523, 95%CI: 0.267-0.858, P=0.0033),TLSs的面积也与PD1-TCF1+CD8+T细胞的表达显著相关(r=0.6058, 95%CI: 0.194~0.836, P=0.0077),见图 4C、D。
|
| A-B: bars indicate x±s, High: High expression of PD1-TCF1+CD8+T cells; Low: low expression of PD1-TCF1+CD8+T cells. Two-tailed unpaired t-test for two-group comparisons; C-D: Pearson's correlation test. 图 4 NSCLC中PD1-TCF1+CD8+T细胞与三级淋巴结构的关系 Figure 4 Relationship between PD1-TCF1+CD8+ T cells and tertiary lymphoid structures (TLSs) in tumour microenvironment of NSCLC |
作为一种慢性消耗性疾病,肿瘤的免疫治疗需要持久的T细胞免疫力。与效应T细胞相比,CD8+记忆T细胞能够在宿主组织和肿瘤中持续存在并发挥作用[12]。TCF1作为一种T细胞转录因子,不仅在CD8+记忆T细胞的分化、维持和功能方面发挥着重要作用[13-14],而且促进了CD8+干细胞的产生及免疫反应的维持[15]。目前已经确定了四种CD8+记忆T细胞亚群,包括中枢性、效应性、干细胞样和组织驻留记忆T细胞[16]。其中,CD8+干细胞样记忆T细胞由于自我更新及多向分化的特点,在抗肿瘤免疫应答中起着重要的作用[17]。有研究[7-8]发现缺乏PD-1和TIGIT的祖细胞亚群主要分化为功能谱系,这表明免疫微环境中抑制性受体的低表达与TCF1的高表达可能代表着一种与衰竭T细胞相反的T细胞状态。因此,PD1-TCF1+CD8+干细胞样记忆T细胞可能在抗肿瘤免疫中发挥着更重要的作用,从而影响肿瘤的预后及免疫治疗效果。
TLSs的存在可能是一个较好的预后因素,并且预示着良好的抗肿瘤免疫反应[18],然而仅从TLSs的角度监测预后及疗效却很有难度。T细胞的增殖分化在淋巴器官内往往是有序而高效的,而在肿瘤微环境中,TLSs的形成起到了类似作用。B淋巴细胞簇、T淋巴细胞簇、巨噬细胞、树突状细胞等免疫成分聚集形成TLSs,提供了足够的抗原呈递、共刺激信号、细胞因子和肿瘤特异性抗体,从而产生更强的抗肿瘤免疫应答[19-20]。因此,PD1-TCF1+CD8+干细胞样记忆T细胞的形成可能与TLSs这个异位淋巴组织密切相关。我们对病理标本上TLSs进行计数后发现,在NSCLC队列中,TLSs的计数与PD1-TCF1+CD8+T细胞的表达显著相关(r=0.6523, P=0.0033),考虑到TLSs的大小差异可能影响免疫应答功能,我们对TLSs的面积进行计算,结果同样显示TLSs的相对面积大小与PD1-TCF1+CD8+T细胞的表达显著相关(r=0.6058, P=0.0077)。我们发现在NSCLC队列中,PD1-TCF1+CD8+T细胞高表达组TLSs的数量(P=0.0151)及相对面积(P=0.0007)均显著高于低表达组。在ESCC队列中这种差异没有统计学意义。由于ESCC队列样本量限制,未发现PD1-TCF1+CD8+T细胞的表达与三级淋巴结构的关系,导致PD1-TCF1+CD8+T细胞高表达组与低表达组中TLSs的数量和大小并没有统计学差异,未来我们会进一步收集增加ESCC样本,进一步探索和验证ESCC中干细胞样记忆T细胞与TLSs的关系。
因此,在NSCLC中,PD1-TCF1+CD8+干细胞样记忆T细胞的形成可能与肿瘤微环境中TLSs的数量及面积密切相关,这也提示PD1-TCF1+CD8+干细胞样记忆T细胞是TLSs的重要免疫组分,而TLSs的形成则更有利于PD1-TCF1+CD8+干细胞样记忆T细胞的诱导分化,然而其形成的具体分子机制仍然需要进一步探索。
本研究不足之处在于样本量较小。由于多重免疫荧光技术(mIHC)对标本质量要求十分严格,且免疫治疗患者的病理标本多为穿刺标本,大部分不符合研究要求。因此,本院343例接受免疫治疗的肺癌和食管癌患者中,仅有33例标本符合研究要求。目前极少有相关技术的大样本量研究报道,我们也会继续收集符合研究要求的病理标本,未来在更大的样本队列中验证。
综上所述,本研究发现PD1-TCF1+CD8+干细胞样记忆T细胞表型在NSCLC及ESCC患者生存预后及免疫疗效中可能有一定的预测作用,并且与NSCLC中TLSs的数量及大小密切相关。我们的实验发现为临床预测肿瘤患者的预后及免疫疗效提供了一个新的方向,如何将二者结合为临床免疫治疗提供有效的监测靶点,使肿瘤患者取得更好的临床获益值得进一步探索。
作者贡献:
崔雪:试验设计、基础实验及数据统计、撰写及修改论文
翁一鸣:试验指导
王培伟:临床资料收集
彭敏:指导试验设计、修改论文
| [1] |
Ribas A, Wolchok JD. Cancer immunotherapy using checkpoint blockade[J]. Science, 2018, 359(6382): 1350-1355. DOI:10.1126/science.aar4060 |
| [2] |
Wherry EJ. T cell exhaustion[J]. Nat Immunol, 2011, 12(6): 492-499. DOI:10.1038/ni.2035 |
| [3] |
Blank CU, Haining WN, Held W, et al. Defining 'T cell exhaustion'[J]. Nat Rev Immunol, 2019, 19(11): 665-674. DOI:10.1038/s41577-019-0221-9 |
| [4] |
Kim C, Jin J, Weyand CM, et al. The Transcription Factor TCF1 in T Cell Differentiation and Aging[J]. Int J Mol Sci, 2020, 21(18): 6497. DOI:10.3390/ijms21186497 |
| [5] |
Steinke FC, Xue H. From inception to output, Tcf1 and Lef1 safeguard development of T cells and innate immune cells[J]. Immunol Res, 2014, 59(1-3): 45-55. DOI:10.1007/s12026-014-8545-9 |
| [6] |
Zhao X, Shan Q, Xue HH. TCF1 in T cell immunity: a broadened frontier[J]. Nat Rev Immunol, 2022, 22(3): 147-157. DOI:10.1038/s41577-021-00563-6 |
| [7] |
Galletti G, De Simone G, Mazza EMC, et al. Two subsets of stem-like CD8+ memory T cell progenitors with distinct fate commitments in humans[J]. Nat Immunol, 2020, 21(12): 1552-1562. DOI:10.1038/s41590-020-0791-5 |
| [8] |
Seo W, Jerin C, Nishikawa H. Transcriptional regulatory network for the establishment of CD8+ T cell exhaustion[J]. Exp Mol Med, 2021, 53(2): 202-209. DOI:10.1038/s12276-021-00568-0 |
| [9] |
Pimenta EM, Barnes BJ. Role of Tertiary Lymphoid Structures (TLS) in Anti-Tumor Immunity: Potential Tumor-Induced Cytokines/Chemokines that Regulate TLS Formation in Epithelial-Derived Cancers[J]. Cancers (Basel), 2014, 6(2): 969-997. DOI:10.3390/cancers6020969 |
| [10] |
Romero D. B cells and TLSs facilitate a response to ICI[J]. Nat Rev Clin Oncol, 2020, 17(4): 195. DOI:10.1038/s41571-020-0338-6 |
| [11] |
Ng SB, Fan S, Choo SN, et al. Quantitative Analysis of a Multiplexed Immunofluorescence Panel in T-Cell Lymphoma[J]. SLAS Technol, 2018, 23(3): 252-258. DOI:10.1177/2472630317747197 |
| [12] |
Henning AN, Roychoudhuri R, Restifo NP. Epigenetic control of CD8(+) T cell differentiation[J]. Nat Rev Immunol, 2018, 18(5): 340-356. DOI:10.1038/nri.2017.146 |
| [13] |
Wen S, Lu H, Wang D, et al. TCF-1 maintains CD8(+) T cell stemness in tumor microenvironment[J]. J Leukoc Biol, 2021, 110(3): 585-590. DOI:10.1002/JLB.5MR1120-778R |
| [14] |
Harly C, Kenney D, Ren G, et al. The transcription factor TCF-1 enforces commitment to the innate lymphoid cell lineage[J]. Nat Immunol, 2019, 20(9): 1150-1160. DOI:10.1038/s41590-019-0445-7 |
| [15] |
Zhang J, Lyu T, Cao Y, et al. Role of TCF-1 in differentiation, exhaustion, and memory of CD8+ T cells: A review[J]. FASEB J, 2021, 35(5): e21549. |
| [16] |
Martin MD, Badovinac VP. Defining Memory CD8 T Cell[J]. Front Immunol, 2018, 9: 2692. DOI:10.3389/fimmu.2018.02692 |
| [17] |
Kanev K, Zehn D. Origin and fine-tuning of effector CD8 T cell subpopulations in chronic infection[J]. Curr Opin Virol, 2021, 46: 27-35. DOI:10.1016/j.coviro.2020.10.003 |
| [18] |
Dieu-Nosjean MC. Tumor-Associated Tertiary Lymphoid Structures: A Cancer Biomarker and a Target for Next-generation Immunotherapy[J]. Adv Exp Med Biol, 2021, 1329: 51-68. |
| [19] |
Cabrita R, Lauss M, Sanna A, et al. Tertiary lymphoid structures improve immunotherapy and survival in melanoma[J]. Nature, 2020, 577(7791): 561-565. DOI:10.1038/s41586-019-1914-8 |
| [20] |
Sautes-Fridman C, Petitprez F, Calderaro J, et al. Tertiary lymphoid structures in the era of cancer immunotherapy[J]. Nat Rev Cancer, 2019, 19(6): 307-325. DOI:10.1038/s41568-019-0144-6 |
 2023, Vol. 50
2023, Vol. 50