文章信息
- HER2阳性结直肠癌研究进展
- Research Progress of HER2 Positive Colorectal Cancer
- 肿瘤防治研究, 2023, 50(1): 86-93
- Cancer Research on Prevention and Treatment, 2023, 50(1): 86-93
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.0120
- 收稿日期: 2022-02-15
- 修回日期: 2022-05-12
2. 730000 兰州,兰州大学第二医院消化内科
2. Department of Gastroenterology, The Second Hospital of Lanzhou University, Lanzhou 730000, China
人表皮生长因子受体2(human epidermal growth factor receptor 2, EGFR2/HER2)是肿瘤发生、发展过程中的癌基因[1],其在结直肠癌(colorectal cancer, CRC)中的异常改变是继乳腺癌、胃癌之后的重要研究方向[2]。研究表明,HER2是CRC潜在的治疗靶点[3],而HER2阳性CRC患者更倾向于对抗EGFR单克隆抗体耐药[4],西妥昔单抗治疗过程中HER2信号通路的激活可能是其治疗失败的原因之一[5]。因此,对HER2阳性CRC的探索至关重要。
1 HER2在结直肠癌中的表达情况 1.1 HER2基因概述HER2(又名HER2/neu、C-erbB2或p185)位于人17号染色体q12~21,其编码的HER2蛋白位于细胞膜,是具有酪氨酸激酶活性的受体[1]。HER2异常改变包括基因扩增、体细胞突变及蛋白过表达[6],HER2蛋白过表达与HER2基因扩增明显相关[3, 7]。
1.2 CRC中HER2的检测方法CRC原发灶、转移灶组织及血液标本均可用于HER2检测。传统的免疫组织化学(IHC)及荧光原位杂交技术(FISH)已较为成熟,是CRC中HER2检测的常用手段[7]。全基因组测序(CGS)和二代测序(NGS)可以检测CRC组织及血液中的HER2基因扩增,即基因拷贝数(GCN)及体细胞突变,而由IHC/FISH评估的HER2阳性与基因检测中的基因扩增具有一致性,与体细胞突变无明显相关[8]。循环肿瘤DNA(ctDNA)技术可检测CRC患者血浆中的HER2 GCN,经研究证实与组织标本NGS检测的HER2 GCN结果基本一致[9]。此外,Pan等[10]研究显示可以通过注射125I-曲妥珠单抗获得CRC患者的SPECT HER2成像,从而评估HER2状态。
1.3 CRC中HER2阳性的诊断标准Valtorta等[11]曾在其研究中提出了基于IHC/FISH检测方法的HERACLES诊断标准,具体为:(1)IHC3+的肿瘤细胞数超过50%;(2)IHC3+的肿瘤细胞数占10%~50%且FISH检测阳性;(3)IHC2+的肿瘤细胞数超过50%且FISH检测阳性;其中FISH阳性定义为超过50%的肿瘤细胞HER2/CEP17≥2。近期,一个国际合作项目通过匹配ISH、FISH及NGS检测结果重新制定了针对CRC的HER2阳性诊断标准,即对手术标本进行IHC/FISH检测,要求超过10%的肿瘤细胞IHC3+或IHC2+且FISH阳性(HER2: CEP17≥2)。该标准强调了用手术切除标本进行检测的重要性,避免了因HER2异质性表达导致的假阳性。与之相对应的NGS检测中HER2基因扩增的标准是GCN > 4[12]。
1.4 CRC中HER2的阳性率既往研究显示,经CGS或NGS检出CRC患者的HER2基因扩增/突变比例约4.8%~7%,其中58.5%为基因扩增,33.3%为基因突变,8.2%的患者同时存在基因扩增与突变。常见的HER2基因突变包括V842I、V777L、L755S、L866M及S310F突变[2, 6]。Wang等[13]统计了由IHC/FISH检测的转移性结直肠癌(metastastic colorectal cancer, mCRC)原发灶中的HER2阳性率,结果显示整体人群HER2扩增/过表达比例为2.2%~9.5%,其中RAS/BRAF野生型患者HER2扩增/过表达比例为4%~14%,以RAS及BRAF均野生型患者为主(14%),明显高于RAS/BRAF突变人群(1%~4.8%)。不同研究之间HRE2阳性率的差异可能与研究样本量大小及诊断标准不同有关,但可以显示出在mCRC中,HER2扩增/过表达与RAS/BRAF突变是互斥的。对西妥昔单抗治疗失败的mCRC人群,Siravegna等[14]通过血液ctDNA检测显示HER2扩增比例达22%(4/22),其中1例HER2扩增的患者在西妥昔单抗治疗前无明显HER2扩增,提示HER2扩增可以在抗EGFR治疗过程中出现。与原发病灶相比,mCRC转移灶HER2阳性率明显升高,总HER2阳性率达31.8%,同时性肝转移灶的HER2阳性率为原发灶的3倍[15],脑转移病灶的HER2阳性率可达20%[16],证实HER2的异常改变能在疾病发展过程中出现,因此,在疾病进展时需重新测定转移灶或复发病灶的HER2状态。Lee等[17]也探讨了这种原发灶与转移灶之间HER2的表达差异,显示mCRC原发灶与肝、肺转移灶HER2一致性仅85.2%,但转移淋巴结的HER2状态与原发灶基本一致[15, 17]。此外,HER2在CRC中的阳性率还与原发肿瘤位置有关。与右半结肠癌相比,左半结肠癌拥有更高的HER2阳性率;相较于左、右半结肠癌,直肠癌HER2阳性率更高[4, 7]。
2 HER2阳性mCRC的治疗在曲妥珠单抗(Herceptin/Trastuzumab, H)问世之后,研究者尝试通过H联合化疗治疗HER2阳性CRC,但研究都因有效率低或入组患者不足而提前终止[18]。此后,随着帕妥珠单抗(Pertuzumab, P)等单克隆抗体及各类抗HER2酪氨酸激酶抑制剂(TKI)的出现,临床前研究发现,来那替尼、阿法替尼等TKI能有效抑制HER2阳性的结肠癌细胞系的生长;在HER2突变的人源异种移植(PDX)模型中,单克隆抗体或TKI单药能延缓肿瘤生长,联合治疗可使肿瘤产生持久的退缩[19],且对西妥昔单抗治疗失败后的HER2扩增mCRC PDX模型也能产生同样的效果[20]。因此,CRC中抗HER2治疗的临床研究再次启动,新型抗体-药物耦联物的出现也助力了CRC的抗HER2治疗。截止目前,以HER2为靶点的药物及免疫治疗策略总结,见图 1,已完成的临床研究充分肯定了抗HER2治疗在CRC中的疗效。
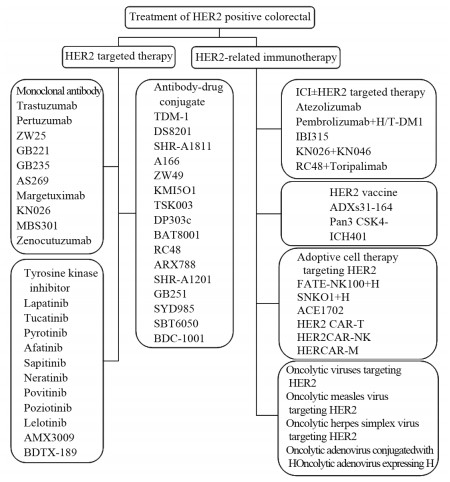
|
| 图 1 HER2阳性结直肠癌的治疗 Figure 1 Treatment of HER2 positive colorectal cancer |
曲妥珠单抗联合帕妥珠单抗(简称HP双靶)为HER2阳性乳腺癌患者带来了明显的生存获益,因此,MyPathwayⅡ期研究探讨了HP双靶对HER2阳性的mCRC的疗效。研究纳入57例HER2扩增的可评价病灶患者,其中35例有IHC检测结果的患者中,27例为HER2蛋白过表达。研究结果显示,1例完全缓解(CR),17例部分缓解(PR),7例疾病稳定(SD),客观缓解率(ORR)为32%,疾病控制率(DCR)为44%,中位无进展生存时间(mPFS)为2.9个月,中位总生存时间(mOS)为11.5个月,研究达到其主要终点。进一步行分子特征分析显示,伴有KRAS突变患者的mPFS及OS都相对较短;仅存在HER2基因扩增而无蛋白过表达的患者对HP双靶治疗均无应答;HER2基因拷贝数低于中位拷贝数的患者ORR及DCR相对较差[21-22]。另一项TRIUMPH研究也探讨了HP双靶治疗RAS野生型、HER2扩增的mCRC的疗效。研究共纳入18例可评价病灶患者,组织及ctDNA证实HER2扩增14例,仅组织HER2扩增3例,仅ctDNA扩增1例。研究结果显示,17例组织HER2扩增患者中,1例CR,5例PR,ORR为35.3%,DCR为64.7%;15例ctDNA检测HER2扩增患者中,1例CR,4例PR,ORR为33.3%,DCR为60%;总体人群mPFS和mOS分别为4.0个月和10.1个月,研究达到预设的主要终点[23]。总之,MyPathway及TRIUMPH两项研究肯定了HP双靶对HER2扩增的mCRC的疗效。
2.1.1.2 ZW25ZW25是靶向HER2 ECD2和HER2 ECD4的双特异性抗体,其Ⅰ期临床研究纳入了24例非乳腺恶性肿瘤的HER2阳性晚期实体瘤患者(CRC患者5例),其中71%的患者既往H治疗失败。研究结果显示,ORR为41%,DCR为82%,mPFS为6.2个月[24]。研究显示出ZW25良好的DCR和mPFS,其Ⅱ期临床研究正在开展。
2.1.2 基于酪氨酸激酶抑制剂的治疗 2.1.2.1 拉帕替尼由Tosi[25]等开展的HERACLES-A研究探讨了H与拉帕替尼联合治疗KRAS野生型、符合HERACLES诊断标准的HER2阳性mCRC的疗效。研究共纳入32例可评价病灶患者,接受H联合拉帕替尼治疗后1例CR并持续7年,8例PR,13例SD,ORR为28%,DCR为69%,mPFS为4.7个月,mOS为10个月。研究过程中6例(19%)患者出现症状性脑转移,明显高于既往报道的CRC患者的脑转移率(4%),可能与HER2阳性患者更易出现脑转移及抗HER2治疗延长生存导致的罕见部位转移多发有关。但其中5例脑转移患者从H联合拉帕替尼治疗中获益(2例PR,3例SD),结合临床前研究,考虑与拉帕替尼良好的血脑屏障穿透能力有关[26]。分子特征分析显示,HER2 GCN高于9.45的患者ORR比GCN低于9.45的患者高33%[27],结果与MyPathway研究一致。此外,Marwan等[28]报告了3例HER2扩增的mCRC患者,既往标准化疗及一线HP双靶治疗失败,接受H联合拉帕替尼治疗,1例PR,2例SD,表明HER2仍是一线抗HER2治疗后肿瘤生长的驱动因素,而H联合拉帕替尼的治疗与HP双靶没有交叉耐药,但结论需要更多研究结果证据支持。
2.1.2.2 图卡替尼图卡替尼对HER2扩增的mCRC的疗效在其Ⅱ期MOUNTAINEER研究中被证实。研究最新结果显示,23例可评价病灶患者接受H联合图卡替尼的治疗,ORR为52%,mPFS为8.1个月,mOS为18.7个月,中位随访10.6个月后mDOR仍未达到[29]。研究的主要终点ORR远高于预设值(40%),且生存获益显著。目前研究仍在进行中。
2.1.2.3 吡咯替尼基于吡咯替尼的研究也在HER2阳性mCRC中被探讨。仲茜等[30]给予6例经NGS检测为HER2阳性(5例基因扩增,1例错义突变)的mCRC患者H联合吡咯替尼治疗,结果显示,1例CR、2例PR、2例SD,ORR为50%,DCR为83%,mPFS为8.26个月;分子特征分析显示,5例应答者均为HER2基因扩增,1例HER2基因突变患者对治疗无应答。研究展示出明显的DCR及mPFS优势,同时也证实HER2扩增对抗HER2治疗的正性预测价值。Li等[31]报道了1例HER2扩增的mCRC患者,既往标准化疗及一线H联合拉帕替尼治疗失败,给予单药吡咯替尼治疗后疗效评价PR,PFS为7.8个月,随后的吡咯替尼联合西妥昔单抗治疗亦获得4个月以上的PFS。以上研究肯定了吡咯替尼及其联合治疗的疗效,值得更多的探讨。
2.1.2.4 阿法替尼阿法替尼在CRC中研究较多,但对HER2阳性mCRC疗效尚不明确。Yang等[32]报道了1例既往标准治疗失败、伴有HER2扩增并S310F突变的mCRC病例,构建PDX模型后药敏结果显示对阿法替尼有效,随后接受阿法替尼治疗后临床症状缓解,PFS为3个月。研究显示出阿法替尼对HER2基因扩增伴突变患者有效,但需更多临床研究去探索。
2.1.3 基于抗体-药物耦联物的治疗 2.1.3.1 TDM-1基于HERACLES-A良好的研究结果,Sartore-Bianchi等[33]进行了HERACLES-B研究,探索P联合TDM-1治疗RAS/BRAF野生型、HER2阳性mCRC的疗效。研究纳入符合HERACLES诊断标准的患者31例,经P联合TDM-1治疗后3例PR,21例SD,ORR为9.7%,DCR为77.4%,mPFS为4.1个月。虽然研究没有达到预设的主要终点(ORR > 30%),但大部分患者获得疾病控制,mPFS结果与HERACLES-A及MyPathway研究相似。Sandhu等[34]报道一例KRAS突变并HER2扩增的mCRC患者,既往标准化疗及HP双靶治疗失败,给予TDM-1后线治疗,最佳疗效SD,PFS为4个月;治疗6周期后ctDNA检测HER2 GCN由治疗前的56.1下降至8.6。该病例报道展示了T-DM1对同时性KRAS突变及HER2扩增mCRC有效。
2.1.3.2 T-DXd(DS8201)T-DXd在mCRC患者中开展的Ⅱ期DESTINY-CRC01研究中,53例HER2阳性患者接受T-DXd治疗,1例CR,23例PR,ORR为45.3%,DCR为83%,mPFS为6.9个月,mOS为15.5个月,研究显示出T-DXd显著的疗效及明显的生存获益[35],其良好的抗肿瘤活性亦在临床前研究被证实,T-DXd对仅HER2蛋白过表达而无基因扩增的CRC细胞有效,对HER2过表达细胞周边的无HER2过表达的CRC细胞也有杀伤作用,这一效应有可能克服CRC中HER2表达异质性的问题[36]。
2.2 HER2相关免疫治疗以免疫检查点抑制剂为代表的免疫治疗极大的改变了晚期实体瘤的治疗前景,各种免疫治疗方法在HER2阳性CRC中的作用正在积极探索。
2.2.1 免疫检查点抑制剂已知免疫检查点抑制剂在CRC中的疗效与肿瘤突变负荷(TMB)和微卫星不稳定(MSI)相关[37]。在MyPathway研究中,所有已知MSI状态的HER2扩增患者(28/57)均为MSI-L或MSI-S[22],其他研究亦证实高TMB或MSI-H几乎均发生在HER2基因突变患者中,仅基因扩增无突变患者无高TMB或MSI-H发生[6, 38],而HER2突变的MSI-H患者接受PD-1治疗的mPFS比HER2阴性的患者差[38]。目前,包括阿替利珠单抗、IBI315及KN046在内的多项临床研究正在CRC中开展,包括HER2阳性队列。
2.2.2 HER2疫苗既往研究发现,在HER2过表达的癌症患者体内可检测到由T细胞介导的对HER2蛋白的免疫应答[39],在HER2阳性CRC中,约14%的患者体内可检测到滴度为1: 1000的HER2抗体[40],因此,过表达的HER2蛋白是免疫治疗的潜在靶点。临床前研究亦证实,基于HER2蛋白的疫苗可以激发相同的免疫反应,如嵌合了HER2基因的减毒李斯特菌载体疫苗ADXS31-164[41]、HER2疫苗Pam3CSK4-MFCH401[42]等,亦有研究显示HER2基因疫苗与PD-L1疫苗联合治疗对HER2过表达肿瘤细胞有显著的杀伤作用[43],但在CRC中研究结果有限。Lynch等[44]给予IIC-IV期CRC患者基于CEA及HER2肽的疫苗,70%的参与者体内检测到免疫应答;另一项HER2疫苗的研究中,1例结肠癌患者接种疫苗后病情稳定[45]。但以上临床研究样本量小,且针对CRC整体人群,对HER2阳性CRC中的疗效尚不明确。
2.2.3 过继细胞治疗过继细胞治疗是免疫治疗领域的重要手段,HER2亦是过继细胞治疗的理想靶抗原。目前自体HER2特异性细胞毒性T淋巴细胞过继治疗、HER2特异性自然杀伤细胞过继治疗,以及靶向HER2的嵌合抗原受体T细胞(HER2 CAR-T)、嵌合抗原受体巨噬细胞(HER2 CAR-M)及嵌合抗原受体NK细胞(HER2 CAR-NK)治疗已被广泛探讨,证实能在体外实验中有效地裂解HER2阳性肿瘤细胞系,并对多种HER2阳性晚期实体瘤有效[46-47]。基于以上研究结果,多项靶向HER2的过继细胞治疗正在HER2阳性实体瘤中开展,期待在HER2阳性CRC中的疗效。
2.2.4 溶瘤细胞的病毒目前在研的靶向HER2的溶瘤病毒有双特异性溶瘤麻疹病毒、溶瘤单纯疱疹病毒,以及表达或耦联了H的溶瘤腺病毒等,并已在部分HER2阳性实体瘤中应用,但在CRC中的疗效尚不明确。有研究显示溶瘤腺病毒能增加HER2 CAR-T的疗效[48],TT16即是HER2 CAR-T与溶瘤腺病毒的复合物,其临床研究正在开展。
3 总结目前,针对CRC的精准治疗相对较少,HER2正在成为CRC中除RAS和BRAF之外的重要靶点,将HER2靶向治疗的临床获益扩展到CRC意义重大。传统的ISH、FISH检测为HER2阳性CRC患者的筛选提供了支持,CGS、NGS等新兴技术对HER2阳性CRC的辅助诊断、疗效预测具有指导意义。HER2阳性诊断标准的统一为更好地开展抗HER2研究奠定了基础。
已完成的多项临床研究显示了不同抗HER2治疗策略的疗效及临床获益,见图 2~3。根据现有数据分析可见,单克隆抗体与酪氨酸激酶抑制剂的联合治疗具有明显优势,如H联合图卡替尼及H联合吡咯替尼的治疗显示出较好的ORR(52.2%, 50%)及mPFS(8.1个月,8.26个月),其中H联合吡咯替尼的治疗有着最佳的DCR(83%),而H联合图卡替尼生存获益最显著(mOS为18.7个月),因此,H联合图卡替尼或吡咯替尼的治疗是目前HER2阳性CRC患者抗HER2治疗的首选策略;H联合拉帕替尼的治疗同样显示出良好的疾病控制(DCR为69%)和总生存获益(mOS为10个月),且证实对CRC脑转移病灶有效。因此,H联合拉帕替尼的治疗也是CRC患者抗HER2治疗的可选策略。新型抗体-药物耦联物T-Dxd单药治疗即显示出对HER2阳性CRC极高的疾病控制(DCR为83%)及明显生存获益(mOS为15.5个月),是除H联合图卡替尼或吡咯替尼之外最佳的选择,而P联合T-DM1的治疗疾病控制显著(DCR为77.4%),但没有显示出明显的mPFS获益。HP双靶联合治疗在MyPathway及TRIUMPH两项研究中获得了10.1~11.5个月的mOS,远超目前标准的三、四线治疗,且在TRIUMPH研究中表现出良好的DCR(60%~64.7%),故HP双靶联合治疗也是可选的治疗方案。与传统HP双靶治疗相比,双特异性抗体ZW25的Ⅰ期研究展现出明显的DCR及PFS优势,但需要更多研究结果来确定最优治疗策略及最佳用药顺序。此外,针对HER2靶向治疗耐药的研究也将有助于探索更为合理的联合治疗方案。

|
| 图 2 HER2阳性CRC临床研究的ORR及DCR Figure 2 ORR and DCR in clinical researches of HER2- positive CRC |
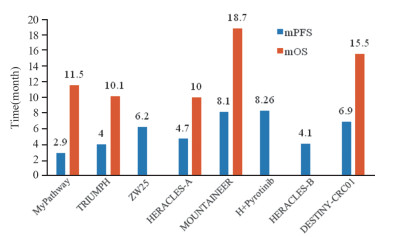
|
| 图 3 HER2阳性CRC临床研究的PFS及OS Figure 3 PFS and OS in clinical researches of HER2- positive CRC |
对HER2阳性CRC的免疫治疗相关研究正在广泛开展,包括但不限于本文所提及的研究。虽然目前尚无研究显示出免疫治疗对HER2阳性CRC患者的生存获益,但免疫治疗是充满前景的治疗方式,其未来值得期待。
总之,尽管CRC中HER2阳性率相对较低,但在全球范围内CRC的高发病率使HER2成为一个不可小觑的靶点,更多围绕HER2阳性CRC的临床研究正在开展,见表 1。HER2阳性CRC将是精准医学时代的下一个分子选择性亚组人群,更合理的抗HER2治疗策略将为HER2阳性CRC患者带来更多生存获益,开启CRC靶向治疗的新篇章。
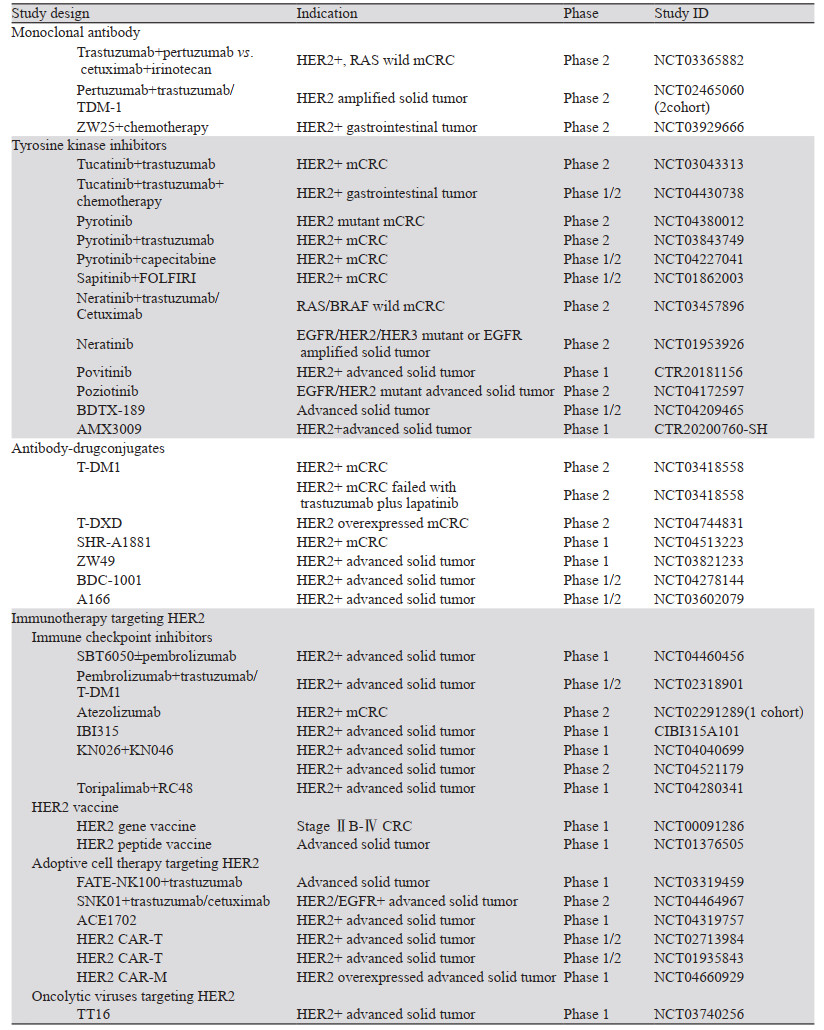
|
作者贡献:
祁雅丽:研究选题、论文构思、文献检索、数据解析及论文撰写
苟亚妮:协助文献检索及数据整理
达丽隽:文献检索交叉核验及协助数据解析
李恩喜、刘雅婷、裴霞霞:协助论文撰写
宋飞雪:论文设计及指导
| [1] |
Yarden Y, Sliwkowski MX. Untangling the ErbB signalling network[J]. Nat Rev Mol Cell Biol, 2001, 2(2): 127-137. DOI:10.1038/35052073 |
| [2] |
Cancer Genome Atlas Network. Comprehensive molecular characterization of human colon and rectal cancer[J]. Nature, 2012, 487(7407): 330-337. DOI:10.1038/nature11252 |
| [3] |
Richman SD, Southward K, Chambers P, et al. HER2 overexpression and amplification as a potential therapeutic target in colorectal cancer: analysis of 3256 patients enrolled in the QUASAR, FOCUS and PICCOLO colorectal cancer trials[J]. J Pathol, 2016, 238(4): 562-570. DOI:10.1002/path.4679 |
| [4] |
Sartore-Bianchi A, Amatu A, Porcu L, et al. HER2 Positivity Predicts Unresponsiveness to EGFR-Targeted Treatment in Metastatic Colorectal Cancer[J]. Oncologist, 2019, 24(10): 1395-1402. DOI:10.1634/theoncologist.2018-0785 |
| [5] |
Yonesaka K, Zejnullahu K, Okamoto I, et al. Activation of ERBB2 signaling causes resistance to the EGFR-directed therapeutic antibody cetuximab[J]. Sci Transl Med, 2011, 3(99): 99ra86. |
| [6] |
Ross J, Fakih M, Ali S, et al. Targeting HER2 in colorectal cancer: The landscape of amplification and short variant mutations in ERBB2 and ERBB3[J]. Cancer, 2018, 124(7): 1358-1373. DOI:10.1002/cncr.31125 |
| [7] |
Seo AN, Kwak Y, Kim DW, et al. HER2 status in colorectal cancer: its clinical significance and the relationship between HER2 gene amplification and expression[J]. PLoS One, 2014, 9(5): e98528. DOI:10.1371/journal.pone.0098528 |
| [8] |
Cenaj O, Ligon AH, Hornick JL, et al. Detection of ERBB2 Amplification by Next-Generation Sequencing Predicts HER2 Expression in Colorectal Carcinoma[J]. Am J Clin Pathol, 2019, 152(1): 97-108. DOI:10.1093/ajcp/aqz031 |
| [9] |
Siravegna G, Sartore-Bianchi A, Nagy RJ, et al. Plasma HER2(ERBB2) Copy Number Predicts Response to HER2-targeted Therapy in Metastatic Colorectal Cancer[J]. Clin Cancer Res, 2019, 25(10): 3046-3053. DOI:10.1158/1078-0432.CCR-18-3389 |
| [10] |
Pan G, Li D, Li X, et al. SPECT/CT imaging of HER2 expression in colon cancer-bearing nude mice using (125) I-Herceptin[J]. Biochem Biophys Res Commun, 2018, 504(4): 765-770. DOI:10.1016/j.bbrc.2018.08.201 |
| [11] |
Valtorta E, Martino C, Sartore-Bianchi A, et al. Assessment of a HER2 scoring system for colorectal cancer: results from a validation study[J]. Mod Pathol, 2015, 28(11): 1481-1491. DOI:10.1038/modpathol.2015.98 |
| [12] |
Fujii S, Magliocco AM, Kim J, et al. International Harmonization of Provisional Diagnostic Criteria for ERBB2-Amplified Metastatic Colorectal Cancer Allowing for Screening by Next-Generation Sequencing Panel[J]. JCO Precis Oncol, 2020, 4(11): 6-19. |
| [13] |
Wang G, He Y, Sun Y, et al. Prevalence, prognosis and predictive status of HER2 amplification in anti-EGFR-resistant metastatic colorectal cancer[J]. Clin Transl Oncol, 2020, 22(6): 813-822. DOI:10.1007/s12094-019-02213-9 |
| [14] |
Siravegna G, Mussolin B, Buscarino M, et al. Clonal evolution and resistance to EGFR blockade in the blood of colorectal cancer patients[J]. Nat Med, 2015, 21(7): 795-801. DOI:10.1038/nm.3870 |
| [15] |
Shan L, Lv Y, Bai B, et al. Variability in HER2 expression between primary colorectal cancer and corresponding metastases[J]. J Cancer Res Clin Oncol, 2018, 144(11): 2275-2281. DOI:10.1007/s00432-018-2744-z |
| [16] |
Tan RYC, Camat MD, Ng M, et al. HER2 positive rates are enriched amongst colorectal cancer brain metastases: a study amongst 1920 consecutive patients[J]. Ann Oncol, 2018, 29(7): 1598-1599. DOI:10.1093/annonc/mdy156 |
| [17] |
Lee WS, Park YH, Lee JN, et al. Comparison of HER2 expression between primary colorectal cancer and their corresponding metastases[J]. Cancer Med, 2014, 3(3): 674-680. DOI:10.1002/cam4.228 |
| [18] |
Ramanathan RK, Hwang JJ, Zamboni WC, et al. Low overexpression of HER-2/neu in advanced colorectal cancer limits the usefulness of trastuzumab (Herceptin) and irinotecan as therapy. A phaseⅡ trial[J]. Cancer Invest, 2004, 22(6): 858-865. DOI:10.1081/CNV-200039645 |
| [19] |
Kavuri SM, Jain N, Galimi F, et al. HER2 activating mutations are targets for colorectal cancer treatment[J]. Cancer Discov, 2015, 5(8): 832-841. DOI:10.1158/2159-8290.CD-14-1211 |
| [20] |
Bertotti A, Migliardi G, Galimi F, et al. A molecularly annotated platform of patient-derived xenografts ("xenopatients") identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer[J]. Cancer Discov, 2011, 1(6): 508-523. DOI:10.1158/2159-8290.CD-11-0109 |
| [21] |
Hainsworth J D, Meric-Bernstam F, Swanton C, et al. Targeted Therapy for Advanced Solid Tumors on the Basis of Molecular Profiles: Results From My Pathway, an Open-Label, Phase IIa Multiple Basket Study[J]. J Clin Oncol, 2018, 36(6): 536-542. DOI:10.1200/JCO.2017.75.3780 |
| [22] |
Meric-Bernstam F, Hurwitz H, Raghav KPS, et al. Pertuzumab plus trastuzumab for HER2-amplified metastatic colorectal cancer (MyPathway): an updated report from a multicentre, open-label, phase 2a, multiple basket study[J]. Lancet Oncol, 2019, 20(4): 518-530. DOI:10.1016/S1470-2045(18)30904-5 |
| [23] |
Nakamura Y, Okamoto W, Kato T, et al. TRIUMPH: Primary efficacy of a phase II trial of trastuzumab (T) and pertuzumab (P) in patients (pts) with metastatic colorectal cancer (mCRC) with HER2(ERBB2) amplification (amp) in tumour tissue or circulating tumour DNA (ctDNA): A GOZILA sub-study[J]. Ann Oncol, 2019, 30: v199-v200. |
| [24] |
ZW25 Effective in HER2-Positive Cancers[J]. Cancer Discov, 2019, 9(1): 8.
|
| [25] |
Tosi F, Sartore-Bianchi A, Lonardi S, et al. Long-term Clinical Outcome of Trastuzumab and Lapatinib for HER2-positive Metastatic Colorectal Cancer[J]. Clin Colorectal Cancer, 2020, 19(4): 256-62.e2. DOI:10.1016/j.clcc.2020.06.009 |
| [26] |
Taskar KS, Rudraraju VR, Mittapalli RK, et al. Lapatinib distribution in HER2 overexpressing experimental brain metastases of breast cancer[J]. Pharm Res, 2012, 29(3): 770-781. DOI:10.1007/s11095-011-0601-8 |
| [27] |
Sartore-Bianchi A, Trusolino L, Martino C, et al. Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2-positive metastatic colorectal cancer (HERACLES): a proof-of-concept, multicentre, open-label, phase 2 trial[J]. Lancet Oncol, 2016, 17(6): 738-746. DOI:10.1016/S1470-2045(16)00150-9 |
| [28] |
Fakih MG. Trastuzumab Plus Pertuzumab Resistance Does Not Preclude Response to Lapatinib Plus Trastuzumab in HER2-Amplified Colorectal Cancer[J]. Oncologist, 2018, 23(4): 474-477. DOI:10.1634/theoncologist.2017-0436 |
| [29] |
Lee A. Tucatinib: First Approval[J]. Drugs, 2020, 80(10): 1033-1038. DOI:10.1007/s40265-020-01340-w |
| [30] |
仲茜, 靳水玲, 宗红. 曲妥珠单抗联合吡咯替尼治疗人表皮生长因子-2阳性晚期结直肠癌临床观察[J]. 肿瘤基础与临床, 2021, 34(2): 114-117. [Zhong X, Jin SL, Zong H. Clinical observation of trastuzumab combined with pyrrotinib in the treatment of hu-man epidermal growth factor-2 positive advanced intestinal cancer[J]. Zhong Liu Ji Chu Yu Lin Chuang, 2021, 34(2): 114-117. DOI:10.3969/j.issn.1673-5412.2021.02.006] |
| [31] |
Li HS, Yang LL, Zhang MY, et al. Remarkable Response of EGFR-and HER2-Amplified Metastatic Colon Cancer to Pyrotinib After Failed Multiline Treatments: A Case Report and Literature Review[J]. Front Oncol, 2020, 10: 548867. DOI:10.3389/fonc.2020.548867 |
| [32] |
Yang M, Fang X, Li J, et al. Afatinib treatment for her-2 amplified metastatic colorectal cancer based on patient-derived xenograft models and next generation sequencing[J]. Cancer Biol Ther, 2019, 20(4): 391-396. DOI:10.1080/15384047.2018.1529120 |
| [33] |
Sartore-Bianchi A, Lonardi S, Martino C, et al. Pertuzumab and trastuzumab emtansine in patients with HER2-amplified metastatic colorectal cancer: the phaseⅡ HERACLES-B trial[J]. ESMO Open, 2020, 5(5): e000911. DOI:10.1136/esmoopen-2020-000911 |
| [34] |
Sandhu J, Wang C, Fakih M. Clinical Response to T-DM1 in HER2-Amplified, KRAS-Mutated Metastatic Colorectal Cancer[J]. J Natl Compr Canc Netw, 2020, 18(2): 116-119. |
| [35] |
Siena S, Di Bartolomeo M, Raghav K, et al. Trastuzumab deruxtecan (DS-8201) in patients with HER2-expressing metastatic colorectal cancer (DESTINY-CRC01): a multicentre, open-label, phase 2 trial[J]. Lancet Oncol, 2021, 22(6): 779-789. DOI:10.1016/S1470-2045(21)00086-3 |
| [36] |
Takegawa N, Tsurutani J, Kawakami H, et al. [fam-] trastuzumab deruxtecan, antitumor activity is dependent on HER2 expression level rather than on HER2 amplification[J]. Inter J Cancer, 2019, 145(12): 3414-3424. DOI:10.1002/ijc.32408 |
| [37] |
Goodman A, Sokol E, Frampton G, et al. Microsatellite-Stable Tumors with High Mutational Burden Benefit from Immunotherapy[J]. Cancer Immunol Res, 2019, 7(10): 1570-1573. DOI:10.1158/2326-6066.CIR-19-0149 |
| [38] |
Qiu MZ, He CY, Yang XH, et al. Relationship of HER2 Alteration and Microsatellite Instability Status in Colorectal Adenocarcinoma[J]. Oncologist, 2021, 26(7): e1161-e1170. DOI:10.1002/onco.13786 |
| [39] |
Disis M, Knutson K, Schiffman K, et al. Pre-existent immunity to the HER-2/neu oncogenic protein in patients with HER-2/neu overexpressing breast and ovarian cancer[J]. Breast Cancer Res Treat, 2000, 62(3): 245-252. DOI:10.1023/A:1006438507898 |
| [40] |
Ward R, Hawkins N, Coomber D, et al. Antibody immunity to the HER-2/neu oncogenic protein in patients with colorectal cancer[J]. Human Immunol, 1999, 60(6): 510-515. DOI:10.1016/S0198-8859(99)00003-8 |
| [41] |
Shahabi V, Seavey MM, Maciag PC, et al. Development of a live and highly attenuated Listeria monocytogenes-based vaccine for the treatment of Her2/neu-overexpressing cancers in human[J]. Cancer Gene Ther, 2011, 18(1): 53-62. DOI:10.1038/cgt.2010.48 |
| [42] |
Feng Q, Manabe Y, Kabayama K, et al. Syntheses and Functional Studies of Self-Adjuvanting Anti-HER2 Cancer Vaccines[J]. Chem Asian J, 2019, 14(23): 4268-4273. DOI:10.1002/asia.201901002 |
| [43] |
Zhang W, Wang S, Gu J, et al. Synergistic tumoricidal effect of combined hPD-L1 vaccine and HER2 gene vaccine[J]. Biochem Biophys Res Commun, 2018, 497(1): 394-400. DOI:10.1016/j.bbrc.2018.02.092 |
| [44] |
Lynch KT, Squeo GC, Kane WJ, et al. A pilot trial of vaccination with carcinoembryonic antigenand Her2/neu peptides in advanced colorectal cancer[J]. Int J Cancer, 2021, 150(1): 164-173. |
| [45] |
Kaumaya PT, Foy KC, Garrett J. Phase I Active Immunotherapy With Combination ofTwo Chimeric, Human Epidermal Growth Factor Receptor 2, B-Cell Epitopes Fused to a Promiscuous T-Cell Epitope in Patients With Metastatic and/or Recurrent Solid Tumors[J]. J Clin Oncol, 2009, 27(31): 5270-5277. DOI:10.1200/JCO.2009.22.3883 |
| [46] |
Schönfeld K, Sahm C, Zhang C, et al. Selective inhibition of tumor growth by clonal NK cells expressing an ErbB2/HER2-specific chimeric antigen receptor[J]. Mol Ther, 2015, 23(2): 330-338. DOI:10.1038/mt.2014.219 |
| [47] |
Zhang C, Burger MC, Jennewein L, et al. ErbB2/HER2-Specific NK Cells for Targeted Therapy of Glioblastoma[J]. J Nat Cancer Inst, 2016, 108(5): 375-386. |
| [48] |
Rosewell Shaw A, Porter CE, Yip T, et al. Oncolytic adeno-immunotherapy modulates the immune system enabling CAR T-cells to cure pancreatic tumors[J]. Commun Biol, 2021, 4(1): 368-380. DOI:10.1038/s42003-021-01914-8 |
 2023, Vol. 50
2023, Vol. 50


