文章信息
- 达沙替尼治疗慢性粒细胞性白血病期间出现皮肤鳞癌1例报告并文献复习
- Cutaneous Squamous-cell Carcinoma During Dasatinib Treatment for Chronic Myeloid Leukemia: A Case Report and Literature Review
- 肿瘤防治研究, 2022, 49(11): 1202-1204
- Cancer Research on Prevention and Treatment, 2022, 49(11): 1202-1204
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0258
- 收稿日期: 2022-03-17
- 修回日期: 2022-05-30
2. 650032 昆明,昆明医科大学第二附属医院皮肤科
2. Department of Dermatology, The Second Affiliated Hospital of Kunming Medical University, Kunming 650032, China
慢性粒细胞性白血病(chronic myelogenous leukemia, CML)是骨髓造血干细胞克隆性增殖形成的恶性肿瘤,占成人白血病的15%,费城染色体(Ph染色体)和(或)BCR-ABL融合基因为其特征。过去,CML患者常选用羟基脲治疗,虽然可以缓解症状,但不能消除Ph染色体,亦不能改善预后。而新药酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKIs)的出现显著改善了CML患者的预后,使患者长期无病生存成为可能,但也可能带来一些晚期问题,比如第二肿瘤的发生。现报道1例确诊慢性粒细胞性白血病多年,使用达沙替尼期间出现的皮肤鳞癌病例,并就其发生的可能相关危险因素进行探讨。
1 病例资料患者男性,65岁,2001年诊断为CML(慢性期),持续羟基脲(2.5 g/d)治疗,2008年右内踝外伤后出现溃疡,大小约1.5 cm×1.5 cm,迁延不愈。2016年开始服用甲磺酸伊马替尼(400 mg/d),右内踝溃疡逐渐愈合,但治疗2年未达到完全血液学缓解。2019年4月检测到BCR-ABL激酶突变:V379I(第379位缬氨酸突变为异亮氨酸),无二代TKIs治疗禁忌证,开始服用尼罗替尼(300 mg,每日2次),3月后达到完全血液学缓解,但无细胞遗传学反应。2019年12月再次检测BCR-ABL激酶突变,仍为V379I,更换达沙替尼(100 mg/d)治疗,期间因血液学毒性,达沙替尼逐渐减量为25 mg/d。治疗4月后达到部分细胞遗传学反应(Ph+细胞9%),无分子学反应(BCR-ABLIS18.57%),继续治疗3个月后仍为部分细胞遗传学反应,建议加用干扰素治疗,患者拒绝。
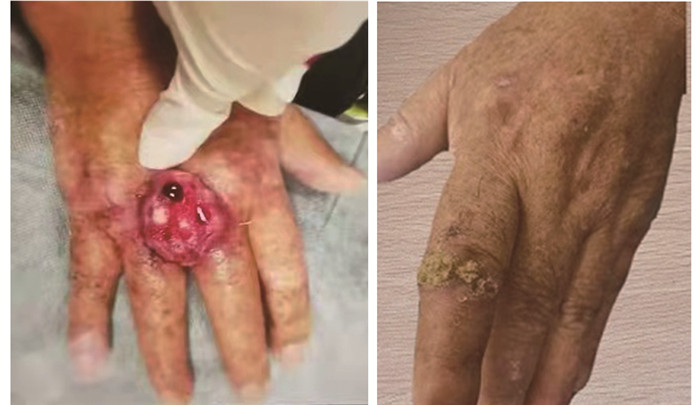
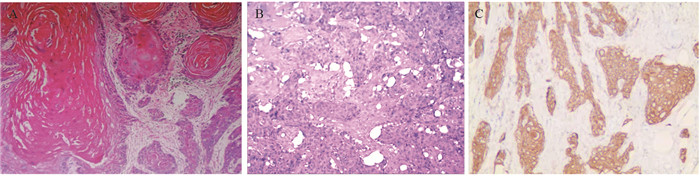
2021年1月患者因右手背肿物于我院皮肤科就诊,该肿物在3个月内迅速增大,约5 cm×4 cm×1 cm,呈分叶状,表面凹凸不平,质地较硬,明显渗血。同时左手食指见约0.5 cm×0.5 cm大小明显角化褐色丘疹,高出皮肤表面,见图 1。患者双手皮肤明显干燥,伴色素沉着,散在浅褐色斑块,表面粗糙。外科手术切除右手背肿物及左手食指病变,术后左手食指病变病理检查示:角化过度,表皮棘层明显增生肥厚,并向真皮内浸润生长,细胞排列紊乱,异型明显,可见核分裂相及角化不良细胞。真皮内可见少许鳞状细胞团块,周边大量炎细胞浸润,病理诊断“高分化鳞状细胞癌”。右手背肿物病理检查示“中分化鳞状细胞癌”,见图 2。
|
| 图 1 患者术前双手病变 Figure 1 Preoperative changes in patient's hands |
|
| A: left hand: well-differentiated squamous-cell carcinoma with keratinized beads (HE ×40); B: right hand: moderately differentiated squamous-cell carcinoma (HE ×40); C: tumor cells withCK5/6(+) in the right hand (IHC ×40) 图 2 患者双手术后病理检查结果 Figure 2 Postoperative pathological examination results of the patient |
术后2月,患者右手指根部再现约3 cm×3 cm大小形状不规则肿物,表面凹凸不平,质地较硬,伴双手多部位散在米粒至蚕豆大小浅褐色丘疹、斑块,表面粗糙、角化明显(图略,请扫描本文OSID码)。同时右侧腋窝触及肿块,CT提示右侧腋窝分叶状肿块,大小约5.9 cm×5.3 cm,环形明显强化,周围组织水肿,考虑转移可能。分别予双手及右侧腋窝3个部位β射线放疗,放疗10余次后患者病情进展,右上肢出现数个突出皮肤的结节,伴有破溃,右手背肿物及腋窝包块皮肤逐渐溃烂,伴有大量出血、脓性渗液及恶臭。患者右上肢疼痛剧烈,病情持续恶化,于2021年7月26日在家中死亡。
2 讨论本例患者在达沙替尼治疗期间出现鳞癌,推测两者之间可能存在某种联系。然而,患者长达16年的羟基脲治疗史不容忽视。羟基脲口服后在体内转化为自由基氮氧化物,通过被动扩散运输到细胞中,使核糖核苷酸还原酶灭活,细胞DNA合成抑制,细胞在S期死亡[1]。其广泛应用于骨髓增殖性肿瘤(包括慢性粒细胞性白血病,真性红细胞增多症和原发性血小板增多症)、镰状细胞贫血和银屑病。羟基脲的长期皮肤不良反应常被低估[2],包括皮肤萎缩、干燥和鳞屑、脱发、色素沉着、口腔炎或舌炎、肢端红斑、皮肌炎样病变、踝溃疡及皮肤肿瘤等[3]。1993年,Papi等[4]首次阐述羟基脲与鳞癌的相关性,之后有20多篇个案报道了羟基脲相关鳞癌。一项纳入1 881例Ph阴性骨髓增殖性肿瘤患者的巢式病例对照研究发现,与未暴露于羟基脲的患者相比,暴露于羟基脲者非黑色素瘤皮肤癌风险增加两倍(OR=2.28, 95%CI: 1.15~4.51)[5]。越来越多的证据表明,羟基脲在皮肤鳞癌进展中可能起作用。本例患者鳞癌的发生不能排除羟基脲的长期作用。
紫外线是皮肤鳞癌的一个重要危险因素。研究发现与防晒皮肤相比,阳光暴露皮肤中存在更多p53突变角质形成细胞[6],这种p53突变可能是光致癌的第一步。此外,慢性紫外线暴露可使p53突变角质形成细胞克隆性扩增,并且这种突变细胞较正常细胞更具生存优势,可导致光化性角化病[3],这是一种重要的癌前病变。云南地处高海拔低纬度地区,紫外线暴露量高。该患者也不排除紫外线因素的影响。
羟基脲与紫外线还可以产生协同作用。羟基脲在体内转化为自由基氮氧化物,可能在患者的上皮组织中诱导高氧化应激,与紫外线协同作用,导致DNA损伤和细胞膜脂质过氧化,改变信号转导途径[7]。此外,羟基脲通过抑制DNA合成,抑制紫外线辐射引起的DNA损伤后的核苷酸修复[1]。二者协同作用下,皮肤鳞癌的发生成为可能。
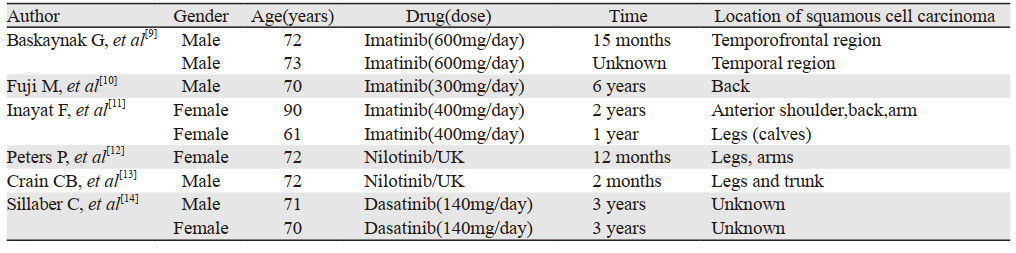
TKIs用于CML患者,显著提高了患者的无病生存期。然而,随着患者生存时间的延长,TKIs治疗的晚期并发症,例如第二肿瘤的发生引起了我们关注[8]。之前已有关于TKIs治疗期间发生皮肤鳞癌的报道,见表 1[9-14]。Gunnarsson等[15]发现TKIs治疗的CML患者发生第二种恶性肿瘤的风险较普通人群增加。
|
本例患者的皮肤鳞癌是在使用达沙替尼后1年内发生。达沙替尼是一种二代酪氨酸激酶抑制剂,常用于伊马替尼治疗失败后的CML患者,临床试验中显示出更高的反应率。Sillaber等[14]在一项达沙替尼治疗伊马替尼耐药CML患者的Ⅱ期临床研究中观察到2例发生皮肤鳞癌,1例发生基底细胞癌。虽然达沙替尼导致皮肤鳞癌的具体机制尚不清楚,但其免疫抑制作用可能发挥着重要作用。体外实验显示达沙替尼会抑制嗜碱性粒细胞IgE依赖的活化及T淋巴细胞TCR途径依赖的活化,同时还会抑制肥大细胞、嗜碱性粒细胞、T淋巴细胞、B淋巴细胞的LYN和BTK等免疫系统关键的靶分子。分析显示免疫缺陷是癌症发病率增加的一个重要原因[16],而达沙替尼相对伊马替尼和尼罗替尼具有更多的免疫抑制特性。达沙替尼的免疫抑制作用使得机体不能及时识别并清除紫外线导致的角质形成细胞突变和DNA损伤,因此达沙替尼与紫外线也可能产生协同作用,使鳞癌的发生成为可能。
同时,有相反的研究表明达沙替尼可诱导皮肤鳞癌消退[17]或促进鳞癌细胞凋亡[18]。体外试验显示,达沙替尼抑制头颈部鳞癌细胞的增殖、迁移和侵袭[19],但是在进一步的头颈部鳞癌临床试验中,达沙替尼并未显示出显著的疗效[20]。因此,达沙替尼与鳞癌的关系目前尚不能确定。
本病例中,患者CML的病程长,由于疗效不满意而多次换药。与既往病例报道中大多数患者不同,本例继发的皮肤鳞癌出现后快速进展并且可能转移,患者最终死于鳞癌。在本例患者中,羟基脲、紫外线、伊马替尼、尼罗替尼、达沙替尼等都可能与皮肤鳞癌的发生有关,需引起临床医生注意。
作者贡献:
李会婷:收集信息,撰写论文
蔡梅:诊治及总结
毕慧:审阅全文,撰写论文
| [1] |
Iancu GM, Ocneanu A, Rotaru M. Hydroxyurea-induced superinfected ulcerations: Two case reports and review of the literature[J]. Exp Ther Med, 2020, 20(6): 191. |
| [2] |
Griesshammer M, Wille K, Sadjadian P, et al. A review of hydroxyurea-related cutaneous adverse events[J]. Expert Opin Drug Saf, 2021, 20(12): 1515-1521. DOI:10.1080/14740338.2021.1945032 |
| [3] |
Cantisani C, Kiss N, Naqeshbandi AF, et al. Nonmelanoma skin cancer associated with Hydroxyurea treatment: Overview of the literature and our own experience[J]. Dermatol Ther, 2019, 32(5): e13043. |
| [4] |
Papi M, Didona B, Depità O, et al. Multiple skin tumors on light-exposed areas during long-term treatment with hydroxyurea[J]. J Am Acad Dermatol, 1993, 28(3): 485-486. DOI:10.1016/S0190-9622(08)81758-6 |
| [5] |
Barbui T, Ghirardi A, Masciulli A, et al. Second cancer in Philadelphia negative myeloproliferative neoplasms (MPN-K). A nested case-control study[J]. Leukemia, 2019, 33(8): 1996-2005. DOI:10.1038/s41375-019-0487-8 |
| [6] |
Piipponen M, Riihilä P, Nissinen L, et al. The Role of p53 in Progression of Cutaneous Squamous Cell Carcinoma[J]. Cancers (Basel), 2021, 13(18): 4507. DOI:10.3390/cancers13184507 |
| [7] |
Sanchez-Palacios C, Guitart J. Hydroxyurea-associated squamous dysplasia[J]. J Am Acad Dermatol, 2004, 51(2): 293-300. DOI:10.1016/j.jaad.2003.11.059 |
| [8] |
Verma D, Kantarjian H, Strom SS, et al. Malignancies occurring during therapy with tyrosine kinase inhibitors (TKIs) for chronic myeloid leukemia (CML) and other hematologic malignancies[J]. Blood, 2011, 118(16): 4353-4358. DOI:10.1182/blood-2011-06-362889 |
| [9] |
Baskaynak G, Kreuzer KA, Schwarz M, et al. Squamous cutaneous epithelial cell carcinoma in two CML patients with progressive disease under imatinib treatment[J]. Eur JHaematol, 2003, 70(4): 231-234. DOI:10.1034/j.1600-0609.2003.00044.x |
| [10] |
Fujii M, Iwasaki T, Takahashi I, et al. Squamous cell carcinoma in a chronic myelogenous leukemia patient treated with imatinib mesylate[J]. J Dermatol, 2015, 42(3): 338-339. DOI:10.1111/1346-8138.12751 |
| [11] |
Inayat F, Saif MW. New Drug and Possible New Toxicity- Squamous Cell Carcinoma Following Imatinib in Patients with Gastrointestinal Stromal Tumors[J]. Anticancer Res, 2016, 36(11): 6201-6204. DOI:10.21873/anticanres.11214 |
| [12] |
Peters P, Rabbolini D, Sinnya S, et al. Multiple squamous cell carcinomas following introduction of nilotinib[J]. Clin Exp Dermatol, 2014, 39(7): 791-794. DOI:10.1111/ced.12388 |
| [13] |
Crain CB, Winsett FT, Woolridge KF, et al. Eruption of squamous cell carcinomas after beginning nilotinib therapy[J]. Dermatol Online J, 2020, 26(6): 13030/qt35b1q4vf. |
| [14] |
Sillaber C, Herrmann H, Bennett K, et al. Immunosuppression and atypical infections in CML patients treated with dasatinib at 140 mg daily[J]. Eur J Clin Invest, 2009, 39(12): 1098-1109. DOI:10.1111/j.1365-2362.2009.02206.x |
| [15] |
Gunnarsson N, Stenke L, Höglund M, et al. Second malignancies following treatment of chronic myeloid leukaemia in the tyrosine kinase inhibitor era[J]. Br J Haematol, 2015, 169(5): 683-688. DOI:10.1111/bjh.13346 |
| [16] |
Grulich AE, van Leeuwen MT, Falster MO, et al. Incidence of cancers in people with HIV/AIDS compared with immunosuppressed transplant recipients: a meta-analysis[J]. Lancet, 2007, 370(9581): 59-67. DOI:10.1016/S0140-6736(07)61050-2 |
| [17] |
Yang X, Daifallah AEM, Shankar S, et al. Topical kinase inhibitors induce regression of cutaneous squamous cell carcinoma[J]. Exp Dermatol, 2019, 28(5): 609-613. DOI:10.1111/exd.13902 |
| [18] |
Farshchian M, Nissinen L, Grénman R, et al. Dasatinib promotes apoptosis of cutaneous squamous carcinoma cells by regulating activation of ERK1/2[J]. Exp Dermatol, 2017, 26(1): 89-92. DOI:10.1111/exd.13109 |
| [19] |
Yang Z, Liao J, Carter-cooper BA, et al. Regulation of cisplatin-resistant head and neck squamous cell carcinoma by the SRC/ETS-1 signaling pathway[J]. BMC Cancer, 2019, 19(1): 485. DOI:10.1186/s12885-019-5664-7 |
| [20] |
Brooks HD, Glisson BS, Bekele BN, et al. Phase 2 study of dasatinib in the treatment of head and neck squamous cell carcinoma[J]. Cancer, 2011, 117(10): 2112-2119. DOI:10.1002/cncr.25769 |
 2022, Vol. 49
2022, Vol. 49


