文章信息
- Tspan8基因敲除联合安罗替尼对结肠癌SW480细胞增殖、迁移、侵袭和凋亡的影响
- Effects of Tspan8 Gene Knockout Combined with Anlotinib on Proliferation, Migration, Invasion and Apoptosis of Colon Cancer SW480 Cells
- 肿瘤防治研究, 2022, 49(10): 1028-1036
- Cancer Research on Prevention and Treatment, 2022, 49(10): 1028-1036
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0198
- 收稿日期: 2022-03-03
- 修回日期: 2022-07-05
2. 730000 兰州,兰州大学第二医院消化内科
2. Department of Gastroenterology, The Second Hospital of Lanzhou University, Lanzhou 730000, China
结肠癌是结肠上皮来源的消化道恶性肿瘤,好发于直肠与乙状结肠交界处,2020年全球结肠癌发病率和死亡率分别位居全部肿瘤的第四位和第五位[1]。虽然其筛查和治疗手段迅速发展,但由于肿瘤转移和治疗耐药,使晚期复发性、转移性、难治性结肠癌患者的死亡率居高不下,5年生存率不超过17%[1],因此,寻找更为有效的治疗方案成为研究热点。近年来,靶向药物治疗为结肠癌患者带来了新的希望,现已研制出数种针对血管内皮细胞生长因子受体(vascular endothelial growth factor receptor, VEGFR)、血小板衍生生长因子受体(platelet derived growth factor receptor, PDGFR)、成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR)及c-Kit等靶点的酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKI)。安罗替尼(anlotinib)作为我国自主研发的小分子多靶点TKI,可抑制肿瘤血管生成和肿瘤细胞的生长及转移[2-3],因具有可控的不良反应、较长的半衰期及广谱的抗肿瘤活性等特点[4],现已被批准用于非小细胞肺癌、小细胞肺癌、软组织肉瘤的三线治疗[5-8]。研究发现,安罗替尼在结肠癌治疗中同样安全有效[9-10]。与瑞戈非尼和呋喹替尼相比,安罗替尼不仅疗效相当,且不良反应更小[11]。表明安罗替尼有望成为结肠癌患者的新选择。
Tspan8是四跨膜蛋白超家族(transmembrane 4 super family, TM4SF)中的一员,对肿瘤细胞的恶性生物学行为具有极其重要的影响。研究发现Tspan8主要高表达于消化系统恶性肿瘤,如结直肠癌中,其表达水平与肿瘤的转移潜能呈正相关,而与患者的生存预后呈负相关[12-16]。提示Tspan8很有可能成为结肠癌治疗的潜在靶点。
本实验以结肠癌SW480细胞为研究对象,探讨安罗替尼联合Tspan8敲除对SW480细胞增殖、迁移、侵袭和凋亡的影响。
1 材料与方法 1.1 材料人结肠癌SW480细胞、HEK293T细胞购自ATCC公司。安罗替尼(10 mg)购自江苏正大天晴公司;高糖DMEM培养基购自上海源培公司;胰蛋白酶、青霉素-链霉素-庆大霉素混合溶液、结晶紫和MTT检测试剂盒购自北京Solarbio公司;FBS购自美国ABW公司;DMSO购自德国BioFroxx公司;Transwell小室购自美国Corning公司;Matrigel基质胶和FITC偶联Annexin-V凋亡检测试剂盒购自美国BD公司;RIPA裂解液购自上海雅酶公司;SDS-PAGE蛋白上样缓冲液购自上海Beyotime公司;多聚甲醛固定液和BCA蛋白浓度测定试剂盒购自上海Biosharp公司;Anti-Tspan-8抗体购自美国Abcam公司;β-TubulinMouse mAb购自上海Abmart公司;Goat Anti-Rabbit IgG(H+L)购自美国Proteintech公司;去内毒素质粒快速小提试剂盒、DNA凝胶回收试剂盒、Gibson无缝连接试剂盒均购自兰州华帜天成公司;限制性内切酶BsmBI购自北京NEB有限公司;嘌呤霉素购自美国Gibco公司;LipofectamineTM2000转染试剂盒购自美国Invitrogen公司;聚凝胺购自上海经科公司。
CO2恒温培养箱、多功能连续光谱(Thermo Fisher)为美国Thermo Scientific Forma公司产品;倒置相差显微镜AE2000为厦门Motic公司产品;倒置荧光显微镜MF52为广州明美光电公司产品;正置荧光显微镜BX53+DP74为日本奥林巴斯公司产品;医用离心机80-2为苏州新康医疗器械公司产品;高速冷冻型微量离心机D3024R为美国Scilogex公司产品;多功能酶标仪SpectraMAX M2为上海Molecular Devices公司产品;流式细胞分析仪CytoFLEX为美国Beckman公司产品;化学发光成像系统JS-M6P为上海培清公司产品。全自动凝胶成像分析系统ChampGel6000、迷你型化学发光荧光成像分析系统MiniChemi 610 plus为北京赛智公司产品。
1.2 方法 1.2.1 细胞培养所有细胞均培养于37℃、5%CO2饱和湿度的细胞培养箱中。高糖DMEM培养基中添加10%FBS和1%三抗配制成完全培养基。0.5%胰蛋白酶消化传代。所有实验均采用对数生长期细胞。
1.2.2 Tspan8基因敲除 1.2.2.1 Tspan8敲除质粒的构建在NCBI网站(https://www.ncbi.nlm.nih.gov/)查询并拷贝Tspan8的基因序列(Gene ID: 7103),使用规律呈簇的间隔短回文重复/CRISPR相关核酸酶9(clustered regularly interspaced short palindromic repeat/CRISPR-associated nuclease 9, CRISPR/Cas9)在线设计工具网站(http://crispr.mit.edu),设计针对Tspan8的3个单向导RNA(single guide RNA, sgRNA)序列,见表 1。根据sgRNA序列,得到三对单链sgRNA引物,见表 2。将其退火形成二聚体,通过Gibson无缝连接试剂盒与经限制性内切酶BsmBⅠ酶切的lenti-CRISPR v2载体连接。将连接产物转化到stbl3感受态细胞中,经氨苄青霉素抗性平板筛选,提取质粒后进行单克隆测序。
取HEK293T细胞接种于培养皿,按照LipofectamineTM2000转染试剂盒说明书进行转染,36 h后离心取上清液备用。
1.2.2.3 Tspan8基因敲除细胞株的构建取SW480细胞接种于6孔板,加入1 ml的慢病毒毒液和2 μl的聚凝胺(8 mg/ml),48 h后用嘌呤霉素(2 μg/ml)筛选,7 d后收集细胞,提取蛋白进行敲除效果验证。
1.2.2.4 Western blot法检测Tspan8基因敲除效果收集待测细胞,加入RIPA裂解液冰上裂解,12 000 r/min,4℃离心15 min,取少量上清液,按照说明书进行各组蛋白浓度测定。配置10%SDS-PAGE电泳,PVDF膜进行转膜,5%脱脂牛奶封闭,TBST洗膜,一抗(Anti-Tspan-8抗体、β-TubulinMouse mAb)4℃孵育过夜,次日加入二抗(Goat Anti-Rabbit IgG(H+L))室温孵育1 h,TBST洗膜,涂匀ECL发光液,并用JS-M6P化学发光成像系统进行显影。Image J软件分析各蛋白条带的灰度值,Tspan8表达水平=Tspan8条带灰度值/内参条带灰度值。
1.2.3 IC50的测定取SW480细胞,以5×104个/孔接种于96孔板,贴壁后用安罗替尼(0、0.25、0.5、1、2、4、8、16、32、64和128 μmol/L)处理(24、48和72 h),每孔加入20 μl MTT(5 mg/ml)孵育4 h,150 μl DMSO震荡15 min,在570 nm波长的多功能酶标仪中测量各孔的光密度(optical density, OD)值,并计算半数抑制浓度(half maximal inhibitory concentration, IC50)。细胞增殖抑制率(%)=[(1-OD值实验组)/OD值对照组]×100%,每组设置5个复孔。
1.2.4 实验分组对照组(SW480细胞用完全培养基培养)、安罗替尼组(SW480细胞用14 μmol/L安罗替尼处理)、Tspan8敲除组(SW480-KO-Ⅲ细胞用完全培养基培养)和联合组(SW480-KO-Ⅲ细胞用14 μmol/L安罗替尼处理)。
1.2.5 细胞增殖实验检测细胞增殖能力细胞以5×104个/孔接种于96孔板,贴壁后根据实验分组进行处理,采用MTT法测定0、1、2、3和4 d各组OD值,并绘制生长曲线,每组设置5个复孔。
1.2.6 克隆形成实验检测细胞成活能力细胞以2.5×106个/孔接种于6孔板,贴壁后根据实验分组处理24 h,后消化重悬细胞并以1×103个/孔接种于新的6孔板孵育,直至出现肉眼可见的细胞集落时终止培养,每孔加入4%多聚甲醛固定液1.5 ml固定30 min,0.1%结晶紫1.5 ml染色30 min后洗涤、风干、拍照,并对50个细胞以上的细胞集落进行计数,每组设置3个复孔。
1.2.7 划痕实验检测细胞迁移能力细胞以1×106个/孔接种于6孔板,贴壁后用200 μl枪头进行划痕,根据实验分组处理细胞0、24和48 h,并用倒置荧光显微镜(×100倍镜)观察和拍摄,Image J软件测定划痕宽度,并计算细胞划痕迁移率。细胞划痕迁移率=[(0 h的划痕宽度-24或48 h的划痕宽度)/0 h的划痕宽度]×100%。各组设置3个复孔。
1.2.8 Transwell小室法检测细胞迁移和侵袭能力根据实验分组制备单细胞悬液(均不含FBS),以8×105个/孔接种到上室,下室加入600 μl含15%FBS的完全培养基,48 h后用棉签擦去上室残留细胞,4%多聚甲醛固定液600 μl固定30 min,0.1%结晶紫600 μl染色30 min后洗涤、风干,在正置荧光显微镜(×100倍镜)随机选取5个视野观察细胞形态并计数。
Transwell侵袭实验:提前将Matrigel基质胶从-20℃冰箱取至4℃冰箱备用,于冰上用高糖DMEM培养基以1:50比例配制成稀释液,取100 μl稀释液包被到上室底面,待基质胶凝固后,制备单细胞悬液并以1.6×106个/孔接种于上室,后续操作同上述Transwell迁移实验。
1.2.9 流式细胞术检测细胞凋亡水平细胞以2.5×106个/孔接种于6孔板,贴壁后根据实验分组处理48 h,按照FITC偶联Annexin-V凋亡检测试剂盒说明书进行操作,并于1 h内上机检测。
1.2.10 Western blot法检测安罗替尼对SW480细胞Tspan8表达水平的影响取SW480细胞,以2.5×106个/孔接种到6孔板中,贴壁后分别加入安罗替尼(14 μmol/L)和完全培养基,48 h后检测Tspan8的表达水平,方法同1.2.2.4。
1.3 统计学方法应用Image J软件进行图像分析,实验数据以均数±标准差表示;采用SPSS25.0和GraphPad Prism 8软件进行统计学分析;多组比较采用单因素方差分析,两两比较采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 Tspan8敲除质粒的构建挑选转染成功的耐药阳性克隆菌株,菌液PCR鉴定后扩大培养,提取阳性单克隆质粒lentil CRISPR-sgTspan8-Ⅰ、lentil CRISPR-sgTspan8-Ⅱ和lentil CRISPR-sgTspan8-Ⅲ进行测序,结果见图 1。说明3条目的Tspan8 sgRNA序列分别已经正确插入载体,证明用于Tspan8基因敲除的3个重组质粒构建成功。
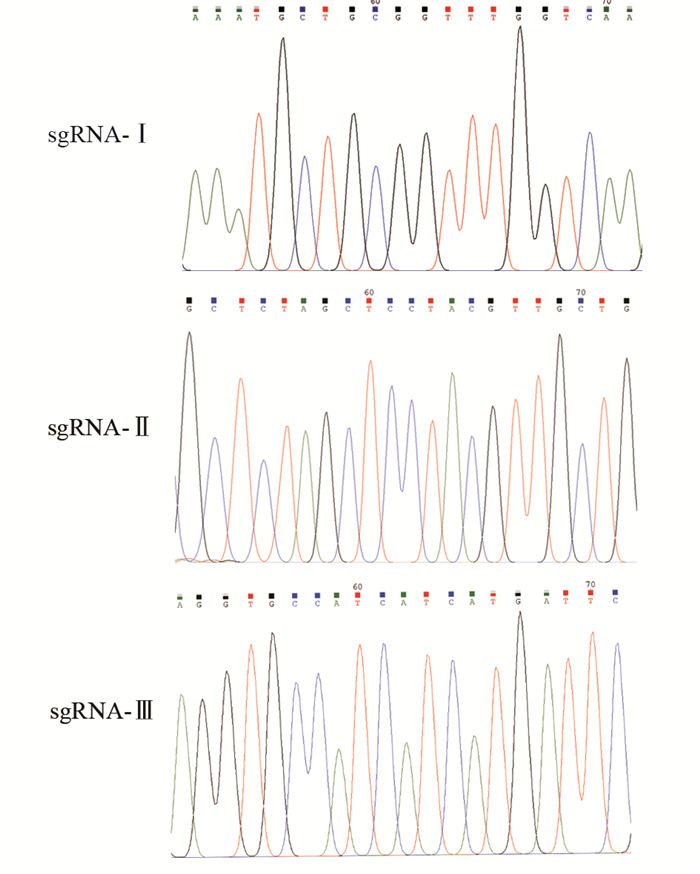
|
| 图 1 三种Tspan8敲除质粒的序列比对图及测序峰图 Figure 1 Sequence alignment and sequencing peaks of three Tspan8 knockout plasmids |
Western blot结果显示,结肠癌SW480-WT、SW480-KO-Ⅰ、SW480-KO-Ⅱ和SW480-KO-Ⅲ细胞中Tspan8的表达水平分别为0.89±0.06、0.78±0.02、0.42±0.04和0.17±0.03。与SW480-WT、SW480-KO-Ⅰ、SW480-KO-Ⅱ细胞相比,SW480-KO-Ⅲ细胞中Tspan8的表达量显著降低,差异有统计学意义(P < 0.01),见图 2。因此选择敲除效率最高的结肠癌SW480-KO-Ⅲ细胞进行后续实验。
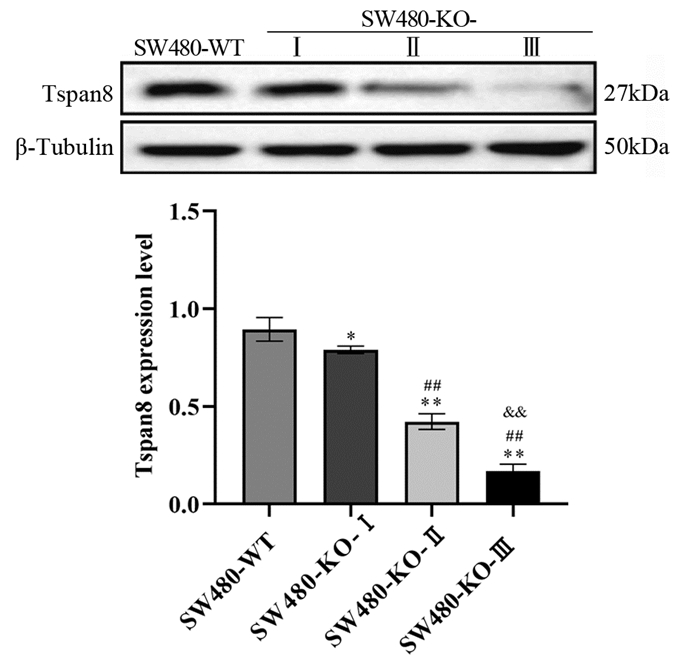
|
| *: P < 0.05, **: P < 0.01, compared with SW480-WT group; ##: P < 0.01, compared with SW480-KO-Ⅰgroup; & & : P < 0.01, compared with SW480-KO-Ⅱgroup. 图 2 Western blot法检测慢病毒感染结肠癌SW480细胞后Tspan8的表达 Figure 2 Western blot was used to detect Tspan8 expression in colon cancer SW480 cells infected with lentivirus |
MTT法结果显示,与0 μmol/L组比较,不同浓度的安罗替尼均能抑制结肠癌SW480细胞的增殖(均P < 0.01),细胞增殖抑制率呈浓度-时间依赖性,见图 3。安罗替尼对结肠癌SW480细胞24、48和72 h的IC50值分别为25.24±6.16、14.41±3.58和8.41±1.97 μmol/L。因后续实验时间需要观察48 h,故而选择14 μmol/L为实验浓度。
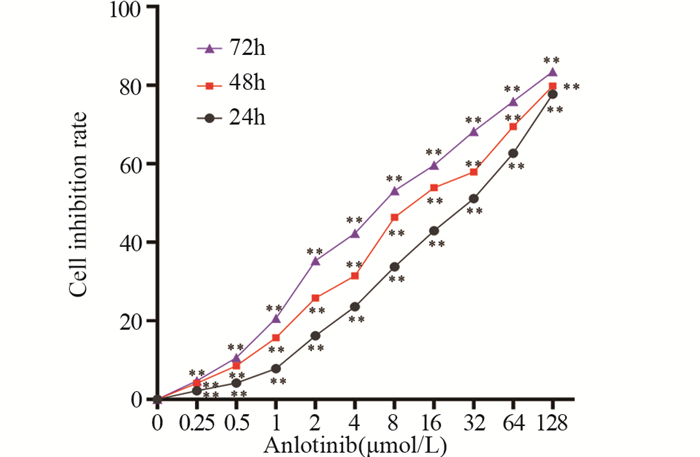
|
| **: P < 0.01, compared with the previous action time at the same action concentration or compared with the previous action concentration at the same action time. 图 3 不同浓度和不同时间安罗替尼作用后对结肠癌SW480细胞抑制率 Figure 3 Inhibitory rate of colon cancer SW480 cells treated with different anlotinib concentrations at different times |
进一步检测各组结肠癌细胞在不同时间(0、1、2、3和4 d)的增殖能力发现,与对照组相比,安罗替尼组、Tspan8敲除组和联合组在1、2、3和4 d的细胞增殖速度明显下降(P < 0.01);且联合组细胞在2、3和4 d的增殖速度明显低于安罗替尼组(P < 0.01),但在1 d时两组差异无统计学意义(P > 0.05),而联合组细胞的增殖速度整体低于Tspan8敲除组,但除了在1 d和2 d时差异有统计学意义以外(P < 0.01),3 d和4 d两组比较差异无统计学意义(P > 0.05),见图 4。
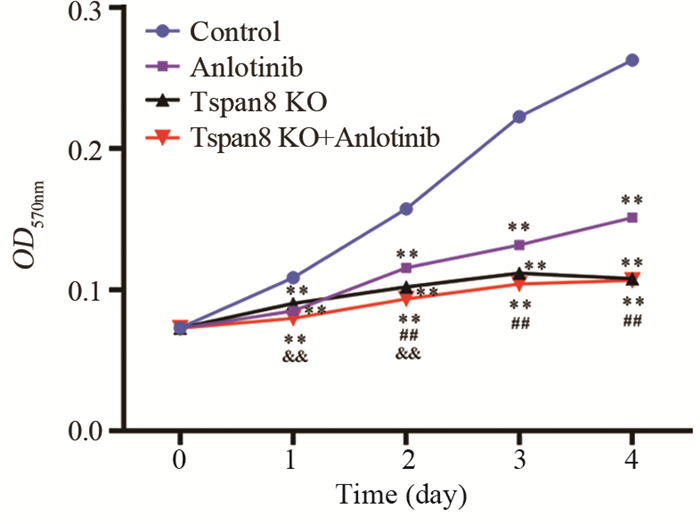
|
| **: P < 0.01, compared with control group; ##: P < 0.01, compared with anlotinib group; & & : P < 0.01, compared with Tspan8 KO group. 图 4 各组结肠癌SW480细胞的生长曲线 Figure 4 Growth curves of colon cancer SW480 cells in each group |
克隆形成实验结果显示,对照组、安罗替尼组、Tspan8敲除组和联合组的克隆形成数分别为84.33±7.23、47.33±15.04、10.00±6.08和1.33±0.58。与对照组相比,安罗替尼组、Tspan8敲除组和联合组的克隆形成数目明显减少,差异有统计学意义(P < 0.01),且联合组的克隆形成数目整体少于安罗替尼组(P < 0.01)和Tspan8敲除组(P > 0.05),见图 5。结果表明安罗替尼联合Tspan8敲除对结肠癌SW480细胞的克隆形成能力具有明显抑制作用。
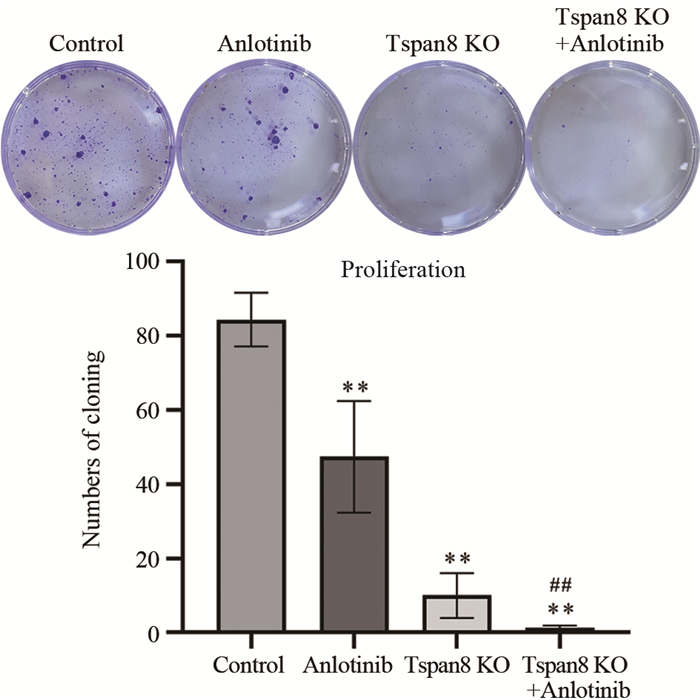
|
| **: P < 0.01, compared with control group; ##: P < 0.01, compared with anlotinib group. 图 5 各组克隆形成实验结果 Figure 5 Results of clonal formation experiment in each group |
对照组、安罗替尼组、Tspan8敲除组和联合组的24 h细胞划痕迁移率分别为(20.92±8.30)%、(13.76±5.77)%、(8.62±1.97)%和(7.47±3.82)%;48 h细胞划痕迁移率分别为(48.40±11.98)%、(20.39±5.17)%、(15.94±3.27)%和(13.01±4.85)%。与对照组相比,安罗替尼组、Tspan8敲除组和联合组24 h和48 h的细胞划痕迁移率均明显减小,差异有统计学意义(P < 0.01)。且联合组24 h和48 h的细胞划痕迁移率明显低于安罗替尼组(P < 0.01)和Tspan8敲除组(P < 0.01),见图 6。结果表明安罗替尼联合Tspan8敲除对结肠癌SW480细胞的迁移能力具有明显抑制作用。
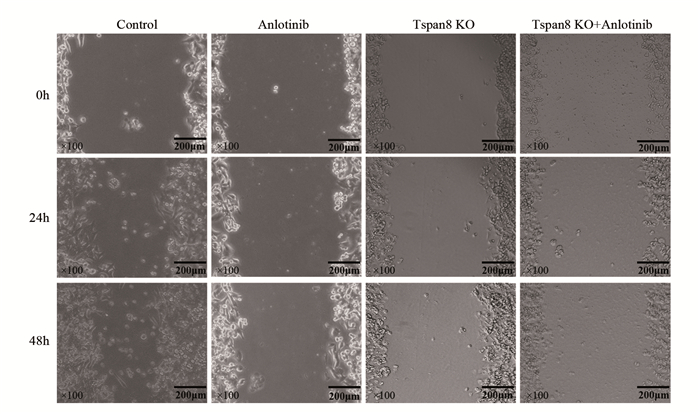
|
| 图 6 各组划痕修复实验结果 Figure 6 Results of scratch repair experiment in each group |
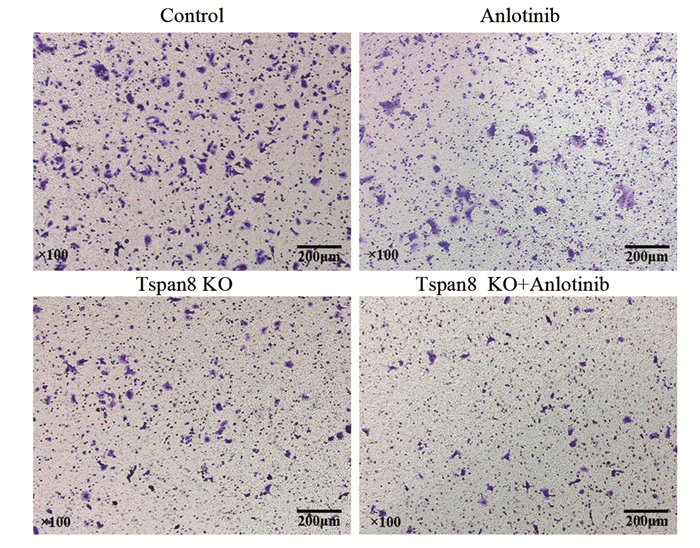
对照组、安罗替尼组、Tspan8敲除组和联合组的迁移细胞数分别为72.00±13.07、60.04±15.27、45.33±8.47和21.09±7.25个。与对照组相比,安罗替尼组、Tspan8敲除组和联合组的迁移细胞数明显减少,差异有统计学意义(P < 0.01),且联合组的迁移细胞数明显少于安罗替尼组(P < 0.01)和Tspan8敲除组(P < 0.01),见图 7。结果表明安罗替尼联合Tspan8敲除对结肠癌SW480细胞的迁移能力具有明显抑制作用。

|
| 图 7 各组Transwell小室迁移结果 Figure 7 Results of Transwell compartment migration in each group |
对照组、安罗替尼组、Tspan8敲除组和联合组的侵袭细胞数分别为52.14±8.35、24.07±4.36、21.26±6.43和14.31±4.33个。与对照组相比,安罗替尼组、Tspan8敲除组和联合组的侵袭细胞数明显减少,差异有统计学意义(P < 0.01),且联合组的侵袭细胞数明显少于安罗替尼组(P < 0.01)和Tspan8敲除组(P < 0.01),见图 8。结果表明安罗替尼联合Tspan8敲除对结肠癌SW480细胞的侵袭能力具有明显抑制作用。
|
| 图 8 各组Transwell小室侵袭结果 Figure 8 Results of Transwell compartment invasion in each group |
对照组、安罗替尼组、Tspan8敲除组和联合组细胞的早期凋亡率分别为(2.42±0.96)%、(6.48±1.51)%、(7.48±0.35)%和(17.78±3.00)%。与对照组相比,安罗替尼组、Tspan8敲除组和联合组细胞的早期凋亡率明显提高,差异有统计学意义(P < 0.01),且联合组的早期凋亡率明显高于安罗替尼组(P < 0.01)和Tspan8敲除组(P < 0.01),见图 9。结果表明安罗替尼联合Tspan8敲除能够明显促进结肠癌SW480细胞发生凋亡。
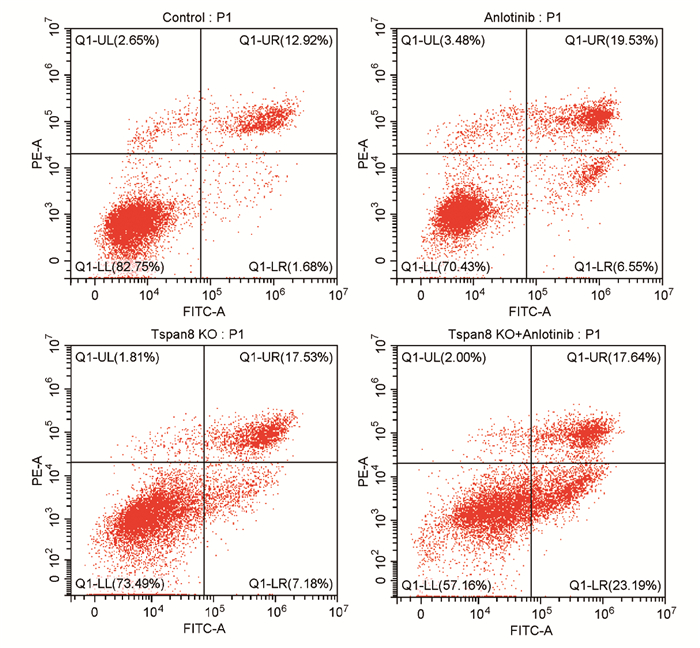
|
| 图 9 各组流式细胞术结果 Figure 9 Results of flow cytometry in each group |
对照组和安罗替尼组结肠癌SW480细胞中Tspan8蛋白的表达水平分别为0.92±0.01和0.49±0.15。与对照组相比,安罗替尼组Tspan8蛋白的表达量显著降低,差异有统计学意义(P < 0.01),见图 10。结果表明安罗替尼作用后可明显抑制结肠癌SW480细胞中Tspan8的表达。
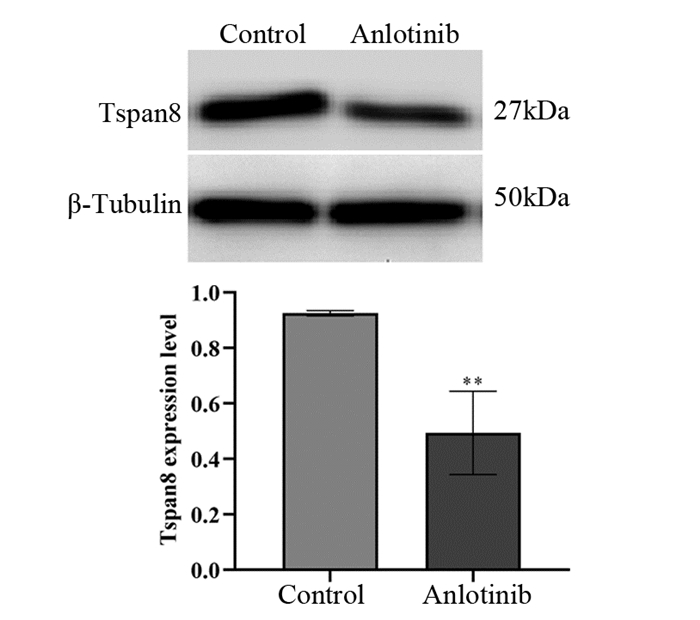
|
| **: P < 0.01, compared with control group. 图 10 Western blot法检测对照组和安罗替尼组SW480细胞中Tspan8的表达水平 Figure 10 Western blot was used to detect the expression of Tspan8 in SW480 cells of control group and anlotinib group |
结肠癌的临床表现不典型,大多数病例被发现时已处于中晚期。目前结肠癌临床治疗采取多学科综合治疗模式,强调个体化原则,中晚期以手术为主,辅以放化疗、靶向治疗等[17-18]。然而由于手术效果不满意、放化疗敏感度差等因素,导致结肠癌患者的预后较差,严重危害着人类健康。因此,寻找更为有效的治疗方案迫在眉睫。
研究发现,安罗替尼可通过作用于VEGFR、PDGFR、FGFR、c-Kit等靶点,阻断PI3K/AKT、AKT/ERK、EGFR/MET/ABCB1以及VEGFR/JAK2/STAT3等信号通路,抑制结肠癌细胞的增殖、迁移、侵袭和血管生成,并诱导结肠癌细胞凋亡,从而发挥抗增殖、抗转移、抗血管生成以及抗多重耐药等作用[19-22]。Tspan8作为肿瘤相关抗原,在肿瘤组织和肿瘤细胞中的表达水平明显高于正常组织和正常细胞,上调Tspan8的表达可明显增强肿瘤细胞的生长、转移、放化疗抵抗,而外源性沉默Tspan8的表达,可显著抑制肿瘤细胞的增殖生长、迁移侵袭,并增加肿瘤细胞对放化疗的敏感度。以上作用主要与MAPK/ERK/MEK、AKT/ERK、PI3K/AKT以及MAPK/AKT等信号通路相关[23-27]。根据上述研究结果,安罗替尼和Tspan8敲除均具有显著的抗肿瘤作用,且通过相似信号通路产生影响。所以我们猜想,安罗替尼与Tspan8敲除两者联合可能具有协同抑制肿瘤细胞活性的能力,但目前尚无相关研究数据支持。因而,本实验探究了安罗替尼与Tspan8敲除联合作用对结肠癌SW480细胞恶性生物学行为的影响,结果显示,与对照组比,安罗替尼或Tspan8敲除均能够明显抑制结肠癌SW480细胞的增殖、克隆形成、迁移、侵袭能力,诱导结肠癌SW480细胞发生凋亡,且两者联合时上述作用更强。此外,与安罗替尼单独作用相比,联合组细胞的早期凋亡率明显提高,细胞增殖速度、克隆形成数目、划痕愈合率和Transwell迁移及侵袭数目显著减小。而与Tspan8敲除单独作用相比,联合组细胞仅在早期凋亡、划痕愈合、Transwell迁移和侵袭方面的差异明显,而在细胞增殖方面,如生长曲线和克隆形成,虽然联合组的总体水平低下,但两者差异无统计学意义。这可能与Tspan8敲除明显抑制结肠癌细胞的增殖有关。
本研究还发现,与安罗替尼单独作用相比,Tspan8敲除组的结肠癌SW480细胞在增殖、克隆形成、迁移侵袭方面的整体水平较低,而凋亡水平略高。结合安罗替尼作用后,能够明显降低结肠癌SW480细胞中Tspan8的表达水平。故推测Tspan8的表达可能受到安罗替尼的影响。根据现有研究证据,Tspan8的转录与ERK/MEK信号通路的激活有关[28],而安罗替尼可通过抑制ERK/MEK信号通路发挥抑癌作用。所以此表型很有可能与ERK/MEK信号通路相关。
结合上述结果,我们推测安罗替尼联合Tspan8敲除主要通过抑制ERK/MEK信号通路发挥协同抗结肠癌作用,且安罗替尼也可通过抑制ERK/MEK通路影响Tspan8的表达,具体机制尚待进一步研究证实。
综上所述,本实验不仅首次证明了安罗替尼联合Tspan8敲除具有协同抑制结肠癌SW480增殖转移的作用,而且还首次发现了安罗替尼可明显降低结肠癌SW480细胞中Tspan8的表达水平,同时探讨了其可能相关的机制。后续本课题组将进行安罗替尼联合Tspan8敲除在结肠癌SW480细胞中具体机制、信号通路及动物实验方面的研究,以期为结肠癌临床治疗提供一个新的思路。
作者贡献:
谢转红:实验设计与实施、数据采集、统计分析及解释、文章撰写
许云鹏:实验设计与实施、数据采集
马珲敏:实验设计
王祥:实验设计、经费支持、文章修订和审校
| [1] |
SungH, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Lin B, Song X, Yang D, et al. Anlotinib inhibits angiogenesis via suppressing the activation of VEGFR2, PDGFRβ and FGFR1[J]. Gene, 2018, 654: 77-86. DOI:10.1016/j.gene.2018.02.026 |
| [3] |
Xie C, Wan X, Quan H, et al. Preclinical characterization of anlotinib, a highly potent and selective vascular endothelial growth factor receptor-2 inhibitor[J]. Cancer Sci, 2018, 109(4): 1207-1219. DOI:10.1111/cas.13536 |
| [4] |
Sun Y, Ni uW, Du F, et al. Safety, pharmacokinetics, and antitumor properties of anlotinib, an oral multi-target tyrosine kinase inhibitor, in patients with advanced refractory solid tumors[J]. J Hematol Oncol, 2016, 9(1): 105. DOI:10.1186/s13045-016-0332-8 |
| [5] |
Zhou M, Chen XY, Zhang H, et al. China National Medical Products Administration approval summary: anlotinib for the treatment of advanced non-small cell lung cancer after two lines of chemotherapy[J]. Cancer Commun(Lond), 2019, 39(1): 36. |
| [6] |
Han B, Li K, Wang Q, et al. Effect of Anlotinib as a Third-Line or Further Treatment on Overall Survival of Patients With Advanced Non-Small Cell Lung Cancer The ALTER 0303 Phase 3 Randomized Clinical Trial[J]. JAMA Oncol, 2018, 4(11): 1569-1575. DOI:10.1001/jamaoncol.2018.3039 |
| [7] |
Cheng Y, Wang Q, Li K, et al. Anlotinib as Third-Line or Further-Line Treatment in Relapsed SCLC: A Multicenter, Randomized, Double-Blind Phase 2 Trial[J]. J Thorac Oncol, 2018(13:10S): S351-S352. |
| [8] |
Chi Y, Fang Z, Hong X, et al. Safety and efficacy of anlotinib a multikinase angiogenesis inhibitor, in patients with refractory metastatic soft tissue sarcoma[J]. Clin Cancer Res, 2018, 24(21): 5233-5238. DOI:10.1158/1078-0432.CCR-17-3766 |
| [9] |
李娜, 黄琦, 张明军, 等. 安罗替尼三线治疗晚期转移性结直肠癌疗效分析[J]. 中华医学杂志, 2019, 99(36): 2844-2847. [Li N, Huang Q, Zhang MJ, et al. Efficacy and safety of Anlotinib as a third-line chemotherapy for metastatic colorectal cancer[J]. Zhonghua Yi Xue Za Zhi, 2019, 99(36): 2844-2847. DOI:10.3760/cma.j.issn.0376-2491.2019.36.010] |
| [10] |
Chi Y, Shu Y, Ba Y, et al. Anlotinib monotherapy for refractory metastatic colorectal cancer: a double-blinded, placebo controlled, randomized phase Ⅲ trial (alter0703)[J]. Oncologist, 2021, 26(10): e1693-e1703. DOI:10.1002/onco.13857 |
| [11] |
Cheng Y, Du FC, Fang FQ, et al. Third-line treatment for metastatic colorectal cancer: anlotinib is superior to chemotherapy and similar to fruquintinib or regorafenib[J]. Neoplasma, 2020, 67(6): 1384-1390. |
| [12] |
Zhan ZY, Zhong LX, Feng M, et al. A Positive Tetraspanin 8 (TSPAN8)/β-Catenin Regulatory Loop Enhances the Stemness of Colorectal Cancer Cells[J]. Med Sci Monit, 2019, 25: 9594-9601. DOI:10.12659/MSM.919749 |
| [13] |
Greco C, Bralet MP, Ailane N, et al. E-cadherin/p120-catenin and tetraspanin Co-029 cooperate for cell motility control in human colon carcinoma[J]. Cancer Res, 2010, 70(19): 7674-7683. DOI:10.1158/0008-5472.CAN-09-4482 |
| [14] |
Zhu Y, Ailane N, Sala-Valdés M, et al. Multi-factorial modulation of colorectal carcinoma cells motility-partial coordination by the tetraspanin Co-029/tspan8[J]. Oncotarget, 2017, 8(16): 27454-27470. DOI:10.18632/oncotarget.16247 |
| [15] |
Guo QS, Xia B, Zhang F, et al. Tetraspanin CO-029 inhibits colorectal cancer cell movement by deregulating cell-matrix and cell-cell adhesions[J]. PLoS One, 2012, 7(6): e38464. DOI:10.1371/journal.pone.0038464 |
| [16] |
Zhang HS, Liu HY, Zhou Z, et al. TSPAN8 promotes colorectal cancer cell growth and migration in LSD1-dependent manner[J]. Life Sci, 2020, 241: 117114. DOI:10.1016/j.lfs.2019.117114 |
| [17] |
中华人民共和国国家卫生健康委员会. 中国结直肠癌诊疗规范(2020版)[J]. 中华消化外科杂志, 2020, 19(6): 563-588. [National Health Commission of the People's Republic of China. Chinese protocol of diagnosis and treatment of colorectal cancer (2020 edition)[J]. Zhonghua Xiao Hua Wai Ke Za Zhi, 2020, 19(6): 563-588. DOI:10.3760/cma.j.cn115610-20200504-00348] |
| [18] |
中国临床肿瘤学会指南工作委员会. CSCO结直肠癌诊疗指南2020版[M]. 北京: 人民卫生出版社, 2020: 131. [Chinese Society of Clinical Oncology Guidelines Working Committee. Guidelines ofChinese society of clinical oncology(CSCO)—Colorectal cancer[M]. Beijing: People's Medical Publishing House, 2020: 131.]
|
| [19] |
Lan WL, Zhao JY, Chen WJ, et al. Anlotinib overcomes multiple drug resistant of the colorectal cancer cells via inactivating PI3K/AKT pathway[J]. Anticancer Agents Med Chem, 2021, 21(15): 1987-1995. DOI:10.2174/1871520621666210112113852 |
| [20] |
Yang Q, Ni LC, Saber Imani, et al. Anlotinib Suppresses Colorectal Cancer Proliferation and Angiogenesis via Inhibition of AKT/ERK Signaling Cascade[J]. Cancer Manag Res, 2020, 12: 4937-4948. DOI:10.2147/CMAR.S252181 |
| [21] |
Yan LH, Zhang D, Mo SS, et al. Anlotinib suppresses metastasis and multidrug resistance via dual blockade of MET/ABCB1 in colorectal carcinoma cells[J]. J Cancer, 2021, 12(7): 2092-2104. DOI:10.7150/jca.45618 |
| [22] |
Jia ZX, Zhang Z, Li Z, et al. Anlotinib inhibits the progress of colorectal cancer cells by antagonizing VEGFR/JAK2/STAT3 axis[J]. Eur Rev Med Pharmacol Sci, 2021, 25(5): 2331-2343. |
| [23] |
Wei L, Li Y, Suo Z. TSPAN8 promotes gastric cancer growth and metastasis via ERK MAPK pathway[J]. Int J Clin Exp Med, 2015, 8(6): 8599-8607. |
| [24] |
高辉, 殷玉敬, 巴雅尔, 等. TSPAN8对肺癌A549细胞体外增殖的影响及机制[J]. 现代肿瘤医学, 2017, 23(6): 864-867. [Gao H, Yin YJ, Bayaer, et al. The effect of TSPAN8 on cell proliferation of human lung cancer A549 cells and the mechanisms[J]. Xian Dai Zhong Liu Yi Xue, 2017, 23(6): 864-867. DOI:10.3969/j.issn.1672-4992.2017.06.007] |
| [25] |
Lv L, Mei F, Wang J. Tetraspanin 8 promotes radioresistance of human nasopharyngeal carcinoma via the activation of PI3K/AKT pathway[J]. Int J Clin Exp Med, 2016, 9(7): 12543-12552. |
| [26] |
Li L, Yang DP, Cui DJ, et al. Quantitative proteomics analysis of the role of tetraspanin-8 in the drug resistance of gastric cancer[J]. Int J Oncol, 2018, 52(2): 473-484. |
| [27] |
Lin X, Bi Z, Hu Q, et al. TSPAN8 serves as a prognostic marker involving Akt/MAPK pathway in nasopharyngeal carcinoma[J]. Ann Transl Med, 2019, 7(18): 470. DOI:10.21037/atm.2019.08.02 |
| [28] |
Akiel MA, Santhekadur PK, Mendoza RG, et al. Tetraspanin 8 mediates AEG-1-induced invasion and metastasis in hepatocellular carcinoma cells[J]. FEBS Lett, 2016, 590(16): 2700-2708. DOI:10.1002/1873-3468.12268 |
 2022, Vol. 49
2022, Vol. 49




