文章信息
- YBX1和FOXA1在胃癌中的表达及其临床病理学意义
- Expression of YBX1 and FOXA1 in Gastric Cancer and Their Clinicopathological Significance
- 肿瘤防治研究, 2022, 49(11): 1159-1164
- Cancer Research on Prevention and Treatment, 2022, 49(11): 1159-1164
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0189
- 收稿日期: 2022-03-02
- 修回日期: 2022-05-25
胃癌是常见的消化系统恶性肿瘤之一,其发病机制目前尚未完全明确[1]。因胃癌起病隐匿且缺乏高特异性及敏感度的早期分子诊断标志物,往往患者一出现症状即已进入进展期[2]。因此,寻找胃癌分子标志物,进一步探究其发生发展机制,对提高患者5年生存率有重要意义。Y-盒结合蛋白1(Y-box binding protein 1, YBX1)是一种DNA结合和RNA结合蛋白,在转录和转录后水平对基因表达起着重要的调节作用[3]。Zhang等[4]研究显示,YBX1在胃癌组织中高表达。叉头框蛋白A1(forkhead box protein A1, FOXA1)又称肝细胞核因子3α,属于FOXA家族成员[5]。Lin等[6]研究结果显示,FOXA1过表达可抑制人胃癌细胞增殖。目前对YBX1、FOXA1蛋白表达与胃癌关系的研究较少。因此本研究对比了YBX1、FOXA1在胃癌组织及癌旁组织中的表达差异,且对二者与胃癌临床病理特征及预后间的关系进行了探究,旨在为胃癌疾病进展提供重要的生物学指标。
1 资料与方法 1.1 一般资料选取2015年1月—2016年7月于南阳市中心医院住院治疗的131例胃癌患者癌组织作为研究对象,患者年龄46~85岁,中位年龄61(60.24±11.70)岁,男70例,女61例。选取各胃癌患者相应癌旁组织作为对照。纳入标准:(1)经胃镜活检及病理组织学检查确诊,患者符合国家卫生健康委员会制定的胃癌诊疗规范[7];(2)经医院伦理委员会审批通过(伦理批号:20150326-7308);(3)初次确诊,术前未进行化疗、放疗、细胞分子靶向治疗等抗肿瘤治疗;(4)临床资料、影像学资料、随访资料齐全者。排除标准:(1)伴有其他消化系统疾病者;(2)有精神障碍性疾病者,哺乳、妊娠期妇女;(3)伴有严重心、肝、肾等脏器病变或其他部位恶性肿瘤者;(4)有胃镜检查禁忌证者。收集患者年龄、性别、Lauren分型、肿瘤大小、分化程度、淋巴结转移、TNM分期等一般临床资料。
1.2 主要试剂与仪器YBX1抗体(货号:FNab09561)购自武汉菲恩生物科技有限公司;FOXA1抗体(货号:PAab03187)购自武汉维克赛思科技有限公司;生物素二抗(货号:GtxOt-070-DFITC)购自广东固康生物科技有限公司;RNA提取试剂盒(货号:R3724)购自北京康瑞纳生物科技有限公司;反转录试剂盒(货号:J-SRP1105-100)购自上海研谨生物科技有限公司;SYBR Green Master Mix(货号:11201ES-)购自翌圣生物科技(上海)股份有限公司。生物显微镜(型号:CX43)购自日本OLYMPUS公司;qRT-PCR仪(型号:7500)购自美国ABI公司。
1.3 研究方法 1.3.1 样品采集及保存采集胃癌患者术中癌组织及相应癌旁组织,所有组织标本采用4%多聚甲醛盐酸缓冲液固定,经脱水、透明、包埋后,进行切片(0.4 μm)。
1.3.2 实时荧光定量PCR法检测组织YBX1 mRNA、FOXA1 mRNA水平RNA提取试剂盒提取组织总RNA,检测浓度和纯度后采用反转录试剂盒将RNA反转录为cDNA。引物设计软件设计引物后委托上海生工生物工程股份有限公司合成,序列见表 1。体系:上下游引物(10 µmol/L)各2 µl,SYBR Green Master Mix 25 µl,cDNA(50 ng/µl)5 µl,ddH2O 16 µl。程序:95℃预变性5 min;95℃变性15 s,60℃退火30 s,72℃延伸30 s,35个循环。2-∆∆CT法计算YBX1 mRNA、FOXA1 mRNA相对表达量,GAPDH作为内参基因。
组织标本切片常规脱蜡至水,置于3%过氧化氢中孵育10 min,PBS缓冲液洗涤。微波炉抗原热修复后滴加正常山羊血清(封闭20 min),弃去血清,滴加提前稀释好的一抗(YBX1、FOXA1抗体,稀释比均为1:100),PBS代替一抗作为阴性对照,37℃孵育2 h后采用PBS缓冲液洗涤,滴加生物素二抗后室温下孵育30 min,PBS缓冲液洗涤,DAB显色,苏木精对比染色,中性树胶封片。
选取10个含有阳性细胞的高倍视野分别计数100个细胞,计算阳性细胞百分率。阳性细胞百分率 < 5%计0分、5%~25%计1分、≥25%~50%计2分、≥50%~75%计3分、≥75%计4分。染色程度无阳性着色时计0分、浅黄色计1分、深黄色计2分、棕黄色计3分。将阳性细胞百分率得分与染色程度得分相乘,分值≥6分则判定为阳性(+),< 6分则判定为阴性(-)[8]。
1.3.4 随访所有胃癌患者均于术后5年内采用电话、邮件及患者自觉入院检查等方式进行系统随访,术后第1~3年平均每3个月随访1次,之后每半年随访1次。生存期从手术之日起计算,随访时间为2015年1月—2021年7月,所有患者均未失访。中位随访时间为23(4~60)个月。随访期间42例存活,89例死亡,其死亡原因均为胃癌转移复发。
1.4 统计学方法利用SPSS25.0软件对数据进行统计分析,计数资料采用n(%)表示,组间比较行配对χ2检验;胃癌患者癌组织YBX1与FOXA1 mRNA和蛋白表达的相关性分别采用Pearson法及Spearman法分析;Kaplan-Meier法分析胃癌组织YBX1、FOXA1蛋白表达与患者5年总生存率的关系;单因素及多因素Cox回归分析影响胃癌患者预后的因素。P < 0.05为差异有统计学意义。
2 结果 2.1 胃癌组织与癌旁组织中YBX1 mRNA、FOXA1 mRNA水平比较与癌旁组织相比,胃癌组织中FOXA1 mRNA水平较低,YBX1 mRNA水平较高,差异有统计学意义(P < 0.001),见表 2。胃癌组织中YBX1、FOXA1均定位于细胞质,见图 1。

|
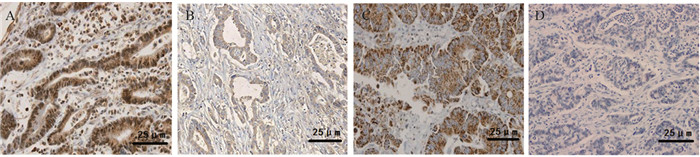
|
| 图 1 胃癌组织中YBX1阳性(A)和阴性(B)表达、FOXA1阳性(C)和阴性(D)表达(IHC ×400) Figure 1 Positive(A) and negative(B) expression of YBX1, positive(C) and negative(D) expression of FOXA1 in gastric cancer tissues (IHC ×400) |
Pearson法分析结果显示,胃癌组织YBX1 mRNA与FOXA1 mRNA负相关(r=-0.675, P < 0.05),见图 2。
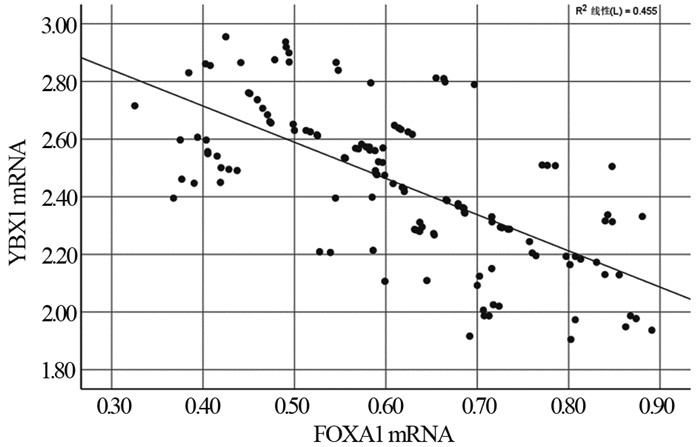
|
| 图 2 胃癌组织YBX1 mRNA与FOXA1 mRNA的相关性 Figure 2 Correlation between YBX1 mRNA and FOXA1 mRNA in cancer tissues of patients with gastric cancer |
与癌旁组织相比,癌组织中FOXA1蛋白阳性表达率较低,YBX1蛋白阳性表达率较高,差异有统计学意义(P < 0.05),见表 3。
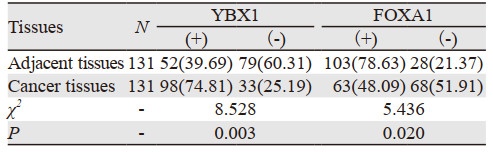
|
Spearman法分析结果显示,胃癌组织中YBX1与FOXA1蛋白表达负相关(Crammer's V=-0.497, P < 0.001),见表 4。

|
结果显示,胃癌组织中YBX1、FOXA1蛋白表达与患者年龄、性别、Lauren分型、肿瘤大小无关(P > 0.05),与分化程度、淋巴结转移、TNM分期有关(P < 0.001),见表 5。
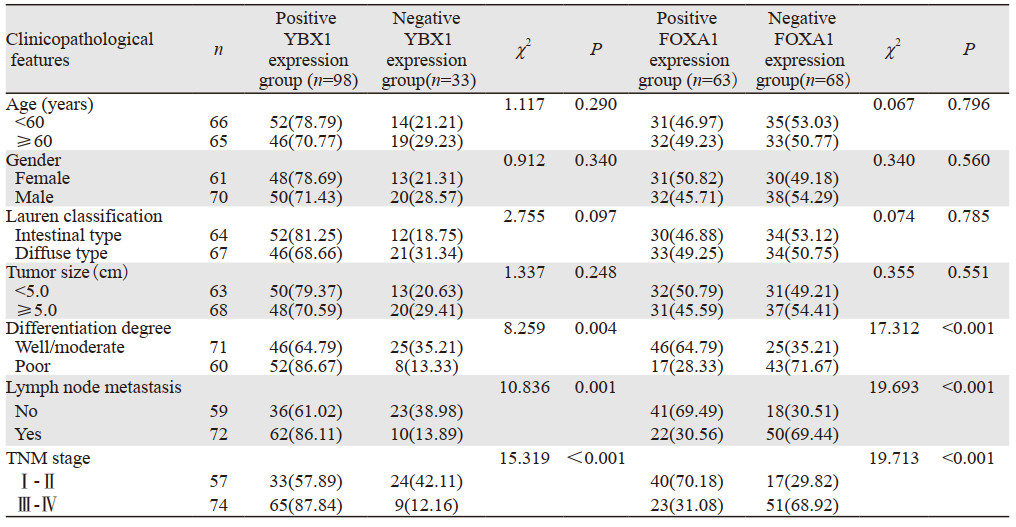
|
结果显示,YBX1阴性表达组5年内存活率(17/33, 51.52%)高于YBX1阳性表达组(25/98, 25.51%)(χ2=7.665, P < 0.05),FOXA1阳性表达组5年内存活率(26/63, 41.27%)高于FOXA1阴性表达组(16/68, 23.53%)(χ2=4.725, P < 0.05),见图 3。
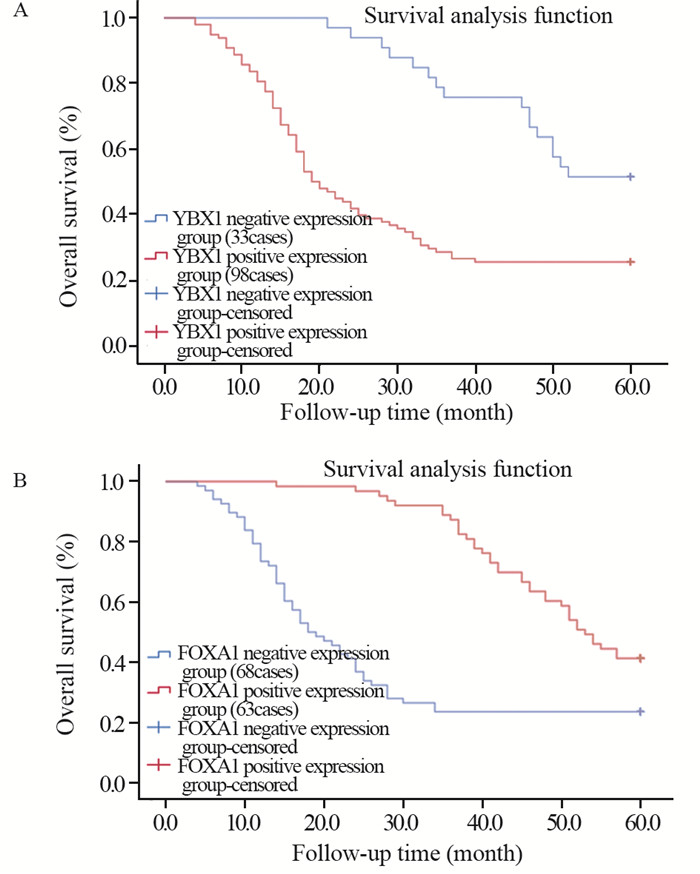
|
| 图 3 胃癌组织YBX1(A)、FOXA1(B)表达与患者5年总生存率的关系 Figure 3 Relationship between YBX1(A), FOXA1(B) expression in gastric cancer tissues and 5-year overall survival rate |
单因素Cox回归分析结果显示,淋巴结转移、TNM分期、YBX1是胃癌患者死亡的危险因素(P < 0.05),肿瘤分化程度、FOXA1是胃癌患者死亡的保护因素(P < 0.05)。多因素Cox回归分析结果显示,TNM分期、YBX1是胃癌患者死亡的独立危险因素(P < 0.05),FOXA1是胃癌患者死亡的保护因素(P < 0.05),见表 6~7。

|

|
胃癌死亡率较高,严重威胁人类的生存及健康,尽管治疗方法已取得突破性的发展,但预后情况并不乐观[9-10]。目前研究显示,胃癌的发生发展与癌基因的表达、抑癌基因的失活及多种信号通路的活化有关,相关基因的重点研究可能对预防术后复发有重要意义[11]。
FOXA1是FOXA家族中的重要成员,研究表明,FOXA亚族蛋白与胃肠道产黏蛋白杯状细胞及肠道内分泌细胞的发育有重要联系,而肠道中此类细胞丢失与营养吸收不足有关[12-13]。FOXA1可通过与染色体特异结合,释放结合位点,调控细胞增殖、凋亡等过程[14]。Lazar等[15]研究结果显示,FOXA1在正常人结肠中高表达,而在结直肠癌中表达显著下调。YBX1是一种参与细胞增殖、分化、凋亡、应激反应及恶性细胞转化等过程的多功能癌蛋白,且不同类型的癌症细胞增殖中YBX1参与调控的细胞信号转导途径亦不同[16-17]。因此,YBX1可作为许多癌症进展的生物标志物。Zhang等[18]研究结果显示,LncRNA DSCAM-AS1通过形成激活FOXA1转录网络的正反馈环,与YBX1相互作用以促进部分癌症进展。而本研究结果中,YBX1蛋白、YBX1 mRNA在胃癌组织中表达上调,FOXA1蛋白、FOXA1 mRNA表达下调,且YBX1、FOXA1蛋白及mRNA表达水平均负相关,提示YBX1可能通过负反馈影响FOXA1,FOXA1通过与染色体特异结合,释放DNA结合位点,参与调控下游信号转导途径及细胞增殖、凋亡等过程,进而参与了胃癌的发生发展。此外,本研究中YBX1、FOXA1两种蛋白表达与胃癌组织分化程度、淋巴结转移、TNM分期有相关性,提示YBX1、FOXA1可能通过相互作用,减少细胞生长阻滞,增强了胃癌细胞的增殖、分化能力,促使胃癌恶性进展。进一步提示YBX1、FOXA1有可能作为评估胃癌疾病进展的生物指标。Kaplan-Meier法分析结果显示,YBX1表达上调、FOXA1表达下调可能与胃癌患者不良预后有关,且二者均是胃癌患者死亡的影响因素,推测YBX1、FOXA1可能参与胃癌细胞的侵袭迁移,进而促使胃癌复发,造成患者死亡,临床中可将两者作为患者预后预测的参考靶标。
综上所述,胃癌组织中YBX1蛋白表达上调、FOXA1蛋白表达下调,二者表达水平与分化程度、淋巴结转移、TNM分期及预后有关。YBX1、FOXA1有可能作为判断胃癌疾病进展及预后的指标,为胃癌的治疗提供新的靶基因。但由于本研究随访时间相对较短、样本量相对较少,且未能避免排除部分病例后对统计结果造成的偏倚,今后将进行多中心、大样本量的研究进一步验证。
作者贡献:
裴正浩、张虎:研究设计与实施、论文撰写
王钧、郝阳:数据整理及分析、论文审核
| [1] |
Huang RJ, Hwang JH. Improving the early diagnosis of gastric cancer[J]. Gastrointest Endosc Clin N Am, 2021, 31(3): 503-517. DOI:10.1016/j.giec.2021.03.005 |
| [2] |
张瑞, 雷林, 彭绩, 等. 胃癌筛查的研究进展[J]. 中国肿瘤, 2020, 29(6): 411-418. [Zhang R, Lei L, Peng J, et al. Research Progress of Gastric Cancer Screening[J]. Zhongguo Zhong Liu, 2020, 29(6): 411-418.] |
| [3] |
Hartley AV, Wang B, Mundade R, et al. PRMT5-mediated methylation of YBX1 regulates NF-κB activity in colorectal cancer[J]. Sci Rep, 2020, 10(1): 15934. DOI:10.1038/s41598-020-72942-3 |
| [4] |
Zhang E, He XZ, Zhang CG, et al. A novel long noncoding RNA HOXC-AS3 mediates tumorigenesis of gastric cancer by binding to YBX1[J]. Genome Biol, 2018, 19(1): 154. DOI:10.1186/s13059-018-1523-0 |
| [5] |
徐晓刚, 代祥军, 张军, 等. 过表达FOXA1促进人胃癌AGS细胞凋亡可能与其抑制EMT有关[J]. 基因组学与应用生物学, 2019, 38(10): 4795-4799. [Xu XG, Dai XJ, Zhang J, et al. Over-expression FOXA1 may Promote the Apoptosis of Human Gastric Cancer AGS Cells Associated with Inhibiting EMT[J]. Ji Yin Zu Xue Yu Ying Yong Sheng Wu Xue, 2019, 38(10): 4795-4799.] |
| [6] |
Lin MX, Pan J, Chen Q, et al. Overexpression of FOXA1 inhibits cell proliferation and EMT of human gastric cancer AGS cells[J]. Gene, 2018, 642: 145-151. DOI:10.1016/j.gene.2017.11.023 |
| [7] |
国家卫生健康委员会. 胃癌诊疗规范(2018年版)[J]. 中华消化病与影像杂志(电子版), 2019, 9(3): 118-144. [National Health Commission. Standard for diagnosis and treatment of gastric cancer (version 2018)[J]. Zhonghua Xiao Hua Bing Yu Ying Xiang Za Zhi (Dian Zi Ban), 2019, 9(3): 118-144. DOI:10.3877/cma.j.issn.2095-2015.2019.03.008] |
| [8] |
Akakura S, Ostrakhovitch E, Sanokawa-Akakura R, et al. Cancer cells recovering from damage exhibit mitochondrial restructuring and increased aerobic glycolysis[J]. Biochem Biophs Res Commun, 2014, 448(4): 461-466. DOI:10.1016/j.bbrc.2014.04.138 |
| [9] |
Ajani JA, D'Amico TA, Bentrem DJ, et al. Gastric Cancer, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw, 2022, 20(2): 167-192. DOI:10.6004/jnccn.2022.0008 |
| [10] |
Sexton RE, Al Hallak MN, Diab M, et al. Gastric cancer: a comprehensive review of current and future treatment strategies[J]. Cancer Metastasis Rev, 2020, 39(4): 1179-1203. DOI:10.1007/s10555-020-09925-3 |
| [11] |
Machlowska J, Baj J, Sitarz M, et al. Gastric Cancer: epidemiology, risk factors, classification, genomic characteristics and treatment strategies[J]. Int J Mol Sci, 2020, 21(11): 4012. DOI:10.3390/ijms21114012 |
| [12] |
Yue M, Yun ZN, Li SQ, et al. NEDD4 triggers FOXA1 ubiquitination and promotes colon cancer progression under microRNA-340-5p suppression and ATF1 upregulation[J]. RNA Biol, 2021, 18(11): 1981-1995. DOI:10.1080/15476286.2021.1885232 |
| [13] |
Mohammadi R, Mohammadi Z, Abedi R, et al. Sexual dimorphism in the expression of GKN2 and FOXA2 genes in the human stomach[J]. Mol Biol Rep, 2019, 46(2): 2355-2362. DOI:10.1007/s11033-019-04692-z |
| [14] |
靳迎春, 周津, 崔颖. CIP2A和FOXA1在直肠癌中的表达关系及诊断价值[J]. 重庆医学, 2021, 50(11): 1801-1805, 1811. [Jin QC, Zhou J, Cui Y. Expression relationship and diagnostic value of CIP2A and FOXA1 in rectal cancer[J]. Chongqing Yi Xue, 2021, 50(11): 1801-1805, 1811. DOI:10.3969/j.issn.1671-8348.2021.11.001] |
| [15] |
Lazar SB, Pongor L, Li XL, et al. Genome-wide analysis of the FOXA1 transcriptional network identifies novel protein-coding and lncRNA targets in colorectal cancer cells[J]. Mol Cell Biol, 2020, 40(21): e00224-20. DOI:10.1128/MCB.00224-20 |
| [16] |
崔琪琪, 王超, 刘双, 等. YBX1在肿瘤中的研究进展[J]. 检验医学与临床, 2021, 18(7): 880-883. [Cui QQ, Wang C, Liu S, et al. Research progress of YBX1 in tumor[J]. Jian Yan Yi Xue Yu Lin Chuang, 2021, 18(7): 880-883. DOI:10.3969/j.issn.1672-9455.2021.07.005] |
| [17] |
Chen Q, Wang H, Li Z, et al. Circular RNA ACTN4 promotes intrahepatic cholangiocarcinoma progression by recruiting YBX1 to initiate FZD7 transcription[J]. J Hepatol, 2022, 76(1): 135-147. DOI:10.1016/j.jhep.2021.08.027 |
| [18] |
Zhang Y, Huang YX, Wang DL, et al. LncRNA DSCAM-AS1 interacts with YBX1 to promote cancer progression by forming a positive feedback loop that activates FOXA1 transcription network[J]. Theranostics, 2020, 10(23): 10823-10837. DOI:10.7150/thno.47830 |
 2022, Vol. 49
2022, Vol. 49

