文章信息
- ITGAV在非小细胞肺癌中的表达及其与放射抵抗的关系
- Expression of ITGAV in Non-small Cell Lung Cancer and Its Relationship with Radioresistance
- 肿瘤防治研究, 2022, 49(11): 1112-1118
- Cancer Research on Prevention and Treatment, 2022, 49(11): 1112-1118
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0177
- 收稿日期: 2022-02-23
- 修回日期: 2022-05-04
2. 442000 十堰,湖北医药学院附属太和医院肿瘤科;
3. 442000 十堰,锦州医科大学十堰市太和医院研究生培养基地
2. Department of Oncology, Taihe Hospital, Hubei University of Medicine, Shiyan 442000, China;
3. Postgraduate Training Basement of Jinzhou Medical University Taihe Hospital, Shiyan 442000, China
肺癌是世界范围内死亡率最高的恶性肿瘤[1],其中非小细胞肺癌(non-small cell lung cancer, NSCLC)是肺癌最常见的病理类型[2]。放疗是肺癌治疗的重要手段之一,但放射抵抗的存在往往限制了非小细胞肺癌治疗效果,因此探寻肺癌放疗抵抗的新靶标及其潜在分子机制有着重要意义。
整合素是一种跨膜黏附受体,由α和β两个亚基组成。细胞与细胞外基质的黏附主要通过整合素家族实现[3]。整合素可以与多种胞质蛋白结合形成复合物,将信号从胞内区传递到胞外区,介导信号转导,在细胞迁移、侵袭、分化、增殖和凋亡相关基因的表达中发挥重要作用[4]。整合素信号增强了癌细胞抵抗化学疗法和放射疗法有害作用的能力[5]。Integrin αV(ITGAV)属于整合素家族一员,与多种肿瘤的发生、发展及不良预后密切相关,但其与NSCLC放射抵抗的关系尚未见报道。
本研究通过公共数据库分析ITGAV在NSCLC中的表达及与患者生存之间的关系,并在细胞水平上验证了ITGAV对NSCLC细胞放射敏感度的影响。
1 材料与方法 1.1 主要试剂人肺腺癌细胞株H1299、A549购自中科院上海细胞库。ITGAV-siRNA-2913、ITGAV-siRNA-1951、ITGAV-siRNA-1312和阴性对照Negative control FAM均由上海吉玛公司合成。抗体均购自美国BOSTER公司。DMEM培养基、胎牛血清及0.25%胰蛋白酶购自美国Gibco公司。蛋白裂解液RIPA、5×蛋白上样缓冲液、BCA蛋白浓度检测试剂盒等均购自碧云天生物科技有限公司。
1.2 实验方法 1.2.1 GEPIA数据库分析进入GEPIA数据库(http://gepia.cancer-pku.cn/),输入基因名称ITGAV后,在Datasets Selection窗口选择“LUAD”、“LUSC”;设置临界值设定条件(|Log2FC|Cutoff:0.5,P value Cutoff:0.05),点击“plot”获取基因表达差异图谱。
1.2.2 HPA数据库分析进入HPA数据库(https://www.proteinatlas.org/),输入基因ITGAV后,点击search,点击“tissue”进入组织图谱,点击“lung”,获取相应的免疫组织化学切片。
1.2.3 Kaplan-Meier Plotter数据库进行在线生存分析进入Kaplan-Meier Plotter [Lung Cancer]栏目(http:/kmplot.com/analysis/index.php?p=service&cancer=lung),输入基因ITGAV后,在Survival窗口选择总生存期(OS)和无复发生存期(RFS),在Radiotherapy窗口选择yes,点击Draw Kaplan Meier-plotter,获取生存曲线。
1.2.4 细胞培养利用FBS浓度为10%的DMEM培养基,于5%CO2、37℃的细胞培养箱内,培养A549、A549R、H1299和H1299R细胞。
1.2.5 非小细胞肺癌放射抵抗株A549R和H1299R细胞的构建将处在对数生长期的A549和H1299细胞(5×106个/瓶)接种于培养瓶内,培养瓶内均加入4 ml含PFS为10%的DMEM培养液,在恒温培养箱中培养24 h后,2 Gy剂量X射线累计照射28次,总剂量达到56 Gy(照射能量6 MV,照射距离100 cm,照射野15 cm×15 cm,剂量率2 Gy/min,放疗设备Varian Unique),每次照射完毕后继续恒温箱中培养。照射完毕,对培养瓶中的细胞进行单克隆,稳定传代,得到肺癌放射抵抗株A549R和H1299R。
1.2.6 细胞转染实验分为ITGAV干扰组和阴性对照组。培养A549R和H1299R细胞使其融合度达50%~70%时,ITGAV siRNA转染:siITGAV的三条干扰序列为:ITGAV-siRNA-2913(F: 5′-CCACAUUGGUUACCACUAATT-3′,R: 5′-UUAGUGGUAACCAAUGUGGTT-3′);ITGAV-siRNA-1951(F: 5′-CCCUCUGACAUUGAUUGUUTT-3′,R: 5′-AACAAUCAAUGUCAGAGGGTT-3′);ITGAV-siRNA-1312(F: 5′-GCAGGUCUCAGUGUCUCUATT-3′,R: 5′-UAGAGACACUGAGACCUGCTT-3′)。阴性对照(negative control, NC)序列为:F: 5′-UUCUCCGAACGUGUCACGUTT-3′,R: 5′-ACGUGACACGUUCGGAGAATT-3′。收集处于对数生长期的A549R和H1299R细胞,将细胞密度调整为2×105个/毫升,接种在6孔板上,按照siRNA mate说明书转染siITGAV和NC组细胞,收集转染48和72 h后的细胞进行后续实验。
1.2.7 qRT-PCR实验qRT-PCR实验收集处对数生长期的A549R和H1299R细胞,裂解后依据RNA反转录试剂盒说明书步骤提取RNA,并进行反转录合成cDNA,然后进行PCR反应,PCR反应条件:95℃预变性1 min,95℃变性15 s,60℃退火1 min,72℃延伸1 min,40个循环。ITGAV引物序列:F: 5'-ATCTGTGAGGTCGAAACAGGA-3',R:5'-TGGAGCATACTCAACAGTCTTTG-3';GAPDH引物序列:F:5'-GGAGCGAGATCCCTCCAAAAT-3',R:5'-GGCTGTTGTCATACTTCTCATGG-3'。GAPDH为内参,按照2-ΔΔCt法计算ITGAV相对表达量。
1.2.8 蛋白提取及Western blot检测收集约1×106个细胞,提取蛋白,使用BCA法进行定量,取10 μl蛋白,10%SDS-PAGE胶进行电泳,转膜后室温下于5%的脱脂奶粉中封闭2 h。4℃条件下一抗孵育8 h,室温条件下二抗孵育2 h,ECL试剂盒显影。ImagePro Plus 6.0软件统计目的蛋白与内参蛋白灰度值,两者之比即为目的蛋白表达量。
1.2.9 克隆形成实验ITGAV siRNA和NC转染A549R和H1299R细胞后,经0、2、4、6、8 Gy照射,将生长状态良好的细胞以1×103个/孔密度传代培养于6孔板中,37℃、5%CO2恒定培养箱培养7~10天,直到细胞长出新的集落,固定,结晶紫染色后显微镜下计数克隆数。
1.2.10 细胞凋亡检测A549R和H1299R细胞经ITGAV siRNA、NC转染后,采用6 Gy X射线照射细胞,继续培养24 h后离心,收集细胞,PBS预冷,洗3遍。依照凋亡试剂盒说明书步骤操作,依次进行Annexin V和PI双染色,流式细胞仪统计细胞凋亡率。
1.2.11 细胞周期检测A549R和H1299R细胞经ITGAV siRNA、NC转染,采用6 Gy X线照射后,收集细胞,预冷的PBS洗3遍。4℃冰箱70%冷乙醇固定过夜,根据细胞周期试剂盒说明书的操作步骤,按顺序进行染色,流式细胞仪检测细胞周期。
1.3 统计学方法采用GraphPad Prism 7.04软件对数据进行分析, 计量数据以(x±s)表示。多组间比较使用单因素方差分析, 两组间比较使用t检验, P<0.05为差异有统计学意义。
2 结果 2.1 NSCLC组织中ITGAV高表达对TCGA的肺腺癌(共594例,包括59例正常组织和535例肺腺癌组织)及肺鳞癌(共551例,包括49例正常组织和502例肺鳞癌组织)数据的查询显示,ITGAV在肺腺癌(图 1A)和肺鳞癌(图 1B)中过表达(P<0.001)。从HPA数据库检索的免疫组织化学染色数据显示,ITGAV蛋白在非小细胞肺癌组织中的表达高于正常组织(图 1C)。
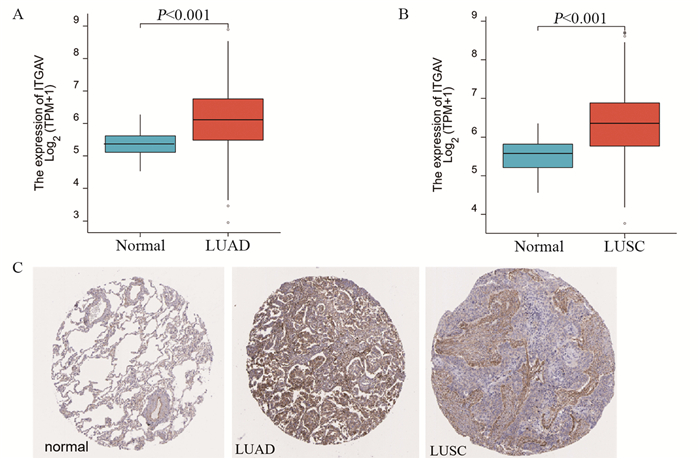
|
| 图 1 TCGA数据库(A, B)和HPA数据库(C)分析ITGAV在肺腺癌和肺鳞癌组织中的表达 Figure 1 Expression of ITGAV in lung adenocarcinoma (LUAD) and lung squamous cell carcinoma (LUSC) analyzed using TCGA database(A, B) and HPA database(C) |
ITGAV高表达与肺腺癌患者的OS(HR=1.47, P=0.0091)和RFS(HR=1.78, P=0.0076)不良密切相关,见图 2A~B。但ITGAV的表达与肺鳞癌患者的OS(HR=1.22, P=0.21)和RFS(HR=1.64, P=0.082)无明显相关性,见图 2C~D。提示ITGAV在肺腺癌组织中高表达并与不良预后相关。
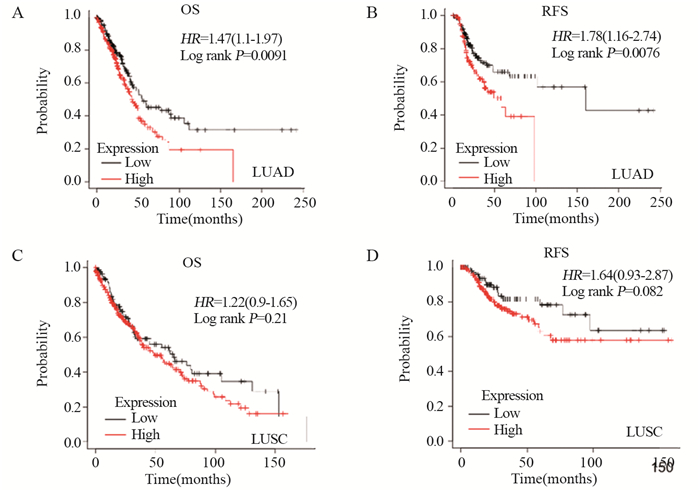
|
| 图 2 利用Kaplan-Meier Plotter数据库分析ITGAV表达水平与肺腺癌(A, B)、肺鳞癌(C, D)患者预后关系 Figure 2 Relationship between ITGAV expression and prognosis of patients with LUAD(A, B) or LUSC(C, D) analyzed using Kaplan-Meier Plotter database |
与亲本细胞相比,A549R和H1299R细胞经过X射线照射后其放疗抵抗能力增加,见图 3。
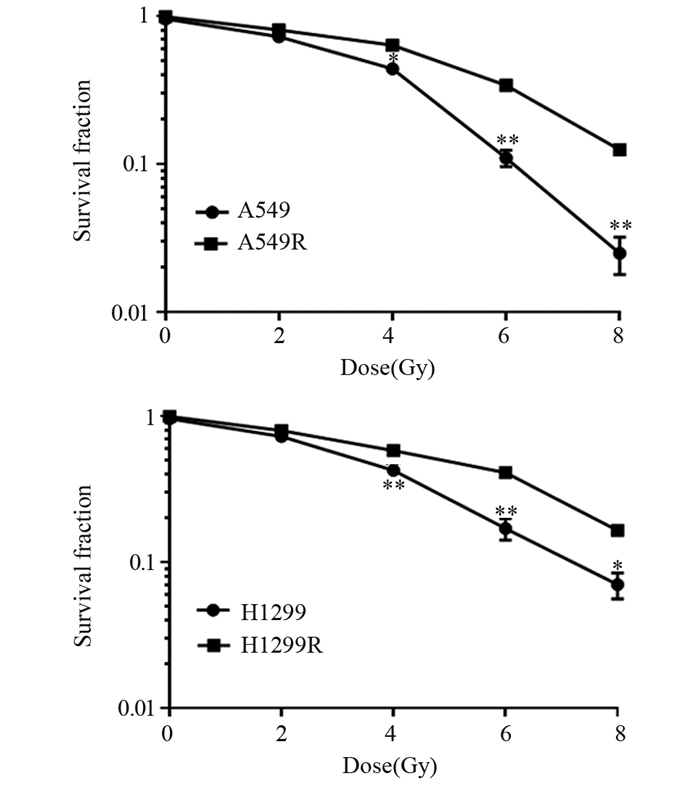
|
| *: P<0.05, **: P<0.01, compared with A549R or H1299R cells. 图 3 A549、A549R(A)和H1299、H1299R(B)照射后细胞存活曲线 Figure 3 Survival curves of A549, A549R(A), H1299, and H1299R cells(B) after irradiation |
Western blot结果显示ITGAV在A549R细胞中的表达高于A549细胞(P=0.0003),在H1299R细胞中的表达高于H1299细胞(P<0.0001),见图 4。
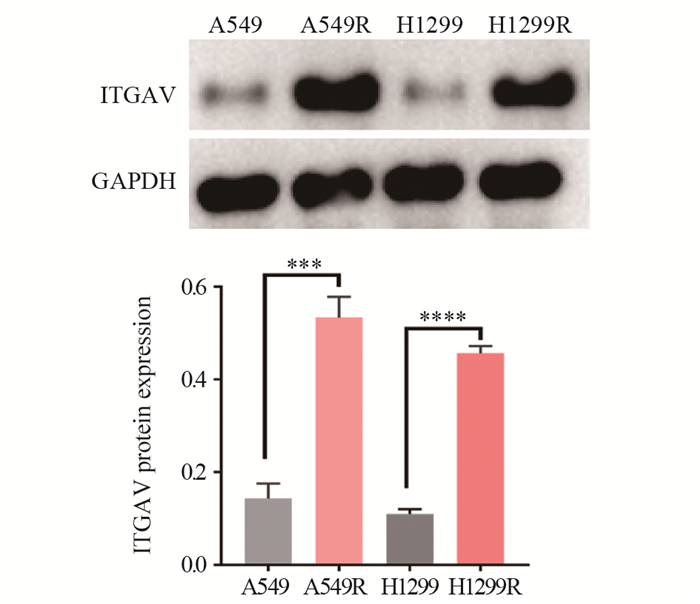
|
| ***: P<0.001; ****: P<0.0001. 图 4 Western blot检测A549、A549R、H1299和H1299R细胞ITGAV的表达水平 Figure 4 Expression of ITGAV in A549, A549R, H1299, and H1299R cells detected by Western blot analysis |
为了研究ITGAV在非小细胞肺癌细胞辐射抗性中的生物学功能,我们用对照(NC)或si-RNA载体(siITGAV-2913、siITGAV-1951、siITGAV-1312)转染A549R和H1299R细胞。通过qRT-PCR和Western blot验证转染效率。qRT-PCR检测结果显示:与NC组(0.96±0.030)相比、siITGAV-2913组(0.32±0.017)、siITGAV-1951组(0.18±0.011)、siITGAV-1312组(0.2367±0.012)mRNA在A549R中相对表达量差异有统计学意义(均P<0.0001),见图 5A;Western blot检测结果显示:A549R和H1299R细胞中,siITGAV-1951、siITGAV-1312、siITGAV-2913均显著抑制了ITGAV蛋白水平的表达,而siITGAV-1951无论是在A549R还是H1299R细胞中,沉默效果最佳(P<0.0001),见图 5B~E。因此,我们选择siITGAV-1951进行后续功能实验。
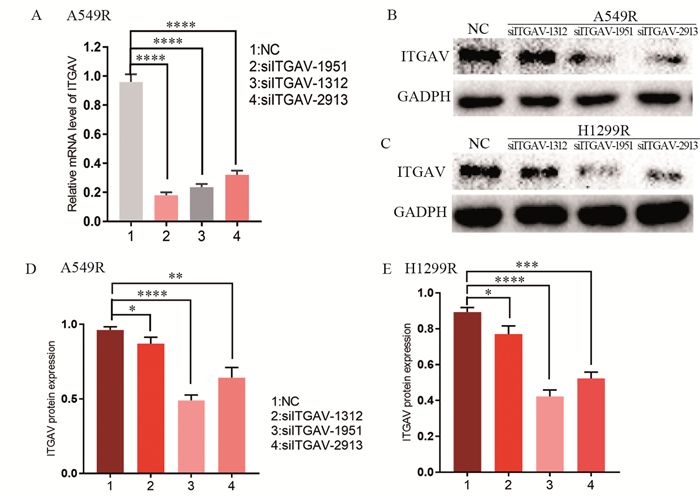
|
| *: P<0.05; **: P<0.01; ***: P<0.001; ****: P<0.0001 图 5 qRT-PCR(A)和Western blot(B~E)检测siITGAV的干扰效果 Figure 5 Interference effects of siITGAV detected by qRT-PCR(A) and Western blot (B-E) analyses |
克隆形成实验结果显示,经0、2、4、6、8 Gy X线照射,ITGAV干扰组细胞的克隆形成能力明显低于阴性对照组(P均<0.05),见图 6。
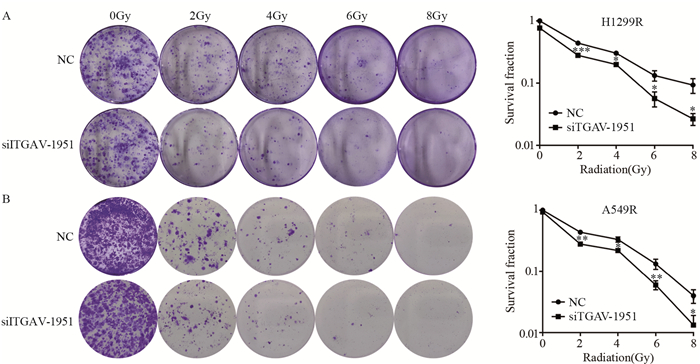
|
| *: P<0.05, **: P<0.01, ***: P<0.001, compared with NC groups. 图 6 克隆形成实验检测不同剂量照射下ITGAV对肺腺癌细胞H1299R(A)和A549R(B)克隆形成能力的影响 Figure 6 Survival of H1299R(A) and A549R(B) cells in each group detected by cloning formation assay after irradiation |
流式细胞仪凋亡分析显示,ITGAV在无照射条件下对NSCLC细胞凋亡无明显影响。然而,6 Gy X线照射48 h后,A549R-siITGAV和H1299R-siITGAV组的凋亡细胞比例明显高于对照组(PH1299R<0.0001, PA549R=0.0002),见图 7A~B。经6 Gy X线照射后,A549R-siITGAV和H1299R-siITGAV细胞的G2/M期细胞比例高于阴性对照组(PH1299R<0.0001, PA549R=0.0007),见图 7C~D。这些结果表明,ITGAV干扰后肺腺癌细胞凋亡率增加、阻滞于G2/M期的细胞增加。
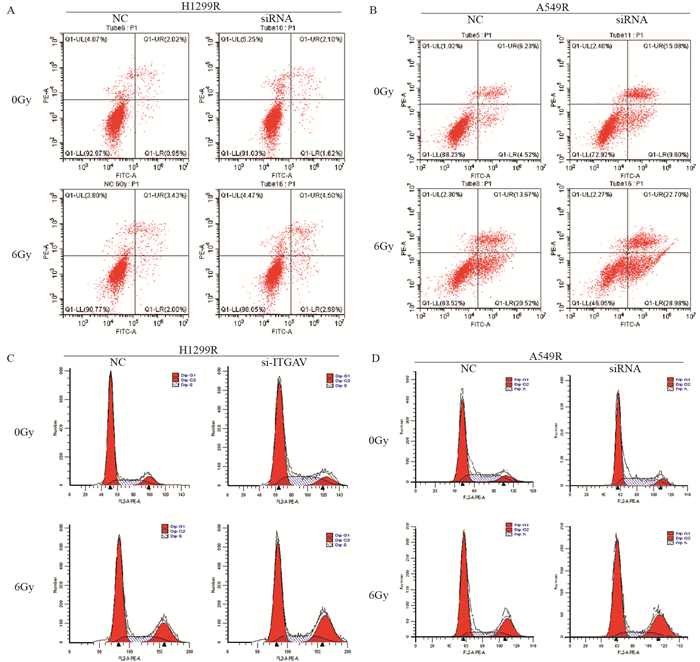
|
| **: P<0.01;***: P<0.001; compared with blank and NC groups. 图 7 流式细胞术检测ITGAV干扰对肺腺癌细胞凋亡(A, B)、周期(C, D)的影响 Figure 7 Cell apoptosis(A, B) and cycle(C, D) in each group detected by flow cytometry |
肿瘤放射抵抗是一个多基因共同调控的复杂生物学过程。文献证实放疗抵抗的发生与DNA损伤修复、细胞周期阻滞、乏氧、逃避凋亡、线粒体能量改变、肿瘤干细胞增殖、亚克隆形成等多种因素相关[6]。因此,研究非小细胞肺癌放射抵抗的分子生物学机制,寻找放疗抵抗新靶点对提高放射敏感度尤为重要。整合素是一种跨膜糖蛋白,其在肿瘤细胞黏附、改变肿瘤细胞周期、抑制肿瘤细胞凋亡、促进肿瘤血管内皮细胞生成、介导肿瘤细胞侵袭转移等方面发挥重要作用[7]。ITGAV作为整合素家族一员,目前已被证实与前列腺癌[8]、胰腺癌[9]和肝癌[10]的侵袭、扩散或不良预后有关。Cheuk等[11]研究显示整合素ITGAV的沉默通过改变BCL2和PXN的表达来抑制乳腺癌细胞的增殖、侵袭和自我更新。但ITGAV在非小细胞肺癌放射抵抗中的作用尚不清楚。
本研究通过TCGA数据库分析表明,与正常肺组织相比,整合素ITGAV在肺腺癌和肺鳞癌组织中表达明显增加,HPA数据库检索的免疫组织化学染色数据也表明ITGAV蛋白在非小细胞肺癌组织中的表达高于正常组织,并且通过Kaplan-Meier Plotter数据库发现ITGAV高表达与肺腺癌患者较短OS和RFS有关。这些结果与Loeser等[12]研究结果一致。
为进一步研究ITGAV与NSCLC放射抵抗关系,本研究干扰了ITGAV在A549R和H1299R细胞中的表达,经不同剂量照射后,发现随着照射剂量增加,干扰组及对照组克隆存活率均显著降低,但与NC组相比,si-ITGAV组克隆形成率下降更为明显。这与Lee等[13]研究结果相似。他们发现沉默ITGAV后,STAT5的磷酸化下降,NSCLC克隆形成率明显减低。本研究还发现,经6 Gy X线照射后,si-ITGAV组凋亡率、G2/M期阻滞增加,证明ITGAV的沉默与NSCLC较低克隆存活率、对辐射诱导的凋亡抵抗力下降以及G2/M期阻滞有关。Li等[14]研究ITGB1与NSCLC放射抵抗关系时也有相似的结果,他们发现沉默ITGB1后,A549R和H460R细胞的克隆形成存活率下降,并且与照射后的野生型细胞相比,细胞凋亡率及G2/M期阻滞增加。
综上所述,本研究初步证实了ITGAV在非小细胞肺癌放射抵抗中的作用,但ITGAV介导非小细胞肺癌放射抵抗的具体分子机制尚未阐明,今后,我们将在本研究的基础上,进一步探究整合素ITGAV及其他成员在肺癌细胞中的表达情况及发生、发展的机制,为解决临床NSCLC放疗抵抗问题提供有利线索和可靠依据。
作者贡献:
唐园惠:实验实施、论文写作
朱圣明、柴晶晶:提供实验技术和写作指导及资金支持
韩佳慧、田超:实验实施
邓鑫州、段奇文:实验设计、提供实验平台及论文写作指导
| [1] |
Siegel RL, Miller KD, Fuchs HE, et al. Cancer Statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. DOI:10.3322/caac.21654 |
| [2] |
Felix AS, Brinton LA. Cancer Progress and Priorities: Uterine Cancer[J]. Cancer Epidemiol Biomarkers Prev, 2018, 27(9): 985-994. DOI:10.1158/1055-9965.EPI-18-0264 |
| [3] |
Ginsberg MH. Integrin activation[J]. BMB Rep, 2014, 47(12): 655-659. DOI:10.5483/BMBRep.2014.47.12.241 |
| [4] |
Li ZH, Zhou Y, Ding YX, et al. Roles of integrin in tumor development and the target inhibitors[J]. Chin J Nat Med, 2019, 17(4): 241-251. |
| [5] |
Ellert-Miklaszewska A, Poleszak K, Pasierbinska M, et al. Integrin Signaling in Glioma Pathogenesis: From Biology to Therapy[J]. Int J Mol Sci, 2020, 21(3): 888. DOI:10.3390/ijms21030888 |
| [6] |
Buckley AM, Lynam-Lennon N, O'Neill H, et al. Targeting hallmarks of cancer to enhance radiosensitivity in gastrointestinal cancers[J]. Nat Rev Gastroenterol Hepatol, 2020, 17(5): 298-313. DOI:10.1038/s41575-019-0247-2 |
| [7] |
Michael M, Parsons M. New perspectives on integrin-dependent adhesions[J]. Curr Opin Cell Biol, 2020, 63: 31-37. DOI:10.1016/j.ceb.2019.12.008 |
| [8] |
Ju G, Zhu Y, Du T, et al. MiR-197 Inhibitor Loaded AbCD133@MSNs@GNR Affects the Development of Prostate Cancer Through Targeting ITGAV[J]. Front Cell Dev Biol, 2021, 9: 646884. DOI:10.3389/fcell.2021.646884 |
| [9] |
Kemper M, Schiecke A, Maar H, et al. Integrin alpha-V is an important driver in pancreatic adenocarcinoma progression[J]. Exp Clin Cancer Res, 2021, 40(1): 214. DOI:10.1186/s13046-021-01946-2 |
| [10] |
Weiler SME, Lutz T, Bissinger M, et al. TAZ target gene ITGAV regulates invasion and feeds back positively on YAP and TAZ in liver cancer cells[J]. Cancer Lett, 2020, 473: 164-175. DOI:10.1016/j.canlet.2019.12.044 |
| [11] |
Cheuk IW, Siu MT, Ho JC, et al. ITGAV targeting as a therapeutic approach for treatment of metastatic breast cancer[J]. Am J Cancer Res, 2020, 10(1): 211-223. |
| [12] |
Loeser H, Scholz M, Fuchs H, et al. Integrin alpha V (ITGAV) expression in esophageal adenocarcinoma is associated with shortened overall-survival[J]. Sci Rep, 2020, 10(1): 18411. DOI:10.1038/s41598-020-75085-7 |
| [13] |
Lee YS, Kim KC, Mongre RK, et al. IL-32γ suppresses lung cancer stem cell growth via inhibition of ITGAV-mediated STAT5 pathway[J]. Cell Death Dis, 2019, 10(7): 506. DOI:10.1038/s41419-019-1737-4 |
| [14] |
Li Y, Sun C, Tan Y, et al. ITGB1 enhances the Radioresistance of human Non-small Cell Lung Cancer Cells by modulating the DNA damage and YAP1-induced Epithelial-mesenchymal Transition[J]. Int J Biol Sci, 2021, 17(2): 635-650. DOI:10.7150/ijbs.52319 |
 2022, Vol. 49
2022, Vol. 49


