文章信息
- 盐酸埃克替尼治疗EGFR突变晚期肺腺癌的预后因素分析
- Prognostic Factors in Patients with Advanced Lung Adenocarcinoma Treated with Icotinib
- 肿瘤防治研究, 2022, 49(11): 1153-1158
- Cancer Research on Prevention and Treatment, 2022, 49(11): 1153-1158
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0174
- 收稿日期: 2022-02-28
- 修回日期: 2022-07-08
我国是肺癌高发国家,2015年中国的肺癌新确诊病例总数约为78.7万,其中有超过1/3的肺癌患者确诊时即为晚期[1]。表皮生长因子受体(epidermal grow factor receptor, EGFR)是一种跨膜受体酪氨酸激酶,该区域的激活即磷酸化对癌细胞增殖、生长的相关信号传递具有重要意义。我国肺癌患者中,EGFR突变约占全部非小细胞肺癌(non-small cell lung cancer, NSCLC)的32%~38%[2],占肺腺癌的50%[3],其中EGFR第19外显子缺失突变(Del19)和第21外显子L858R突变约占所有EGFR基因突变的90%[4]。EGFR突变的NSCLC是一组异质性疾病,不同的EGFR敏感突变位点对于表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor, EGFR-TKI)的疗效不同。现有研究表明EGFR-TKI在EGFR 19突变患者中显示出比EGFR 21突变患者更好的长期生存[5],但是很少有文献报道不同EGFR 19突变位点与患者预后的关系[6]。本研究回顾性分析了101例晚期肺腺癌患者EGFR基因19、21突变情况及临床特征与预后的关系。
1 资料与方法 1.1 临床资料回顾性分析2013年1月至2019年12月河北省胸科医院晚期肺腺癌患者的临床资料。纳入标准:(1)组织学或细胞学确诊为肺腺癌Ⅳ期的患者;(2)基因检测应用突变扩增阻滞系统PCR(amplification refractory mutation system PCR, ARMS PCR)和二代测序(next generation sequencing, NGS)提示EGFR19、21基因突变,且接受盐酸埃克替尼片一线靶向治疗;(3)临床资料完整,可定期随访。排除标准:(1)合并原发其他系统的恶性肿瘤;(2)一线联合化疗和(或)抗血管治疗;(3)存在其他危及患者安全,或影响研究结果的器质性疾病。全组共纳入124例存在19、21基因突变的Ⅳ期肺腺癌,且接受埃克替尼一线靶向治疗的患者,随访资料完整101例。患者的年龄、性别、EGFR突变类型、转移部位数目、转移部位、一线治疗进展等临床特征,见表 1。

|
从患者治疗后开始随访,至2020年12月1日随访截止时有61例患者死亡。
1.3 统计学方法应用SPSS26.0统计软件进行统计学处理。Kaplan-Meier法计算生存率,Log rank法进行单因素分析的显著性检验,Cox模型进行多因素分析。P < 0.05为差异有统计学意义。
2 结果全组患者客观缓解率(objective response rate, ORR)达63.4%。截至随访日期,全组患者中位无疾病进展时间(PFS)为13个月,中位总生存时间(OS)达27个月,其中1、2、3年的生存率分别为84.9%、55.3%、29.4%,见图 1。
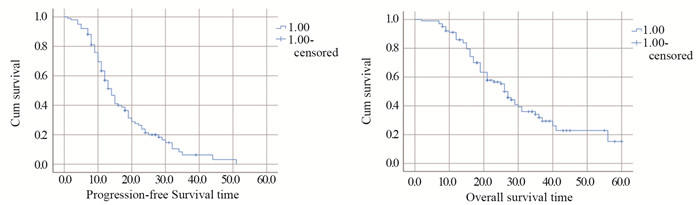
|
| 图 1 101例晚期肺腺癌患者无进展生存时间和总生存时间(B)曲线 Figure 1 Progression-free survival time and overall survival curves of 101 advanced lung adenocarcinoma patients |
Log rank秩和检验将年龄、性别、基因突变亚型、EGFR19突变位点、转移器官数目、有无胸膜转移纳入分析,其中有1个转移部位的患者中位PFS是16个月,高于转移部位≥2个患者的12个月,差异有统计学意义(χ2=7.326, P=0.007)。Del19患者的中位PFS为15个月高于EGFR基因21突变的11个月,差异无统计学意义(χ2=1.699, P=0.192)。EGFR19突变中,746~750位点的患者PFS高于其他突变位点(15个月vs.13个月),但差异无统计学意义(χ2=2.342, P=0.126)。年龄、性别、有无胸膜转移与患者PFS无关(χ2=1.976, P=0.160; χ2=0.139, P=0.710;χ2=0.007, P=0.932),见图 2。
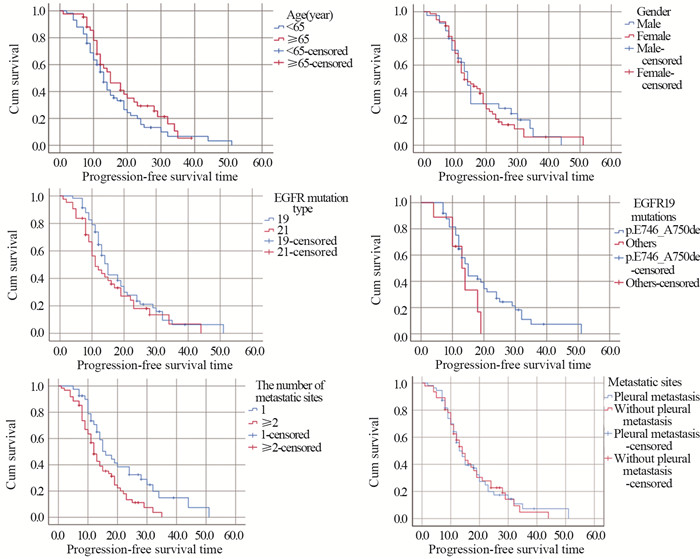
|
| 图 2 不同年龄、性别、基因突变类型、EGFR19突变位点、转移器官数目和转移部位患者的无疾病进展时间分析 Figure 2 Progression-free time analysis of patients with different ages, gender, gene mutation type, EGFR19 mutations, number of metastatic sites, and metastatic sites |
Log rank秩和检验将年龄、性别、基因突变类型、EGFR 19突变位点、转移数目、有无胸膜转移分别纳入单因素分析,结果显示转移部位数≤3的患者中位OS是29个月,高于转移部位数 > 3个的患者(19个月),差异有统计学意义(χ2=3.995, P=0.046),其中转移部位数越少,患者中位OS越长,转移部位数1、2、3、> 3的患者中位OS分别为35、26、21、19个月。胸膜转移组、无胸膜转移组中位OS分别为21、27个月,差异有统计学意义(χ2=4.112, P=0.043)。EGFR基因19突变患者的中位OS为29个月,高于EGFR基因21突变的26个月,但差异无统计学意义(χ2=1.339, P=0.247),EGFR19突变亚型中,746-750位点突变的患者OS高于其他突变位点31个月与21个月,但差异无统计学意义(χ2=3.372, P=0.066)。性别、年龄不是患者OS的影响因素(χ2=0.020, P=0.887; χ2=0.372, P=0.542),见图 3。
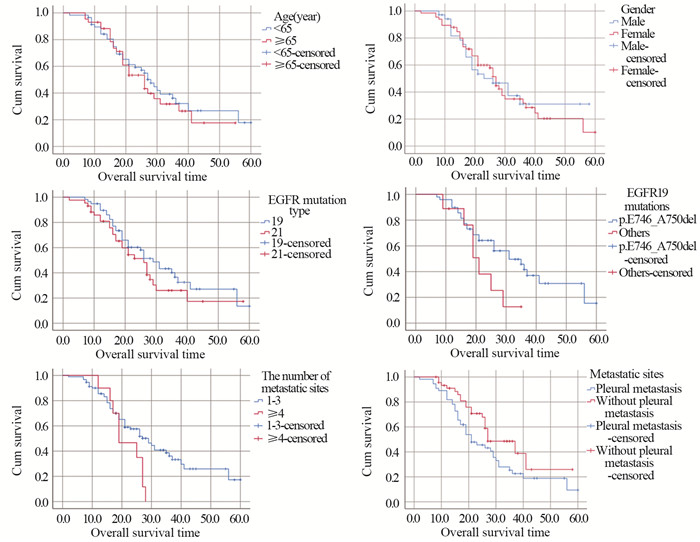
|
| 图 3 不同年龄、性别、基因突变类型、EGFR19突变位点、转移器官数目和转移部位患者的总生存时间分析 Figure 3 Overall survival analysis of patients with different ages, gender, gene mutation type, EGFR19 mutations, number of metastatic sites, and metastatic sites |
Cox模型对所有单因素变量进行多因素分析结果显示,转移部位数目和有无胸膜转移是晚期肺腺癌患者OS的独立影响因素(P=0.027; P=0.041),见表 2。

|
2004年Lynch和Paez等[7-9]首次报道了EGFR-TKI域存在突变,主要集中于18~21号外显子区域,包括三种不同的类型,即缺失突变、插入突变和点突变。其中最常见的突变包括19号外显子的缺失突变(45%)和21号外显子的点突变(40%~45%)。19号外显子的缺失突变和21号外显子的L858R点突变为非小细胞肺癌的优势突变,这两种突变都会导致酪氨酸激酶结构域的激活,并且都与小分子EGFR-TKI的敏感度有关。埃克替尼、吉非替尼、厄洛替尼等均为EGFR基因具有敏感突变的晚期非小细胞肺癌患者的一线治疗手段。近年来,EGFR-TKI的应用明显改善了存在EGFR敏感基因突变肺腺癌患者的生存期,总生存时间提高至2年左右[10-11]。Ke等[12]检索有关Del19和L858R继发T790M突变耐药病例分析,发现Del19组和L858R突变组中位OS分别为33.3个月和26.4个月(HR=0.72, P= 0.028)。本研究仅分析了埃克替尼对晚期肺腺癌治疗疗效的影响,排除了其他不同EGFR-TKI的混杂因素,结果显示Del19患者的中位生存时间为29个月长于L858R突变的26个月,因是回顾性研究,未把后续的治疗纳入分析中,可能会对结果有一定影响。
多个大型随机对照试验发现,EGFR-TKI治疗EGFR 19号外显子缺失突变和EGFR 21 L858R突变患者显示出不同的疗效,总体来看,19号外显子缺失突变患者的PFS和OS获益要明显高于EGFR 21 L858R突变的患者[13-14]。Rossi等[15]为评估EGFR不同突变亚型及位点与EGFR-TKI治疗之间的疗效及临床预后,分析了55例有EGFR18、19和21号外显子突变的转移性NSCLC患者,入组患者接受了一线和(或)二线及以上的TKI治疗。结果发现,与21号外显子突变相比,19号外显子缺失突变患者中位OS更长(+6.6个月);比较19号外显子的p.E746_A750del、p.E746_T751del及21号外显子的p.L858R,p.E746_A750del有延长OS的趋势。Liu等[16]发现EGFR经典突变患者的OS更好,是预测生存的独立因素。本研究分析显示,EGFR Del19患者的PFS和OS均高于EGFR基因21号外显子突变患者,其中EGFR19 746-750位点突变的患者,较EGFR19非746-750位点突变者有延长OS的倾向(31月vs. 21月),与既往研究结果相似。这可能是因为Del19号发生于第745位的赖氨酸残基(K745)下游,此处为ATP结合的关键点,其下游数个氨基酸的缺失会改变EGFR催化位点(αC-helix区域),进而改变受体酪氨酸激酶ATP结合能力,可提高肿瘤细胞对EGFR-TKI的敏感度;而21外显子位于EGFR分子的A-loop区,其与ATP结合的关键位点关系不如αC-helix紧密,所以没有相对优势。因此EGFR21突变对靶向药物的反应敏感度不及19基因突变,这也解释了OS和PFS的研究数据不及19基因突变的原因。此外,有研究表明,此差异与19外显子缺失患者T790M突变发生率高有关[12],这也是我们下一步的研究方向。
Ng等[17]对41例EGFR突变的转移性肺腺癌患者进行了回顾性分析,发现远处转移器官的数量和胸腔/心包积液的存在不是患者PFS的影响因素。但也有许多研究表明[18-19],在初诊时就出现恶性胸腔积液的肺癌患者OS更短。Wang等[20]分析104例行一线靶向治疗的EGFR突变ⅢB期或Ⅳ期肺腺癌患者,发现初治有胸腔积液的患者PFS和OS明显短于无胸腔积液的患者(中位PFS:8.2月vs. 15.3月,P=0.0004;中位OS:16.3月vs. 28.2月,P=0.0003),且是否存在胸腔积液是影响患者生存的独立危险因素,与本研究结果相同,提示即使接受靶向药物治疗的患者,有较高的临床获益,但是合并恶性胸腔积液时,仍然需要给予高度关注。Okauchi等[21]认为不同转移模式的肺癌可能有不同生存率和不利的预后因素,应当结合不同转移模式对疾病进行不同的治疗策略。本研究结果显示,随着患者转移部位数目的增多,预后越差,我们应当积极监测患者病情变化,或者对于转移部位多,瘤负荷更重的患者,在机体可以耐受的情况下采用联合的治疗策略给予更积极的治疗。
本研究存在很多局限性:首先是样本量小,为单中心回顾性研究;其次,未分析一线埃克替尼靶向治疗进展后,进行二线治疗对生存的影响;最后,未分析伴随基因突变对EGFR靶向治疗疗效的影响。
综上所述,晚期肺腺癌EGFR19、21基因突变患者总生存差异并不显著。不同转移部位数目的肺腺癌患者之间生存率存在明显差异。对于多部位转移和有胸膜转移的患者在靶向治疗的同时,积极监测,必要时可以给予更积极的联合治疗策略。
作者贡献:
张红斌:研究设计、统计分析、论文撰写
朱玲玲:数据汇总、统计分析、文献查阅
谢炯、才虹美、姬巧霞、梁香存、李华、王愿:资料收集、文献查阅
赵敏:研究设计、审阅、论文修改
| [1] |
Gao S, Li N, Wang S, et al. Lung Cancer in People's Republic of China[J]. J Thorac Oncol, 2020, 15(10): 1567-1576. DOI:10.1016/j.jtho.2020.04.028 |
| [2] |
Zhang YL, Yuan JQ, Wang KF, et al. The prevalence of EGFR mutation in patients with non-small cell lung cancer: a systematic review and meta-analysis[J]. Oncotarget, 2016, 7(48): 78985-78993. DOI:10.18632/oncotarget.12587 |
| [3] |
Shi Y, Au JS, Thongprasert S, et al. A Prospective, Molecular Epidemiology Study of EGFR Mutations in Asian Patients with Advanced Non-Small-Cell Lung Cancer of Adenocarcinoma Histology (PIONEER)[J]. J Thorac Oncol, 2014, 9(2): 154-162. DOI:10.1097/JTO.0000000000000033 |
| [4] |
Tu HY, Ke EE, Yang JJ, et al. A comprehensive review of uncommon EGFR mutations in patients with non-small cell lung cancer[J]. Lung Cancer, 2017, 114: 96-102. DOI:10.1016/j.lungcan.2017.11.005 |
| [5] |
Patel N, Wu P, Zhang H. Comparison of gefitinib as first- and second-line therapy for advanced lung adenocarcinoma patients with positive exon 21 or 19 del epidermal growth factor receptor mutation[J]. Cancer Manag Res, 2017, 9: 243-248. DOI:10.2147/CMAR.S138643 |
| [6] |
Akamatsu H, Koh Y, Okamoto I, et al. Clinical significance of monitoring EGFR mutation in plasma using multiplexed digital PCR in EGFR mutated patients treated with afatinib (West Japan Oncology Group 8114LTR study)[J]. Lung Cancer, 2019, 131: 128-133. DOI:10.1016/j.lungcan.2019.03.021 |
| [7] |
Lynch TJ, Bell DW, Sordella R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J]. N Engl J Med, 2004, 350(21): 2129-2139. DOI:10.1056/NEJMoa040938 |
| [8] |
Pao W, Miller V, Zakowski M, et al. EGF receptor gene mutations are common in lung cancers from "never smokers" and are associated with sensitivity of tumors to gefitinib and erlotinib[J]. Proc Natl Acad Sci U S A, 2004, 101(36): 13306-13311. DOI:10.1073/pnas.0405220101 |
| [9] |
Paez JG, Jänne PA, Lee JC, et al. EGFR Mutations in Lung Cancer: Correlation with Clinical Response to Gefitinib Therapy[J]. Science, 2004, 304(5676): 1497-1500. DOI:10.1126/science.1099314 |
| [10] |
Bergqvist M, Christensen HN, Wiklund F, et al. Real world utilization of EGFR TKIs and prognostic factors for survival in NSCLC during 2010-2016 in Sweden: A nationwide observational study[J]. Int J Cancer, 2020, 146(9): 2510-2517. DOI:10.1002/ijc.32596 |
| [11] |
Lee CK, Davies L, Wu Y, et al. Gefitinib or Erlotinib vs Chemotherapy for EGFR Mutation-Positive Lung Cancer: Individual Patient Data Meta-Analysis of Overall Survival[J]. J Natl Cancer Inst, 2017, 109(6): 1-9. |
| [12] |
Ke EE, Zhou Q, Zhang QY, et al. A Higher Proportion of the EGFR T790M Mutation May Contribute to the Better Survival of Patients with Exon 19 Deletions Compared with Those with L858R[J]. J Thorac Oncol, 2017, 12(9): 1368-1375. DOI:10.1016/j.jtho.2017.05.018 |
| [13] |
Mok TS, Cheng Y, Zhou X, et al. Improvement in Overall Survival in a Randomized Study That Compared Dacomitinib With Gefitinib in Patients With Advanced Non-Small-Cell Lung Cancer and EGFR-Activating Mutations[J]. J Clin Oncol, 2018, 36(22): 2244-2250. DOI:10.1200/JCO.2018.78.7994 |
| [14] |
Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2018, 378(2): 113-125. DOI:10.1056/NEJMoa1713137 |
| [15] |
Rossi S, D'Argento E, Basso M, et al. Different EGFR Gene Mutations in Exon 18, 19 and 21 as Prognostic and Predictive Markers in NSCLC: A Single Institution Analysis[J]. Mol Diagn Ther, 2016, 20(1): 55-63. DOI:10.1007/s40291-015-0176-x |
| [16] |
Liu HL, Han G, Peng M, et al. Efficacy of EGFR tyrosine kinase inhibitors in non-small cell lung cancer patients harboring different types of EGFR mutations: A retrospective analysis[J]. J Huazhong Univ Sci Technolog Med Sci, 2017, 37(6): 864-872. |
| [17] |
Ng SK, Sun CK, Ting KB, et al. Prognostic factors of EGFR-mutated metastatic adenocarcinoma of lung[J]. Eur J Radiol, 2020, 123: 108780. DOI:10.1016/j.ejrad.2019.108780 |
| [18] |
Taniguchi Y, Tamiya A, Nakahama K, et al. Impact of metastatic status on the prognosis of EGFR mutation-positive non-small cell lung cancer patients treated with first-generation EGFR-tyrosine kinase inhibitors[J]. Oncol Lett, 2017, 14(6): 7589-7596. |
| [19] |
Yoshimura A, Yamada T, Tsuji T, et al. Prognostic impact of pleural effusion in EGFR-mutant non-small cell lung cancer patients without brain metastasis[J]. Thorac Cancer, 2019, 10(3): 557-563. DOI:10.1111/1759-7714.12979 |
| [20] |
Wang TF, Chu SC, Lee JJ, et al. Presence of pleural effusion is associated with a poor prognosis in patients with epidermal growth factor receptor-mutated lung cancer receiving tyrosine kinase inhibitors as first-line treatment[J]. Asia Pac J Clin Oncol, 2017, 13(4): 304-313. DOI:10.1111/ajco.12658 |
| [21] |
Okauchi S, Watanabe H, Yamada H, et al. The Prognosis of Lung Cancer With Different Metastatic Patterns[J]. Anticancer Res, 2020, 40(1): 421-426. DOI:10.21873/anticanres.13969 |
 2022, Vol. 49
2022, Vol. 49


