文章信息
- 外泌体传递非编码RNA调控乳腺癌耐药
- Exosomal Delivery of Non-coding RNA Regulates Breast Bancer Drug Resistance
- 肿瘤防治研究, 2022, 49(10): 1071-1076
- Cancer Research on Prevention and Treatment, 2022, 49(10): 1071-1076
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0142
- 收稿日期: 2022-02-21
- 修回日期: 2022-03-31
2. 010050 呼和浩特,内蒙古医科大学基础医学院;
3. 010050 呼和浩特,内蒙古医科大学附属医院检验科
2. School of Basic Medical Sciences, Inner Mongolia Medical University, Hohhot 010050, China;
3. Department of Laboratory Medicine, The Affiliated Hospital of Inner Mongolia Medical University, Hohhot 010050, China
乳腺癌(breast cancer, BC)是发生在乳腺腺上皮组织的恶性肿瘤,全球乳腺癌发病率自20世纪70年代末开始呈上升趋势[1]。2022年国家癌症中心公布的最新数据显示:中国女性乳腺癌发病率(29.05/10万)、死亡率(6.39/10万)分别占女性癌症新发病率第一位和癌症相关死亡率第四位[2]。临床上,针对不同亚型的乳腺癌需要使用不同类型的抗肿瘤药物。耐药性仍然是阻碍乳腺癌治疗的主要原因之一。因此,寻找克服或逆转乳腺癌耐药的方法是当前亟需解决的问题。近年来,外泌体成为研究热点之一,外泌体非编码RNA(non-coding RNA, ncRNA)参与调节乳腺癌耐药已被广泛证实[3-4]。研究外泌体ncRNA调节乳腺癌患者耐药的具体机制,可为乳腺癌提供新的治疗靶点,也有利于发现新的疗效预测生物标志物。本文综述了国内外关于外泌体非编码RNA与乳腺癌耐药相关的最新研究进展,以期明确外泌体非编码RNA在乳腺癌耐药中的机制,并为提高乳腺癌治疗疗效提供新的策略。
1 肿瘤获得性耐药机制目前,大多数类型的肿瘤治疗都需要抗肿瘤药物和局部治疗(如手术、放疗)的联合应用。随着抗肿瘤药物的广泛应用,耐药性的产生不可避免。不管肿瘤类型或选择什么治疗方案,耐药性的获得是一个高度复杂的过程。肿瘤通过多种机制对抗肿瘤药物产生耐药。在特定肿瘤中可能有多种耐药机制[5]。研究表明,肿瘤耐药机制的产生主要包括以下几点:(1)药物诱导肿瘤细胞产生保护性自噬[6];(2)相关基因突变可改变药物敏感度[7];(3)信号通路失调影响肿瘤细胞耐药性[8];(4)药物吸收、外排相关蛋白质介导肿瘤细胞耐药性[9];(5)上皮-间充质转化(EMT)有助于产生耐药性[10];(6)DNA修复途径影响耐药性[11]。外泌体介导的细胞间信号转导是新近发现的一种耐药机制[12]。
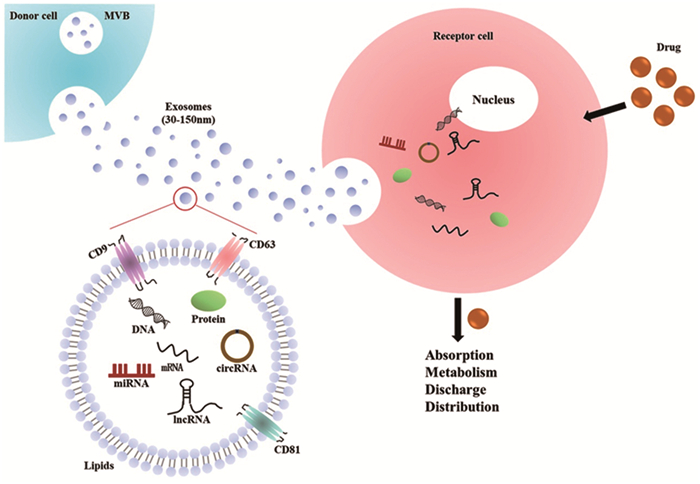
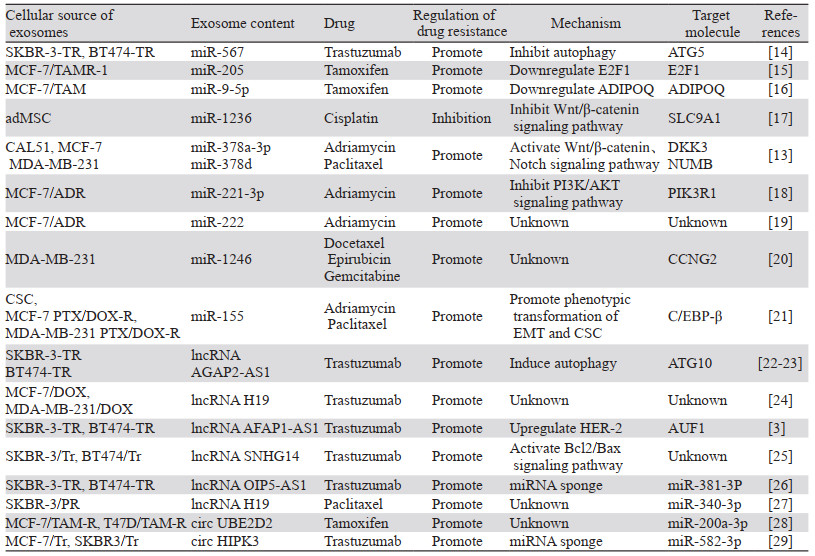
2 外泌体ncRNA与乳腺癌耐药ncRNA是在真核生物基因组中发现的独特的RNA转录本,不能翻译成蛋白质,在许多肿瘤中发挥重要作用。ncRNA主要分为miRNA、lncRNA、circRNA。近年的研究推翻了ncRNA是“垃圾”转录产物的看法,发现ncRNA是细胞生长、增殖、分化、凋亡、转录后调控等过程的关键调控因子[13]。外泌体通过传递ncRNA,影响药物吸收、分布、代谢、外排,见图 1,与乳腺癌耐药程度密切相关[14],见表 1。
|
| 图 1 受体细胞摄取外泌体 Figure 1 Recipient cell uptake of exosomes |
|
miRNA是一种长度约22个核苷酸的ncRNA,在基因的转录调控中发挥重要作用。miRNA与多种肿瘤的联系已被广泛证实。肿瘤细胞外泌体miRNA可被其他类型细胞摄取,使miRNA发挥对基因的转录后调控或降解mRNA的作用[30]。研究表明,肿瘤细胞外泌体特定的miRNA通过复杂的调控机制参与了肿瘤治疗的耐药性。
2.1.1 外泌体传递miRNA调节乳腺癌耐药自噬是进化过程中一个高度保守的细胞过程,受多种病理、应激反应诱导。研究表明,包括分子靶向治疗在内的抗肿瘤治疗可以诱导肿瘤细胞保护性自噬[31]。一系列的miRNA可以通过调节自噬来调节乳腺癌的耐药性[32]。LC3是自噬标志物,主要参与自噬小体的形成。ATG5是调节自噬小体形成的关键蛋白,促进LC3Ⅱ向LC3Ⅰ转化,LC3Ⅱ/LC3Ⅰ比值的高低与自噬水平相关。与人乳腺癌细胞(SKB-R3、BT474)相比,曲妥珠单抗耐药的乳腺癌细胞(SKB-R3-TR、BT474-TR)中miR-567低表达,miR-567可以直接靶向ATG5,从而阻止LC3Ⅱ向LC3Ⅰ转化,抑制自噬小体形成,增强对曲妥珠单抗的敏感度;转染miR-567的MCF-10A分泌的外泌体与SKBR-3-TR、BT474-TR共培育后,可逆转对曲妥珠单抗的耐药性[14]。自噬在调节乳腺癌耐药中起着关键作用,阻断自噬可能成为乳腺癌治疗的一种有前途的治疗策略。
E2F1是一种细胞因子,属于E2F家族。E2F1被证明是抗肿瘤药物诱导相关细胞凋亡的关键调节因子[33]。通过靶向E2F1,他莫昔芬耐药的MCF-7(MCF-7/TAMR-1)细胞经外泌体传递miR-205至敏感细胞,通过抑制caspase信号通路而抑制细胞凋亡,并诱导他莫昔芬耐药[15]。经体内外实验证明,外泌体miR-9-5p通过调节ADIPOQ而增强非耐药乳腺癌细胞对他莫昔芬的耐药性[16]。此调控网络可以为乳腺癌耐药的治疗和预防提供一个有潜力的靶点。
肿瘤干细胞(CSC)是一群具有自我更新能力的细胞,肿瘤细胞的耐药性可部分归因于CSC。肿瘤细胞获得CSC表型和耐药性均与EMT相关。Santos等[21]发现,将来自乳腺癌CSC表型细胞和化疗耐药细胞的外泌体(富含miR-155)与敏感细胞共培育后,miR-155通过下调C/EBP-β、TGF-β,促进敏感细胞的EMT进程(抑制E-cadherin,促进Slug、Snail),并促进敏感细胞向CSC表型转化,从而增强对多柔比星/紫杉醇的耐药性。因此,靶向miR-155与蒽环类和紫杉类化疗药物相结合可能有利于改善乳腺癌化疗耐药。
研究表明[19],阿霉素耐药的乳腺癌细胞(MCF-7/ADR)经外泌体传递miR-222至阿霉素敏感乳腺癌细胞(MCF-7/S),增强了MCF-7/S细胞的耐药性。Li等[20]研究发现,转染miR-1246的乳腺癌细胞(MDA-MB-231)源性外泌体被人正常乳腺上皮细胞(HMLE)摄取后,miR-1246直接靶向3’-UTR区而下调CCNG2的表达,促使HMLE对多西他赛(DOC)、表阿霉素(EPI)和吉西他滨(GEM)产生耐药性。
目前已经筛选出在紫杉醇耐药乳腺癌细胞及其亲本细胞外泌体中差异表达的miR-200c。研究证明[34],miR-200c的异常表达是卵巢癌、乳腺癌等女性生殖系统肿瘤侵袭和耐药的标志。鉴于外泌体可以通过传递miRNA影响肿瘤细胞的耐药性,我们合理推断:紫杉醇耐药乳腺癌细胞源性外泌体miR-200c可以调控肿瘤细胞的耐药性。下一步,我们将通过实验验证外泌体miR-200c作为乳腺癌治疗疗效与耐药发生预判的有效分子标志物和治疗靶点,希望可以为克服乳腺癌细胞紫杉醇耐药提供一种有前途的方法。
2.1.2 外泌体miRNA调控相关信号通路介导乳腺癌耐药Wnt信号是一条在进化上保守的信号转导途径,参与多种肿瘤的发生发展[35]。Wnt是由Wnt基因编码的分泌性蛋白质,存在于大多数哺乳动物(包括人类基因组)的基因组中。Wnt配体与不同受体结合可激活不同的下游信号通路,其中,Wnt/β-catenin信号通路是经典的Wnt通路,也是研究最深入的Wnt通路之一。β-catenin是一种双功能蛋白质,参与细胞间黏附和基因转录调控。研究表明,肿瘤对治疗产生耐药性与Wnt/β-catenin信号增强密切相关[36]。生物信息学分析显示顺铂耐药的乳腺癌细胞中SLC9A1(NHE1)显著上调,且SLC9A1的上游调节因子miR-1236在脂肪间充质干细胞来源的外泌体中富集;富含miR-1236的外泌体被耐药细胞吸收后,抑制SLC9A1表达、使Wnt/β-catenin通路失活,从而逆转乳腺癌细胞对顺铂的耐药性[17]。
Notch信号通路通过多种复杂的机制调控细胞增殖、分化、器官发育等过程[37]。Notch配体(Jagged-1、Jagged-2、Delta-like 1、Delta-like 3、Delta-like 4)与其受体(Notch 1、Notch 2、Notch 3、Notch 4)结合,触发基于配体-受体的Notch信号转导。Notch信号失调在肿瘤耐药中的作用得到了广泛研究。化疗药物(阿霉素或紫杉醇)可激活乳腺癌细胞中EZH2/STAT3轴,促进乳腺癌细胞分泌富含miR-378a-3p、miR-378d的外泌体。这些外泌体被化疗后存活的乳腺癌细胞摄取,进入细胞的miR-378a-3p、miR-378d通过靶向DKK3(Wnt途径抑制剂)、NUMB(Notch途径抑制剂)激活Wnt/β-catenin和Notch信号通路,从而使细胞产生耐药性[13]。
PI3K是一种质膜相关蛋白激酶,在上游生长因子/细胞因子信号和下游细胞内信号转导之间起连接作用[38]。AKT属于丝氨酸/苏氨酸蛋白激酶家族,是PI3K的下游效应因子,参与调控包括基因转录、蛋白质合成、细胞增殖、凋亡等多种生理过程[39]。PI3K/AKT通路是肿瘤耐药的关键环节,通过与上下游靶点的协同作用,为肿瘤细胞提供生存信号。阿霉素耐药的乳腺癌细胞外泌体miR-221-3p可以在体外、体内通过靶向PIK3R1来抑制PI3K/AKT信号通路,从而促进乳腺癌细胞对阿霉素的耐药[18]。
2.2 外泌体lncRNA与乳腺癌耐药在ncRNA中,长度超过200个碱基的RNA被归类为lncRNA,通过顺式(邻近编码基因)或反式(不同染色体基因)作用调控基因的表达。lncRNA在细胞分化、组织器官发育、肿瘤转移等多个重要的生物学过程和疾病中发挥关键作用。外泌体lncRNA在肿瘤细胞侵袭、血管生成和耐药中发挥重要作用[24]。
2.2.1 外泌体传递lncRNA调节乳腺癌耐药Zheng等[23]发现,与亲本细胞相比,曲妥珠单抗耐药细胞中lncRNA AGAP2-AS1表达上调,AGAP2-AS1可以通过外泌体在乳腺癌细胞中传递曲妥珠单抗耐药性。Wang等[24]研究发现,阿霉素耐药乳腺癌细胞分泌的外泌体中lncRNA H19高表达,经外泌体介导的H19转移增强了乳腺癌细胞的耐药性,因此靶向外泌体H19可能是一种缓解阿霉素耐药的新策略。
HNRNPA2B1属于RNA结合蛋白,在许多生物学过程中发挥作用,其中一点就是形成RNA-RBP复合物来选择性地包装不同的RNA进入外泌体[40]。Han等[3]发现,lncRNA AFAP1-AS1在曲妥珠单抗耐药细胞上调,且以HNRNPA2B1依赖的方式包装到外泌体中。外泌体被敏感细胞吸收后,AFAP1-AS1通过与AUF1结合来促进ERBB2翻译,从而诱导HER-2蛋白水平上调和对曲妥珠单抗的耐药性。该团队还发现,外泌体lncRNA AGAP2-AS1通过促进ATG10表达来增加自噬,从而促进乳腺癌细胞对曲妥珠单抗的耐药[22]。
2.2.2 外泌体lncRNA调控相关信号通路介导乳腺癌耐药抵抗凋亡是肿瘤细胞的一大特点。细胞存活是抗凋亡与促凋亡信号之间的动态平衡,这些信号传递给Bcl2家族从而调控相关蛋白表达[41]。Bcl2家族由抗凋亡(Bcl2、Mcl、Bclw、Bfl1等)和促凋亡(Bax、Bak、Bik、Bim、Bid等)蛋白组成[41],两者作用相互拮抗。肿瘤细胞对抗肿瘤药物诱导凋亡的敏感度与线粒体中Bcl2/Bax比率密切相关。
Dong等[25]发现,与亲本细胞相比,曲妥珠单抗耐药乳腺癌细胞中lncRNA SNHG14上调,lncRNA SNHG14经外泌体传递到敏感细胞,靶向Bcl2/Bax凋亡信号通路,促进Bcl2表达、抑制Bax表达,抑制细胞凋亡,从而诱导曲妥珠单抗耐药;此外,与对曲妥珠单抗敏感的患者相比,耐药患者血清外泌体lncRNA SNHG14上调,鉴于外泌体的稳定性和易检测性,血清外泌体lncRNA SNHG14可作为乳腺癌的潜在诊断生物标志物。
2.2.3 外泌体lncRNA调控miRNA介导乳腺癌耐药目前,lncRNA对miRNA的调控机制主要有以下三种[42]:(1)lncRNA与miRNA竞争性结合mRNA,间接调控miRNA功能;(2)lncRNA作为竞争性内源RNA(competing endogenous RNA,ceRNA)吸附特定的miRNA,发挥海绵作用;(3)lncRNA借助胞内剪切作用形成miRNA前体(非成熟miRNA),进一步加工为成熟的miRNA后发挥功能。
最新研究发现[26],耐药细胞外泌体lncRNA OIP5-AS1表达上调,具有生物活性的OIP5-AS1进入敏感细胞后,对miR-381-3p发挥海绵作用,从而正向调节HMGB3,增强乳腺癌细胞对曲妥珠单抗的敏感度。紫杉醇耐药乳腺癌细胞外泌体lncRNA H19相较于亲本细胞表达较高,与敏感细胞共培养后,耐药细胞外泌体lncRNA H19可进入敏感细胞,通过下调miR-340-3p来诱导乳腺癌细胞耐药[27]。
2.3 外泌体circRNA与乳腺癌耐药circRNA在真核生物中含量丰富,有高度组织特异性、保守性,是前体RNA(pre-mRNA)在反向剪切机制下形成的单链、共价闭合环状ncRNA。circRNA通过与RNA结合蛋白相互作用或充当miRNA海绵在转录、转录后调节基因表达[43-44]。
起初,circRNA被认为是剪切的副产品,随着高通量测序的发展,在不同的肿瘤中发现了差异表达的circRNA[43]。与线性RNA不同,circRNA较稳定,不易被核酸内切酶降解,这一特点有助于它成为肿瘤液体活检的生物标志物。外泌体circRNA对肿瘤增殖、转移、侵袭、凋亡、血管生成以及抗肿瘤药物的敏感度均有调节功能,可作为新的治疗靶点用于治疗各种肿瘤,包括乳腺癌。
Hu等[28]发现,circ-UBE2D2在他莫昔芬耐药的乳腺癌组织和细胞系中表达上调,并且circ-UBE2D2在耐药细胞外泌体中显著过表达。亲本细胞摄取来自耐药细胞的外泌体后,circ-UBE2D2与miR-200a-3p相互作用,促进肿瘤细胞存活、转移,降低ERα水平,从而显著增强ERα阳性乳腺癌对他莫昔芬的耐药性。Zhang等[29]发现,在HER2阳性乳腺癌中,曲妥珠单抗耐药细胞分泌的外泌体中circ-HIPK3高表达,外泌体被敏感细胞吸收后,circ-HIPK3作为海绵竞争性地与miR-582-3p相互作用,上调RNF11表达,增强细胞增殖、侵袭能力,抑制细胞凋亡,以提高敏感细胞对曲妥珠单抗的耐药性。
3 小结使用抗肿瘤药物是乳腺癌治疗的主要方法之一,但耐药性的产生往往导致治疗失败。外泌体属于细胞外囊泡,在细胞间信号转导中发挥重要作用。外泌体携带的ncRNA(miRNA、lncRNA、circRNA)与乳腺癌耐药密切相关。尽管面临诸多挑战,但外泌体ncRNA可作为逆转耐药性的潜在靶点,可作为可靠的生物标志物,对乳腺癌的预测和治疗至关重要。
作者贡献:
郭鑫:查阅文献、撰写论文
杜华:查阅文献、绘制图表
师迎旭:指导及审校论文
| [1] |
Wilkinson L, Gathani T. Understanding breast cancer as a global health concern[J]. Br J Radiol, 2022, 95(1130): 20211033. DOI:10.1259/bjr.20211033 |
| [2] |
Zheng R, Zhang S, Zeng H, et al. Cancer incidence and mortality in China, 2016[J]. J Natl Cancer Cent, 2022, 2(1): 1-9. DOI:10.1016/j.jncc.2022.02.002 |
| [3] |
Han M, Gu Y, Lu P, et al. Exosome-mediated lncRNA AFAP1-AS1 promotes trastuzumab resistance through binding with AUF1 and activating ERBB2 translation[J]. Mol Cancer, 2020, 19(1): 26. DOI:10.1186/s12943-020-1145-5 |
| [4] |
Liang G, Zhu Y, Ali DJ, et al. Engineered exosomes for targeted co-delivery of miR-21 inhibitor and chemotherapeutics to reverse drug resistance in colon cancer[J]. J Nanobiotechnology, 2020, 18(1): 10. DOI:10.1186/s12951-019-0563-2 |
| [5] |
Gerard L, Duvivier L, Gillet JP. Targeting tumor resistance mechanisms[J]. Fac Rev, 2021, 10: 6. |
| [6] |
Patel NH, Xu J, Saleh T, et al. Influence of nonprotective autophagy and the autophagic switch on sensitivity to cisplatin in non-small cell lung cancer cells[J]. Biochem Pharmacol, 2020, 175: 113896. DOI:10.1016/j.bcp.2020.113896 |
| [7] |
Tsubata Y, Tanino R, Isobe T. Current Therapeutic Strategies and Prospects for EGFR Mutation-Positive Lung Cancer Based on the Mechanisms Underlying Drug Resistance[J]. Cells, 2021, 10(11): 3192. DOI:10.3390/cells10113192 |
| [8] |
Su D. MCM7 affects the cisplatin resistance of liver cancer cells and the development of liver cancer by regulating the PI3K/Akt signaling pathway[J]. Immunopharmacol Immunotoxicol, 2022, 44(1): 17-27. DOI:10.1080/08923973.2021.1991372 |
| [9] |
Wang JQ, Wang B, Ma LY, et al. Enhancement of anticancer drug sensitivity in multidrug resistance cells overexpressing ATP-binding cassette (ABC) transporter ABCC10 by CP55, a synthetic derivative of 5-cyano-6-phenylpyrimidin[J]. Exp Cell Res, 2021, 405(2): 112728. DOI:10.1016/j.yexcr.2021.112728 |
| [10] |
Choi JD, Kim TJ, Jeong BC, et al. ISL1 promotes enzalutamide resistance in castration-resistant prostate cancer (CRPC) through epithelial to mesenchymal transition (EMT)[J]. Sci Rep, 2021, 11(1): 21984. DOI:10.1038/s41598-021-01003-0 |
| [11] |
Nickoloff JA, Taylor L, Sharma N, et al. Exploiting DNA repair pathways for tumor sensitization, mitigation of resistance, and normal tissue protection in radiotherapy[J]. Cancer Drug Resist, 2021, 4(2): 244-263. |
| [12] |
Goh CY, Wyse C, Ho M, et al. Exosomes in triple negative breast cancer: Garbage disposals or Trojan horses?[J]. Cancer Lett, 2020, 473: 90-97. DOI:10.1016/j.canlet.2019.12.046 |
| [13] |
Yang Q, Zhao S, Shi Z, et al. Chemotherapy-elicited exosomal miR-378a-3p and miR-378d promote breast cancer stemness and chemoresistance via the activation of EZH2/STAT3 signaling[J]. J Exp Clin Cancer Res, 2021, 40(1): 120. DOI:10.1186/s13046-021-01901-1 |
| [14] |
Han M, Hu J, Lu P, et al. Exosome-transmitted miR-567 reverses trastuzumab resistance by inhibiting ATG5 in breast cancer[J]. Cell Death Dis, 2020, 11(1): 43. DOI:10.1038/s41419-020-2250-5 |
| [15] |
Zhao Y, Jin LJ, Zhang XY. Exosomal miRNA-205 promotes breast cancer chemoresistance and tumorigenesis through E2F1[J]. Aging (Albany NY), 2021, 13(14): 18498-18514. |
| [16] |
Liu J, Zhu S, Tang W, et al. Exosomes from tamoxifen-resistant breast cancer cells transmit drug resistance partly by delivering miR-9-5p[J]. Cancer Cell Int, 2021, 21(1): 55. DOI:10.1186/s12935-020-01659-0 |
| [17] |
Jia Z, Zhu H, Sun H, et al. Adipose Mesenchymal Stem Cell-Derived Exosomal microRNA-1236 Reduces Resistance of Breast Cancer Cells to Cisplatin by Suppressing SLC9A1 and the Wnt/β-Catenin Signaling[J]. Cancer Manag Res, 2020, 12: 8733-8744. DOI:10.2147/CMAR.S270200 |
| [18] |
Pan X, Hong X, Lai J, et al. Exosomal MicroRNA-221-3p Confers Adriamycin Resistance in Breast Cancer Cells by Targeting PIK3R1[J]. Front Oncol, 2020, 10: 441. DOI:10.3389/fonc.2020.00441 |
| [19] |
Yu DD, Wu Y, Zhang XH, et al. Exosomes from adriamycin-resistant breast cancer cells transmit drug resistance partly by delivering miR-222[J]. Tumour Biol, 2016, 37(3): 3227-3235. DOI:10.1007/s13277-015-4161-0 |
| [20] |
Li XJ, Ren ZJ, Tang JH, et al. Exosomal MicroRNA MiR-1246 Promotes Cell Proliferation, Invasion and Drug Resistance by Targeting CCNG2 in Breast Cancer[J]. Cell Physiol Biochem, 2017, 44(5): 1741-1748. DOI:10.1159/000485780 |
| [21] |
Santos JC, Lima NDS, Sarian LO, et al. Exosome-mediated breast cancer chemoresistance via miR-155 transfer[J]. Sci Rep, 2018, 8(1): 829. DOI:10.1038/s41598-018-19339-5 |
| [22] |
Qian X, Qu H, Zhang F, et al. Exosomal long noncoding RNA AGAP2-AS1 regulates trastuzumab resistance via inducing autophagy in breast cancer[J]. Am J Cancer Res, 2021, 11(5): 1962-1981. |
| [23] |
Zheng Z, Chen M, Xing P, et al. Increased Expression of Exosomal AGAP2-AS1 (AGAP2 Antisense RNA 1) In Breast Cancer Cells Inhibits Trastuzumab-Induced Cell Cytotoxicity[J]. Med Sci Monit, 2019, 25: 2211-2220. DOI:10.12659/MSM.915419 |
| [24] |
Wang X, Pei X, Guo G, et al. Exosome-mediated transfer of long noncoding RNA H19 induces doxorubicin resistance in breast cancer[J]. J Cell Physiol, 2020, 235(10): 6896-6904. DOI:10.1002/jcp.29585 |
| [25] |
Dong H, Wang W, Chen R, et al. Exosome-mediated transfer of lncRNA-SNHG14 promotes trastuzumab chemoresistance in breast cancer[J]. Int J Oncol, 2018, 53(3): 1013-1026. |
| [26] |
Yu Q, Li Y, Peng S, et al. Exosomal-mediated transfer of OIP5-AS1 enhanced cell chemoresistance to trastuzumab in breast cancer via up-regulating HMGB3 by sponging miR-381-3p[J]. Open Med (Wars), 2021, 16(1): 512-525. DOI:10.1515/med-2021-0249 |
| [27] |
董正远. 外泌体lncRNAH19调控miR-340-3p诱导乳腺癌紫杉醇耐药的研究[D]. 蚌埠医学院, 2021. [Dong ZY. Exosomal lncRNAH19 regulates miR-340-3p to induce paclitaxel resistance in breast cancer[D]. Bengbu Medical College, 2021.]
|
| [28] |
Hu K, Liu X, Li Y, et al. Exosomes Mediated Transfer of Circ_UBE2D2 Enhances the Resistance of Breast Cancer to Tamoxifen by Binding to MiR-200a-3p[J]. Med Sci Monit, 2020, 26: e922253. |
| [29] |
Zhang H, Yan C, Wang Y. Exosome-mediated transfer of circHIPK3 promotes trastuzumab chemoresistance in breast cancer[J]. J Drug Target, 2021, 29(9): 1004-1015. DOI:10.1080/1061186X.2021.1906882 |
| [30] |
Lin Q, Zhou CR, Bai MJ, et al. Exosome-mediated miRNA delivery promotes liver cancer EMT and metastasis[J]. Am J Transl Res, 2020, 12(3): 1080-1095. |
| [31] |
Usman RM, Razzaq F, Akbar A, et al. Role and mechanism of autophagy-regulating factors in tumorigenesis and drug resistance[J]. Asia Pac J Clin Oncol, 2021, 17(3): 193-208. DOI:10.1111/ajco.13449 |
| [32] |
Wen N, Lv Q, Du ZG. MicroRNAs involved in drug resistance of breast cancer by regulating autophagy[J]. J Zhejiang Univ Sci B, 2020, 21(9): 690-702. DOI:10.1631/jzus.B2000076 |
| [33] |
Spear JM, Lu Z, Russu WA. Pharmacological Inhibition of CDK8 in Triple-Negative Breast Cancer Cell Line MDA-MB-468 Increases E2F1 Protein, Induces Phosphorylation of STAT3 and Apoptosis[J]. Molecules, 2020, 25(23): 5728. DOI:10.3390/molecules25235728 |
| [34] |
Zhang M, Wang F, Xiang Z, et al. LncRNA XIST promotes chemoresistance of breast cancer cells to doxorubicin by sponging miR-200c-3p to upregulate ANLN[J]. Clin Exp Pharmacol Physiol, 2020, 47(8): 1464-1472. DOI:10.1111/1440-1681.13307 |
| [35] |
Zhong Z, Virshup DM. Wnt Signaling and Drug Resistance in Cancer[J]. Mol Pharmacol, 2020, 97(2): 72-89. DOI:10.1124/mol.119.117978 |
| [36] |
Bian P, Dou Z, Jia Z, et al. Activated Wnt/β-Catenin signaling contributes to E3 ubiquitin ligase EDD-conferred docetaxel resistance in prostate cancer[J]. Life Sci, 2020, 254: 116816. DOI:10.1016/j.lfs.2019.116816 |
| [37] |
Below M, Osipo C. Notch Signaling in Breast Cancer: A Role in Drug Resistance[J]. Cells, 2020, 9(10): 2204. DOI:10.3390/cells9102204 |
| [38] |
Pungsrinont T, Kallenbach J, Baniahmad A. Role of PI3K-AKT-mTOR Pathway as a Pro-Survival Signaling and Resistance-Mediating Mechanism to Therapy of Prostate Cancer[J]. Int J Mol Sci, 2021, 22(20): 11088. DOI:10.3390/ijms222011088 |
| [39] |
Liu R, Chen Y, Liu G, et al. PI3K/AKT pathway as a key link modulates the multidrug resistance of cancers[J]. Cell Death Dis, 2020, 11(9): 797. DOI:10.1038/s41419-020-02998-6 |
| [40] |
Zhou X, Wang L, Zou W, et al. hnRNPA2B1 Associated with Recruitment of RNA into Exosomes Plays a Key Role in Herpes Simplex Virus 1 Release from Infected Cells[J]. J Virol, 2020, 94(13): e00367-20. |
| [41] |
Senichkin VV, Pervushin NV, Zuev AP, et al. Targeting Bcl-2 Family Proteins: What, Where, When?[J]. Biochemistry (Mosc), 2020, 85(10): 1210-1226. DOI:10.1134/S0006297920100090 |
| [42] |
梁新丽, 徐希强, 董伟, 等. 外泌体来源的非编码RNA介导肿瘤耐药研究进展[J]. 国际药学研究杂志, 2020, 47(3): 163-168. [Liang XL, Xu XQ, Dong W, et al. Exosome-derived non-coding RNA-mediated chemotherapy resistance in cancer: research advances[J]. Guo Ji Yao Xue Yan Jiu Za Zhi, 2020, 47(3): 163-168.] |
| [43] |
Li Y, Feng W, Kong M, et al. Exosomal circRNAs: A new star in cancer[J]. Life Sci, 2021, 269: 119039. DOI:10.1016/j.lfs.2021.119039 |
| [44] |
郭马娣, 赵娟, 黄小义. 以外泌体为基础的液体活检在胰腺癌诊断中的研究进展[J]. 肿瘤防治研究, 2022, 49(3): 240-245. [Guo MD, Zhao J, Huang XY. Research Progress of Exosome-based Liquid Biopsy in Diagnosis of Pancreatic Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2022, 49(3): 240-245.] |
 2022, Vol. 49
2022, Vol. 49


