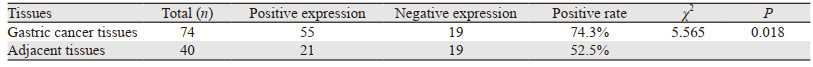文章信息
- m6A甲基化转移酶ZC3H13在胃癌组织和血清中的表达及临床意义
- Expression and Clinical Significance of m6A Methylatransferase ZC3H13 in Gastric Cancer Tissues and Serum
- 肿瘤防治研究, 2022, 49(8): 792-798
- Cancer Research on Prevention and Treatment, 2022, 49(8): 792-798
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0039
- 收稿日期: 2022-01-11
- 修回日期: 2022-03-12
2. 730050 兰州, 中国人民解放军联勤保障部队第九四〇医院肿瘤科;
3. 730000 兰州, 甘肃省人民医院普外二科;
4. 730050 兰州, 中国人民解放军联勤保障部队第九四〇医院眼科
2. Department of Oncology, The 940th Hospital of Joint Logistics Support Force of People's Liberation Army, Lanzhou 730050, China;
3. Second Department of General Surgery, Gansu Provincial People's Hospital, Lanzhou 730000, China;
4. Department of Ophthalmology, The 940th Hospital of Joint Logistics Support Force of People's Liberation Army, Lanzhou 730050, China
胃癌是全球最常见的恶性肿瘤之一,位居全国癌症发病率及死亡率排名的前两位,严重威胁着人们的健康和生活质量[1]。研究胃癌发生发展的分子机制对预防、诊断和治疗具有十分重要的意义。锌指CCCH结构域蛋白13(zinc finger CCCH domain containing protein 13, ZC3H13)作为m6A甲基化转移酶,与甲基转移酶样因子3(methyltransferase like 3, METTL3)、METTL14、METTL16、Wilms’肿瘤1相关蛋白(Wilms’ tumor 1-associated protein, WTAP)、RNA结合基序蛋白15(RNA-binding motif protein 15, RBM15)等形成甲基转移酶复合体共同调控RNA m6A甲基化[2]。许多研究已经证实ZC3H13在多种肿瘤组织中异常表达,在肿瘤的发生发展中扮演着重要的角色:ZC3H13在膀胱癌[3]、透明细胞肾癌[4]、甲状腺旁腺癌[5]、子宫内膜癌[6]中低表达;在肺腺癌[7]、宫颈鳞状细胞癌[8]、原发性肛门鳞状细胞癌[9]、卵巢癌[10]中高表达。目前尚缺乏ZC3H13在胃癌中作用的报道。本文拟探讨ZC3H13在胃癌组织和血清中的表达及其与临床病理特征的关系,旨在寻找一种新的胃癌生物标志物。
1 资料与方法 1.1 病例资料收集2020年12月—2021年12月中国人民解放军联勤保障部队第九四〇医院因胃癌入院行根治性手术,并经病理证实为胃腺癌的患者血清标本80例,其中男65例,女15例;年龄23~83岁,平均61.71±11.81岁。采用同期体检的50例健康者血清标本作为正常对照组,两组性别、年龄差异无统计学意义(均P≥0.05);另随机选取2012年12月—2014年6月行手术治疗的74例胃腺癌患者的癌组织以及40例非配对的癌旁正常组织,其中胃腺癌患者中男59例,女15例;年龄29~81岁,平均58.07±10.83岁。纳入标准:首次诊治;未经化疗、放疗或其他肿瘤相关生物学治疗;标本组织学分类、肿瘤分期明确;患者或其委托人知情同意。排除标准:曾行肿瘤相关放化疗、免疫治疗;严重心、肺、肝、肾等重要脏器功能不全者;临床资料不全者。本研究经中国人民解放军联勤保障部队第九四〇医院伦理委员会批准。
1.2 试剂ZC3H13 ELISA试剂盒购自中国江苏酶标生物科技有限公司;兔抗人ZC3H13多克隆抗体购自美国Sigma公司;即用型免疫组织化学SP试剂盒和PBS缓冲液购自福州迈新公司、柠檬酸组织抗原修复液、DAB显色试剂盒购自福州迈新生物技术开发有限公司。
1.3 数据库UALCAN(http://ualcan.path.uab.edu)是基于癌症基因组图谱(The Cancer Genome Atlas, TCGA)和MET500队列数据的交互式网络资源,用来分析肿瘤与正常组织差异基因的表达及与临床病理学参数的关系[11]。GEPIA(http://gepia.cancer-pku.cn)将TCGA癌症大数据和GTEx正常组织两者数据整合在一起,用来揭示癌症亚型、驱动基因、差异基因表达等,挖掘新型癌症靶点和标志物[12]。Kaplan-Meier Plotter数据库用来评估差异基因对21种癌症类型生存率的影响[13]。
1.4 标本制备取胃癌患者、正常对照组晨起空腹静脉血3 ml置于促凝管中,静置15 min后3 000 r/min离心15 min,取血清置于-80℃冰箱备用。癌旁正常组织取自距离癌灶5 cm处,术后病理证实均为正常胃壁组织,并制作成石蜡标本。
1.5 血清ZC3H13蛋白检测ZC3H13试剂盒采用ELISA法,R > 0.95;批内变异系数与批间变异系数应分别小于10%和15%;检测范围:0.3125~10 ng/ml;最低检测浓度小于0.1 ng/ml;严格依据试剂盒说明书进行操作。酶标仪在450 nm波长处依序测量各孔的吸光度(OD值)。
1.6 免疫组织化学检测组织中ZC3H13表达石蜡标本4 μm厚切片,二甲苯及不同浓度乙醇对组织进行脱蜡复水,柠檬酸盐高压修复,3%H2O2阻断内源性过氧化物酶,山羊血清室温封闭。一抗孵育:ZC3H13抗体使用一抗稀释液稀释至1:500,滴加生物素标记的二抗和链霉素-过氧化物酶溶液。DAB显色,苏木精对比染色。中性树胶封片,显微镜观察。
结果判定:由2名病理科副主任以上资历医师采取双盲法阅片。半定量法进行评分,以细胞核着色为主,偶有细胞质着色。肿瘤细胞胞核着色强度分为四个等级:0(无染色)、1(淡黄色)、2(棕黄色)、3(棕褐色或黑色);阳性肿瘤细胞占总体肿瘤细胞数百分率:1%~25%为1分、26%~50%为2分、51%~75%为3分、76%~100%为4分。将细胞阳性率及染色强度两者结果相乘,≥4分为高表达或阳性表达。
1.7 随访对于2012年12月—2014年6月的74例患者采用电话或门诊复查的方式进行随访,并通过病历系统进行查询和补充。随访截至2021年10月31日,出院后第一年内1、3、6、12月随访,以后每半年随访一次。失访病例按照删失值进行统计。OS定义为从患者确诊至随访结束或死亡。
1.8 统计学方法应用SPSS25.0软件进行分析。计量资料呈正态分布时以均数±标准差(x±s)表示,两样本间的比较采用t检验,多个样本间比较采用单因素方差分析。计数资料分析采用χ2检验或Fisher精确检验;生存曲线分析采用Kaplan-Meier法及Log rank检验;绘制ROC曲线以评价ZC3H13对胃癌的诊断价值。采用Cox比例风险模型进行多因素分析。P < 0.05为差异有统计学意义。
2 结果 2.1 数据库分析利用UALCAN及GEPIA两个数据库进行验证,发现ZC3H13在胃癌组织中显著高表达(P < 0.05),见图 1A、B。检索Kaplan-Meier Plotter及GEPIA数据库发现,ZC3H13蛋白高表达组的患者总生存期(overall survival, OS)与低表达组差异无统计学意义(P≥0.05),见图 1C、D。
|
| A: in GEPIA database, ZC3H13 was significantly highly-expressed in gastric cancer tissues, *: P < 0.05; B: in UALCAN database, ZC3H13 was significantly highly-expressed in gastric cancer tissues; C: Kaplan-Meier Plotter database; D: GEPIA database; STAD: stomach adenocarcinoma. 图 1 数据库分析ZC3H13蛋白在胃癌中的表达及与OS的关系 Figure 1 Expression of ZC3H13 in gastric cancer and its relation with OS analyzed by databases |
ELISA法检测结果显示,胃癌组血清ZC3H13蛋白浓度明显高于正常对照组((6.920±1.418)ng/ml vs.(4.969±1.360)ng/ml),差异有统计学意义(t=7.749, P < 0.0001),见图 2。

|
| 图 2 ELISA法检测胃癌患者和正常对照组血清ZC3H13的浓度表达水平 Figure 2 ZC3H13 levels in serum of gastric cancer patients and healthy controls detected by ELISA |
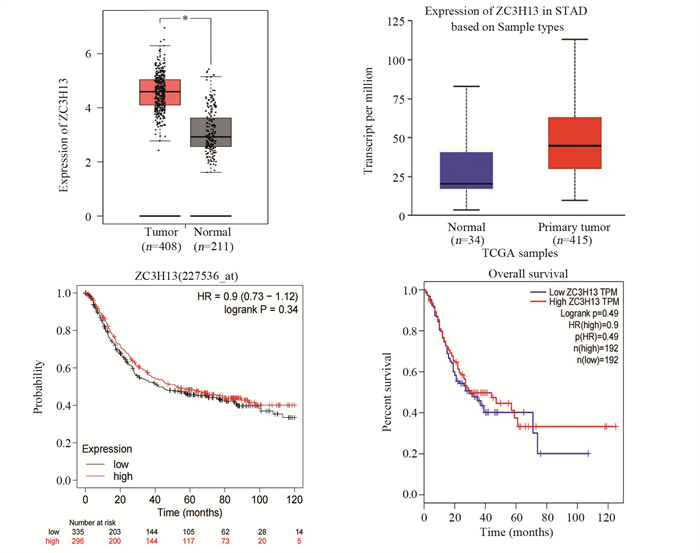
ROC曲线分析结果显示,胃癌患者与健康对照者ROC曲线下面积为0.826(P < 0.0001),见图 3。胃癌患者与健康对照者的最佳临界值为4.87 ng/ml,敏感度为98.8%,特异性为50%。
|
| 图 3 胃癌患者与健康对照者血清ZC3H13水平ROC曲线图 Figure 3 ROC curve of serum ZC3H13 levels in gastric cancer patients and healthy controls |
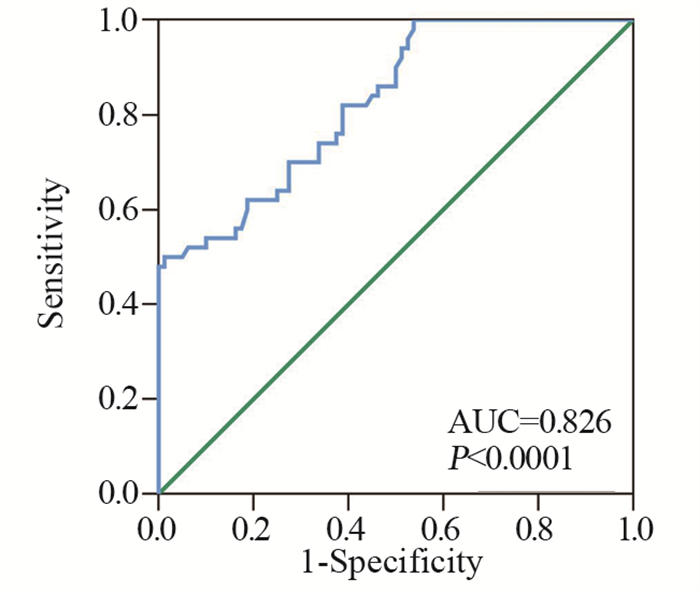
免疫组织化学结果显示,ZC3H13蛋白主要表达于细胞核,偶而表达于细胞质,见图 4。癌组织中55(74.3%)例阳性表达,非配对的癌旁正常组织19(52.5%)例阳性表达,差异有统计学意义(P < 0.05),见表 1。
|
| 图 4 ZC3H13在癌旁组织(A, ×100)和胃癌组织(B, ×100)中的免疫组织化学结果 Figure 4 Immunohistochemical results of ZC3H13 expression in adjacent tissues(A, ×100) and gastric cancer tissues(B, ×100) |
胃癌组织和外周血清中ZC3H13的表达水平均与胃癌患者的性别、分化程度、浸润深度和肿瘤分期相关(P < 0.05),见表 2。
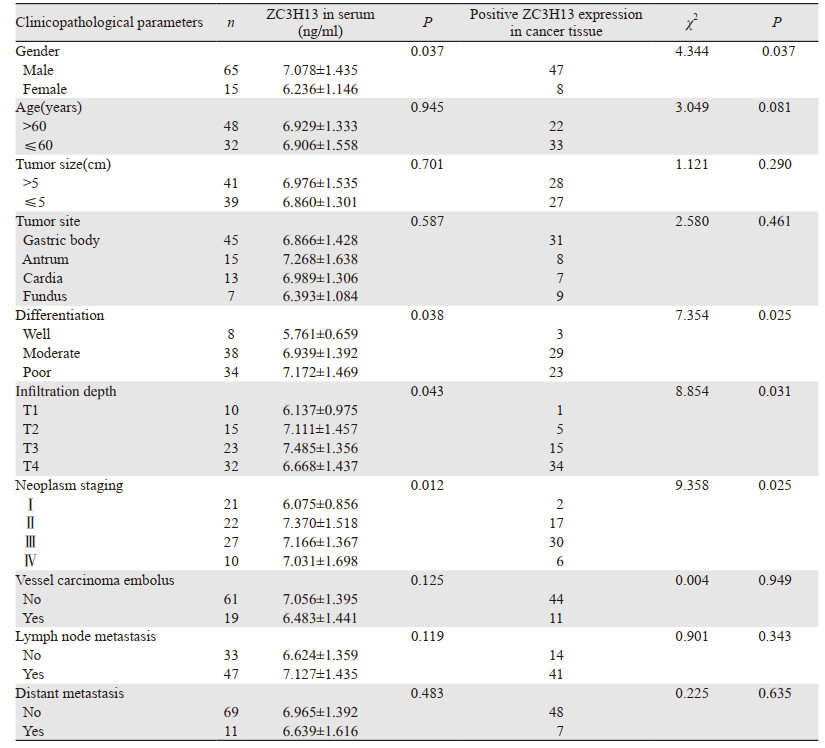
|
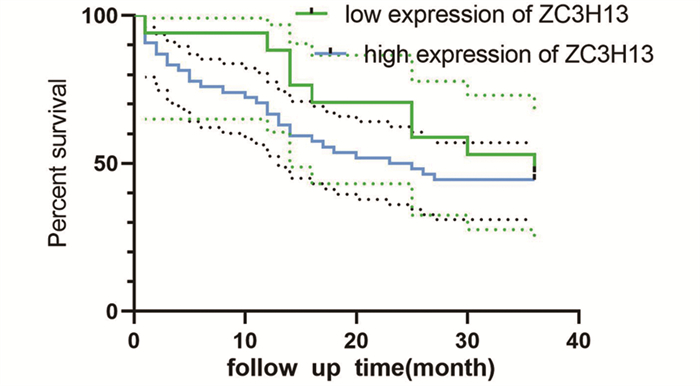
Kaplan-Meier生存曲线检验结果显示ZC3H13蛋白的表达高低与患者的3年总生存期差异无统计学意义(P≥0.05),见图 5。
|
| 图 5 胃癌患者中ZC3H13高表达与3年OS的关系 Figure 5 Relation between high ZC3H13 expression and 3-year OS of gastric cancer patients |
多因素生存分析中,将临床病理特征包括浸润深度、肿瘤分期、分化程度、ZC3H13表达纳入Cox回归模型(因性别因素的模型系数检验P=0.645,故未纳入分析)。结果显示,ZC3H13蛋白表达不是胃癌的独立预后因素(P≥0.05),见表 3。
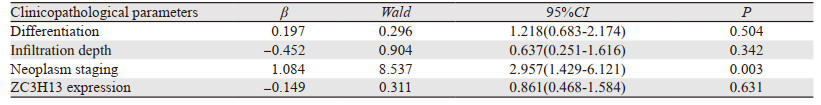
|
在胃癌发病初期,患者一般无明显症状或症状轻微、不典型,通常在进展期才被发现,5年总生存率低于40%。如果患者能在早癌阶段(限于胃壁的黏膜层)被检出并进行内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)治疗,其5年生存率可达85%,故早期发现并及早治疗对改善胃癌患者的预后具有重要意义[14]。因此寻找高灵敏度和特异性的胃癌生物标志物,将有助于了解胃癌发生发展机制,为临床预防、早期诊断和治疗胃癌提供有效的方法。
目前的研究证实ZC3H13是一个典型的CCCH型锌指蛋白,位于人类染色体13q14.13,含有1 729个氨基酸。在哺乳动物中高度保守,绝大多数存在于细胞质中,而在细胞内其他部位无明显表达[15]。Knuckles等[2]研究发现ZC3H13能够调节m6A甲基化,主要调控WTAP或甲基转移酶复合物在RNA上的募集并促进m6A修饰,负责与RBM15的连接,发挥支架作用协助ZC3H13/WTAP/KIAA1429/HAKAI的复合物进行核定位,确保m6A沉积到靶向转录本。此外,ZC3H13还可以调控胚胎干细胞自我更新以及RNA代谢,从而影响细胞的生长发育和疾病的发生[2, 16]。
近些年来,m6A RNA表观遗传修饰成为肿瘤研究的热点,研究发现m6A不仅可以调控编码RNAs,还可以修饰长链非编码RNA(long noncoding RNA, lncRNA),调控并影响m6A RNA的转录、加工、翻译和代谢等过程,参与肿瘤的发生发展[17]。越来越多的研究证实m6A RNA相关修饰酶与肿瘤的发生发展密切相关[18]。
最近有文献[19]报道,ZC3H13在结直肠癌组织中低表达,且其低表达与癌细胞转移和患者不良预后呈正相关。功能实验证实ZC3H13过表达可通过调控RAS-ERK信号通路抑制结直肠癌的发生发展。Gong等[20]研究发现METTL14和ZC3H13在乳腺癌中表达显著下调,其通过调控Wnt信号通路抑制剂抗原提呈细胞(antigen presenting cells, APC)m6A表达水平,异常激活肿瘤Wnt信号通路而促进乳腺癌的侵袭和转移。Guo等[21]研究发现ZC3H13在肾透明细胞癌(kidney renal clear cell carcinoma, KIRC)中低表达,而与患者的总生存期、无进展生存期和肿瘤特异性生存期无关。此外,ZC3H13可参与形成非炎性反应表型,并可预测KIRC患者免疫检查点的预后、临床反应及对靶向治疗的敏感度。
然而,到目前为止,ZC3H13在胃癌中的作用尚不清楚。因此,本研究分析了ZC3H13在胃癌组织和血清中的表达与临床意义,结果与UALCAN和GEPIA数据库中的一致。进一步的临床病理相关分析显示:胃癌组织和外周血血清中ZC3H13表达水平与患者的性别、分化程度、肿瘤分期和浸润深度相关。此外ZC3H13蛋白高表达组与低表达组的3年OS差异无统计学意义,与数据库检索结果一致。以上结果提示ZC3H13可能在胃癌的发生发展中发挥重要作用,对胃癌的诊断有一定的价值,有望成为早期筛查胃癌的肿瘤标志物。
本研究有一定局限性:(1)单中心的研究,患者主要来自单一省份地区,纳入的患者例数相对较少,可能会增大样本间的异质性,存在一定的风险偏倚;(2)纳入的患者中肿瘤进展或患者死亡的比例较低,随访结果可能无法达到预期目的;(3)未进行细胞功能实验及体内实验验证等深入的作用机制研究;(4)因条件限制纳入的样本量较小,因此所得结论并不一定能全面客观地反映ZC3H13在胃癌中的临床应用价值。
综上,m6A甲基化转移酶ZC3H13在胃癌组织中呈高表达,外周血血清中ZC3H13的浓度也明显升高,有望成为胃癌的新型生物标志物,未来有必要深入探究ZC3H13对胃癌细胞恶性表型的影响及其作用机制,为胃癌的诊断和治疗提供新的线索。
作者贡献:
贾丽娟:实验实施、实验数据统计及文章撰写
张云强:生物信息学数据的统计及处理
张百红、岳红云:文章修改
| [1] |
Siegel RL, Miller KD, Fuchs Hannah E, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. DOI:10.3322/caac.21708 |
| [2] |
Knuckles P, Lence T, Haussmann IU, et al. Zc3h13/Flacc is required for adenosine methylation by brid-ging the mRNA-binding factor Rbm15/Spenito to the m6A machinery component Wtap/Fl(2)d[J]. Genes Dev, 2018, 32(5-6): 415-429. DOI:10.1101/gad.309146.117 |
| [3] |
Chen M, Nie ZY, Wen XH, et al. m6A RNA methylation regulators can contribute to malignant progression and impact the prognosis of bladder cancer[J]. Biosci Rep, 2019, 39(12): BSR20192892. DOI:10.1042/BSR20192892 |
| [4] |
Chen J, Yu K, Zhong G, et al. Identification of a m6A RNA methylation regulators-based signature for predicting the prognosis of clear cell renal carcinoma[J]. Cancer Cell Int, 2020, 20: 157. DOI:10.1186/s12935-020-01238-3 |
| [5] |
Hou J, Shan H, Zhang Y, et al. m6A RNA methylation regulators have prognostic value in papillary thyroid carcinoma[J]. Am J Otolaryngol, 2020, 41(4): 102547. DOI:10.1016/j.amjoto.2020.102547 |
| [6] |
Zhai J, Li S, Sen S, et al. m6A RNA Methylation Regulators Contribute to Eutopic Endometrium and Myometrium Dysfunction in Adenomyosis[J]. Front Genet, 2020, 11: 716. DOI:10.3389/fgene.2020.00716 |
| [7] |
Zhuang Z, Chen L, Mao Y, et al. Diagnostic, progressive and prognostic performance of m6A methylation RNA regulators in lung adenocarcinoma[J]. Int J Biol Sci, 2020, 16(11): 1785-1797. DOI:10.7150/ijbs.39046 |
| [8] |
Pan J, Xu L, Pan H. Development and Validation of an m6A RNA Methylation Regulator-Based Signature for Prognostic Prediction in Cervical Squamous Cell Carcinoma[J]. Front Oncol, 2020, 10: 1444. DOI:10.3389/fonc.2020.01444 |
| [9] |
Trilla-Fuertes L, Ghanem I, Maurel J, et al. Comprehensive Characterization of the Mutational Landscape in Localized Anal Squamous Cell Carcinoma[J]. Transl Oncol, 2020, 13(7): 100778. DOI:10.1016/j.tranon.2020.100778 |
| [10] |
Fan L, Lin Y, Lei H, et al. A newly defined risk signature, consisting of three m6A RNA methylation regulators, predicts the prognosis of ovarian cancer[J]. Aging (Albany NY), 2020, 12(18): 18453-18475. |
| [11] |
Chandrashekard DS, Bashele B, Balasubramanys SAH, et al. UALCAN: a portal for facilitating tumor subgroup gene expression and survival analyses[J]. Neoplasia, 2017, 19(8): 649-658. DOI:10.1016/j.neo.2017.05.002 |
| [12] |
Tang Z, Li C, Kang B, et al. GEPIA: a web server for cancer and normal gene expression profiling and interactive analyses[J]. Nucleic Acids Res, 2017, 45(W1): W98-W102. DOI:10.1093/nar/gkx247 |
| [13] |
Nagy Á, Lánczky A, Menyhárt O, et al. Validation of miRNA prognostic power in hepatocellular carcinoma using expression data of independent datasets[J]. Sci Rep, 2018, 8(1): 9227. DOI:10.1038/s41598-018-27521-y |
| [14] |
Allemani C, Matsuda T, Carlo DV, et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries[J]. Lancet, 2018, 391(10125): 1023-1075. DOI:10.1016/S0140-6736(17)33326-3 |
| [15] |
Ouna BA, Stewart M, Helbig C, et al. The Trypanosoma brucei CCCH zinc finger proteins ZC3H12 and ZC3H13[J]. Mol Biochem Parasitol, 2012, 183(2): 184-188. DOI:10.1016/j.molbiopara.2012.02.006 |
| [16] |
Wen J, Lv R, Ma H, et al. ZC3H13 Regulates Nuclear RNA m6A Methylation and Mouse Embryonic Stem Cell Self-Renewal[J]. Mol Cell, 2018, 69(6): 1028-1038. DOI:10.1016/j.molcel.2018.02.015 |
| [17] |
Huang HL, Weng HY, Chen JJ. m6A Modification in Coding and Non-coding RNAs: Roles and Therapeutic Implications in Cancer[J]. Cancer Cell, 2020, 37(3): 270-288. DOI:10.1016/j.ccell.2020.02.004 |
| [18] |
Wei WQ, Ji XY, Guo XQ, et al. Regulatory role of N6-methyladenosine (m6A) methylation in RNA processing and human diseases[J]. J Cell Biochem, 2017, 118(9): 2534-2543. DOI:10.1002/jcb.25967 |
| [19] |
Zhu D, Zhou J, Zhao J, et al. ZC3H13 suppresses colorectal cancer proliferation and invasion via inactivating Ras-ERK signaling[J]. J Cell Physiol, 2019, 234(6): 8899-8907. DOI:10.1002/jcp.27551 |
| [20] |
Gong PJ, Shao YC, Yang Y, et al. Analysis of N6-Methyladenosine Methyltransferase Reveals METTL14 and ZC3H13 as Tumor Suppressor Genes in Breast Cancer[J]. Front Oncol, 2020, 10: 578963. DOI:10.3389/fonc.2020.578963 |
| [21] |
Guo T, Duan H, Chen J, et al. N6-Methyladenosine Writer Gene ZC3H13 Predicts Immune Phenotype and Therapeutic Opportunities in Kidney Renal Clear Cell Carcinoma[J]. Front Oncol, 2021, 11: 718644. DOI:10.3389/fonc.2021.718644 |
 2022, Vol. 49
2022, Vol. 49