文章信息
- 预测M0期炎性乳腺癌术后生存的新N分期系统
- A New N-staging System for Predicting Postoperative Survival of M0 Stage Inflammatory Breast Cancer
- 肿瘤防治研究, 2022, 49(8): 799-805
- Cancer Research on Prevention and Treatment, 2022, 49(8): 799-805
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1532
- 收稿日期: 2021-12-30
- 修回日期: 2022-04-28
2. 225000 扬州, 苏北人民医院甲乳外科
2. Department of Thyroid and Breast Surgery, Subei Peoplp's Hospital, Yangzhou 225000, China
炎性乳腺癌(inflammatory breast cancer, IBC)是罕见且极具侵袭性的乳腺癌亚型。与其他亚型相比,它的发病率和死亡率均最高,其发病率占所有乳腺癌的2%,死亡率占所有乳腺癌的7%[1-2]。尽管多模式治疗延长了患者的生存时间,但IBC的预后仍然较差,5年生存率不足50%[3]。美国癌症联合会(American Joint Committee on Cancer, AJCC)最新制定的第8版乳腺癌TNM分期中,仍将IBC患者划在T4d亚类[4],无论患者肿瘤大小或淋巴结转移状况如何,所有的非转移性IBC患者均被归为Ⅲ期,即ⅢB期(N0-2淋巴结状态)或ⅢC期(N3淋巴结状态),可见淋巴结信息在分期中没有得到充分利用。
在乳腺癌中,淋巴结状况是重要的预后指标之一,55%~85%的IBC患者在发病时腋窝淋巴结受累[5]。目前关于IBC预后与淋巴结状态之间关系的研究较少,因此,我们基于美国癌症中心SEER(Surveillance, Epidemiology and End Results)数据库中IBC患者数据,为M0期的IBC建立一个新的N分期系统。
1 资料与方法 1.1 数据准备使用SEER*State v8.3.9软件获取SEER数据库IBC病例。2004年1月1日至2012年12月31日的患者作为训练组,2013年1月1日至2015年12月31日的患者作为验证组。纳入标准:(1)原发部位局限于胸部;(2)第三版国际肿瘤疾病分类组织编码为8530,病理证实IBC。排除标准:(1)年龄 < 20岁;(2)发生远处转移;(3)患肿瘤数量 > 1个;(4)未行手术治疗、无法确定转移淋巴结数目(metastatic lymph node number, MLNN)和检出淋巴结数目(examined lymph node number, ELNN)。所有患者在手术治疗后均被随访至少1年,并根据第8版TNM分期系统定义进行重新分级。癌症特异性生存(cancer-specific survival, CSS)作为主要终点。
1.2 统计学方法在基线特征中,连续变量使用X-tile程序进行分类,分类变量被描述为频数和百分比。使用X-tile程序计算的MLNN和转移淋巴结比率(metastatic lymph node rate, MLNR)截断值对淋巴结信息进行分层,形成采用新标准的N分期系统,Kaplan-Meier法绘制CSS曲线,Log rank进行检验。单多因素Cox分析,并展示相应的95%置信区间(confidence interval, CI)。对比两个分期多因素Cox风险比例模型的一致性指数(concordance index, C-index)和时间依赖ROC(time dependent ROC, TD-ROC)曲线的受试者工作特征曲线下面积(area under curve, AUC)。构建列线图并验证,使用校正曲线和绘制决策曲线分析(decision curve analysis, DCA)进行模型评估。风险比(relative risk, HR)用于计算分期组之间的区分度,风险比越大,表明生存曲线之间的距离越远。采用SPSS25.0、R语言4.0.3、GraphPad Prism 8以及MedCalc软件进行数据分析。survival包和survminer包生成生存曲线,survival包计算C-index,rms包构建列线图,stDCA包进行DCA分析。TD-ROC曲线来源于R包survival ROC。P < 0.05为差异有统计学意义。
2 结果 2.1 患者临床特点共纳入1 001例经病理证实的IBC患者,其中740例发生淋巴结转移。MLNN的平均值为5.49,ELNN的平均值为12.78,确诊时的平均年龄为56岁,平均癌症特异性生存时间为54.9个月。患者的临床特征,见表 1。
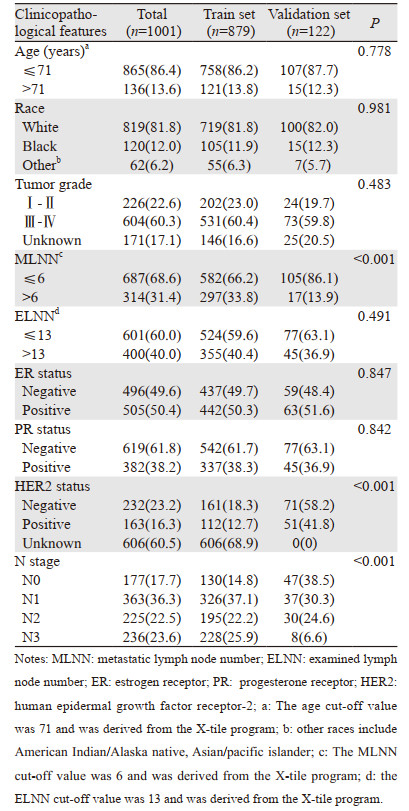
|
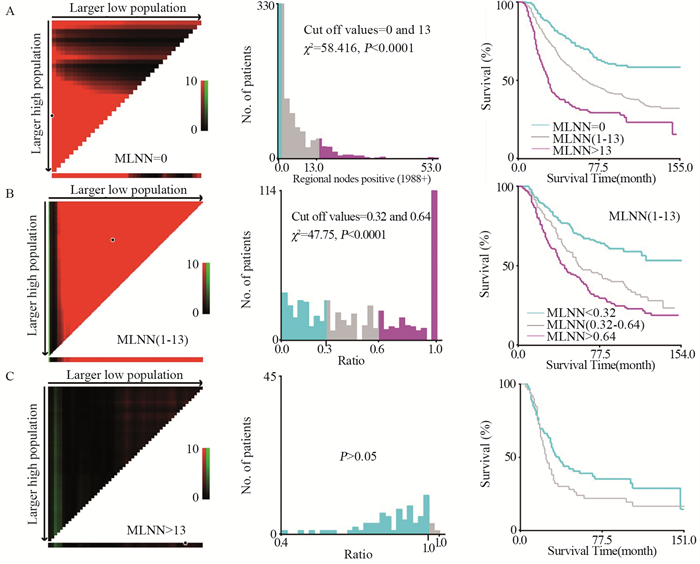
使用X-tile程序计算MLNN的最佳截断值。结果显示,0和13是MLNN的最佳截断值(P < 0.001),见图 1A。以MLNR为条件,将患者分为三组:MLNN=0、1≤MLNN≤13、MLNN > 13,分别对这三个亚组进行分析,结果显示:MLNN=0时,MLNR值为0,无法继续分组。1≤MLNN≤13时,0.32和0.64是MLNR的最佳截断值(P < 0.001),见图 1B。MLNN > 13时,以MLNR为截断值的分组无统计学意义,见图 1C。本研究根据MLNN截断值0和13将患者分为三组:MLNN=0、1≤MLNN≤13和MLNN > 13。再将,1≤MLNN≤13组的患者根据MLNR的截断值0.32和0.64又分为三个亚组。最终我们一共得到5个亚组:MLNN=0、1≤MLNN≤13且MLNR < 0.32、1≤MLNN≤13且0.32≤MLNR < 0.64、1≤MLNN≤13且MLNR≥0.64和MLNN > 13。采用Kaplan-Meier法对5个亚组进行分析发现:MLNN=0和1≤MLNN≤13且MLNR < 0.32两个组之间差异无统计学意义,因此将这两个亚组合并,形成了新的N分期系统:N0:0≤MLNN≤13且MLNR < 0.32;N1:1≤MLNN≤13且0.32≤MLNR < 0.64;N2:1≤MLNN≤13且MLNR≥0.64;N3:MLNN > 13,见图 2。
|
| MLNN: metastatic lymph node number, MLNR: metastatic lymph node rate. 图 1 基于肿瘤特异性生存率,使用X-tile分析确定MLNN(A)和MLNR(B: 1≤MLNN≤13; C: MLNN > 13)的最佳截断值 Figure 1 Optimal cutoff value of MLNN(A) and MLNR (B: 1≤MLNN≤13; C: MLNN > 13) identified by X-tile software based on cancer-specific survival |

|
| 图 2 基于MLNN和MLNR形成新的N分期系统 Figure 2 A new N-staging system based on MLNN and MLNR |
Cox单因素分析结果显示,新的N分期系统、年龄、种族、MLNN、激素受体状态及放化疗均是有意义的预测因素(P < 0.001)。将以上因素纳入多因素Cox分析显示,新的N分期系统仍然可以独立预测(P < 0.001)。年龄 > 71岁、黑人、PR阴性、HER2阴性和未行放化疗也与较差的预后独立相关(P < 0.05),见表 2。
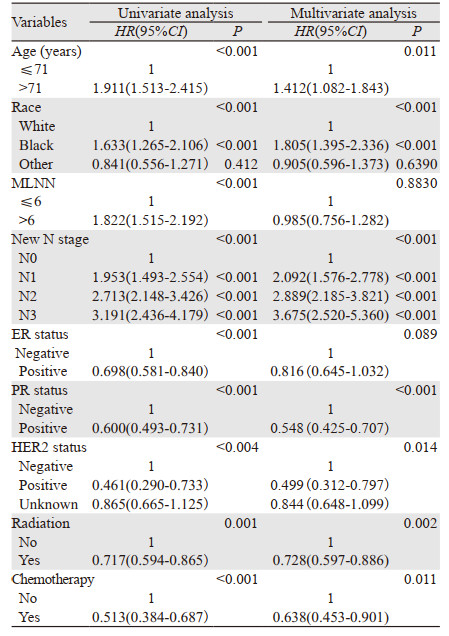
|
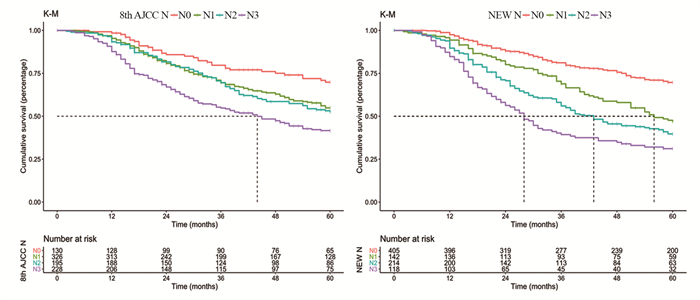
对两个N分期系统进行比较,新N分期系统的生存曲线显示出较好的区分性,见图 3。在新N分期中的每个亚分期,患者的5年CSS中同样具有较好的区分性,N0、N1、N2和N3的5年CSS率分别为69.7%、46.9%、39.7%和31.1%。AJCC的N分期中N0、N1、N2和N3的5年CSS结果分别为69.8%、54.9%、52.6%和41.7%,见表 3。结果表明:新N分期系统在HR分层上同样比AJCC系统显示出更好的区分性。新N分期系统和AJCC系统的C-index分别为0.711(95%CI: 0.686~0.736)和0.677(95%CI: 0.650~0.703)(χ2=80.363, P < 0.0001)。
|
| 图 3 新N分期和第8版AJCC-N分期系统的比较(Kaplan-Meier法) Figure 3 Comparison of new N-staging and the eighth edition of AJCC-N staging by Kaplan-Meier analysis |

|
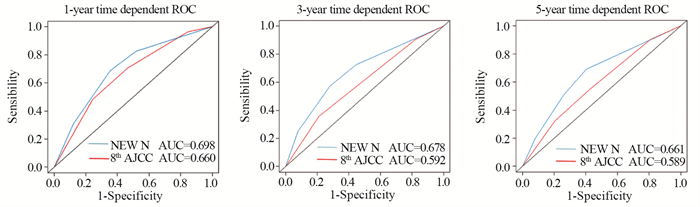
使用ROC曲线比较两个分期系统的评估能力时,新N分期系统的AUC值为0.680(95%CI: 0.648~0.711),AJCC-N分期系统的AUC值为0.606(95%CI: 0.573~0.639)。两分期之间曲线下面积差异为0.0735(95%CI: 0.044~0.103, P < 0.001),见图 4。标准的ROC曲线分析将个体的疾病状态和因素取值视作固定值,未结合时间因素,所以我们使用TD-ROC再次作了比较,在1、3、5年的TD-ROC中,新的N分期系统的AUC值分别为:0.698、0.678、0.661。AJCC系统的AUC值分别为:0.660、0.592、0.589。新N分期系统的TD-ROC的AUC值均高于AJCC系统,表现出良好的评估能力,见图 5。

|
| 图 4 标准ROC曲线分析新N分期与AJCC-N分期的评估能力 Figure 4 Evaluation capacity of new N-staging and AJCC-N staging analyzed by standard ROC curve |
|
| 图 5 时间依赖ROC验证新N分期与AJCC-N分期的评估能力 Figure 5 Evaluation capacity of new N-staging and AJCC-N staging verified by time-dependent ROC curves |
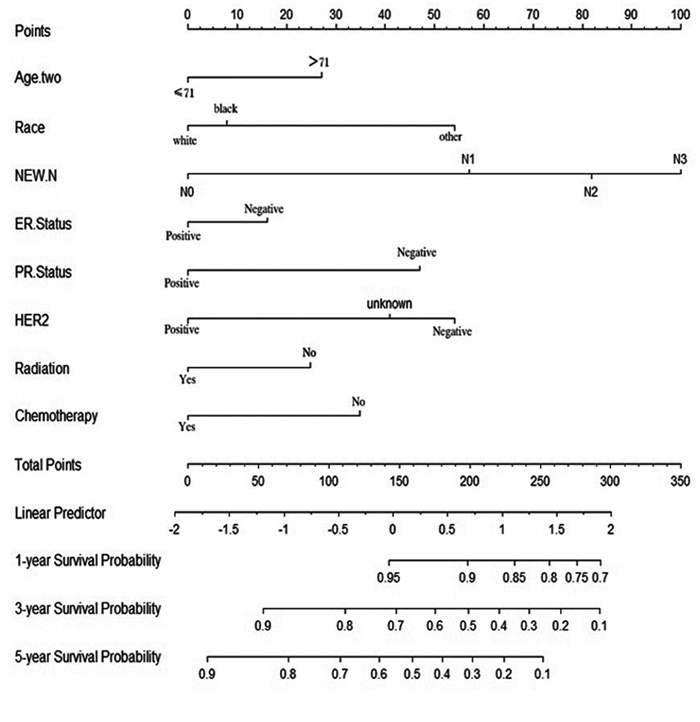
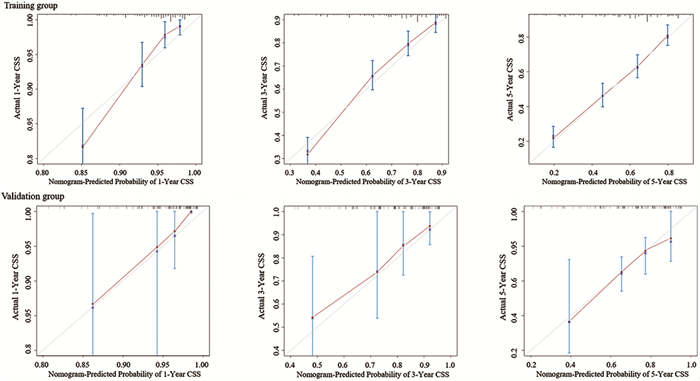
在多因素Cox风险比例回归模型分析的基础上构建列线图,见图 6。该模型的C-index为0.711,在代入验证组数据计算后所得C-index为0.736,相比之下,AJCC的N分期模型C-index为0.677。采用校准曲线对列线图的一致性进行评估,见图 7,校准图横坐标为预测的生存率,纵坐标为实际的生存率,对角线是预测概率等于实际概率,偏离对角线越远说明预测的误差越大。研究所得预测曲线基本与对角线重合,显示列线图所预测的生存率与实际生存率之间有高度的一致性,模型具有良好预测效能。
|
| 图 6 预测1、3、5年乳腺癌特异性生存的列线图预后模型 Figure 6 Prediction of 1-, 3- and 5-year breast cancer-specific survival by nomograph prognostic model |
|
| 图 7 列线图预后模型的校准曲线 Figure 7 Calibration curve of nomograph prognostic model |
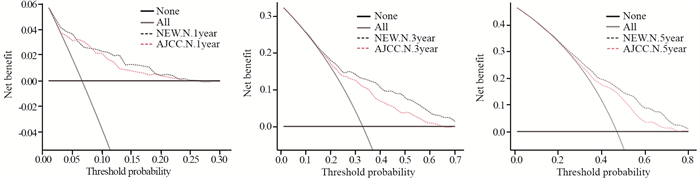
绘制DCA来进一步对比列线图与AJCC-N分期系统的临床应用价值,两个分期系统在1、3、5年CSS的决策曲线中,新N分期参与构建的列线图的净收益率总体上均优于AJCC-N分期,显示出新N分期具有良好的临床效能,见图 8。
|
| 图 8 新N分期与AJCC-N分期系统的1、3、5年的决策曲线 Figure 8 Decision curves of the new N staging system and AJCC-N staging system at 1-, 3- and 5-years |
AJCC制定的TNM分期对乳腺癌生存的预测能力是不可否认的[6]。然而,IBC与非IBC的临床特征、预后以及分子分型的分布均有不同,IBC较非IBC预后更差,三阴性乳腺癌占比更高,侵袭性更强[7],传统的分期系统是基于非IBC患者数据而建立的,且IBC患者的淋巴结信息在分期中没有得到充分利用,不足以精准预测IBC患者的生存。部分研究结果显示:MLNR、阳性淋巴结状态是独立预后因素,并结合MLNR提出过新的分期系统[8-10]。但上述研究,验证方法仅限于Kaplan-Meier分析,或仅使用MLNR一个因素,或仅限于非IBC患者,目前还没有针对性的在IBC患者中将MLNN和MLNR结合使用的先例。
本研究将MLNN与MLNR结合,针对未发生远处转移的术后IBC患者提出了新的N分期。两者联合包含两个重要的信息,即区域转移和外科手术处理,均被认为与预后相关[11-12]。而乳腺癌改良根治术是IBC患者的标准手术方式[13],这证明了所获得的淋巴结状态信息的完整性。值得注意的是,在Cox分析中,肿瘤大小并不是IBC的预后影响因素。我们认为有三个主要原因导致了这个结果。首先,临床上许多IBC病例在体检时没有明显的肿块[14],结合影像学检查更易发现疾病。而IBC的炎性反应征象如弥漫性红斑、继发水肿引起的乳腺密度改变会掩盖真实影像[15]。在SEER数据库的字段中,有关肿瘤大小的“CS TUMOR SIZE”字段解释说明:乳腺X线显示2.5 cm的乳腺癌,记作代码025,即肿瘤大小为2.5 cm。说明有一部分肿瘤大小信息是根据影像学资料记载的,而影像学表现可能会因IBC弥漫性的炎性反应征象产生一定的误差。其次,在病理学家的观点中,IBC这类侵袭性肿瘤通常不伴有明显的导管内成分,并且经常广泛浸润间质,使得在大体病理检查中难以准确评估肿瘤的大小和范围[12]。最后,三阴性乳腺癌在IBC发生的比例可达30%~40%,这一比例在非IBC中仅占20%[16-17],且IBC是乳腺癌中侵袭性最强的实体,生存时间相对较短,预后差,独特的病理特性导致出现这样的结果。
为评估新的N分期系统在预测预后方面的优势,我们与AJCC-N分期系统进行了对比。新N分期系统获得的4个亚分期的生存曲线之间得到充分分离,4个亚组之间P值均小于0.001。新N分期系统中N0、N1、N2和N3的5年CSS分别为69.7%、46.9%、39.7%和31.1%。相比之下,AJCC-N分期系统所对应的5年CSS结果分别为69.8%、54.9%、52.6%和41.7%。研究所得数据与文献报道的IBC患者预后较差,5年生存率不足50%[3]的事实高度一致,表明新的N分期系统不仅提高了亚分期之间的区分度,也更真实地反映了M0期IBC患者术后的生存率。新N分期系统的AUC值为0.680,AJCC-N分期系统的AUC值为0.606,均不足0.7,但两个分期的AUC差异具有统计学意义(P < 0.001)。同时,新的N分期参与构建的列线图模型经过内外部验证,显示出良好的预测能力,C-index达到了0.711。
同时,本研究存在的局限性:第一,由于研究的回顾性,这种时间框架上的差异可能造成了患者治疗方案的差异,特别是在抗HER2治疗方面。Rueth等报道,在SEER数据库中,只有60%~70%的IBC患者接受了三联疗法(化疗、手术和放疗),而且其利用不足会对IBC患者的生存产生负面影响[18]。然而SEER数据库本身缺乏具体的治疗方案,我们无法比较治疗细节;第二,数据库中部分患者信息存在不完整的情况,我们选择保留生存信息、临床病理信息均有记录的病例;第三,回溯地建立了列线图,这可能会导致潜在的选择偏差;第四,IBC是一种罕见的疾病,临床难以获得足量的现实病例数据进行验证,是本研究的遗憾。
总之,本研究中,新N分期系统对IBC的临床生存预测比传统分期更准确。这表明在传统的分期系统中充分利用淋巴结状态信息加以分层,可以提供准确的预后信息,并设计根据风险对患者进行分类的临床试验。由于与非IBC相比,IBC的侵袭性和预后不同,研究同样说明目前的TNM分期对于这种特殊类型的乳腺癌并不适用,特殊类型的乳腺癌需要有其特殊的临床评价标准及治疗指南,未来我们希望可以更加充分地发掘利用可获得临床信息,探索完善出一种更好的基于IBC数据的分期系统,从而更精准的服务临床。
作者贡献:
隋大星:选题、统计学分析及论文撰写
王雪莹:下载和处理原始数据、论文修改
章佳新:文章整体构思、论文审阅
| [1] |
Fouad TM, Kogawa T, Liu DD, et al. Overall survival differences between patients with inflammatory and noninflammatory breast cancer presenting with distant metastasis at diagnosis[J]. Breast Cancer Res Treat, 2015, 152(2): 407-416. DOI:10.1007/s10549-015-3436-x |
| [2] |
Devi GR, Hough H, Barrett N, et al. Perspectives on Inflammatory Breast Cancer (IBC) Research, Clinical Management and Community Engagement from the Duke IBC Consortium[J]. J Cancer, 2019, 10(15): 3344-3351. DOI:10.7150/jca.31176 |
| [3] |
Arias-Pulido H, Cimino-Mathews AM, Chaher N, et al. Differential effects of CD20+ B cells and PD-L1+ immune cells on pathologic complete response and outcome: comparison between inflammatory breast cancer and locally advanced breast cancer patients[J]. Breast Cancer Res Treat, 2021, 190(3): 477-489. DOI:10.1007/s10549-021-06391-5 |
| [4] |
Cserni G, Chmielik E, Cserni B, et al. The new TNM-based staging of breast cancer[J]. Virchows Arch, 2018, 472(5): 697-703. DOI:10.1007/s00428-018-2301-9 |
| [5] |
Kinoshita T, Goto T. Links between Inflammation and Postoperative Cancer Recurrence[J]. J Clin Med, 2021, 10(2): 228. DOI:10.3390/jcm10020228 |
| [6] |
Kida K, Hess KR, Lim B, et al. Validation of Prognostic Stage and Anatomic Stage in the American Joint Committee on Cancer 8th Edition for Inflammatory Breast Cancer[J]. Cancers (Basel), 2020, 12(11): 3105. DOI:10.3390/cancers12113105 |
| [7] |
Wang Z, Wang H, Ding X, et al. A large-cohort retrospective study of metastatic patterns and prognostic outcomes between inflammatory and non-inflammatory breast cancer[J]. Ther Adv Med Oncol, 2020, 12: 1758835920932674. |
| [8] |
Liu C, Li H, Zhuo R, et al. Grade-lymph node ratio predicts the survival of breast cancer in different molecular types: A surveillance, epidemiology, and end results population-based analysis[J]. Medicine (Baltimore), 2019, 98(28): e16436. DOI:10.1097/MD.0000000000016436 |
| [9] |
Oven Ustaalioglu BB, Bilici A, Kefeli U, et al. Does the metastatic lymph node ratio influence the disease-free survival of patients with breast cancer: single-center experiences[J]. Oncology, 2010, 79(1-2): 105-111. DOI:10.1159/000320162 |
| [10] |
Wecsler JS, Tereffe W, Pedersen RC, et al. Lymph node status in inflammatory breast cancer[J]. Breast Cancer Res Treat, 2015, 151(1): 113-120. DOI:10.1007/s10549-015-3367-6 |
| [11] |
Rosso KJ, Tadros AB, Weiss A, et al. Improved Locoregional Control in a Contemporary Cohort of Nonmetastatic Inflammatory Breast Cancer Patients Undergoing Surgery[J]. Ann Surg Oncol, 2017, 24(10): 2981-2988. DOI:10.1245/s10434-017-5952-x |
| [12] |
Mamouch F, Berrada N, Aoullay Z, et al. Inflammatory Breast Cancer: A Literature Review[J]. World J Oncol, 2018, 9(5-6): 129-135. DOI:10.14740/wjon1161 |
| [13] |
Adesoye T, Lucci A. Current Surgical Management of Inflammatory Breast Cancer[J]. Ann Surg Oncol, 2021, 28(10): 5461-5467. DOI:10.1245/s10434-021-10522-z |
| [14] |
Fouad TM, Barrera AMG, Reuben JM, et al. Inflammatory breast cancer: a proposed conceptual shift in the UICC-AJCC TNM staging system[J]. Lancet Oncol, 2017, 18(4): e228-e232. DOI:10.1016/S1470-2045(17)30192-4 |
| [15] |
Schairer C, Hablas A, Eldein IAS, et al. Clinico-pathologic and mammographic characteristics of inflammatory and non-inflammatory breast cancer at six centers in North Africa[J]. Breast Cancer Res Treat, 2019, 176(2): 407-417. DOI:10.1007/s10549-019-05237-5 |
| [16] |
Bertucci F, Rypens C, Finetti P, et al. NOTCH and DNA repair pathways are more frequently targeted by genomic alterations in inflammatory than in non-inflammatory breast cancers[J]. Mol Oncol, 2020, 14(3): 504-519. DOI:10.1002/1878-0261.12621 |
| [17] |
Li J, Gonzalez-Angulo AM, Allen PK, et al. Triple-negative subtype predicts poor overall survival and high locoregional relapse in inflammatory breast cancer[J]. Oncologist, 2011, 16(12): 1675-1683. DOI:10.1634/theoncologist.2011-0196 |
| [18] |
Rueth NM, Lin HY, Bedrosian I, et al. Underuse of trimodality treatment affects survival for patients with inflammatory breast cancer: an analysis of treatment and survival trends from the National Cancer Database[J]. J Clin Oncol, 2014, 32(19): 2018-2024. DOI:10.1200/JCO.2014.55.1978 |
 2022, Vol. 49
2022, Vol. 49


