文章信息
- 前列腺癌免疫治疗研究热点的可视化分析
- Research Hotspots and Frontiers of Immunotherapy for Prostate Cancer: A Visual Analysis
- 肿瘤防治研究, 2022, 49(7): 667-674
- Cancer Research on Prevention and Treatment, 2022, 49(7): 667-674
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1486
- 收稿日期: 2021-12-21
- 修回日期: 2022-02-28
2. 730000 兰州,甘肃省人民医院泌尿外科
2. Department of Urology, Gansu Provincial People's Hospital, Lanzhou 730000, China
前列腺癌是指发生在前列腺的上皮性恶性肿瘤,是男性泌尿生殖系统最常见的恶性肿瘤之一。2020年全球癌症统计指出,前列腺癌发病例数占男性总发病例数的14.1%,死亡例数占男性总死亡率的6.8%[1]。当前我国前列腺癌发病率仍处于较低水平,但随着老龄化人口增加、生活条件改善及医疗水平的提高,我国前列腺癌的发病率呈现逐年增加的趋势,已经成为危害我国男性生命健康最常见的恶性肿瘤之一[2]。由于前列腺癌具有显著的肿瘤异质性,因此如何对前列腺癌患者进行精准化和个体化治疗一直是领域内研究重点。目前,前列腺癌的治疗以主动监测、前列腺癌根治术、化疗等为主。研究表明随着内分泌治疗的进行,多数患者出现对内分泌药物抵抗的现象,进入去势抵抗性前列腺癌(castration resistant prostate cancer, CRPC)阶段,最终会发展为转移性去势抵抗性前列腺癌(metastatic castration resistant prostate cancer, mCRPC)[3]。免疫治疗利用激活抗癌宿主免疫细胞达到杀伤肿瘤效果,已广泛应用于包括前列腺癌等多种恶性肿瘤。免疫治疗作为标准治疗无效的后续个体化治疗,近年来随着Sipuleucel-T、肿瘤相关抗原特异性单克隆抗体以及免疫检查点抑制剂(immune checkpoint inhibitors, ICI)等发展受到越来越多的重视。因此,对该领域的研究文献进行科学性的归纳总结具有重要意义。文献计量学是一组数学和统计方法,用于分析和衡量书籍、文章和其他形式的出版物的数量和质量[4]。CiteSpace和VOSviewer是当前功能最全面、使用最广泛的可视化工具,可用于某一领域的发展趋势和热点前沿的跟踪分析[5-6]。本文利用文献计量学对近20年前列腺癌免疫治疗相关文献进行梳理分析,可视化展示前列腺癌免疫治疗的演进历程,以期预测未来研究方向,为前列腺癌免疫治疗提供可参考的理论依据。
1 资料与方法 1.1 文献检索策略计算机检索Web of Science核心合集数据库,搜索2002—2021年发表的与前列腺癌免疫治疗相关的所有文献,检索词为TS=(“Prostate Neoplasm*”)AND(“Immunotherap*”),采用主题词与自由词结合展开检索。
1.2 文献纳入与排除标准纳入标准:(1)语种为英语;(2)类型为论著类。排除标准:(1)非英语文献;(2)其他文献类型,如Review articles、Proceedings papers、Book chapters、Early access、Retracted publications;(3)重复发表的研究。
1.3 文献筛选与资料提取由2位研究者独立对文献进行数据提取并交叉核对,如有争议,与第3位研究者讨论决定是否纳入。每条数据包含参考文献及全记录,保存为纯文本文件用于可视化分析。
1.4 研究方法CiteSpace5.8.3R和VOSviewer1.6.17软件对文献进行可视化分析,节点类型分别选择国家/地区、研究机构、作者、关键词。对引用文献进行聚类分析和时间线视图,用于筛选重要文献并绘制热点演进进程。将时间跨度设置为2002—2021年,单个时间分区的长度设置为1年,关联强度为cosine,阈值项选择“Top N”,在每一个时间片段中选择前100个高频节点进行数据分析,对网络不采取剪切,以期获得更多的数据来进行可视化分析。2020年版的期刊引证报告(JCR)和影响因子(IF)作为衡量研究领域内期刊科学价值的重要指标。
2 结果 2.1 检索结果2002年1月—2021年12月Web of Science核心合集数据库收录前列腺癌免疫治疗相关文献共计3 751篇文献,排除不相关研究(Review articles 1 320篇、Proceedings papers 59篇、Book chapters 26篇、Early access 18篇、Retracted publications 2篇)后,最终纳入2 326篇文献,年度发文量,见图 1。
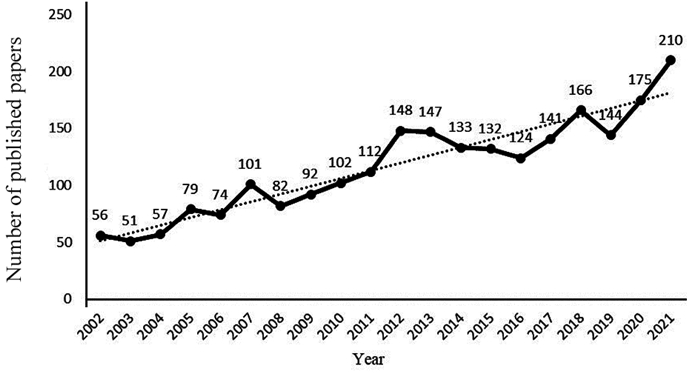
|
| 图 1 2002-2021年度发文量 Figure 1 Annual number of published papers, 2002-2021 |
共有71个国家/地区为前列腺癌免疫治疗相关研究做出贡献。2002—2021年间,美国发文量最多(1 260篇),其次为中国(348篇)、德国(182篇)。发文量前10的国家/地区中心性超过0.1的国家有3个,分别是美国、德国和意大利,表明这些国家在前列腺癌免疫治疗领域内与其他国家合作交流密切,见表 1。国家/地区分布及合作网络视图,见图 2。
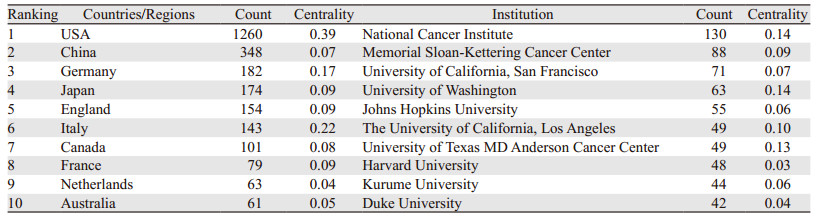
|
|
| 图 2 国家/地区合作网络图谱 Figure 2 Cooperation network of countries/regions |
2002—2021年该领域发文量前10的研究机构见表 1。其中,美国国家癌症研究所(130),纪念斯隆-凯特琳癌症中心(88)和加利福尼亚大学旧金山分校(71)发文量居前三,表明在该领域内影响力重大。在研究机构密度图谱中,美国国家癌症研究所,纪念斯隆-凯特琳癌症中心等处于黄色区域的机构为该领域研究中的热点机构,见图 3。
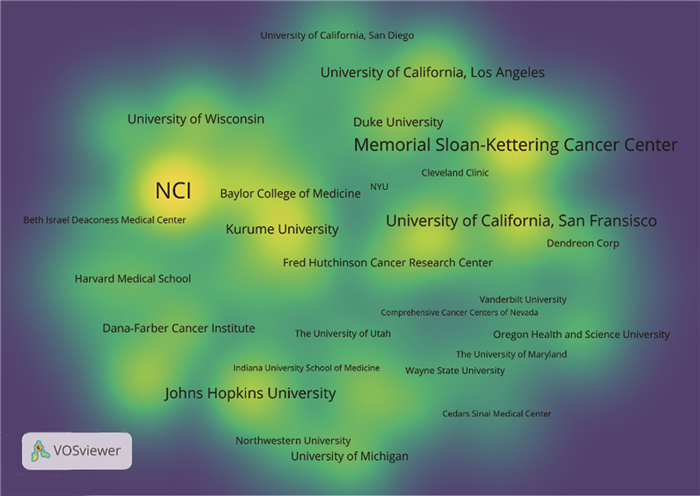
|
| 图 3 2002—2021年度研究机构密度图谱 Figure 3 Density map of research institutions, 2002—2021 |
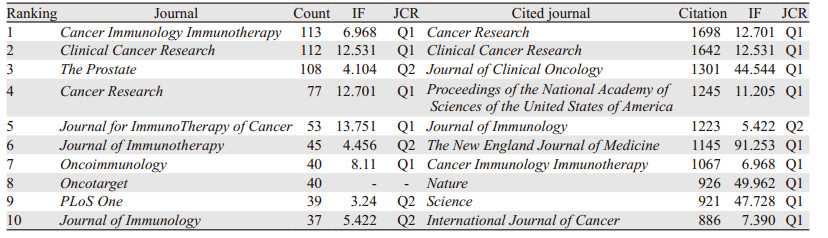
研究纳入的2 326篇文献共涉及556个期刊,刊文量及被引用次数最多的前10个期刊中心性、影响因子(IF)及期刊引用报告(JCR)等数据,见表 2。结果显示刊文量排名前3的期刊分别为Cancer Immunology Immunotherapy、Clinical Cancer Research和The Prostate,总发文333篇,占文献总量的14.32%;被引用期刊中Cancer Research、Clinical Cancer Research和Journal of Clinical Oncology引用最多,分别是1 698次、1 642次和1 301次,表明这些期刊在前列腺癌免疫治疗的发展进展中起到重要作用。
|
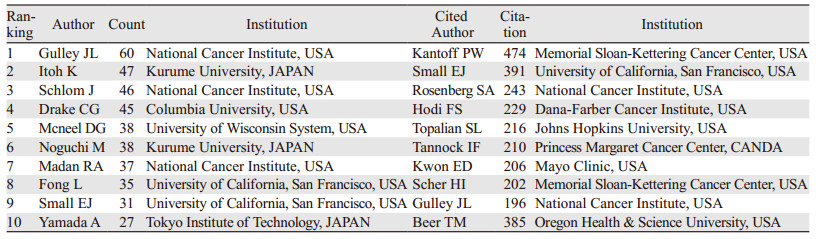
利用发文量和中心性综合评估作者和被引作者在该领域的贡献价值,见表 3。来自美国国家癌症研究所的Gulley JL,发文量最多(60篇),其次日本久留米大学的Itoh K,发文47篇,排名第三的是来自美国国家癌症研究所的Schlom J,发文46篇。分析该领域高被引作者,结果表明纪念美国斯隆-凯特琳癌症中心的Kantoff PW,引用次数最多(474次)、其次为加州大学旧金山分校的Small EJ(391次),美国国家癌症研究所的Rosenberg SA排名第三(243次)。
|
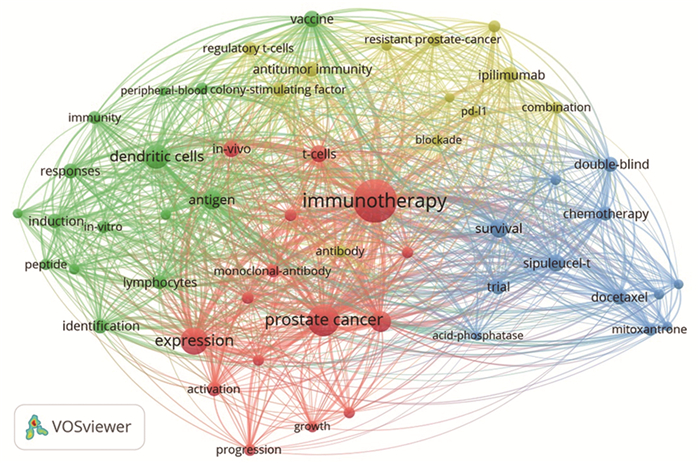
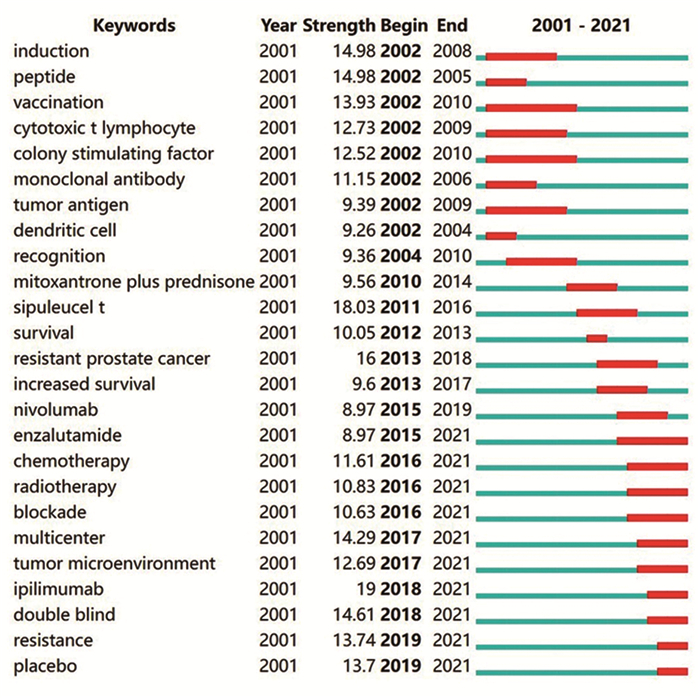
通过关键词共现分析,绘制出前列腺癌免疫治疗研究热点视图,使用频率最高的10个关键词分别是“immunotherapy”、“prostate cancer”、“expression”、“dendritic cell”、“therapy”、“antigen”、“survival”、“sipuleucel-t ”、“cancer”、“vaccine ”,见图 4。对关键词进行突现性检测,可显示一段时期频繁使用的关键词,进而显示某一主题新的爆发点,见图 5。结果显示关键词突现呈现出年份相关性,近年来集落刺激因子、细胞毒性T淋巴细胞、树突状细胞以及Sipuleucel-T等研究逐渐减少,而高质量的临床试验、肿瘤微环境及ICI等研究受到越来越多的重视。
|
| 图 4 关键词共现网络图谱 Figure 4 Co-occurrence network map of keywords |
|
| 图 5 前25个关键词突发性分析 Figure 5 Burstiness of top 25 keywords |
利用CiteSpace5.8.3R软件绘制被引文献关键词聚类时间线图,以明晰近年来前列腺癌免疫治疗热点演变路径,见图 6。聚类图谱的Modularity Q=0.7662(> 0.3);Mean Silhouette=0.8767(> 0.7),证明该聚类结构显著且令人信服[7]。结果显示该领域最大的5个聚类分别为树突状细胞、错配修复、调节性T细胞、免疫检查点抑制剂和雄激素受体。同时,树突状细胞、调节性T细胞等研究相对趋冷,而ICI相关研究在近几年成为新的研究热点。
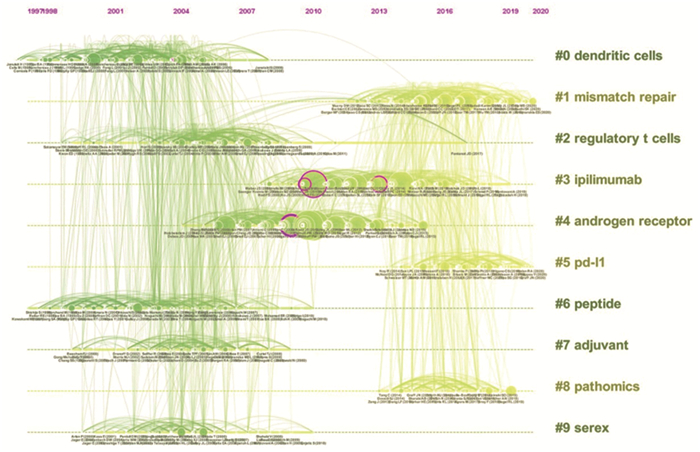
|
| 图 6 2002-2021年被引文献主题词聚类时间线图 Figure 6 Timeline of keywords clustering in cited literature, 2002-2021 |
根据文章的本地被引频次(local citation score, LCS)筛选出2002年至2021年该领域发表的被引用次数最多的10篇文章,见表 4。LCS值的大小可快速锁定研究领域内极具重要性及开创性的文章。结果显示研究领域内高被引文献多与高质量的临床试验有关,研究内容主要涉及前列腺癌治疗性疫苗Sipuleucel-T、PROSTVAC-VF以及ICI。
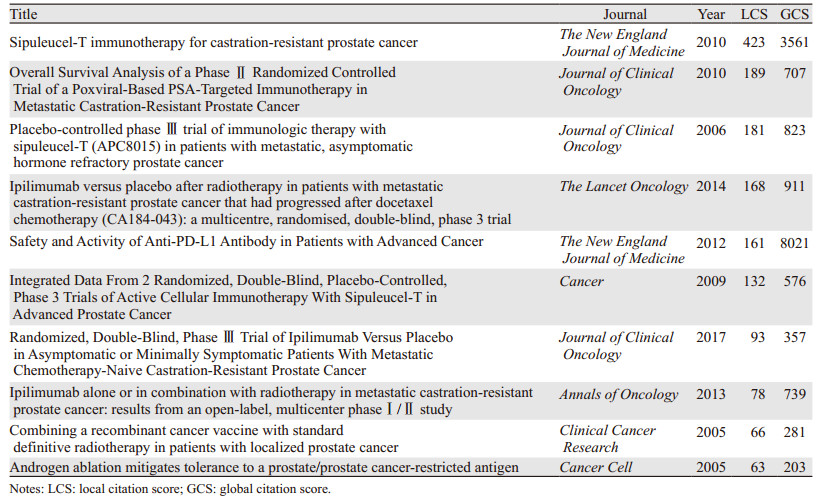
|
当前,前列腺癌免疫疗法正处于快速发展阶段,各种新型疗法和联合疗法层出不穷;同时,由于自身免疫的特殊性,免疫治疗的安全性和有效性仍需要进一步的研究[8-9]。利用文献计量学可视化工具绘制的知识图谱可以展现知识单元或知识群之间网络、结构、互动、交叉、演化或衍生等诸多隐含的复杂关系,从而实现学术研究的可视化[7]。
本研究表明近20年关于前列腺癌免疫治疗的相关领域发文量呈现稳步上升趋势,近10年来一直维持在年均大于100篇的高位。从国家/地区里看,美国作为发文量最多的国家,在领域内优势显著,同时中心性最高,表明在该领域研究中处于中心地位。我国在该领域发展前期较为缓慢,近些年迎来快速发展,后发优势显著。同时,从国家/地区合作网络来看,美国早期与德国、英国等国家合作紧密,近年来与中国的合作越来越密切,这一点也表明我国在该领域日益重要的影响力。从研究机构来看,发文量前10的机构绝大多数为美国研究机构,其中美国国家癌症研究所发文量最多,中心性最高。我国的发文量排名第二,说明我国在该领域有一定的基础实力,但目前我国缺乏该领域领跑机构。从高影响力的作者群体来看,Gulley、Itoh及Schlom等在该领域内发文量最多,这些团队主要致力于前列腺癌治疗性疫苗的相关研究,如靶向前列腺特异性抗原的痘病毒疫苗(PROSTVAC-VF)[10]、前列腺癌个性化肽疫苗[11]、重组腺病毒疫苗[12]等。高被引作者Kantoff、Small团队主要研究内容为前列腺癌治疗性疫苗Sipuleucel-T等[13-15]。Rosenberg团队主要关注于肿瘤免疫反应中T细胞的相关研究[16]。
关键词及被引文献聚类分析可以反映一段时间内的研究热点。从关键词共现网络图谱可以发现不同关键词之间联系紧密,关联度较高,这表明该领域内学科交叉显著。关键词突发性及被引文献关键词聚类时间线图结果均表明高质量的临床试验推动着这一领域的不断发展;同时,前列腺癌治疗性疫苗研究在近些年来趋冷,ICI正在受到越来越多的重视。
目前研究较多的前列腺癌治疗性疫苗主要有Sipuleucel-T和PROSTVAC-VF等。Sipuleucel-T(商品名:Provenge®,美国Dendreon公司)是由离体加载的自体抗原递呈细胞(antigen-presenting cells, APC)与PA2024在37℃、5%CO2培养箱中培养36~44 h组成的免疫治疗产品。2010年基于三项双盲随机临床试验[17-19],美国食品药品监督管理局(FDA)正式批准Sipuleucel-T为治疗前列腺癌的首个癌症疫苗。令人遗憾的是,尽管Sipuleucel-T取得了初步成功,但其他前列腺癌疫苗未能取得新的进展。
PROSTVAC-VF是一种基于痘苗病毒的前列腺癌治疗性疫苗,由痘苗病毒疫苗(PROSTVAC -V)和鸡痘病毒疫苗(PROSTVAC-F),这两种携带修饰后PSA部分基因的载体和三联体共刺激分子(triad of costimulatory molecules, Tricom)组成。尽管PROSTVAC-VFⅡ期研究结果显示可使mCRPC患者的死亡率减少44%,中位总生存期(overall survival, OS)提高8.5个月,但Ⅲ期临床试验表明其并未对mCRPC中位OS产生影响[15, 20]。
目前,ICI为前列腺癌免疫治疗领域内最主要研究热点,其作用机制是通过调节T细胞通路来激活机体的免疫系统从而抑制肿瘤生长[21]。其中,与前列腺癌密切相关的免疫检查点主要有细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen4, CTLA-4)和程序性死亡因子1/程序性死亡因子配体1(programmed death 1/programmed death ligand 1, PD-1/PD-L1)[22]。
由于前列腺癌是一种低T细胞浸润的“冷”肿瘤,其肿瘤微环境处于免疫抑制状态[23-24],单一免疫疗法治疗mCRPC往往效果不佳。Sena等[25]指出由于前列腺癌及其宿主环境的特征,可能使其对CTLA4和PD1阻断剂具有普遍抗性。因此,Handa等[26]建议针对现有的多条免疫途径,探索组合策略,使用免疫强化和免疫调节以及开发新的生物标志物,将更好地区分目标人群,发挥前列腺癌免疫治疗最大抗肿瘤效应。Sinha等[14]研究表明mCRPC患者完成Sipuleucel-T治疗后立即或延迟3周后联合CTLA-4阻断剂ipilimumab治疗可产生适度的临床活性且安全性良好。Abdul等[27]研究指出新辅助PROSTVAC可以诱导肿瘤免疫反应和外周免疫反应。一项单臂试验研究显示CTLA-4阻断剂(tremelimumab)联合PD-L1阻断剂(durvalumab)在未接受过化疗的mCRPC患者中安全且耐受性良好[28]。同时,研究证实通过促炎性反应细胞因子和抗炎细胞因子进行免疫调节可能诱导免疫反应[29];而放疗和化疗会通过杀死肿瘤细胞来释放新的抗原,导致额外的抗原特异性T细胞的交叉激发[30]。这些研究无疑表明联合治疗可能增加抗肿瘤活性,将前列腺癌从“冷”转变为“热”。目前,临床上相关联合试验正在进行中。相信在未来合理有效的联合疗法将进一步提高免疫治疗杀伤肿瘤的效果,为前列腺癌的治疗带来新的曙光。
综上所述,表明前列腺癌免疫治疗当前正处于高速发展阶段,美国在该领域内影响力巨大,中国后发优势明显。但本研究仍存在一定的局限性,首先我们仅选择Web of Science核心合集数据库收录的英文论著作为研究对象,其他类型文献以及其他数据库的结果并没有纳入,可能造成选择性偏倚;同时,文献计量学分析工具因为其自身特性,可视化分析时可能遗漏一些关键的细节。目前,高质量的临床研究及免疫检查点抑制剂是该领域主要研究热点。由于多种免疫抑制机制在肿瘤微环境中共存和相互作用,因此不同疗法之间如何高度个性化的联合,仍然是未来前列腺癌治疗中需要迫切解决的问题。
作者贡献:
靳通通:选题与设计、数据收集、撰写及修改论文
周川:数据收集
王超、达子健:指导统计分析
周逢海:选题与设计、指导及修改文章
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
Merseburger AS, Alcaraz A, von Klot CA. Androgen deprivation therapy as backbone therapy in the management of prostate cancer[J]. Onco Targets Ther, 2016, 9: 7263-7274. DOI:10.2147/OTT.S117176 |
| [4] |
Xavier-Santos D, Padilha M, Fabiano GA, et al. Evidences and perspectives of the use of probiotics, prebiotics, synbiotics, and postbiotics as adjuvants for prevention and treatment of COVID-19: A bibliometric analysis and systematic review[J]. Trends Food Sci Technol, 2022, 120: 174-192. DOI:10.1016/j.tifs.2021.12.033 |
| [5] |
Wu M, Wang Y, Yan C, et al. Study on subclinical hypothyroidism in pregnancy: a bibliometric analysis via CiteSpace[J]. J Matern Fetal Neonatal Med, 2022, 35(3): 556-567. DOI:10.1080/14767058.2020.1729731 |
| [6] |
Cheng P, Tang H, Dong Y, et al. Knowledge Mapping of Research on Land Use Change and Food Security: A Visual Analysis Using CiteSpace and VOSviewer[J]. Int J Environ Res Public Health, 2021, 18(24): 13065. DOI:10.3390/ijerph182413065 |
| [7] |
陈悦, 陈超美, 刘则渊, 等. CiteSpace知识图谱的方法论功能[J]. 科学学研究, 2015, 33(2): 242-253. [Chen Y, Chen CM, Liu ZY, et al. The methodology function of CiteSpace mapping knowledge domains[J]. Ke Xue Xue Yan Jiu, 2015, 33(2): 242-253. DOI:10.3969/j.issn.1003-2053.2015.02.009] |
| [8] |
Zhou X, Yao Z, Bai H, et al. Treatment-related adverse events of PD-1 and PD-L1 inhibitor-based combination therapies in clinical trials: a systematic review and meta-analysis[J]. Lancet Oncol, 2021, 22(9): 1265-1274. DOI:10.1016/S1470-2045(21)00333-8 |
| [9] |
Kennedy LB, Salama AKS. A review of cancer immunotherapy toxicity[J]. CA Cancer J Clin, 2020, 70(2): 86-104. DOI:10.3322/caac.21596 |
| [10] |
Gulley JL, Borre M, Vogelzang NJ, et al. Phase Ⅲ Trial of PROSTVAC in Asymptomatic or Minimally Symptomatic Metastatic Castration-Resistant Prostate Cancer[J]. J Clin Oncol, 2019, 37(13): 1051-1061. DOI:10.1200/JCO.18.02031 |
| [11] |
Noguchi M, Arai G, Egawa S, et al. Mixed 20-peptide cancer vaccine in combination with docetaxel and dexamethasone for castration-resistant prostate cancer: a randomized phase Ⅱ trial[J]. Cancer Immunol Immunother, 2020, 69(5): 847-857. DOI:10.1007/s00262-020-02498-8 |
| [12] |
Bilusic M, McMahon S, Madan RA, et al. Phase Ⅰ study of a multitargeted recombinant Ad5 PSA/MUC-1/brachyury-based immunotherapy vaccine in patients with metastatic castration-resistant prostate cancer (mCRPC)[J]. J Immunother Cancer, 2021, 9(3): e002374. DOI:10.1136/jitc-2021-002374 |
| [13] |
Sartor O, Armstrong AJ, Ahaghotu C, et al. Survival of African-American and Caucasian men after sipuleucel-T immunotherapy: outcomes from the PROCEED registry[J]. Prostate Cancer Prostatic Dis, 2020, 23(3): 517-526. DOI:10.1038/s41391-020-0213-7 |
| [14] |
Sonpavde G, Di Lorenzo G, Higano CS, et al. The role of sipuleucel-T in therapy for castration-resistant prostate cancer: a critical analysis of the literature[J]. Eur Urol, 2012, 61(4): 639-647. DOI:10.1016/j.eururo.2011.10.027 |
| [15] |
Crawford ED, Petrylak DP, Higano CS, et al. Optimal timing of sipuleucel-T treatment in metastatic castration-resistant prostate cancer[J]. Can J Urol, 2015, 22(6): 8048-8055. |
| [16] |
Seitter SJ, Sherry RM, Yang JC, et al. Impact of Prior Treatment on the Efficacy of Adoptive Transfer of Tumor-Infiltrating Lymphocytes in Patients with Metastatic Melanoma[J]. Clin Cancer Res, 2021, 27(19): 5289-5298. DOI:10.1158/1078-0432.CCR-21-1171 |
| [17] |
Kantoff PW, Higano CS, Shore ND, et al. Sipuleucel-T immunotherapy for castration-resistant prostate cancer[J]. N Engl J Med, 2010, 363(5): 411-422. DOI:10.1056/NEJMoa1001294 |
| [18] |
Small EJ, Schellhammer PF, Higano CS, et al. Placebo-controlled phaseⅢ trial of immunologic therapy with sipuleucel-T (APC8015) in patients with metastatic, asymptomatic hormone refractory prostate cancer[J]. J Clin Oncol, 2006, 24(19): 3089-3094. DOI:10.1200/JCO.2005.04.5252 |
| [19] |
Higano CS, Schellhammer PF, Small EJ, et al. Integrated data from 2 randomized, double-blind, placebo-controlled, phase 3 trials of active cellular immunotherapy with sipuleucel-T in advanced prostate cancer[J]. Cancer, 2009, 115(16): 3670-3679. DOI:10.1002/cncr.24429 |
| [20] |
Kantoff PW, Schuetz TJ, Blumenstein BA, et al. Overall survival analysis of a phase Ⅱ randomized controlled trial of a Poxviral-based PSA-targeted immunotherapy in metastatic castration-resistant prostate cancer[J]. J Clin Oncol, 2010, 28(7): 1099-1105. DOI:10.1200/JCO.2009.25.0597 |
| [21] |
Bagchi S, Yuan R, Engleman EG. Immune Checkpoint Inhibitors for the Treatment of Cancer: Clinical Impact and Mechanisms of Response and Resistance[J]. Annu Rev Pathol, 2021, 16: 223-249. DOI:10.1146/annurev-pathol-042020-042741 |
| [22] |
Venkatachalam S, McFarland TR, Agarwal N, et al. Immune Checkpoint Inhibitors in Prostate Cancer[J]. Cancers (Basel), 2021, 13(9): 2187. DOI:10.3390/cancers13092187 |
| [23] |
Vitkin N, Nersesian S, Siemens DR, et al. The Tumor Immune Contexture of Prostate Cancer[J]. Front Immunol, 2019, 10: 603. DOI:10.3389/fimmu.2019.00603 |
| [24] |
Tsaur I, Brandt MP, Juengel E, et al. Immunotherapy in prostate cancer: new horizon of hurdles and hopes[J]. World J Urol, 2021, 39(5): 1387-1403. DOI:10.1007/s00345-020-03497-1 |
| [25] |
Sena LA, Denmeade SR, Antonarakis ES. Targeting the spectrum of immune checkpoints in prostate cancer[J]. Expert Rev Clin Pharmacol, 2021, 14(10): 1253-1266. DOI:10.1080/17512433.2021.1949287 |
| [26] |
Handa S, Hans B, Goel S, et al. Immunotherapy in prostate cancer: current state and future perspectives[J]. Ther Adv Urol, 2020, 12: 1756287220951404. |
| [27] |
Abdul Sater H, Marté JL, Donahue RN, et al. Neoadjuvant PROSTVAC prior to radical prostatectomy enhances T-cell infiltration into the tumor immune microenvironment in men with prostate cancer[J]. J Immunother Cancer, 2020, 8(1): e000655. DOI:10.1136/jitc-2020-000655 |
| [28] |
Subudhi SK, Siddiqui BA, Aparicio AM, et al. Combined CTLA-4 and PD-L1 blockade in patients with chemotherapy-naïve metastatic castration-resistant prostate cancer is associated with increased myeloid and neutrophil immune subsets in the bone microenvironment[J]. J Immunother Cancer, 2021, 9(10): e002919. DOI:10.1136/jitc-2021-002919 |
| [29] |
Pachynski RK, Morishima C, Szmulewitz R, et al. IL-7 expands lymphocyte populations and enhances immune responses to sipuleucel-T in patients with metastatic castration-resistant prostate cancer (mCRPC)[J]. J Immunother Cancer, 2021, 9(8): e002903. |
| [30] |
Collins JM, Redman JM, Gulley JL. Combining vaccines and immune checkpoint inhibitors to prime, expand, and facilitate effective tumor immunotherapy[J]. Expert Rev Vaccines, 2018, 17(8): 697-705. |
 2022, Vol. 49
2022, Vol. 49


