文章信息
- 左右半结直肠肿瘤转移风险模型构建及评价
- Construction and Evaluation of Metastatic Risk Model in Left and Right Colorectal Cancer
- 肿瘤防治研究, 2022, 49(9): 931-936
- Cancer Research on Prevention and Treatment, 2022, 49(9): 931-936
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1481
- 收稿日期: 2021-12-20
- 修回日期: 2022-04-23
2. 225001 扬州,苏北人民医院肿瘤科;
3. 225200 扬州,扬州市江都人民医院肿瘤科
2. Department of Oncology, Northern Jiangsu People's Hospital, Yangzhou 225001, China;
3. Department of Oncology, Jiangdu People's Hospital of Yangzhou, Yangzhou 225200, China
结直肠癌(colorectal cancer, CRC)的发病率和死亡率在全球排前三位,中国居前五位[1-2],给社会和家庭带来了极大的精神和经济负担。约2/3的结直肠癌为散发性[3],发病机制复杂,基因突变频繁,极大地影响了治疗及预后。早在1990年,Bufill教授就提出,以结肠脾曲为分界点,两侧的肠癌具有不同的生物和流行病学特性[4]。随着对肿瘤不同原发部位研究的深入,结直肠癌是一种异质性疾病已被业内共识并写进指南。直肠癌虽然在流行病和分子机制上与结肠相似,但也有其独特的特点,有学者认为应该将直肠癌与左半结肠癌分开进行相关研究[5-6]。
有研究表明,15%以上的结直肠癌患者在诊断时就发生了肝转移[7]。未经治疗的患者中位生存期仅6.9个月。肺是结直肠癌仅次于肝脏的第二大转移部位,病程进展较慢,预后相对较好[8],具有其独特的转移和治疗模式。但目前尚未有针对其的专家共识[9]。结直肠癌骨转移发生率约为10%~15%[10],预后较差,临床症状较重,并常合并其他部位的转移,严重影响患者的生活质量[10],因此应该积极预防和治疗,但目前关于结直肠癌骨转移的临床数据较少。结直肠癌脑转移发病率不到5%,但诊断时病程相对较晚,预后差[11]。MRI是脑转移首选的影像学检查,但费用较高,尚未被推荐作为初诊时的检查手段。
基于以上原因和现状,若能早期识别肝、肺、骨和脑转移的影响因素,构建可靠的模型来提高预测结直肠癌转移风险的能力,并积极采取相应的诊疗措施,将对提高患者预后具有明显的临床获益。有研究探讨了原发部位不同的结直肠肿瘤转移相关的影响和预后因素[12-13],但尚未见相关Nomogram模型构建研究报道。本研究旨在通过筛选SEER数据库中结直肠癌患者信息,根据不同原发肿瘤部位进行肝、肺、骨和脑转移的影响因素分析并构建转移预测模型,以期帮助临床医生量化转移风险,更好地对病情进行评估。
1 资料与方法 1.1 数据来源从SEER数据库中筛选结直肠癌患者。数据通过SEER*Stat软件(version 8.3.8,https://seer.cancer.gov/seerstat/)下载。由于肝、肺、骨和脑转移信息只从2010年开始记录,因此,纳入2010—2018年间诊断并记录的患者。
1.2 数据筛选和分组数据筛选时纳入内容包括:年龄、性别、种族、婚姻和保险状态、病理分级、T、N分期、病理类型、原发肿瘤部位,诊断时肝、肺、骨和脑转移状态、CEA和嗜神经侵袭状态,以及生存时间和生存状态。排除标准:报告来源仅为尸检或死亡证明;患者生存资料不完整;转移状态未知。共有50 516例符合条件的结直肠癌患者。由于结直肠癌患者大部分为腺癌,且考虑到分组后部分病理类型的例数更少,会影响分析结果,因此只选取腺癌病例进行相关研究。最终,49 335例符合条件的患者被纳入。根据结肠肝曲、结肠脾曲和直肠乙状结肠交接部位,将患者分为右半结肠癌(right-sided colorectal cancer, LCC)、左半结肠癌(left-sided colorectal cancer, RCC)和直肠癌(rectal cancer, REC)三组。记录为“横结肠”和“未知部位”的病例未纳入研究。
1.3 统计学方法用SPSS22.0软件进行统计学分析。采用多因素Logistic回归分析各组结直肠腺癌患者转移风险影响因素。根据Logistic分析结果,用R软件(version 4.0.1)构建转移预测模型并用校正曲线和ROC曲线下面积AUC进行评价。P值采用双尾检验,P < 0.05为差异有统计学意义。Nomogram图可根据模型中各因素对转移影响的大小,即回归系数,进行重新量化和赋值,计算出转移发生的概率。
2 结果 2.1 预测转移变量筛选多因素Logistic回归分析结果显示:三组患者肝转移的共同保护性因素为:女性、非白人或黑人;而风险因素为N1和N2分期、病理分级为2和3级、CEA阳性和嗜神经侵犯。分组分析发现:在LCC组中保护性因素为年龄 > 80岁,风险因素为病理分级4级。RCC组中风险因素为黑人。REC组中保护性因素为41~80岁,见图 1。
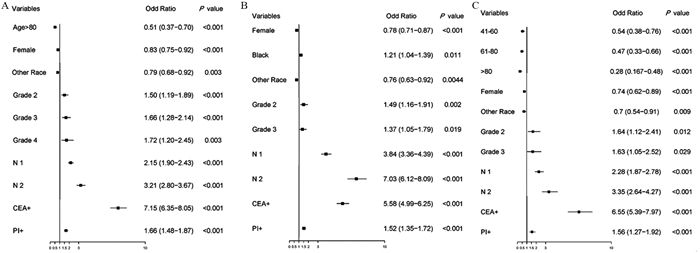
|
| LCC: left-sided colorectal cancer; RCC: right-sided colorectal cancer; REC: rectal cancer; N: N stage; CEA: carcinoimbryonic antigen; PI: neurotropic invasion. 图 1 诊断时发生肝转移的LCC(A)、RCC(B)和REC(C)亚组结直肠癌的多因素Logistic回归分析 Figure 1 Multiple Logistic regression analysis of liver metastasis in LCC(A), RCC(B), and REC(C) patients at diagnosis |
三组患者肺转移的共同风险因素为:N1和N2分期、CEA阳性。分组分析发现:LCC组和REC组的保护性因素为已婚。RCC组的保护性因素为女性;风险因素为病理分级2级。REC组风险因素为病理分级4级,见图 2。
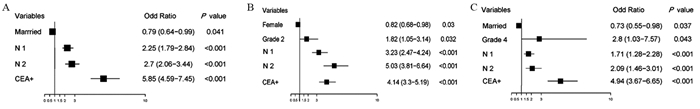
|
| 图 2 诊断时发生肺转移的LCC(A)、RCC(B)和REC(C)亚组结直肠癌的多因素Logistic回归分析 Figure 2 Multiple logistic regression analysis of lung metastasis in LCC(A), RCC(B) and REC(C) patients at diagnosis |
三组患者骨转移的共同风险因素为:N2分期和CEA阳性。分组分析发现:RCC组的保护性因素为有医保;风险因素为N1分期。REC组的保护性因素为61~80岁。
三组患者脑转移的共同风险因素为CEA阳性。分组分析发现:RCC组的风险因素为N2分期;REC组的风险因素为女性、N1和N2分期,见表 1。
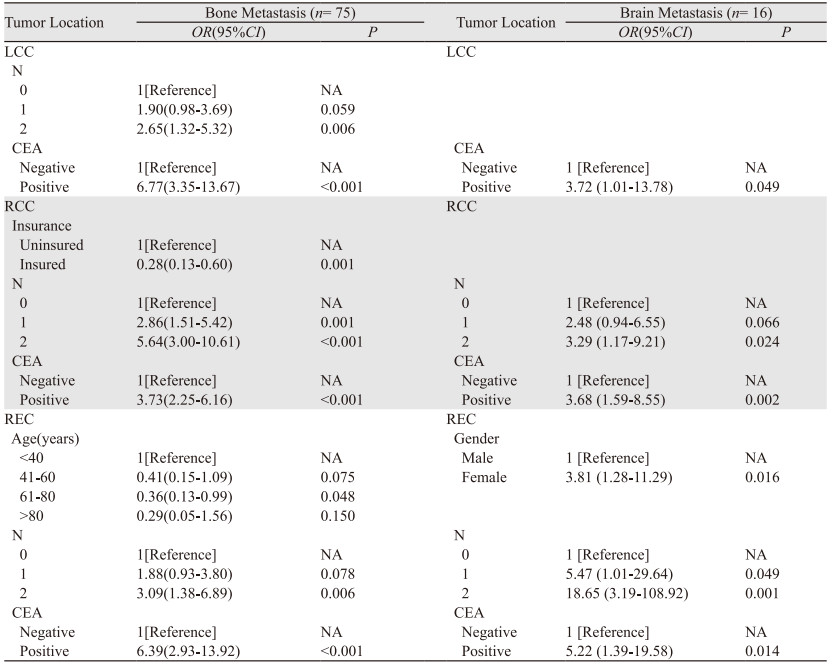
|
根据上述Logistic回归分析变量筛选结果和原发肿瘤转移部位,分别构建Nomogram模型预测转移发生概率。由于肺、骨和脑转移发生的病例数较少,因此,只构建了预测肝转移Nomogram模型,校正曲线显示该模型具有较好的预测效果,见图 3。ROC曲线分析显示,LCC预测肝转移Nomogram模型的AUC为0.821(95%CI: 0.813~0.830),RCC组模型的AUC值为0.841(95%CI: 0.833~0.848),REC组的AUC值为0.796(95%CI: 0.782~0.811),可见该模型预测效力较强。RCC和REC亚组的Logistic回归中,未识别出病理分级4对肝转移的发生有影响。RCC亚组的Nomogram模型中,病理分级2和3级的OR值分别为1.49和1.37,见图 3B。REC亚组的Nomogram模型中,病理分级2和3级的OR值分别为1.64和1.63,见图 3C。由比值比(odds ratios, ORs)可见病理分级2级对肝转移的影响风险比大于病理分级3级,Logistic回归分析的结果与Nomogram预测模型结果一致。
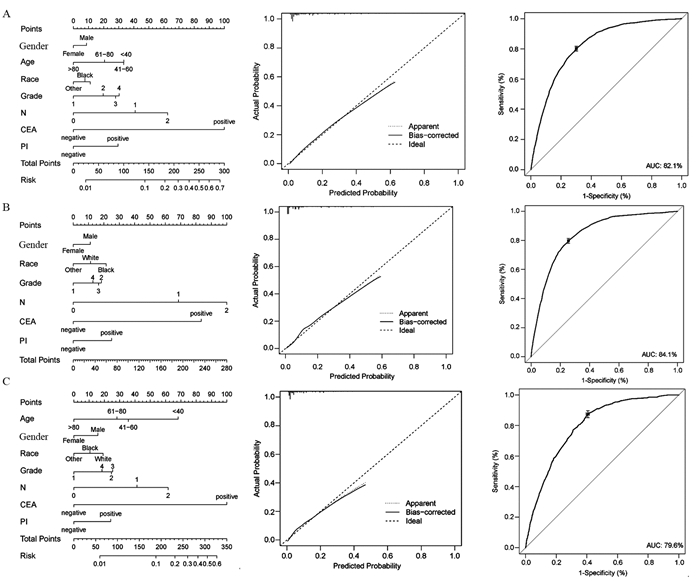
|
| 图 3 诊断时发生肝转移的LCC(A)、RCC(B)和REC(C)亚组结直肠癌的Nomogram模型、校正曲线和ROC曲线 Figure 3 Nomogram models, calibration, and ROC curves for LCC(A), RCC(B) and REC(C) subgroups of colorectal cancer with liver metastasis at diagnosis |
上述结果表明,LCC、RCC和REC三组患者的Nomogram预后预测模型存在差异。既往部分研究把直肠纳入左半结肠,本研究结果显示,左半结肠和直肠存在差异,预后的预测模型并不通用。综合三组模型的共同影响因素来看,N2分期在RCC患者组的肝转移预测模型中占有最大比重。CEA对三个肿瘤位置的肝转移均有明显的预测预后作用。
3 讨论远处转移是影响结直肠癌患者预后的重要因素之一,显著影响患者生存。临床上,结直肠癌肝转移患者手术后5年生存率可高达30%~57%[7]。但80%~90%患者发现肝转移时已失去手术机会,预后明显差于可手术患者[14]。因此,利用多种有效手段对患者病情的评估、早期肝转移风险的预测、诊疗方案的选择和提高患者预后,具有较高的临床价值。由于左右半结直肠癌分子特征、发病机制以及临床诊疗等方面均存在显著差异,且大量回顾性分析数据均表明,不同原发部位的肿瘤患者,发生肝转移的可能性存在差异。且肿瘤原发位置已被证明是预后的独立因素。因此,本研究旨在探究影响原发部位不同的结直肠癌患者转移因素的差异,并构建各自的预测模型,更好地选择患者群体进行评估。
癌胚抗原(CEA)作为消化道肿瘤标志物已广泛应用于临床肿瘤的预后监测,但在诊断和筛查方面并没有发挥明显的作用。本研究显示,CEA是结直肠癌肝转移的风险因素,这与临床认知一致。根据预测模型看,CEA预测效力较强,但与肿瘤原发位置无关。此外,N分期对远处转移的影响也与肿瘤原发位置无关。肿瘤的组织病理学分级表明肿瘤的恶性程度,可为临床治疗和预后估计提供参考性依据,在本次肝转移影响因素分析中被识别为风险因素,与肿瘤原发位置无关。此外,Logistic的ORs分析结果和Nomogram预测模型均显示,病理分级2和3级患者比4级患者更容易发生肝转移,这似乎与临床认知相悖,可能是由于分级越高,细胞分化程度越低,对治疗越敏感,因此减少了潜在的微小转移灶和转移风险。此外,由于个体和肿瘤原发部位存在差异,因此组织学病理分级在左右半结直肠肿瘤中对转移的预测权重可能存在差异,这也一定程度上反映了现有分级系统的不完善性,需要更加个体化的分型系统,如分子分型等,从而达到精准医学的诊疗目的。
既往研究证实,左半结肠肿瘤发生肝转移的风险较右半结肠更高。本次结果的预测模型也表明了,左半结肠癌中,与肝转移相关的各影响因素占权重比更高,与既往认知一致。此外,本研究发现,左半、右半以及直肠癌患者诊断时发生肝转移的影响因素大致相似,但他们对转移的影响权重存在差异。这除了与结直肠解剖、血供等临床病理特征存在差异相关外,潜在的分子机制也与这种现象密不可分。
既往有研究总结了结直肠癌转移的影响和预后因素,并建立了预测模型。但甚少有研究关注和分析肿瘤原发位置对结直肠癌转移的影响。Han等[15]证明了腺癌、低分级、N+以及CEA与骨转移相关。Huang等[16]构建了肺转移的预测模型。Gaitanidis等[17]分析构建了直肠癌患者肝、肺和骨转移的预测模型,并取得了良好的验证预测效果。Guo等[18]分析了淋巴结转移的影响因素并构建了预测模型。目前关注结直肠癌肝转移的研究大多报道了转移风险和预后相关因素[19-22],而风险预测模型和肿瘤原发位置的关系尚未见报道。考虑到结直肠肿瘤大多为腺癌,分组后其他肿瘤类型数量较少,影响分析结果以及腺癌对转移和预后的报道较多且结论明确。本研究结果发现,不同原发部位的结直肠癌患者,其发生肝转移的风险存在差异。即使是相同的转移风险因素,他们在预测模型中的比例权重大不相同。
本研究仍存在一定的局限性:(1)所分析数据为回顾性,具有一定的时间跨度,由于诊疗观念和指南的迅速更新,数据存在一定的选择偏倚;(2)虽然研究的结果显示了构建的模型良好的预测能力,但未进行外部数据的验证;(3)由于例数较少,不同原发肿瘤部位的肺、骨和脑转移的预测模型未能成功构建,需要更多和多中心的数据来进行研究。
综上,本研究基于大样本量数据研究了结直肠癌患者肝转移和原发肿瘤部位的关系。本研究构建的列线图预测模型,具有良好的预测能力,有助于早期识别肝转移发生的高风险患者,为临床医生和患者提供了对转移性疾病风险进行定量评估的参考。
作者贡献
葛宜枝:论文构思与设计、数据分析、论文撰写及修改
许艳:论文构思与设计、数据分析、论文撰写
陈小军、顾祥:数据分析、论文修改
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Feng RM, Zong YN, Cao SM, et al. Current cancer situation in China: good or bad news from the 2018 Global Cancer Statistics?[J]. Cancer Commun(Lond), 2019, 39(1): 22. |
| [3] |
Carethers JM, Jung BH. Genetics and Genetic Biomarkers in Sporadic Colorectal Cancer[J]. Gastroenterology, 2015, 149(5): 1177-1190. DOI:10.1053/j.gastro.2015.06.047 |
| [4] |
Bufill JA. Colorectal cancer: evidence for distinct genetic categories based on proximal or distal tumor location[J]. Ann Intern Med, 1990, 113(10): 779-788. DOI:10.7326/0003-4819-113-10-779 |
| [5] |
Cheng L, Eng C, Nieman LZ, et al. Trends in colorectal cancer incidence by anatomic site and disease stage in the United States from 1976 to 2005[J]. Am J Clin Oncol, 2011, 34(6): 573-580. DOI:10.1097/COC.0b013e3181fe41ed |
| [6] |
Wang F, Bai L, Liu TS, et al. Right-sided colon cancer and left-sided colorectal cancers respond differently to cetuximab[J]. Chin J Cancer, 2015, 34(9): 384-393. |
| [7] |
中国医师协会外科医师分会, 中华医学会外科分会胃肠外科学组, 中华医学会外科学分会结直肠外科学组, 等. 中国结直肠癌肝转移诊断和综合治疗指南(2020)[J]. 中国临床医学, 2021, 28(1): 129-144. [Chinese College of Surgeons, Chinese Medical Doctor Association, Chinese Society Gastrointestinal Surgery, Chinese Society of Surgery, Chinese Medical Association, Chinese Society of Colorectal Surgery, Chinese Society of Surgery, Chinese Medical Association, et al. China guideline for diagnosis and comrehensive treatment of colorectal liver metastases(2020 edition)[J]. Zhongguo Lin Chuang Yi Xue, 2021, 28(1): 129-144.] |
| [8] |
Nordholm-Carstensen A, Krarup PM, Jorgensen LN, et al. Occurrence and survival of synchronous pulmonary metastases in colorectal cancer: A nationwide cohort study[J]. Eur J Cancer, 2014, 50(2): 447-456. DOI:10.1016/j.ejca.2013.10.009 |
| [9] |
中国医师协会外科医师分会多学科综合治疗专业委员会, 中国抗癌协会大肠癌专业委员会. 结直肠癌肺转移多学科综合治疗专家共识(2018版)[J]. 实用肿瘤杂志, 2018, 33(6): 487-501. [Multidisciplinary comprehensive treatment professional committee, Chinese College of Surgeons, Chinese Medical Doctor Association, Colorectal cancer Professional Committee of China Anti Cancer Association. Expert consensus on multidisciplinary treatment of colorectal cancer with lung metastasis(2018 edition)[J]. Shi Yong Zhong Liu Za Zhi, 2018, 33(6): 487-501.] |
| [10] |
中国医师协会结直肠肿瘤专业委员会. 中国结直肠癌骨转移多学科综合治疗专家共识(2020版)[J]. 中华肿瘤杂志, 2020, 42(6): 433-437. [Colorectal cancer Professional Committee of Chinese Medical Doctor Association. Chinese expert consensus on multidisciplinary treatment of bone metastasis from colorectal cancer (2020 version)[J]. Zhonghua Zhong Liu Za Zhi, 2020, 42(6): 433-437. DOI:10.3760/cma.j.cn112152-20200402-00295] |
| [11] |
中国医师协会结直肠肿瘤专业委员会. 中国结直肠癌脑转移多学科综合治疗专家共识(2020版)[J]. 中华结直肠疾病电子杂志, 2020, 9(2): 109-114. [Colorectal cancer Professional Committee of Chinese Medical Doctor Association. Chinese experts consensus on multidisciplinary treatment of brain metastases from colorectal cancer (2020 version)[J]. Zhonghua Jie Zhi Chang Ji Bing Dian Zi Za Zhi, 2020, 9(2): 109-114. DOI:10.3877/cma.j.issn.2095-3224.2020.02.001] |
| [12] |
Ge Y, Lei S, Cai B, et al. Incidence and prognosis of pulmonary metastasis in colorectal cancer: a population-based study[J]. Int J Colorectal Dis, 2020, 35(2): 223-232. DOI:10.1007/s00384-019-03434-8 |
| [13] |
Lei S, Ge Y, Tian S, et al. Colorectal Cancer Metastases to Brain or Bone and the Relationship to Primary Tumor Location: a Population-Based Study[J]. J Gastrointest Surg, 2020, 24(8): 1833-1842. DOI:10.1007/s11605-019-04308-8 |
| [14] |
Weiss L, Grundmann E, Torhorst J, et al. Haematogenous metastatic patterns in colonic carcinoma: an analysis of 1541 necropsies[J]. J Pathol, 1986, 150(3): 195-203. DOI:10.1002/path.1711500308 |
| [15] |
Han L, Dai W, Mo S, et al. Nomogram to predict the risk and survival of synchronous bone metastasis in colorectal cancer: a population-based real-world analysis[J]. Int J Colorectal Dis, 2020, 35(8): 1575-1585. DOI:10.1007/s00384-020-03612-z |
| [16] |
Huang Y, Zhao M, Yin J, et al. Pulmonary metastasis in newly diagnosed colon-rectal cancer: a population-based nomogram study[J]. Int J Colorectal Dis, 2019, 34(5): 867-878. DOI:10.1007/s00384-019-03270-w |
| [17] |
Gaitanidis A, Alevizakos M, Tsaroucha A, et al. Predictive Nomograms for Synchronous Distant Metastasis in Rectal Cancer[J]. J Gastrointest Surg, 2018, 22(7): 1268-1276. DOI:10.1007/s11605-018-3767-0 |
| [18] |
Guo K, Feng Y, Yuan L, et al. Risk factors and predictors of lymph nodes metastasis and distant metastasis in newly diagnosed T1 colorectal cancer[J]. Cancer Med, 2020, 9(14): 5095-5113. DOI:10.1002/cam4.3114 |
| [19] |
Wang Y, Duan B, Shen C, et al. Treatment and multivariate analysis of colorectal cancer with liver metastasis[J]. Hepatogastroenterology, 2014, 61(134): 1568-1573. |
| [20] |
Hackl C, Neumann P, Gerken M, et al. Treatment of colorectal liver metastases in Germany: a ten-year population-based analysis of 5772 cases of primary colorectal adenocarcinoma[J]. BMC Cancer, 2014, 14: 810. |
| [21] |
Tang M, Wang H, Cao Y, et al. Nomogram for predicting occurrence and prognosis of liver metastasis in colorectal cancer: a population-based study[J]. Int J Colorectal Dis, 2021, 36(2): 271-282. |
| [22] |
Li Y, Liu W, Zhao L, et al. Nomograms predicting Overall Survival and Cancer-specific Survival for Synchronous Colorectal Liver-limited Metastasis[J]. J Cancer, 2020, 11(21): 6213-6225. |
 2022, Vol. 49
2022, Vol. 49
