文章信息
- 抗体偶联药物在晚期非小细胞肺癌中的研究进展
- Research Progress of Antibody-drug Conjugates in Advanced Non-small Cell Lung Cancer
- 肿瘤防治研究, 2022, 49(8): 855-860
- Cancer Research on Prevention and Treatment, 2022, 49(8): 855-860
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1466
- 收稿日期: 2021-12-16
- 修回日期: 2022-03-28
2. 730000 兰州,兰州大学第一医院肿瘤外科
2. Department of Oncology Surgery, First Hospital of Lanzhou University, Lanzhou 730000, China
非小细胞肺癌(non-small cell lung cancer, NSCLC)是我国最常见和致死率最高的恶性肿瘤,约占所有肺癌的85%~90%,且大部分患者确诊时已为晚期,预后较差[1]。为改善晚期NSCLC患者的预后,新的治疗策略包括靶向、免疫以及不同药物间的联合疗法,已成为晚期NSCLC患者治疗的重要选择,并显示出持久的获益[2-3]。无论是靶向治疗还是免疫治疗,大部分患者仍会产生获得性耐药,需要替代治疗。这使得靶向特异性单克隆抗体的开发成为急需,从而创建了高效低毒的抗体偶联药物(antibody-drug conjugates, ADC)[4]。近年来,随着科技的进步,ADC的研发取得了突破性的进展。FDA已批准几种ADC用于治疗乳腺、泌尿系统及血液系统等恶性肿瘤,其中一部分在晚期NSCLC患者中显示出良好的疗效。本文综述了ADC的基本原理及其针对部分靶点的相关药物在NSCLC中的研究进展。
1 ADC的药物结构、特点及作用机制ADC是由单克隆抗体、连接子及小分子细胞毒性物质(也称有效载荷)构成的靶向抗肿瘤药物[5-6]。抗体一般具有高特异性、高亲和力、长循环半衰期和低免疫原性的特点[7]。其作用主要是将小分子药物靶向肿瘤细胞,通过结合肿瘤表面特异性表达或高表达的靶点分子,直接抑制肿瘤细胞或通过抗体介导的细胞毒性作用杀伤肿瘤细胞[8]。临床上常用的抗体大多选自人免疫球蛋白G(IgG)[9]。连接子是连接抗体和细胞毒性药物的重要组成部分,其最主要的特点是稳定性强。主要分为两类:可切割的和不可切割的。可切割的连接子用于有效负载解偶联,其疏水性可在解偶联后,细胞毒性药物离开靶细胞并通过“旁观者效应”对其他附近的癌细胞发挥作用[10]。不可切割的连接子形成不可还原的键,可增加小分子药物在血浆中的稳定性,降低脱靶毒性的可能[11]。
小分子细胞毒性物质是已被证实有抗肿瘤效果的药物,通过溶酶体作用在细胞内释放后杀伤肿瘤细胞,称为“弹头”或“效应器有效载荷”。具有可结合性、稳定性、溶解性以及在皮摩尔范围内含有足够的毒性和效力等特点[12]。当前的临床试验及应用中,大部分小分子药物是美坦辛的衍生物或金黄色葡萄糖素,两者都属于微管抑制剂。其余是破坏DNA的药物,包括导致DNA双链断裂(DSB)的药物(如烯二炔类抗生素)、使DNA烷基化的药物(如多卡霉素)以及与DNA交联的药物(如吡咯球苯并二氮杂二聚体)[13-14]。
选择合格的靶点需具备三个方面的条件:(1)高表达于肿瘤组织,低表达于正常组织;(2)表达于肿瘤组织并与相应的抗体结合;(3)取决于细胞内转运的速率和途径[15]。目前作用于NSCLC治疗的ADC主要靶点有:HER2、HER3、Trop-2、MET、PTK7、Napi2b、AXL、EGFR、B7-H3等,余治疗靶点目前正在积极探究中。
2 ADC在非小细胞肺癌中的研究进展 2.1 抗HER2-靶向治疗人表皮生长因子受体2(HER2)是由erb-b2受体酪氨酸激酶2(ERBB2)基因编码的受体酪氨酸激酶,与HER2的配体相结合促进受体在同源或异源二聚化和自磷酸化后过度激活,触发多种信号通路(MAPK、PI3K、AKT、PKC等),导致细胞增殖失控,从而促进肿瘤发生[16]。研究[17]表明,通过诱导HER2基因突变可增加HER2受体内化,进而为ADC在NSCLC中的应用提供了机制基础。
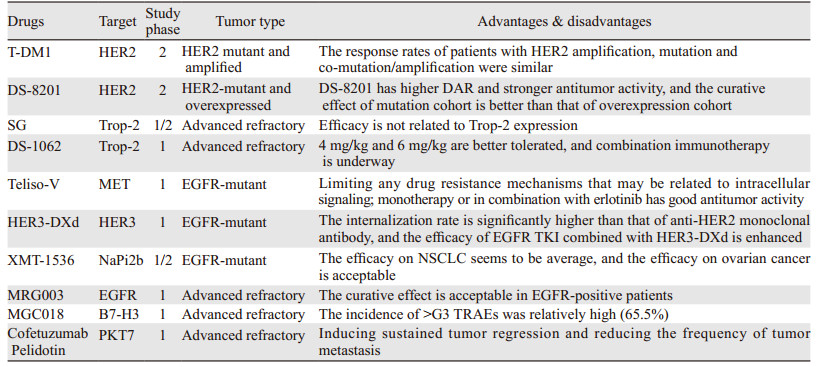
T-DM1是一种抗HER2的ADC,由曲妥珠单抗和细胞毒性微管制剂美坦辛(DM1)构成。T-DM1通过受体介导的内吞作用进入HER2阳性细胞,在溶酶体作用下的抗体部分蛋白降解后释放DM1[18]。T-DM1是第一个在晚期HER2阳性NSCLC中试验的ADC,为HER2阳性晚期患者开启了新的治疗策略。一项治疗HER2突变或扩增晚期NSCLC患者的Ⅱ期研究[19]中,患者每3周进行一次T-DM1,ORR为51%,PFS为5个月。HER2扩增、突变和共突变/扩增患者的应答率分别55%、50%和50%。该研究获得了令人鼓舞的结果,接受治疗患者对ADC耐受性及疗效良好,不良反应较少,主要为贫血和血小板减少。基于此,NCCN推荐T-DM1为治疗晚期HER2突变的NSCLC的2A类药物。期待NCT02675829、NCT03784599等研究结果。
DS-8201是一种由曲妥珠单抗通过蛋白酶可裂解的肽链与拓扑异构酶抑制剂Deruxtecan(DXd)偶联而成的一种抗HER2的新型ADC。其作用机制与其他ADC不同:它与拓扑异构酶I-DNA复合物结合并使其稳定,进而诱导DNA双链断裂和凋亡[20]。此外,与其他ADC相比,DS-8201具有更高的药物/抗体比率(DAR),从而增强抗肿瘤活性[21]。Tsurutani等[22]研究发现HER2突变型NSCLC患者对DS-8201的反应明显,表明DS-8201具有临床抗肿瘤活性和良好的耐受性。Ⅱ期临床研究Destination-Lung01评估了DS-8201剂量为6.4 mg/kg在HER2突变和非鳞状非小细胞肺癌队列中的效果。42例经免疫或化疗后复发的HER2突变NSCLC患者入选[23],ORR为61.9%,中位PFS为14个月。基于以上结果,DS-8201于2020年5月被批准用于治疗以铂为基础的化疗中或之后进展的转移性HER2突变非小细胞肺癌患者,目前已被列入NCCN指南;2021年1月在世界肺癌大会(WCLC)上公布了Destination-Lung01试验HER2过表达队列最新的研究结果[24],突变队列与过表达队列的PFS分别为14月 vs. 5.4月,3级不良事件较低,且明显低于过表达组。研究表明,DS-8201在突变队列中显示出较强的抗肿瘤活性且安全性良好。后续的Destination-Lung02是一项比较5.4或6.4 mg/kg两种剂量水平的Ⅱ期研究,已于2021年3月开始登记。
抗HER2的其余靶向新型ADC,例如A166、XMT-152等在Ⅰ/Ⅱ期难治性HER2阳性实体瘤(包括乳腺、胃、非小细胞肺癌)研究结果中显示其安全性和耐受性尚可,为晚期NSCLC的治疗提供了新希望[25-26]。
2.2 抗Trop-2-靶向治疗Trop-2又称肿瘤相关钙信号转导蛋白-2,是TACSTD2基因的蛋白产物。这种跨膜蛋白参与了多种细胞信号通路转导途径,如TP63/TP53L、WT1等途径,其中许多与肿瘤发生有关[27]。研究表明,Trop-2表达于多种上皮癌中,包括NSCLC和SCLC[28]。此外,Trop-2的过表达也被证明与肺腺癌不良预后有关[29]。基于在多种癌症中的过表达且与不良预后相关,Trop-2已成为药物开发的目标,包括ADC。
Sacituzumab govitecan(SG)由抗Trop-2人源化单克隆抗体hRS7 IgG1k与有效载荷SN-38(一种伊立替康的活性代谢产物)偶联构成的新型ADC。SG的首个Ⅰ/Ⅱ期临床试验是针对难治性转移性上皮癌的晚期患者[30],其安全性扩增试验包括了NSCLC队列。54例晚期难治性NSCLC患者分别接受剂量为8、10或12 mg/kg的SG治疗。研究显示,中位PFS为4.4个月,中位OS为7.3个月[31]。该研究表明SG对于NSCLC患者耐受性及有效性良好,且与Trop-2表达无关,为进一步临床试验的开启奠定了基础。部分与SG相关的其他肺癌临床研究包括正在进行的NCT03337698、NCT04826341等。
DS-1062由人源化抗Trop-2的单克隆抗体与DNA拓扑异构酶Ⅰ抑制剂DXd组成ADC。首次临床研究关于DS-1062治疗晚期非小细胞肺癌患者耐受性及安全性的最新研究结果已在2021年ASCO年会公布[32],结果显示DS-1062治疗晚期NSCLC患者安全性及耐受性良好。基于此研究结果,以6 mg/kg为基础量对比多西他赛治疗晚期NSCLC患者的随机Ⅲ期临床研究已开展,主要结局是PFS、OS。此外,阿斯利康等公司也在今年10月25日公布即将启动Ⅲ期临床试验,主要研究DS-1062联合PD-1抑制剂帕博利珠单抗vs.单药帕博利珠单抗,一线治疗高表达PD-L1且不伴有靶向基因组改变的晚期或转移性NSCLC患者。
2.3 抗MET-靶向治疗MET基因编码受体酪氨酸激酶肝细胞生长因子(HGF),当HGF配体与MET结合时MET通路被激活,诱导其催化域内的细胞内酪氨酸残基同源二聚和自磷酸化,进而激活下游细胞内信号通路,包括MAPK、PI3K/AKT等,促进细胞增殖、迁移和生存[33]。据报道MET在NSCLC中过表达频率较高,预示着不良的预后[34]。基于以上研究,MET已成为ADC发展的一个强有力的靶点。
Teliso-V由一种抗MET单克隆抗体(ABT-700)与细胞毒素单甲基微管蛋白聚合抑制剂(auristatin E, MMAE)偶联而成的ADC。主要作用机制为在抗体结合后,细胞毒性载荷可直接传递到肿瘤细胞,限制任何可能与细胞内信号有关的耐药机制,如EGFR TKI耐药中的ME3扩增[35]。一项Ⅰ期研究Teliso-V作为单药或其联合厄洛替尼治疗MET阳性晚期NSCLC患者的耐受性良好,无论是作为单一疗法还是与厄洛替尼联合,都显出良好的抗肿瘤活性[36]。此外,在一项单独的Ⅰ期剂量递增和扩大的研究中[37],单药Teliso-V仅对MET阳性晚期NSCLC患者显示应答反应。考虑到以上令人鼓舞的结果,Ⅱ期研究评估了MET阳性晚期鳞状NSCLC患者的疗效。由于较重不良反应及较低客观应答,导致研究早期停止[38]。
2.4 抗HER3靶向治疗HER3(ErbB3编码)是HER蛋白受体家族中的一员,异常表达于非小细胞肺癌、结直肠癌等多种恶性肿瘤中[38]。有研究表明HER3在癌细胞存活和耐药中发挥至关重要的作用,特别是针对EGFR或HER2靶向治疗的某些恶性肿瘤[39-41]。HER3也可通过与多种受体(包括EGFR、HER2、HER4和MET)的异质偶联而实现转磷酸化,随后刺激PI3K/AKT下游信号,使癌细胞抗凋亡[40]。因此,HER3既在多种癌症中的表达增强又在介导靶向治疗的耐药中发挥潜在的作用,这使得HER3成为一个强吸引力的靶点。
Patritumab Deruxtecan(HER3-DXd)由抗HER3的单克隆抗体Patritumab和拓扑异构酶Ⅰ抑制剂有效载荷DXd构成。一项临床前研究显示HER3-DXd的结合水平低于抗HER2单克隆抗体,但其内化率明显高于抗HER2单克隆抗体[42]。药物进入细胞内一经内化,单个连接子裂解释放数个有效载荷,导致癌细胞通过DNA损伤而发生凋亡[42]。基于以上研究,一项在EGFR突变NSCLC患者中的Ⅰ期临床试验显示,接受HER3-DXd治疗的NSCLC患者安全性和耐受性良好[43]。为了提高其疗效,联合疗法必不可少。Yonesaka等的一项研究显示HER3-DXd联合靶向突变的表皮生长因子受体的酪氨酸激酶抑制剂(EGFR-TKI)治疗EGFR突变的NSCLC患者疗效明显增强,因为EGFR-TKI会上调这些细胞表面HER3的表达[44]。EGFR TKI联合HER3-DXd可能会增强HER3-DXd在EGFR突变NSCLC患者中的抗癌作用。此外,联合免疫疗法也取得了令人欣慰的结果,Haratani等[45]的研究表明PD-1联合HER3-DXd显示了更强的免疫反应和抗肿瘤疗效。
2.5 抗Napi2b-靶向治疗NaPi2b是由SLC34A2编码的多跨膜钠依赖磷酸盐转运蛋白,已被证实在细胞分化和肿瘤基因的形成中发挥作用[46]。研究表明NaPi2b高表达于肺癌在内的各种癌症中,尤其在TTF1阳性以及KRAS和EGFR突变的患者中表达更显著[47]。鉴于NaPi2b在多种癌症中的表达升高,它是ADC发展的一个强吸引力的靶点。
XMT-1536是由人源化抗NaPi2B靶向抗体与有效载荷auristatin F-羟丙胺(AF-HPA)连接组成的ADC。一项临床前研究显示[48],XMT-1536在非小细胞肺癌和卵巢癌的小鼠模型中具有强大抗肿瘤疗效。鉴于此,用于治疗难治性晚期NSCLC患者和卵巢癌患者的Ⅰ/Ⅱ期XMT-1536的剂量递增和扩大研究显示[49],接受XMT-1536治疗的患者安全性及耐受性良好,早期疗效令人鼓舞,尤其对于卵巢癌患者,部分患者可达到完全缓解。
2.6 抗EGFR-靶向治疗表皮生长因子受体(EGFR)属于酪氨酸受体激酶的ErbB家族,通过激活下游PI3K/AKT、MAPK和JAK/STAT信号级联等多种途径促进肿瘤细胞增殖和存活[50]。EGFR的基因组改变主要包括基因突变和扩增,已在非小细胞肺癌、结直肠癌等恶性肿瘤中被证实[50]。针对EGFR敏感突变的NSCLC患者,EGFR靶向治疗已成为一线标准,尽管不可避免地出现了治疗的耐药性[51]。鉴于EGFR靶向治疗在多种恶性肿瘤中的疗效及后期出现治疗的耐药性,目前有兴趣扩大针对EGFR的治疗,包括ADC。
MRG003是由人源化抗EGFR单克隆抗体与MMAE载荷结合而成一种新型ADC。2020年ASCO年会上公布了MRG003Ⅰ期临床研究部分结果[52],研究显示难治性实体肿瘤患者每3周接受0.3~3.0 mg/kg的剂量是安全和可耐受的,最常见的不良反应是中性粒细胞减少。在多个剂量扩大队列中,MRG003被评估为每3周2.5 mg/kg的单药。此外,中国的一项Ⅱ期非随机研究正在评估每3周使用2.0 mg/kg治疗晚期EGFR突变NSCLC的疗效。
此外,针对晚期NSCLC部分靶点的ADC,如MGC018是一个由人源化的抗B7-H3单克隆抗体(PRCA157)与双卡霉素结合成的ADC。Ⅰ/Ⅱ期剂量递增和扩大研究表明患者每3周接受3 mg/kg是安全和可耐受的,主要不良反应为中性粒细胞增多和淋巴细胞减少[53]。Cofetuzumab Pelidotin是一种由人源化的抗PKT7单克隆抗体通过一个可切割的缬氨酸-瓜氨酸连接子与auristatin微管抑制剂Aur0101偶联而成的ADC。Ⅰ期安全性研究显示Cofetuzumab Pelidotin联合Gedatolisib(PI3K/mTOR抑制剂)在难治实体瘤患者中被发现是安全且可耐受的,ORR为18.8%[54]。此外,NCT04189614是一项目前正在多中心进行的Ⅰ期研究,患者每3周使用2.8 mg/kg的Cofetuzumab Pelidotin,我们期待此研究结果。余靶点的ADC目前正在积极研究中,期待后续的研究成果。
本综述根据各种ADC所对抗的靶点、临床试验分期、纳入的肺癌患者人群、目前的临床研究结果及各种药物的相对优势及不足归纳总结见表 1。
|
综上所述,针对HER2、Trop-2、MET、HER3等靶点的ADC已取得了突破性的进展,这为晚期NSCLC患者开启了新的临床治疗模式。此外,为最大限度地发挥下一代ADC的潜力,目前许多其他策略也在快速研究中。这些措施包括将有效载荷联合小分子结合物以增强可能渗透血脑屏障的药物输送,生长抑素受体2与微型化药物结合物PEN-221联合以及有效载荷直接与PD-1抗体结合[55-56]。基于这些策略和其他联合治疗策略,ADC在NSCLC和其他恶性肿瘤治疗的前景是光明的。
作者贡献:
陈雅蕊:文献查询、论文撰写
王江涛:归类总结、数据分析
关泉林:论文修改及审阅
姬薇、焦福智:资料整料及思路设计
| [1] |
Herbst RS, Morgensztern D, Boshoff C. The biology and management of non-small cell lung cancer[J]. Nature, 2018, 553(7689): 446-454. DOI:10.1038/nature25183 |
| [2] |
Socinski MA, Jotte RM, Federico C, et al. Atezolizumab for First-Line Treatment of Metastatic Nonsquamous NSCLC[J]. N Engl J Med, 2018, 378(24): 2288-2301. DOI:10.1056/NEJMoa1716948 |
| [3] |
Luis PA, Ciuleanu TE, Cobo M, et al. First-line nivolumab plus ipilimumab combinedwith two cycles of chemotherapy in patients with non-small-cell lung cancer (CheckMate 9LA): an international, randomised, open-label, phase3 trial[J]. Lancet Oncol, 2021, 22(2): 198-211. DOI:10.1016/S1470-2045(20)30641-0 |
| [4] |
Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity[J]. J Immunol, 2005, 174(5): 2453-2455. |
| [5] |
Makawita S, Meric-Bernstam F. Antibody-Drug Conjugates: Patient and Treatment Selection[J]. Am Soc Clin Oncol Educ Book, 2020, 40: 1-10. |
| [6] |
Leung D, Wurst JM, Liu T, et al. Antibody Conjugates-Recent Advances and Future Innovations[J]. Antibodies (Basel), 2020, 9(1): 2. DOI:10.3390/antib9010002 |
| [7] |
Goulet DR, Atkins WM. Considerations for the Design of Antibody-BasedTherapeutics[J]. J Pharm Sci, 2019, 109(1): 74-103. |
| [8] |
Chau A, Steeg PS, Figg WD. Antibody-drug conjugates for cancer[J]. Lancet, 2019, 394(10200): 793-804. DOI:10.1016/S0140-6736(19)31774-X |
| [9] |
Schumacher D, Helma J, Schneider A, et al. Chemical functionalization strategies and intracellular applications of nanobodies[J]. Angew Chem Int Ed Engl, 2018, 57(9): 2314-2333. DOI:10.1002/anie.201708459 |
| [10] |
Mccombs JR, Owen SC. Antibody Drug Conjugates: Design and Selection of Linker, Payload and Conjugation Chemistry[J]. AAPS J, 2015, 17(2): 339-351. DOI:10.1208/s12248-014-9710-8 |
| [11] |
Dan N, Setua S, Kashyap VK, et al. Antibody-Drug Conjugates for Cancer Therapy: Chemistry to Clinical Implications[J]. Pharmaceuticals (Basel), 2018, 11(2): 32. DOI:10.3390/ph11020032 |
| [12] |
Beck A, Goetsch L, Dumontet C, et al. Strategies and challenges for thenext generation of antibody-drug conjugates[J]. Nat Rev Drug Discov, 2017, 16(5): 315-337. DOI:10.1038/nrd.2016.268 |
| [13] |
Elgersma RC, Coumans RGE, Huijbregts T, et al. Design, Synthesis, andEvaluation of Linker-Duocarmycin Payloads: Toward Selection of HER2-Targeting Antibody-Drug Conjugate SYD985[J]. Mol Pharma, 2015, 12(6): 1813-1835. DOI:10.1021/mp500781a |
| [14] |
Sutherland MSK, Walter RB, Jeffrey SC, et al. SGN-CD33A: a novel CD33-targeting antibody-drug conjugate using a pyrrolobenzodiazepine dimer is active in models of drug-resistant AML[J]. Blood, 2013, 122(8): 1455-1463. DOI:10.1182/blood-2013-03-491506 |
| [15] |
Olivier Jr KJ, Hurvitz SA. Antibody-Drug Conjugates: Fundamentals, Drug, Development, and Clinical Outcomes to Target Cancer[M]. Wiley, 2016.
|
| [16] |
Robichaux JP, Elamin YY, Vijayan RSK, et al. Pan-Cancer Landscape and Analysis of ERBB2 Mutations Identifies Poziotinib as a Clinically Active Inhibitor and Enhancer of T-DM1 Activity[J]. Cancer Cell, 2020, 37(3): 420. DOI:10.1016/j.ccell.2020.03.003 |
| [17] |
Li BT, Michelini F, Misale S, et al. HER2-mediated internalization of cytotoxic agents in ERBB2 amplified or mutant lung cancers[J]. Cancer Discov, 2020, 10(5): 674-687. DOI:10.1158/2159-8290.CD-20-0215 |
| [18] |
Lewis Phillips GD, Li G, Dugger DL, et al. Targeting HER2-positive breast cancer with trastuzumab-DM1, an antibodyecytotoxic drug conjugate[J]. Cancer Res, 2008, 68(22): 9280-9290. DOI:10.1158/0008-5472.CAN-08-1776 |
| [19] |
Li BT, Michelini F, Misale S, et al. HER2-Mediated Internalization of Cytotoxic Agents in ERBB2 Amplified or Mutant Lung Cancers[J]. Cancer Dis Covery, 2020, 10(5): 674-687. DOI:10.1158/2159-8290.CD-20-0215 |
| [20] |
Pommier Y. Topoisomerase Ⅰ inhibitors: camptothecins and beyond[J]. Nat Rev Cancer, 2006, 6(10): 789-802. DOI:10.1038/nrc1977 |
| [21] |
Andrikopoulou A, Zografos E, Liontos M, et al. Trastuzumab deruxtecan(DS-8201a): the latest research and advances in breast cancer[J]. Clin Breast Cancer, 2021, 21(3): e212-e219. DOI:10.1016/j.clbc.2020.08.006 |
| [22] |
Tsurutani J, Iwata H, Krop I, et al. Targeting HER2 with trastuzumab deruxtecan: a dose-expansion, Phase Ⅰ Study in multiple advanced solid tumors[J]. Cancer Discov, 2020, 10(5): 688-701. DOI:10.1158/2159-8290.CD-19-1014 |
| [23] |
Smit EF, Nakagawa K, Nagasaka M, et al. Trastuzumab deruxtecan (T-DXd; DS-8201) in patients with HER2-mutated metastatic non-small cell lung cancer (NSCLC): Interim results of DESTINY-Lung01[J]. J Clin Oncol, 2020, 38(15_suppl): 9504-9504. DOI:10.1200/JCO.2020.38.15_suppl.9504 |
| [24] |
Nakagawa K, Nagasaka M, Felip E, et al. OA04.05 Trastuzumab Deruxtecan in HER2-Overexpressing Metastatic Non-Small Cell Lung Cancer: InterimResults of DESTINY-Lung01[J]. J Thoracic Oncol, 2021, 16(3): 28-31. |
| [25] |
Liu Y, Lian W, Zhao X, et al. SKB264 ADC: A first-in-human study of SKB264 in patients with locally advanced unresectable/metastatic solid tumors who are refractory to available standard therapies[J]. J Clin Oncol, 2020, 38(15_suppl): TPS3659-TPS3659. DOI:10.1200/JCO.2020.38.15_suppl.TPS3659 |
| [26] |
Hamilton EP, Barve MA, Bardia A, et al. Phase 1 dose escalation of XMT-1522, a novel HER2-targeting antibody-drug conjugate (ADC), in patients (pts) with HER2-expressing breast, lung and gastric tumors[J]. J Clin Oncol, 2018, 36(15_suppl): 2546-2546. DOI:10.1200/JCO.2018.36.15_suppl.2546 |
| [27] |
Goldenberg DM, Stein R, Sharkey RM. The emergence of trophoblast cell-surface antigen 2 (TROP-2) as a novel cancer target[J]. Oncotarget, 2018, 9(48): 28989-29006. DOI:10.18632/oncotarget.25615 |
| [28] |
Goldenberg DM, Cardillo TM, Govindan SV, et al. Trop-2 is a novel target for solid cancer therapy with sacituzumab govitecan (IMMU-132), anantibody-drug-conjugate(ADC)[J]. Oncotarget, 2015, 6(26): 22496-22512. DOI:10.18632/oncotarget.4318 |
| [29] |
Jiang A, Gao X, Zhang D, et al. Expression and clinical significance of the Trop-2 gene in advanced non-small cell lung carcinoma[J]. Oncol Lett, 2013, 6(2): 375-380. DOI:10.3892/ol.2013.1368 |
| [30] |
Bardia A, Messersmith WA, Kio EA, et al. Sacituzumab Govitecan, a Trop-2-Directed Antibody-Drug Conjugate, for Patients with Epithelial Cancer: Final Safety and Efficacy Results from the Phase 1/2 IMMU-132-01 Basket Trial[J]. Ann Oncol, 2021, 32(16): 746-756. |
| [31] |
Heist RS, Guarino MJ, Masters G, et al. Therapy of advanced non-small-cell lung cancer with an SN-38-anti-T rop-2 drug conjugate, sacituzumab govitecan[J]. J Clin Oncol, 2017, 35(24): 2790-2797. DOI:10.1200/JCO.2016.72.1894 |
| [32] |
Meric-Bernstam F, Spira AI. TROPION-Pan Tumor 01: Dose analysis ofThe TROP2-directed antibody-drug conjugate (ADC) datopotamab deruxtecan (Dato-DXd, DS-1062) for the treatment (Tx) of advanced or metastatic non-small cell lung cancer (NSCLC)[J]. J Clin Oncol, 2021, 39(15): 9058. |
| [33] |
Ko B, He T, Gadgeel S, et al. MET/HGF pathway activation as a paradigm of resistance to targeted therapies[J]. Ann Transl Med, 2017, 5(1): 4. DOI:10.21037/atm.2016.12.09 |
| [34] |
Salgia R. MET in Lung Cancer: Biomarker Selection Based on Scientific Rationale[J]. Mol Cancer Ther, 2017, 16(4): 555-565. DOI:10.1158/1535-7163.MCT-16-0472 |
| [35] |
Wang J, Anderson MG, Oleksijew A, et al. ABBV-399, a c-Met Antibody Drug Conjugate that Targets Both MET Amplified and c-Met OverexpressingTumors, Irrespective of MET Pathway Dependence[J]. Clin Cancer Res, 2016, 23(4): 992-1000. |
| [36] |
Goldman J, Angevin E, Strickler J, et al. MA 02.10 Phase Ⅰ Study of ABBV-399 (Telisotuzumab Vedotin) as Monotherapy and in Combination with Erlotinib in NSCLC[J]. J Thoracic Oncol, 2017, 12(11): 1805-1806. |
| [37] |
Strickler JH, Weekes CD, Nemunaitis J, et al. First-in-human phaseⅠ, dose-escalation and expansion study of telisotuzumab vedotin, an antibody-drug conjugate targeting c-Met, in patients with advanced solid tumors[J]. J Clin Oncol, 2018, 36(33): 3298-3306. DOI:10.1200/JCO.2018.78.7697 |
| [38] |
Waqar SN, Redman MW, Arnold SM, et al. A phase Ⅱ study of telisotuzumab vedotin in patients with c-MET-positive stage Ⅳor recurrent squamous cell lung cancer (LUNG-MAP Sub-study S1400K, NCT03574753)[J]. Clin Lung Cancer, 2020, 22(3): 170-177. |
| [39] |
Kawakami H, Yonesaka K. HER3 and its ligand, heregulin, as targets forcancer therapy[J]. Recent Pat Anticancer Drug Discov, 2016, 11(3): 267-274. DOI:10.2174/1574892811666160418123221 |
| [40] |
Yonesaka K, Hirotani K, Kawakami H, et al. Anti-HER3 monoclonal antibody patritumab sensitizes refractory non-small cell lung cancer to the epidermal growth factor receptor inhibitor erlotinib[J]. Oncogene, 2016, 35(7): 878-886. DOI:10.1038/onc.2015.142 |
| [41] |
Watanabe S, Yonesaka K, Tanizaki J, et al. Targeting of the HER2/HER3signaling axis overcomes ligand-mediated resistance to trastuzumab in HER2-positive breast cancer[J]. Cancer Med, 2019, 8(3): 1258-1268. DOI:10.1002/cam4.1995 |
| [42] |
Hashimoto Y, Koyama K, Kamai Y, et al. A novel HER3-targeting antibody-drug conjugate U3-1402 exhibits potent therapeutic efficacy through the delivery of cytotoxic payload by efficient internalization[J]. Clin Cancer Res, 2019, 25(23): 7151-7161. DOI:10.1158/1078-0432.CCR-19-1745 |
| [43] |
Yu HA, Baik CS, Gold K, et al. LBA62 Efficacy and safety of patritumab deruxtecan (U3-1402), a novel HER3 directed antibody drug conjugate, in patients (pts) with EGFR-mutated (EGFRm) NSCLC-Science Direct[J]. Ann Oncol, 2020, 31: 1189-1190. |
| [44] |
Yonesaka K, Takegawa N, Watanabe S, et al. An HER3-targeting antibody-drug conjugate incorporating a DNA topoisomerase I inhibitor U3-1402 conquers EGFR tyrosine-kinase-inhibitor-resistantNSCLC[J]. Oncogene, 2019, 9(38): 1398-1409. |
| [45] |
Haratani K, Yonesaka K, Takamura S, et al. U3-1402 sensitizes HER3-expressing tumors to PD-1 blockade by immune activation[J]. J Clin Invest, 2020, 130(1): 374-388. |
| [46] |
Jiang Z, Hao Y, Ding X, et al. The effects and mechanisms of SLC34A2on tumorigenicity in human non-small cell lung cancer stem cells[J]. Tumor Biol, 2016, 37(8): 10383-10392. DOI:10.1007/s13277-016-4928-y |
| [47] |
Heynemann S, Yu H, Churilov L, et al. NaPi2b expression in a large surgical Non-Small Cell Lung Cancer (NSCLC) cohort[J]. Clin Lung Cancer, 2022, 23(2): e90-e98. DOI:10.1016/j.cllc.2021.11.005 |
| [48] |
Bodyak ND, Mosher R, Yurkovetskiy AV, et al. The dolaflexin-based antibody-drug conjugate XMT-1536 targets the solid tumor lineage antigen SLC34A2/NaPi2b[J]. Mol Cancer Ther, 2021, 20(5): 896-905. DOI:10.1158/1535-7163.MCT-20-0183 |
| [49] |
Richardson DL, Barve MA, Strauss JF, et al. PhaseⅠ expansion studyof XMT-1536, a novel NaPi2b-targeting antibody-drug conjugate (ADC): preliminary efficacy, safety, and biomarker results in patients with previously treatedmetastatic ovarian cancer (OC) or non-small cell lung cancer (NSCLC)[J]. Clin Oncol, 2020, 38(15_suppl): 3549. |
| [50] |
Kato S, Okamura R, Mareboina M, et al. Revisiting Epidermal Growth Factor Receptor (EGFR) Amplification as a Target for Anti-EGFR Therapy: Analysis of Cell-Free Circulating Tumor DNA in Patients With Advanced Malignancies[J]. JCO Precis Oncol, 2019, 3: PO.18.00180. |
| [51] |
Ramalingam SS, Vansteenkiste J, Planchard D, et al. Overall survival with osimertinib in untreated, EGFR-mutated advanced NSCLC[J]. N Engl J Med, 2020, 382(1): 41-50. DOI:10.1056/NEJMoa1913662 |
| [52] |
Xu RH, Qiu MZ, Zhang Y, et al. First-in-human dose-escalation study ofanti-EGFR ADC MRG003 in patients with relapsed/refractory solid tumors[J]. Clin Oncol, 2020, 38(15_suppl): 3550. |
| [53] |
Jang S, Powderly JD, Spira AI, et al. Phase 1 dose escalation study of MGC018, an anti-B7-H3 antibody-drug conjugate (ADC) in patients with advanced solid tumors[J]. Clin Oncol, 2021, 39(15_suppl): 2631-2632. |
| [54] |
Radovich M, Solzak JP, Hancock BA, et al. Abstract PS10-26: An initialsafety study of gedatolisib plus cofetuzumab pelidotin for metastatic triple-negative breast cancer[J]. Cancer Res, 2021, 81(4): 10-26. |
| [55] |
Gébleux R, Stringhini M, Casanova R, et al. Non-internalizing antibody-drug conjugates display potent anti-cancer activity upon proteolytic release of monomethyl auristatin E in the subendothelial extracellular matrix[J]. Int J Cancer, 2017, 140(7): 1670-1679. DOI:10.1002/ijc.30569 |
| [56] |
Whalen KA, White BH, Quinn JM, et al. Targeting the Somatostatin Receptor 2 with the Miniaturized Drug Conjugate, PEN-221: A Potent and Novel Therapeutic for the Treatment of Small Cell Lung Cancer[J]. Mol Cancer Ther, 2019, 18(11): 1926-1936. DOI:10.1158/1535-7163.MCT-19-0022 |
 2022, Vol. 49
2022, Vol. 49


