文章信息
- CK2α'在肝细胞癌组织中的表达及其对预后的影响
- Expression and Prognostic Value of CK2α' in Hepatocellular Carcinoma
- 肿瘤防治研究, 2022, 49(7): 662-666
- Cancer Research on Prevention and Treatment, 2022, 49(7): 662-666
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1291
- 收稿日期: 2021-11-09
- 修回日期: 2022-04-07
2. 200433 上海,海军军医大学附属东方肝胆外科医院肿瘤科
2. Department of Oncology, Eastern Hepatobiliary Surgery Hospital, Naval Medical University, Shanghai 200433, China
肝细胞癌(hepatocellular carcinoma, HCC)是全球第六大常见癌症,也是死亡率排名前三的癌症[1]。中国每年约有38.3万人死于肝癌,占全球肝癌相关死亡人数的51%。尽管治疗干预(如射频消融、肝切除、肝移植及全身放疗)进展迅速,但由于发生远处转移和复发,肝癌患者的预后并不理想。此外,由于早期症状的非特异性及敏感生物诊断标志物的缺乏,大多数病例最初即被诊断为肝癌晚期。因此,揭示新的诊断和预后分子生物标志物对开发有效的HCC治疗策略尤其关键[2]。Casein kinase 2 alpha 2(CSNK2A2, CK2α')酪蛋白激酶CK2α'是蛋白激酶CK2的催化亚单位,蛋白激酶CK2是最早发现的蛋白激酶之一,也是一种以磷酸化丝氨酸/苏氨酸位点为主的蛋白激酶,CK2可以磷酸化数百种生理底物,参与了大量人类蛋白质的磷酸化修饰[3]。人体中,包含两个CK2激酶基因CSNK2A1和CSNK2A2,分别编码高度保守的丝氨酸/苏氨酸激酶蛋白CK2α和CK2α'[4]。CK2激酶可以作为单体激酶发挥作用,也可以在两个CK2激酶蛋白(CK2α和(或)CK2α')和两个调节蛋白CK2β(CK2β由CSNK2B编码)组成的四聚体复合物中发挥作用[5]。蛋白激酶CK2被报道参与重要的细胞生物学过程如细胞生长和增殖[6]、细胞存活、细胞形态、细胞转化和血管生成[7]。在癌症中,CK2可通过对原癌基因或是抑癌基因的磷酸化作用触发不同的下游机制影响肿瘤的发生发展[3]。研究显示CK2蛋白的上调及核定位与胃癌、头颈癌的临床病理指标和预后呈负相关[4],而作为催化亚基存在的CK2α'在肝癌中的作用却未见报道。本研究利用免疫组织化学及统计学分析方法探究该基因在肝癌组织中的表达及其与预后的关系,以此判断CK2α'是否可能成为肝癌预后标志物。
1 资料与方法 1.1 临床资料收集2003年4月—2009年9月在第二军医大学附属东方肝胆外科医院手术切除的原发性肝细胞癌患者组织及相应癌旁组织标本83例。年龄范围10~79岁,其中男67例、女16例。
入组标准:(1)病理诊断确认为原发性肝细胞癌;(2)肿瘤可切除且无明显肝外转移;(3)未经过其他治疗或者至少4周前经过治疗未明显控制肿瘤进展;(4)年龄10~80岁,Child-Pugh评分A/B。患者入组后,记录肝癌的直径、是否存在门脉癌栓等临床数据,并对患者进行随访,记录患者肝癌复发及死亡的时间。末次随访时间为2012年3月。本研究经第二军医大学东方肝胆外科医院医学研究伦理委员会批准,且所有患者均签署了知情同意书。
1.2 免疫组织化学检测肿瘤组织标本固定于中性缓冲的40%甲醛溶液中,将固定好的组织包埋于石蜡内。组织切片4 µm厚,60℃烘烤2 h,冷却后将切片脱蜡至水,在二甲苯中浸泡10 min,更换二甲苯后再次浸泡10 min,三次浸泡共30 min,之后在不同浓度梯度乙醇中复水处理。滴加3%过氧化氢甲醇液,常温20 min孵育进行内源性过氧化物酶灭活。双蒸水洗5 min×3次,10 mmol/L柠檬酸盐缓冲液(pH=6.0)通过沸水煮浴15 min进行抗原修复, 常温冷却后双蒸水洗5 min×2次,37℃下用1%BSA进行封闭,30 min后吸弃封闭液,4℃下用CSNK2A2一抗(稀释,1:100)进行过夜孵育,并将切片置于湿盒中,以防干片。第二日将切片从4℃中取出,复温15 min,0.01 mol/L PBS洗5 min×4次,滴加兔二抗,37℃孵育30 min,弃兔二抗后使用DAB显色,染色约3~10 min,出现砖红色后置于双蒸水内终止染色,使用苏木精对比染色10 min,1%盐酸乙醇分化后使用自来水冲洗20~30 min,反蓝,取出片子沥干水进行脱水处理,最后滴加中性树脂50 µl,盖玻片封片。免疫组织化学染色的对照设置:利用已知在肝癌组织中呈阳性表达的抗体进行肝癌组织切片免疫组织化学染色,并将其作为阳性对照;并将相同的组织切片使用血清BSA染色作为阴性对照。免疫组织化学评分方法:Image Scope Count程序对每个芯片点进行“阳性Pixel”计算,每个组织芯片点的组化评分计算方法为Log10[255/平均强度],其中平均强度=(弱阳性+阳性+强阳性象素总强度)/(弱阳性+阳性+强阳性象素数量)。
1.3 统计学方法用SPSS25.0统计软件对数据进行分析。计数资料用χ2检验或Fisher精确检验进行统计学分析,统计结果以频数/百分比表示,采用χ2检验。卡方检验时,若样本总量n≥40且0单元格的理论数T < 5,采用卡方检验,但其中一个格子理论数1≤T < 5时,采用连续性校正卡方检验;若有理论数T < 1,则用Fisher精确检验。Kaplan-Meier生存曲线分析CK2α'的表达与肝癌患者预后的关系,P < 0.05为差异有统计学意义。
2 结果 2.1 CK2α'在肝癌及癌旁正常组织中的表达通过免疫组织化学染色法检测并分析83对临床肝癌样本中肿瘤组织及其癌旁正常组织中CK2α'的表达和定位情况。结果显示,CK2α'在癌组织中的表达低于其对应的癌旁正常组织,且主要定位于细胞质,见图 1A。为进一步量化CK2α'的表达水平,Image Scope Count程序对每个芯片点进行“阳性Pixel”计算,通过对每个芯片点阳性比例(Positivity=Npositive/Ntotal)的统计,结果显示,CK2α'在肝癌组织及癌旁正常组织中的平均阳性表达率分别为47.8%及65.4%,且差异有统计学意义(P < 0.01),见图 1B。计算癌组织与其对应癌旁正常组织的染色信号比值,结果显示,74.7%的患者中CK2α'在癌组织(T)的表达量低于癌旁组织(N)。因此,认为与癌旁正常组织相比,CK2α'在肝癌组织中表达下调,见图 1C。
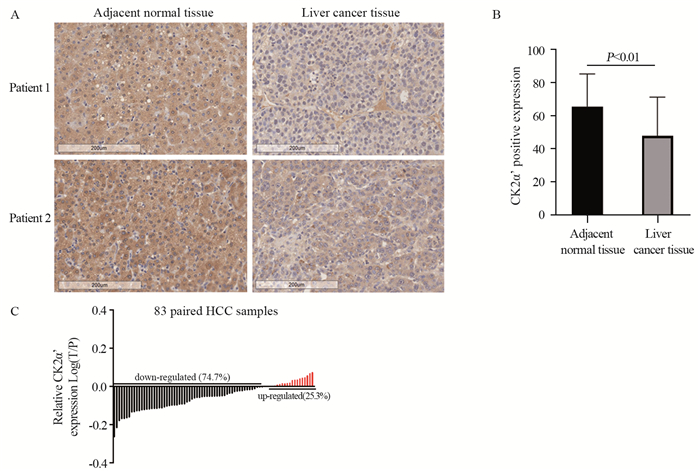
|
| 图 1 CK2α'在肝癌患者肿瘤组织及癌旁正常组织中的表达水平 Figure 1 Expression of CK2α' in hepatocellular carcinoma (HCC) tissues and adjacent normal tissues |
为进一步研究CK2α'的表达与肝癌预后的关系,对83例肝癌患者的肿瘤组织样本染色的强度值,算出ROC曲线,根据ROC曲线中的敏感度和特异性差值计算出约登指数,设定绝对值最大的约登指数为分界点,将患者分为CK2α'高表达组和CK2α'低表达组,之后将高表达组赋值为“1”,低表达组赋值为“0”,结合随访资料中患者生存状态及总体生存期进行统计,Kaplan-Meier生存曲线分析CK2α'与肝癌预后的关系。复发曲线采用同样的分析方法。结果显示,CK2α'低表达组的患者总体生存时间更短(图 2A),且更容易复发(图 2B)。

|
| 图 2 CK2α'在肝癌组织中的表达及其与预后之间的关系 Figure 2 Expression of CK2α' in HCC tissues and its correlation with prognosis |
CK2α'的表达在年龄、性别、门脉癌栓、AFP水平、CK18、肿瘤大小、包膜完整度、子灶、肝炎、肝硬化、病理分级及免疫组织化学指标Hep-1间差异均无统计学意义(均P > 0.05),在CK19的阳性表达差异上有统计学意义(P < 0.05),CK2α'高表达的患者CK19阳性率更低,见表 1。
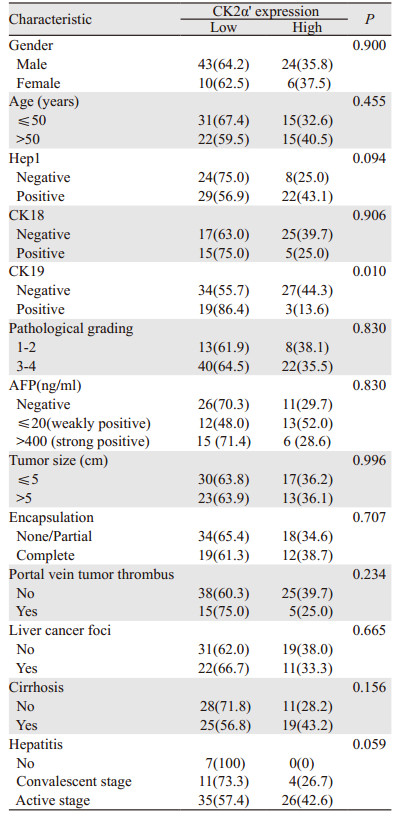
|
蛋白激酶CK2(以前称为酪蛋白激酶Ⅱ)是一种进化上高度保守且普遍存在的蛋白激酶。通常以四聚体形式存在于细胞中,由两个催化亚基(α或其亚型α')和两个调节亚基(β)组成,主要功能是控制底物选择性和酶稳定性[8]。它在真核生物的所有组织中均有表达,对正常胚胎发育至关重要。CK2磷酸化数百种底物,几乎参与所有细胞过程,但其主要功能与细胞生长、增殖和存活有关[9]。另外,Dominguez等[10-11]研究发现,蛋白激酶CK2参与调节肿瘤中关键的信号通路,如Wnt、JAK/STAT和PTEN/PI3K/Akt-PKB等,并且可以通过增强MYC原癌基因的稳定性[12]、激活NF-κB(抗凋亡因子)、抑制DNA修复和抑制肿瘤抑制磷酸酶PTEN[13-14]来促进肿瘤发生。尽管在多种实体瘤及血液肿瘤中都检测到了CK2的表达上调,但并非所有数据都支持CK2的过表达可以驱动肿瘤发生。Storz等[15]研究结果显示,CK2α'在滤泡性淋巴瘤中转录表达下调,但其下调机制尚未明确,并且CK2α'在乳腺癌、卵巢癌和胰腺癌中也表达下调[4]。说明蛋白激酶CK2在肿瘤中的作用很大程度上取决于它如何调节关键的信号通路,这在不同的癌症中可能是不同的[16]。
本研究发现CK2α'在肝癌组织中的表达相较于癌旁组织显著下调。对患者的预后分析发现,CK2α'高表达的患者更不易复发,且总生存时间更长。CK19作为肝祖细胞和胆管细胞中表达的细胞角蛋白[17],通常能在恶性肿瘤及癌症早期复发的患者血液中检测到,常与肝癌预后不良相关[18]。进一步对83例肝癌患者的临床病理指标分析后发现,CK2α'的表达在肝癌患者的年龄、性别、肝硬化、肝炎、肿瘤大小、CK18、病理分级等临床指标间差异均无统计学意义,但在CK19的阳性表达上差异有统计学意义,CK2α'低表达患者CK19的阳性比例更高,说明CK2α'低表达的患者预后更差。
HCC作为世界范围内与癌症相关的主要死亡原因之一,发病率和致死性高,发病机制复杂,人们不断寻求发现筛查、诊断和治疗策略,以改善这种恶性肿瘤的预后。用于监测和早期HCC诊断的有用生物标志物显得至关重要[19]。本研究探讨了CK2α'与肝癌形成及预后的关联,发现CK2α'在肝癌患者的肿瘤组织中的表达低于癌旁正常组织,结合随访资料分析,发现CK2α'低表达的患者生存期短、复发率高,且CK2α'低表达的患者病理指标CK19阳性比例高,以上结果均提示CK2α'的表达水平与肝癌预后有关,CK2α'有望成为肝癌患者的诊疗新标志物。
作者贡献:
周思蕾:实验数据分析及文章撰写
孙冠群:数据整理及数据分析
曾榃伦:统计学软件分析及实验材料准备
程卓:数据分析及实验设计核实
梁喜俊:文章修改和数据补充
| [1] |
Liu Y, Veeraraghavan V, Pinkerton M, et al. Viral Biomarkers for Hepatitis B Virus-Related Hepatocellular Carcinoma Occurrence and Recurrence[J]. Front Microbiol, 2021, 12: 665201. DOI:10.3389/fmicb.2021.665201 |
| [2] |
Zhang Z, Chen P, Xie H, et al. Overexpression of GINS4 Is Associated With Tumor Progression and Poor Survival in Hepatocellular Carcinoma[J]. Front Oncol, 2021, 11: 654185. DOI:10.3389/fonc.2021.654185 |
| [3] |
Borgo C, D'Amore C, Sarno S, et al. Protein kinase CK2: a potential therapeutic target for diverse human diseases[J]. Signal Transduct Target Ther, 2021, 6(1): 183. |
| [4] |
Chua M, Lee M, Dominguez IM. Cancer-type dependent expression of CK2 transcripts[J]. PLos One, 2017, 12(12): e0188854. DOI:10.1371/journal.pone.0188854 |
| [5] |
Roffey SE, Litchfield DW. CK2 Regulation: Perspectives in 2021[J]. Biomedicines, 2021, 9(10): 1361. DOI:10.3390/biomedicines9101361 |
| [6] |
Seongrak K, Sunyoung H, Kyungmi Y, et al. Protein kinase CK2 activation is required for transforming growth factor-β-induced epithelial-mesenchymal transition[J]. Mol Oncol, 2018, 12(10): 1811-1826. DOI:10.1002/1878-0261.12378 |
| [7] |
de Villavicencio-Diaz TN, Rabalski AJ, Litchfield DW. Protein Kinase CK2: Intricate Relationships within Regulatory Cellular Networks[J]. Pharmaceuticals (Basel), 2017, 10(1): 27. |
| [8] |
Pinna LA. Protein kinase CK2: a challenge to canons[J]. J Cell Sci, 2002, 115(Pt 20): 3873-3878. |
| [9] |
Borgo C, Ruzzene M. Role of protein kinase CK2 in antitumor drug resistance[J]. J Exp Clin Cancer Res, 2019, 38(1): 287. DOI:10.1186/s13046-019-1292-y |
| [10] |
Dominguez I, Mizuno J, Wu H, et al. A role for CK2alpha/beta in Xenopus early embryonic development[J]. Mol Cell Biochem, 2005, 274(1-2): 125-131. DOI:10.1007/s11010-005-3073-5 |
| [11] |
Dominguez I, Mizuno J, Wu H, et al. Protein kinase CK2 is required for dorsal axis formation in Xenopus embryos[J]. Dev Biol, 2004, 274(1): 110-124. DOI:10.1016/j.ydbio.2004.06.021 |
| [12] |
Hong H, Benveniste EN. The Immune Regulatory Role of Protein Kinase CK2 and Its Implications for Treatment of Cancer[J]. Biomedicines, 2021, 9(12): 1932. DOI:10.3390/biomedicines9121932 |
| [13] |
Channavajhala P, Seldin DC. Functional interaction of protein kinase CK2 and c-Myc in lymphomagenesis[J]. Oncogene, 2002, 21(34): 5280-5288. |
| [14] |
Gomes AM, Soares MV, Ribeiro P, et al. Adult B-cell acute lymphoblastic leukemia cells display decreased PTEN activity and constitutive hyperactivation of PI3K/Akt pathway despite high PTEN protein levels[J]. Haematologica, 2014, 99(6): 1062-1068. |
| [15] |
Storz MN, van de Rijn M, Kim YH, et al. Gene expression profiles of cutaneous B cell lymphoma[J]. J Invest Dermatol, 2003, 120(5): 865-870. |
| [16] |
Lian H, Su M, Zhu Y, et al. Protein Kinase CK2, a Potential Therapeutic Target in Carcinoma Management[J]. Asian Pac J Cancer Prev, 2019, 20(1): 23-32. |
| [17] |
安晓刚, 马万龙, 马玉, 等. 血清细胞角蛋白19检测在原发性肝癌中的应用价值[J]. 宁夏医科大学学报, 2018, 40(2): 211-213. [An XG, Ma WL, Ma Y, et al. Application value of serum cytokeratin 19 in primary liver cancer[J]. Ningxia Yi Ke Da Xue Xue Bao, 2018, 40(2): 211-213.] |
| [18] |
Chen Y, Chen J, Zhang Y, et al. Preoperative Prediction of Cytokeratin 19 Expression for Hepatocellular Carcinoma with Deep Learning Radiomics Based on Gadoxetic Acid-Enhanced Magnetic Resonance Imaging[J]. J Hepatocell Carcinoma, 2021, 8: 795-808. |
| [19] |
Piñero F, Dirchwolf M, Pessôa MG. Biomarkers in Hepatocellular Carcinoma: Diagnosis, Prognosis and Treatment Response Assessment[J]. Cells, 2020, 9(6): 1370. |
 2022, Vol. 49
2022, Vol. 49


