文章信息
- 骨肉瘤免疫治疗的现状和前景
- Current Status and Prospects of Immunotherapy for Osteosarcoma
- 肿瘤防治研究, 2022, 49(7): 721-726
- Cancer Research on Prevention and Treatment, 2022, 49(7): 721-726
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1281
- 收稿日期: 2021-11-08
- 修回日期: 2022-02-14
骨肉瘤是最常见的具有高度侵袭性和转移性的原发恶性骨肿瘤,发病率约占原发恶性骨肿瘤的56%[1]。骨肉瘤在儿童和青少年(中位年龄16岁)中较为常见,好发于长骨干骺端,包括股骨远端和胫骨近端[2]。根据第5版世界卫生组织(WHO)骨与软组织肿瘤分类,将骨肉瘤分为低级别中心性骨肉瘤、普通型骨肉瘤、血管扩张型骨肉瘤、小细胞型骨肉瘤、骨膜骨肉瘤、骨旁骨肉瘤、高级别表面骨肉瘤和继发性骨肉瘤[3]。外科手术是治疗骨肉瘤的重要方法,随着新辅助化疗方案的推广,化疗联合手术治疗使非转移性骨肉瘤患者5年生存率达到70%。对于晚期和复发性骨肉瘤患者,尽管加入了各种化疗方案,在以往数十年的研究中治疗效果仍然很差,5年生存率仅为20%[4]。因此,迫切需要寻找一种可以从根本上改善骨肉瘤预后的新型治疗方案。
一般情况下,人体内细胞发生癌变后,免疫系统都可识别并消灭肿瘤细胞,但肿瘤细胞非常“狡猾”,可通过多种手段“欺骗”免疫系统实现免疫逃逸。为避免肿瘤免疫逃逸的发生,肿瘤免疫治疗应运而生。肿瘤免疫治疗是通过重新激活体内的免疫系统,再次启动并维持“肿瘤-免疫循环”进而杀伤肿瘤细胞的手段。肿瘤免疫反应以细胞免疫反应为主,CD8+细胞毒性T淋巴细胞(CTL)受到抗原特异性信号和协同刺激信号双重信号激活,是杀伤肿瘤细胞的主要效应细胞;CD4+T细胞在接受双重信号刺激后活化也释放IL-2和IFN-γ等细胞因子,在调节抗肿瘤过程中发挥重要作用[5];NK细胞(natural killer cells)和NKT细胞(natural killer T cells)通过抗体依赖细胞介导的细胞毒性作用、Fas/FasL途径、穿孔素-颗粒酶途径以及释放TNF等细胞毒性因子杀伤肿瘤细胞[6]。体液免疫仅在某些情况下起协同作用,甚至可以抑制免疫细胞的功能,进而促进肿瘤的生长。持续的体液免疫反应加剧肿瘤微环境中先天免疫细胞的募集和激活,进而影响肿瘤组织及癌旁组织的组织重塑、血管生成等功能,这些保护机制反而共同促进了肿瘤进展[7]。如乳腺癌诱导引流淋巴结中的B细胞积累,这些B细胞通过产生靶向糖基化膜蛋白HSPA4的致病性IgG,选择性促进淋巴结转移[8]。
近年来在肿瘤免疫反应研究的基础上,研究者们针对肿瘤微环境中T细胞或其受体的靶向治疗(如免疫检查点抑制剂PD-1/PD-L1单抗),以PD-1/PD-L1单抗为代表的免疫治疗在黑色素瘤、肺癌、乳腺癌等不同类型的肿瘤中取得了令人鼓舞的疗效[9],再次激发了肿瘤免疫治疗研究的热潮。近年来随着骨肉瘤患者的规范化治疗后所遇到的瓶颈,针对骨肉瘤免疫治疗的基础研究和临床试验日益增多,本文从增强患者自身免疫系统对肿瘤的应答和外源性增强患者免疫功能两个方面对骨肉瘤的免疫治疗进行综述,见图 1,以期将来能发挥免疫治疗的优势治愈骨肉瘤。
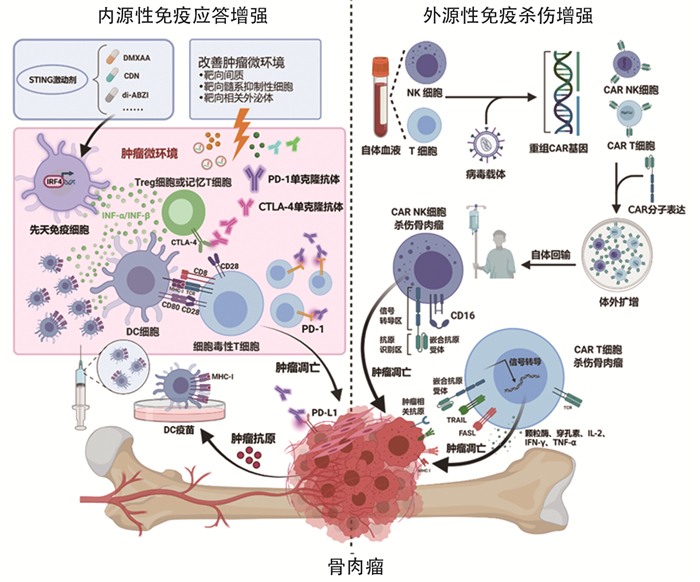
|
| 图 1 骨肉瘤免疫治疗手段 Figure 1 Immunotherapy for osteosarcoma |
人体免疫系统极为复杂,各种免疫细胞和免疫因子通过协同作用共同抵御外来威胁(例如感染、肿瘤等)。肿瘤细胞可通过隐藏抗原、下调人类白细胞抗原(HLA)表达、释放抑制性细胞因子、募集Treg细胞、骨髓源性抑制细胞和肿瘤相关M2巨噬细胞等手段实现免疫逃逸[10]。因此,增强患者自身免疫功能旨在消除肿瘤免疫逃逸并重新唤醒机体自身免疫系统识别,以达到清除肿瘤细胞的目的。
1.1 免疫检查点抑制剂近年来,研究者们开发了靶向细胞毒性T淋巴细胞相关抗原-4(CTLA-4)、PD-1/PD-L1单抗,并且这些已经在黑色素瘤[11]、肺癌[12]等恶性肿瘤治疗中取得了较好的疗效。PD-1/PD-L1作为免疫治疗靶点,开启了免疫治疗的新时代并加速了对骨肉瘤免疫治疗的研究。PD-1表达于包括CTL、NK细胞、B细胞等在内的各种免疫细胞表面,可与癌细胞表明的PD-L1结合从而对免疫细胞传递程序性死亡信号。目前已经有研究发现通过抗体阻断PD-1/PD-L1相互作用显著改善骨肉瘤对CTL的反应性,使转移性骨肉瘤小鼠模型的肿瘤负荷减少和存活率增加[13]。此外,阻断PD-1/PD-L1轴还增强了顺铂对骨肉瘤的化疗效果[14]。这些研究的有效性仅停留在动物模型阶段,而相关临床试验针对PD-1/PD-L1的单克隆抗体并未表现出和动物模型相同的治疗效果。Le Cesne等在17例晚期骨肉瘤患者中进行Ⅱ期临床试验发现6个月无进展生存率仅为13.3%,他们认为抑制PD-1在骨肉瘤免疫治疗中的疗效有限[15]。北京大学人民医院进行的卡瑞利珠单抗联合阿帕替尼治疗晚期骨肉瘤的Ⅱ期临床试验也未达到6个月的无进展生存(PFS)预设目标[16]。一项关于派姆单抗疗效的多中心Ⅱ期临床试验(SARC028)是第一个通过阻断免疫检查点来治疗晚期软组织肉瘤和骨肉瘤的前瞻性研究。虽然该研究显示出了一定应用前景,但入组患者疗效远未达到预期。只有18%的软组织肉瘤患者对于派姆单抗出现了临床反应,而出现临床反应的骨肉瘤患者仅有5%[17]。有研究报道,骨肉瘤的PD-L1表达水平不一且通常伴有MHCⅠ类分子的丢失导致了免疫逃逸的发生[18],这也许是免疫检查点抑制剂对于骨肉瘤疗效不佳的重要原因。因此骨肉瘤患者在进行免疫检查点抑制剂治疗之前,检测PD-L1和MHCⅠ类分子的表达水平对于改善疗效可能具有重要意义。
CTLA-4表达于调节性T细胞(Tregs)和记忆T细胞表面,表达过高将竞争性抑制T细胞CD28接受足够的协同刺激信号从而丧失抗癌活性,或与树突状细胞上的CD80/86结合后导致树突状细胞功能抑制[19]。与16例健康志愿者相比,19例骨肉瘤患者血液中发现T细胞CTLA-4表达水平上调,这是开发CTLA-4抑制剂的基础[20]。2011年开发的CTLA-4单克隆抗体易普利姆玛(Ipilimumab)被美国食品药品监督管理局(FDA)批准为首个治疗黑色素瘤的新一代免疫检查点抑制剂[21]。一项Ⅰ期临床试验研究发现25%的骨肉瘤患者在接受易普利姆玛治疗后病情稳定[22]。在转移性骨肉瘤K7M2小鼠模型中进行的联合α-CTLA-4和α-PD-L1抗体阻断免疫疗法使大多数小鼠肿瘤得到完全控制[23],这为治疗骨肉瘤提供了新的策略。
1.2 肿瘤疫苗肿瘤疫苗旨在通过暴露肿瘤抗原从而诱导人体免疫系统抗肿瘤反应。目前肿瘤疫苗技术最为成熟的当属宫颈癌疫苗,宫颈癌发病多为人乳头状瘤病毒(human papillomavirus, HPV)诱导,所以宫颈癌疫苗分为预防性疫苗(针对HPV感染)和治疗性疫苗(暴露肿瘤抗原)[24]。树突状细胞(DC)作为一种专职的抗原呈递细胞,可激活并增强CTL的增殖能力。DC疫苗作为目前主要的肿瘤疫苗已被应用于多种类型的肿瘤治疗以消除难治性肿瘤中的肿瘤细胞,在骨肉瘤中DC疫苗应用最为普遍[25]。虽然Mackall等研究显示接种DC疫苗的30例患者与对照组相比,5年生存率从31%延长到43%[26],但Himoudi观察的12例接受DC疫苗治疗的骨肉瘤患者,只有2例诱导了针对肿瘤的特异性T细胞免疫反应[27];Miwa等在37例骨肉瘤患者中评估了35例患者的临床反应,仅有6例患者病情稳定,28例患者出现了肿瘤的进展[28]。这些研究表明肿瘤疫苗治疗骨肉瘤是安全的,并且可以在一定程度上激活免疫系统,但对骨肉瘤的治疗效果或与其他免疫疗法联用是否会改善患者预后仍不清楚,需要更多相关研究支持。
1.3 改善肿瘤微环境肿瘤的发生发展与肿瘤组织周围环境的改变密切相关且同时发生,肿瘤细胞通过分泌各种细胞因子、趋化因子和其他因子来功能性地塑造肿瘤生存微环境,这种微环境又可以反过来影响肿瘤的发生发展,这就是肿瘤微环境。肿瘤微环境中不仅存在多种细胞(巨噬细胞、中性粒细胞、树突状细胞、髓源性抑制细胞、NK细胞、T细胞、B细胞、肿瘤相关成纤维细胞等),还存在丰富的细胞外基质(胶原蛋白、纤连蛋白、层粘连蛋白、玻连蛋白和生腱蛋白等)以及各种细胞因子(IL-1β、IL-6、IL-10、IFN-γ和TGF-β等)[29]。这些非细胞成分抑制了肿瘤微环境中T细胞的活性,促进了肿瘤血管生成和生长,构成了药物递送的物理屏障,抑制药物渗透到肿瘤的深部区域,从而导致肿瘤对各种治疗药物的敏感度降低[30]。研究发现骨肉瘤细胞通过控制免疫浸润细胞的募集和分化,建立有利于肿瘤生长、耐药和转移的局部微环境[31]。针对骨肉瘤微环境的研究从未停下脚步,近年来许多研究证实骨肉瘤来源的外泌体可以广泛促进免疫抑制,此类外泌体可以通过多种途径抑制T细胞和NK细胞的活性,甚至诱导T细胞凋亡,同时增强骨髓源性抑制细胞(MDSC)活性以支持骨肉瘤细胞免疫逃逸[32]。另外,一些细胞因子如TGF-β在骨肉瘤中表达高于健康个体,这是导致转移和化疗耐药的重要原因,与单独使用TGF-β阻断剂相比,骨肉瘤小鼠模型在TGF-β阻断剂与DC疫苗联合使用时CTL数量增加,显示出更强的抗肿瘤作用[33]。这些研究表明,靶向骨肉瘤肿瘤微环境的免疫抑制状态可能是一种有效的治疗策略,但仍需进一步临床试验加以验证。
1.4 增强先天免疫虽然适应性免疫是肿瘤免疫治疗的主要手段,但是先天性免疫的作用同样不可或缺。最近,先天免疫细胞在控制肿瘤进展中的作用已得到证实,先天免疫通过直接识别杀伤、自我激活触发强烈的适应性免疫反应来抑制肿瘤进展[34]。由于先天免疫细胞在抗原呈递、抗原特异性T细胞引发和不依赖主要组织相容性复合体(MHC)的直接细胞杀伤方面的作用,其在消除骨肉瘤方面具有独特优势。树突状细胞、巨噬细胞、NK细胞、NKT细胞和γδ T细胞等先天免疫细胞已经在骨肉瘤中得到广泛研究,并且与免疫检查点抑制剂联合应用进行了多项临床试验[35]。环磷酸鸟苷-腺苷酸合成酶-干扰素基因刺激蛋白(cGAS-STING)通路由于可激活产生Ⅰ型干扰素进而提高抗肿瘤免疫力从而获得了极大的关注[36],STING是一种存在于内质网中的胞质DNA传感器,可招募和激活TANK结合激酶1(TBK1),后者进一步磷酸化干扰素调节转录因子3(IRF3)上调Ⅰ型干扰素的表达[37],Ⅰ型干扰素具有多种免疫刺激功能,促进DC、T细胞和NK细胞等成熟、迁移和激活[38]。鉴于STING的重要性,研究者们开发了多种STING激动剂(如DMXAA、CDN、di-ABZI等),并将其作为肿瘤疫苗佐剂、免疫检查点治疗增敏剂等应用于动物肿瘤治疗中[37],如STING激动剂改变了小鼠胰腺癌模型的肿瘤负荷,增加了小鼠存活率[39];STING激动剂和抗PD-1抗体联合应用可减少小鼠卵巢癌模型的腹水并延长生存时间[40]。如果将STING激动剂应用于骨肉瘤的治疗,可能是一种有效的策略。
2 外源性免疫功能细胞杀伤骨肉瘤组织外源性增强患者免疫功能主要是通过输注免疫细胞,也被称为过继细胞疗法(ACT)。肿瘤细胞可能会下调自身HLA和肿瘤抗原的表达,从而使它们无法被T细胞识别,而工程化T细胞对肿瘤特定抗原具有高亲和力,无需在HLA呈递的背景下即可识别肿瘤细胞[41],这种T细胞称为嵌合抗原受体T细胞(CAR-Ts)。T细胞可以通过由α和β链组成的T细胞受体(TCR)识别抗原,但只有在抗原以8-11个氨基酸长的肽段形式存在时,αβ-TCR才能识别响应抗原[42],说明人体内T细胞识别肿瘤抗原的条件较为苛刻。CAR与TCR不同,CAR分子不需要MHC可以直接识别和结合表达在细胞表面的靶分子。CAR分子是一种合成融合蛋白,由识别靶抗原的胞外域、铰链区、跨膜域和胞内信号域组成[43]。首先需要采集分离并纯化肿瘤患者外周血中的T细胞,然后利用病毒载体将CAR分子的基因构建体插入到T细胞的基因组中,使T细胞在其表面表达CAR分子,由此产生的CAR-T细胞在体外扩增后(一般需要达到十亿至百亿数量级)回输患者体内[44]。
CAR-T细胞在血液系统肿瘤的治疗中进行了广泛的临床试验,并取得了重大突破。一项临床试验发现CD22 CAR-T细胞在治疗难治性或复发性B型急性淋巴细胞白血病可使80%(24/30)的患者得到缓解,也为后续造血干细胞移植实现持久缓解提供了宝贵的时间窗口[45]。鉴于CAR-T细胞治疗的重要性,美国FDA于2017年8月批准了诺华公司的tisagenlecleucel(CTL019)作为一种CD19导向的CAR-T细胞产品,用于治疗25岁以下复发或难治性急性淋巴细胞白血病的患者[46]。在骨肉瘤中,由于原发性骨肿瘤通常表现出低突变负荷并伴随罕见的天然抗肿瘤T细胞,因此CAR-T细胞疗法可能是一种有效的策略[47]。Majzner团队开发了针对泛癌抗原B7-H3的CAR-T细胞,并在动物体内展现出显著的抗肿瘤活性,可使异种移植模型中已建立的骨肉瘤、髓母细胞瘤和尤文肉瘤等实体瘤消退[48]。CAR-T疗法在实体瘤中寻找其他合适的CAR靶点以及实体瘤中免疫抑制性的肿瘤微环境比血液系统肿瘤更具有挑战性。原发性骨肿瘤相对罕见,这也给专门针对肿瘤抗原的CAR-T细胞进行临床试验带来了局限。另外CAR-T细胞治疗的不良反应也不容忽视,CAR-T细胞相关性脑病综合征(CRES)、全身炎性反应综合征(SIRS)、炎性结肠炎和对靶器官的毒性仍有待解决[49]。
其他过继细胞治疗方案包括CAR-NK细胞和CAR-肿瘤浸润淋巴细胞(TIL)。与T细胞不同,NK细胞是先天免疫细胞,具有细胞毒性和调节免疫功能[33],它不介导移植物抗宿主病(GVHD),可以最大限度地提高靶向肿瘤细胞毒性,同时减少不良作用,有望实现抗肿瘤效应而无需担心长期毒性。TIL是另一种形式的过继细胞疗法,研究显示转移性黑色素瘤患者对TIL的客观反应率(ORR)为40%~70%,治疗效果令人满意[50]。一项临床前研究报告表明,从骨肉瘤组织中提取的TIL可以有效穿透肿瘤微环境,并对同种异体肿瘤细胞显示出明显细胞毒性作用,这表明TIL疗法可能是治疗骨肉瘤的有效策略[49]。
3 总结和展望骨肉瘤的生物学特征表明,增强人体免疫反应可能会改善骨肉瘤患者的预后,但是骨肉瘤的异质性和免疫系统的复杂性又决定了骨肉瘤免疫治疗所具有的艰巨性。骨肉瘤从来都不是某种单一的治疗方案可以治愈的,进行SARC028临床试验的专家分析骨肉瘤对免疫治疗抵抗的机制可能是由于抑癌基因PTEN失效后导致PI3K-AKT通路过度激活所致[17],由此可见不同方案的联合治疗策略是非常有必要的。在小鼠转移性骨肉瘤模型中同时阻断CTLA-4和PD-L1可完全控制50%的小鼠发生肿瘤扩散,且该联合策略也在治疗儿童复发或难治性实体瘤中展现了希望的曙光[23]。不同机制的治疗方案联用展现出了令人满意的治疗效果,如免疫检查点抑制剂可增加CAR-T细胞和TIL的活性[51],免疫检查点抑制剂也在Ⅰ期临床试验中与CAR-T细胞疗法和肿瘤疫苗联用以检测联合用药的效果[52]。此外,这些免疫治疗手段也可辅助手术、化疗以及靶向治疗等,它们相辅相成,共同发挥抗骨肉瘤作用。
即使有如此多的免疫治疗手段,但骨肉瘤临床治疗上,特别是骨肉瘤的免疫治疗,仍未取得明显的突破。骨肉瘤是一种基因组高度复杂、具有复杂的核型、突变负荷较高的肿瘤,使用单一的疗法治疗骨肉瘤,往往不能取得良好的效果[53-54]。而且临床上发现肿瘤时,肿瘤往往已经处于一种低免疫原性的状态,单纯增加免疫效应细胞或者免疫应答细胞可能在骨肉瘤中并不能取得比较好的效果。切实提高骨肉瘤的免疫原性可能是未来肿瘤免疫治疗的重点和难点。期待将来逆转骨肉瘤免疫逃逸的治疗方案可以彻底治愈骨肉瘤,为骨肉瘤患者带来新的希望。
作者贡献:
吴蔚:论文撰写
景豆豆:论文修改
曹理:论文修改、插图绘制
浦飞飞:论文审校
邵增务:选题设计、论文审校
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. DOI:10.3322/caac.21442 |
| [2] |
Chen C, Xie L, Ren T, et al. Immunotherapy for osteosarcoma: Fundamental mechanism, rationale, and recent breakthroughs[J]. Cancer Lett, 2021, 500: 1-10. DOI:10.1016/j.canlet.2020.12.024 |
| [3] |
Choi JH, Ro JY. The 2020 WHO Classification of Tumors of Bone: An Updated Review[J]. Adv Anat Pathol, 2021, 28(3): 119-138. DOI:10.1097/PAP.0000000000000293 |
| [4] |
Meyers PA, Healey JH, Chou AJ, et al. Addition of pamidronate to chemotherapy for the treatment of osteosarcoma[J]. Cancer, 2011, 117(8): 1736-1744. DOI:10.1002/cncr.25744 |
| [5] |
Haworth KB, Leddon JL, Chen CY, et al. Going back to class Ⅰ: MHC and immunotherapies for childhood cancer[J]. Pediatr Blood Cancer, 2015, 62(4): 571-576. DOI:10.1002/pbc.25359 |
| [6] |
Subleski JJ, Wiltrout RH, Weiss JM. Application of tissue-specific NK and NKT cell activity for tumor immunotherapy[J]. J Autoimmun, 33(3-4): 275-281.
|
| [7] |
Tan TT, Coussens LM. Humoral immunity, inflammation and cancer[J]. Curr Opin Immunol, 2007, 19(2): 209-216. DOI:10.1016/j.coi.2007.01.001 |
| [8] |
Gu Y, Liu Y, Fu L, et al. Tumor-educated B cells selectively promote breast cancer lymph node metastasis by HSPA4-targeting IgG[J]. Nat Med, 2019, 25(2): 312-322. DOI:10.1038/s41591-018-0309-y |
| [9] |
Brahmer JR, Tykodi SS, Chow LQ, et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer[J]. N Engl J Med, 2012, 366(26): 2455-2465. DOI:10.1056/NEJMoa1200694 |
| [10] |
Schreiber RD, Old LJ, Smyth MJ. Cancer immunoediting: integrating immunity's roles in cancer suppression and promotion[J]. Science, 2011, 331(6024): 1565-1570. DOI:10.1126/science.1203486 |
| [11] |
Larkin J, Chiarion-Sileni V, Gonzalez R, et al. Combined Nivolumab and Ipilimumab or Monotherapy in Untreated Melanoma[J]. N Engl J Med, 2015, 373(1): 23-34. DOI:10.1056/NEJMoa1504030 |
| [12] |
Forde PM, Chaft JE, Smith KN, et al. Neoadjuvant PD-1 Blockade in Resectable Lung Cancer[J]. N Engl J Med, 2018, 378(21): 1976-1986. DOI:10.1056/NEJMoa1716078 |
| [13] |
Lussier DM, O'Neill L, Nieves LM, et al. Enhanced T-cell immunity to osteosarcoma through antibody blockade of PD-1/PD-L1 interactions[J]. J Immunother, 2015, 38(3): 96-106. DOI:10.1097/CJI.0000000000000065 |
| [14] |
Liu X, He S, Wu H, et al. Blocking the PD-1/PD-L1 axis enhanced cisplatin chemotherapy in osteosarcoma in vitro and in vivo[J]. Environ Health Prev Med, 2019, 24(1): 79. DOI:10.1186/s12199-019-0835-3 |
| [15] |
Le Cesne A, Marec-Berard P, Blay JY, et al. Programmed cell death 1 (PD-1) targeting in patients with advanced osteosarcomas: results from the PEMBROSARC study[J]. Eur J Cancer, 2019, 119: 151-157. DOI:10.1016/j.ejca.2019.07.018 |
| [16] |
Xie L, Xu J, Sun X, et al. Apatinib plus camrelizumab (anti-PD1 therapy, SHR-1210) for advanced osteosarcoma (APFAO) progressing after chemotherapy: a single-arm, open-label, phase 2 trial[J]. J Immunother Cancer, 2020, 8(1): e000798. DOI:10.1136/jitc-2020-000798 |
| [17] |
Tawbi HA, Burgess M, Bolejack V, et al. Pembrolizumab in advanced soft-tissue sarcoma and bone sarcoma (SARC028): a multicentre, two-cohort, single-arm, open-label, phase 2 trial[J]. Lancet Oncol, 2017, 18(11): 1493-1501. DOI:10.1016/S1470-2045(17)30624-1 |
| [18] |
Shen JK, Cote GM, Choy E, et al. Programmed cell death ligand 1 expression in osteosarcoma[J]. Cancer Immunol Res, 2014, 2(7): 690-698. DOI:10.1158/2326-6066.CIR-13-0224 |
| [19] |
Callahan MK, Postow MA, Wolchok JD. CTLA-4 and PD-1 Pathway Blockade: Combinations in the Clinic[J]. Front Oncol, 2014, 4: 385. |
| [20] |
Hingorani P, Maas ML, Gustafson MP, et al. Increased CTLA-4(+) T cells and an increased ratio of monocytes with loss of class Ⅱ (CD14(+) HLA-DR(lo/neg)) found in aggressive pediatric sarcoma patients[J]. J Immunother Cancer, 2015, 3: 35. DOI:10.1186/s40425-015-0082-0 |
| [21] |
Wolchok JD, Neyns B, Linette G, et al. Ipilimumab monotherapy in patients with pretreated advanced melanoma: a randomised, double-blind, multicentre, phase 2, dose-ranging study[J]. Lancet Oncol, 2010, 11(2): 155-164. DOI:10.1016/S1470-2045(09)70334-1 |
| [22] |
Merchant MS, Wright M, Baird K, et al. Phase Ⅰ Clinical Trial of Ipilimumab in Pediatric Patients with Advanced Solid Tumors[J]. Clin Cancer Res, 2016, 22(6): 1364-1370. DOI:10.1158/1078-0432.CCR-15-0491 |
| [23] |
Lussier DM, Johnson JL, Hingorani P, et al. Combination immunotherapy with α-CTLA-4 and α-PD-L1 antibody blockade prevents immune escape and leads to complete control of metastatic osteosarcoma[J]. J Immunother Cancer, 2015, 3: 21. DOI:10.1186/s40425-015-0067-z |
| [24] |
Roden R, Wu TC. How will HPV vaccines affect cervical cancer?[J]. Nat Rev Cancer, 2006, 6(10): 753-763. DOI:10.1038/nrc1973 |
| [25] |
Dyson KA, Stover BD, Grippin A, et al. Emerging trends in immunotherapy for pediatric sarcomas[J]. J Hematol Oncol, 2019, 12(1): 78. DOI:10.1186/s13045-019-0756-z |
| [26] |
Mackall CL, Rhee EH, Read EJ, et al. A pilot study of consolidative immunotherapy in patients with high-risk pediatric sarcomas[J]. Clin Cancer Res, 2008, 14(15): 4850-4858. DOI:10.1158/1078-0432.CCR-07-4065 |
| [27] |
Himoudi N, Wallace R, Parsley KL, et al. Lack of T-cell responses following autologous tumour lysate pulsed dendritic cell vaccination, in patients with relapsed osteosarcoma[J]. Clin Transl Oncol, 2012, 14(4): 271-279. DOI:10.1007/s12094-012-0795-1 |
| [28] |
Miwa S, Nishida H, Tanzawa Y, et al. Phase 1/2 study of immunotherapy with dendritic cells pulsed with autologous tumor lysate in patients with refractory bone and soft tissue sarcoma[J]. Cancer, 2017, 123(9): 1576-1584. DOI:10.1002/cncr.30606 |
| [29] |
Wu T, Dai Y. Tumor microenvironment and therapeutic response[J]. Cancer Lett, 2017, 387: 61-68. DOI:10.1016/j.canlet.2016.01.043 |
| [30] |
Qian BZ, Pollard JW. Macrophage diversity enhances tumor progression and metastasis[J]. Cell, 2010, 141(1): 39-51. DOI:10.1016/j.cell.2010.03.014 |
| [31] |
Heymann MF, Lézot F, Heymann D. The contribution of immune infiltrates and the local microenvironment in the pathogenesis of osteosarcoma[J]. Cell Immunol, 2019, 343: 103711. DOI:10.1016/j.cellimm.2017.10.011 |
| [32] |
Pu F, Chen F, Zhang Z, et al. Information Transfer and Biological Significance of Neoplastic Exosomes in the Tumor Microenvironment of Osteosarcoma[J]. Onco Targets Ther, 2020, 13: 8931-8940. DOI:10.2147/OTT.S266835 |
| [33] |
Wedekind MF, Wagner LM, Cripe TP. Immunotherapy for osteosarcoma: Where do we go from here?[J]. Pediatr Blood Cancer, 2018, 65(9): e27227. DOI:10.1002/pbc.27227 |
| [34] |
Woo SR, Corrales L, Gajewski TF. Innate immune recognition of cancer[J]. Ann Rev Immunol, 2015, 33: 445-474. DOI:10.1146/annurev-immunol-032414-112043 |
| [35] |
Wang Z, Wang Z, Li B, et al. Innate Immune Cells: A Potential and Promising Cell Population for Treating Osteosarcoma[J]. Front Immunol, 2019, 10: 1114. |
| [36] |
Pu F, Chen F, Liu J, et al. Immune Regulation of the cGAS-STING Signaling Pathway in the Tumor Microenvironment and Its Clinical Application[J]. Onco Targets Ther, 2021, 14: 1501-1516. DOI:10.2147/OTT.S298958 |
| [37] |
Li A, Yi M, Qin S, et al. Activating cGAS-STING pathway for the optimal effect of cancer immunotherapy[J]. J Hematol Oncol, 2019, 12(1): 35. |
| [38] |
Fuertes MB, Woo SR, Burnett B, et al. Type Ⅰ interferon response and innate immune sensing of cancer[J]. Trends Immunol, 2013, 34(2): 67-73. DOI:10.1016/j.it.2012.10.004 |
| [39] |
Jing W, McAllister D, Vonderhaar EP, et al. STING agonist inflames the pancreatic cancer immune microenvironment and reduces tumor burden in mouse models[J]. J Immunother Cancer, 2019, 7(1): 115. DOI:10.1186/s40425-019-0573-5 |
| [40] |
Ghaffari A, Peterson N, Khalaj K, et al. STING agonist therapy in combination with PD-1 immune checkpoint blockade enhances response to carboplatin chemotherapy in high-grade serous ovarian cancer[J]. Br J Cancer, 2018, 119(4): 440-449. |
| [41] |
Jaspers JE, Brentjens RJ. Development of CAR T cells designed to improve antitumor efficacy and safety[J]. Pharmacol Ther, 2017, 178: 83-91. |
| [42] |
Folkert IW, Devalaraja S, Linette GP, et al. Primary Bone Tumors: Challenges and Opportunities for CAR-T Therapies[J]. J Bone Miner Res, 2019, 34(10): 1780-1788. |
| [43] |
Guedan S, Calderon H, Posey AD Jr, et al. Engineering and Design of Chimeric Antigen Receptors[J]. Mol Ther Methods Clin Dev, 2019, 12: 145-156. |
| [44] |
Feinberg D, Paul B, Kang Y. The promise of chimeric antigen receptor (CAR) T cell therapy in multiple myeloma[J]. Cell Immunol, 2019, 345: 103964. |
| [45] |
Pan J, Niu Q, Deng B, et al. CD22 CAR T-cell therapy in refractory or relapsed B acute lymphoblastic leukemia[J]. Leukemia, 2019, 33(12): 2854-2866. |
| [46] |
Pehlivan KC, Duncan BB, Lee DW. CAR-T Cell Therapy for Acute Lymphoblastic Leukemia: Transforming the Treatment of Relapsed and Refractory Disease[J]. Curr Hematol Malig Rep, 2018, 13(5): 396-406. |
| [47] |
Potter JW, Jones KB, Barrott JJ. Sarcoma-The standard-bearer in cancer discovery[J]. Crit Rev Oncol Hematol, 2018, 126: 1-5. |
| [48] |
Majzner RG, Theruvath JL, Nellan A, et al. CAR T Cells Targeting B7-H3, a Pan-Cancer Antigen, Demonstrate Potent Preclinical Activity Against Pediatric Solid Tumors and Brain Tumors[J]. Clin Cancer Res, 2019, 25(8): 2560-2574. |
| [49] |
Théoleyre S, Mori K, Cherrier B, et al. Phenotypic and functional analysis of lymphocytes infiltrating osteolytic tumors: use as a possible therapeutic approach of osteosarcoma[J]. BMC Cancer, 2005, 5: 123. |
| [50] |
Rosenberg SA, Yannelli JR, Yang JC, et al. Treatment of patients with metastatic melanoma with autologous tumor-infiltrating lymphocytes and interleukin 2[J]. J Nat Cancer Inst, 1994, 86(15): 1159-1166. |
| [51] |
Tang H, Wang Y, Chlewicki LK, et al. Facilitating T Cell Infiltration in Tumor Microenvironment Overcomes Resistance to PD-L1 Blockade[J]. Cancer Cell, 2016, 30(3): 500. |
| [52] |
Sierro SR, Donda A, Perret R, et al. Combination of lentivector immunization and low-dose chemotherapy or PD-1/PD-L1 blocking primes self-reactive T cells and induces anti-tumor immunity[J]. Eur J Immunol, 2011, 41(8): 2217-2228. |
| [53] |
Kansara M, Teng MW, Smyth MJ, et al. Translational biology of osteosarcoma[J]. Nat Rev Cancer, 2014, 14(11): 722-735. |
| [54] |
Kovac M, Blattmann C, Ribi S, et al. Exome sequencing of osteosarcoma reveals mutation signatures reminiscent of BRCA deficiency[J]. Nat Commun, 2015, 6: 8940. |
 2022, Vol. 49
2022, Vol. 49


