文章信息
- 多靶点CAR-T细胞治疗肿瘤的研究进展
- Research Progress of Multi-target CAR-T Cell Therapy for Cancer
- 肿瘤防治研究, 2022, 49(7): 709-714
- Cancer Research on Prevention and Treatment, 2022, 49(7): 709-714
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1224
- 收稿日期: 2021-11-01
- 修回日期: 2022-02-08
2. 710000 西安,西北工业大学医学研究院;
3. 710054 西安,空军第986医院泌尿外科
2. Medical Research Institute of Northwestern Polytechnical University, Xi'an 710000, China;
3. Department of Urology, Air Force 986 Hospital, Xi'an 710054, China
恶性肿瘤的治疗依然是世界性难题,根据GLOBOCAN 2020数据库显示,2020年全球新发癌症19 292 789例,9 958 133例癌症患者死亡,较2018年统计数据均有所上升,乳腺癌、肺癌、结直肠癌的发病率位列前三[1]。近年来,肿瘤免疫治疗技术逐步提高,包括单克隆抗体、双特异性抗体、肿瘤疫苗、免疫检查点的抑制、CAR-T细胞治疗等,为肿瘤患者带来了新的曙光。CAR-T细胞通过对T细胞的基因改造,表达特异性识别肿瘤的融合性受体,并发挥强大的抗肿瘤功能,然而CAR-T在实际应用过程中存在诸多副作用及肿瘤复发问题。为了提高CAR-T的敏感度和抗肿瘤能力,融合基因的表达模式也逐渐由单靶点过渡到双靶点或多靶点模式。本文将系统介绍多靶点CAR-T的发展及应用前景。
1 CAR-T疗法CAR-T是一种过继细胞免疫疗法,该方法是从患者血液中提取T淋巴细胞,在体外进行基因改造及扩增,再回输给患者,进而发挥靶向杀伤肿瘤的作用。改造后的T细胞表达独特的融合性受体,该受体胞外结构域一般由能够特异性地识别肿瘤相关抗原(tumor-associated antigen, TAA)的单链片段(single-chain variable fragment, scFv)组成,往往决定了CAR-T细胞的肿瘤靶向性。CAR-T细胞的胞内区为免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motifs, ITAMs),发挥信号转导和细胞激活功能,加上共刺激分子的作用,激活的T细胞大量释放穿孔素和颗粒酶对肿瘤细胞产生直接溶解作用,同时分泌干扰素γ(interferon-gamma, IFN-γ)等细胞因子介导靶细胞的杀伤。CAR-T较普通的T细胞更具有靶向性、杀伤性,而且不受主要组织相容性复合体(MHC)限制[2],成为了抗肿瘤的一大利器。
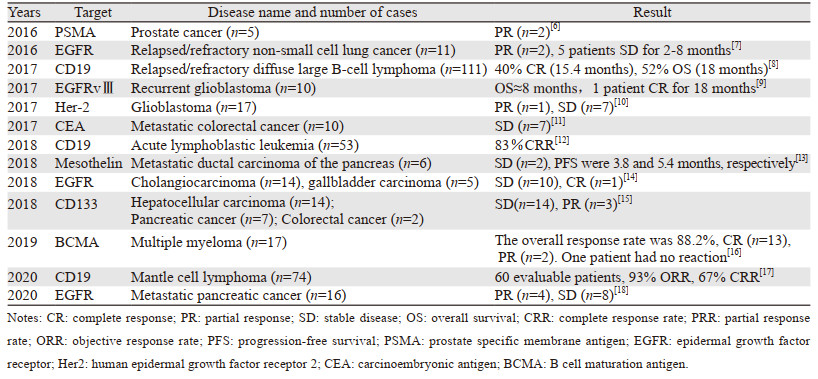
2 CAR-T治疗肿瘤的现状在一系列临床研究中,发现CAR-T对血液相关肿瘤有显著的疗效。2013年全球首例CD19的CAR-T免疫疗法治疗1名急性淋巴细胞白血病患儿,病情获得完全缓解(complete response, CR)[3]。随后以CD19为靶点的CAR-T在治疗血液系统肿瘤中得到了广泛应用,有效率高达60%~80%。然而强大的杀伤力也带来了细胞因子风暴(cytokine release syndrome, CRS)、脱靶效应等不良反应。同时,抗原的丢失可能使CAR-T逐渐失效,肿瘤复发或难治成为了新的难题,据统计:CAR-T细胞治疗复发性/难治性急性B细胞淋巴细胞白血病,1年累积复发率约50%~60%[4]。在实体肿瘤中,由于异质性高,靶点特异性不强,脱靶效应更加显著,CAR-T在攻击肿瘤细胞时也攻击了正常细胞,造成不必要的器官损害,加之复杂的抑制性肿瘤微环境,导致CAR-T治疗实体肿瘤效能低下,整体有效率只有9%左右[5]。近年来一些代表性的临床试验结果见表 1。
抗原逃逸是逃避免疫治疗的主要潜在机制,单靶点的CAR-T治疗后不可避免地面临着复发快、复发率高等问题,当肿瘤出现复发后往往更难治疗,多靶点CAR-T细胞可能是解决这一问题的有效方法。多靶点的嵌合抗原受体工程T细胞是指T细胞上同时表达2个或2个以上的受体,两者各自发挥功能或协同发挥功能,而且在一定程度上提高了抗原覆盖率,克服抗原逃逸,提高靶抗原的特异性和持久性,当一种抗原丢失后仍能保持肿瘤的杀伤能力。目前最常见的多靶点CAR-T是双靶点CAR-T,主要的几种形式为:联合CAR-T疗法;Dual CAR;双靶点串联CAR-T;三靶点CAR-T。
3.1 联合CAR-T疗法这是一种混合式或鸡尾酒式疗法,即两个不同靶点的CAR-T细胞系混合或序贯治疗,每种细胞表达不同的抗原特异性CAR;例如:Ruella等研究发现,患有B-ALL的儿童经过CD19-CAR-T治疗后出现复发,这些患儿检测表型为CD19+、CD123+,随后给予CD123-CAR-T,能够很好地根除疾病[19]。Wang等报道了一项序贯CD19和CD22-CAR-T细胞治疗难治/复发性B细胞恶性肿瘤的疗效和安全性,纳入的89例患者,51例B-ALL患者的微小残留(MRD)阴性反应率为96.0%;38例非霍奇金淋巴瘤(NHL)患者总反应率为72.2%,CR为50.0%,表明序贯输注CD19/22CAR-T细胞治疗B细胞肿瘤是有效的[20]。值得注意的是,使用两种CAR-T细胞系可能导致细胞群体的不平衡,对肿瘤细胞产生强烈的免疫压力,这也可能导致两种抗原同时逃逸[21]。在一项实验中向胰腺导管癌(PDAC)患者注入CD19-CAR-T和Meso-CAR-T后,发现两种CAR-T表现出不同的扩张能力,在纳入本研究的三例患者中观察到CD19-CAR-T细胞与Meso-CAR-T细胞联合时并没有提高Meso-CAR-T细胞的持久性[22]。另一项研究中,1例对放化疗不敏感的晚期转移性胆管癌(CAA)患者采取了CAR-T鸡尾酒疗法,从CART-EGFR治疗中获得了8.5月的部分缓解(PR),随后从CART133治疗中获得了持续4.5月的PR,几次CAR-T的注射都引起了相关急性不良反应,比如寒颤、发热、肌痛、呕吐、皮疹等,甚至需要临床干预[23]。目前仍需更多的临床研究来优化联合CAR-T细胞治疗方案,尽可能减轻不良反应,避免复发。
3.2 Dual CARDual CAR是通过共转染等方式,使单个T细胞共同表达两个独立的CAR结构,传递独立的两种信号。由于肿瘤异质性,没有单一的特异性肿瘤抗原,这种组合的多抗原靶向策略可能抵消潜在的抗原逃逸机制。研究表明,Dual CAR-T与单靶点的CAR-T或者联合两个单靶点CAR-T细胞群相比,能够更有效地防止抗原逃逸,增强抗肿瘤效果,而且当Dual CAR-T细胞遇到两种抗原共同存在时,可表现出最大的下游信号转导。Ruella等[19]建立的CD19和CD123的Dual CAR-T细胞,证实了具有较好的抗肿瘤作用和较长的持久性,在异种移植模型中防止了因CD19抗原丢失引起的复发。同样,在实体肿瘤中应用Dual CAR-T也有类似的效果,一种双靶点CAR-T分别靶向前列腺特异性膜抗原(PSMA)和前列腺干细胞抗原(PSCA)。在小鼠前列腺癌模型中证实,双靶点CAR-T细胞能够根除PSCA+ PSMA+的小鼠肿瘤,而PSCA+PSMA-的小鼠肿瘤对治疗反应差[24]。虽然Dual CAR-T能够高度激活T细胞,但也容易引起细胞因子风暴,并对低表达靶抗原的正常细胞过度杀伤,因此需要在结构设计和功能上进一步的优化,在确保安全的情况下有效发挥肿瘤杀伤作用。
3.3 双靶点串联CAR-T该形式是两个不同的抗原结合结构域串联表达在同一个工程化T细胞上,可引起不同的应答,不论识别哪种抗原,都可以保留细胞溶解能力。基于此种设计,研究人员构建了一种人源化的CD37-CD19 CAR-T细胞,能够特异的靶向CD37阳性或CD19阳性细胞,杀伤效果和分泌IFN-γ情况均优于CD19单靶点的CAR-T[25]。最近,一项Ⅰ期临床试验首次使用抗CD20、抗CD19双特异性CAR T细胞来治疗复发难治性B细胞恶性肿瘤,22例患者输入双特异性抗体后,第28天的总体反应率为82%,其中14例患者获得完全缓解,4例部分缓解,在治疗中显示出低毒性和高疗效,值得注意的是,在复发或经历治疗失败的患者中未观察到CD19的丢失,表明双特异性CAR可以通过减轻靶抗原下调作为复发机制来改善临床反应[26]。在实体瘤的研究中,与共表达BCMA和CS1的Dual CAR-T细胞相比,BCMA/CS1双靶点串联CAR-T细胞表现出出众的CAR表达率和更加优越的功能[27]。可见,这种双靶点串联的CAR-T有着广泛的研究前景。由于实体肿瘤微环境中抑制性受体的存在,尤其是T细胞表面存在程序性死亡因子1(programmed death factor 1, PD-1),使得CAR-T细胞注入后容易出现衰竭,因此研究人员也青睐于引入PD-L1作为CAR-T的另一靶点,提高CAR-T的存活力和持久力。比如Li等构建的PD-L1/MUC16双靶点CAR-T,在体内外均显示出对卵巢癌细胞的强大杀伤能力,存活时间方面,双特异性CAR-T细胞的功效比单特异性CAR-T细胞高2~4倍[28]。此外,还有Trop 2、C-MET等与PD-1或PD-L1为组合设计的双靶点CAR-T[29-31],与单靶CAR-T细胞相比,双靶点CAR-T细胞显示出较低的抑制性受体表达和较低的分化特性,从而在PD-L1高表达的肿瘤异种移植模型中产生了强大的抗肿瘤作用,并延长了生存期。
3.4 三靶点CAR-T为了进一步解决肿瘤抗原逃逸,克服耐药性问题,目前也积极在开发三靶点的CAR-T。该类型CAR-T细胞是由三个靶向有效抗原的CAR组成的单一工程T细胞。Miltenyi Biotec公司的一个科学家团队报道了CD19-CD20-CD22三靶点CAR-T细胞研究成果,他们表明,在体外和B-ALL小鼠模型中,CD19-CD20-CD22 CAR-T细胞能够有效控制CD19抗原逃逸的肿瘤,可用于顽固性疾病患者的抢救或一线CAR治疗[32]。在胶质母细胞瘤的治疗中,虽然双特异性CAR-T带来一些希望,但因患者肿瘤表面抗原表达的差异性,双特异性CAR-T仍不能提供足够的抗原覆盖。Bielamowicz[33]团队设计了同时串联靶向HER2、IL13Rα2和EphA2的三靶点CAR-T细胞用以克服患者之间的变异性,这些细胞实现了GBM肿瘤细胞近100%的捕获率并发挥强大的抗肿瘤作用。他们表明,三靶点CAR-T细胞的功能增强可能是由增强的T细胞激活信号,广泛的肿瘤抗原覆盖范围和强大的免疫突触形成而引起的。此外,贝勒医学院的研究人员还开发出了一种新型CAR-T(Smar T),可独立识别前列腺干细胞抗原(PSCA)和TGF-β、IL-4,传递独立的信号包括:抗原识别,共刺激和细胞因子分泌,当三种关键信号被识别并传递给T细胞后,T细胞就会被激活并在肿瘤部位扩增,同时抵抗肿瘤环境的抑制作用,确保其持续的长期生存和效应功能[34]。这种新型CAR-T有望成为多靶点CAR-T的发展方向。未来需要更多的优化靶点设计,更合理的逻辑门控系统来增加CAR-T细胞的治疗智能化。
4 多靶点CAR-T的未来发展方向 4.1 提高安全性能提高安全性的最好办法是寻找特异性好的靶点,目前一些常用的靶点如:间皮素(mesothelin, MSLN)、神经节苷脂2(GD2)、人类表皮生长因子受体2(human epidermal growth factor receptor 2, Her-2)、癌胚抗原(carcinoembryonic antigen, CEA)、前列腺特异性膜抗原(prostate-specific membrane antigen, PSMA)等,但这些靶点虽然在肿瘤中高表达,在正常组织中也有少量表达,因此都只能称为肿瘤相关性抗原(TAA)。除了寻找特异性更高的靶点外,另一种策略是引入自杀基因,即在CAR-T产生不良毒性作用的时候终止CAR-T。单纯疱疹病毒-胸苷激酶(Herpes simplex vires-derived enzyme thymidine kinase, HSV-TK)是一种高度免疫原性的病毒衍生蛋白,能将前体药物更昔洛韦(ganciclovir, GCV)转化为GCV-三磷酸,通过阻断DNA合成导致细胞死亡。将HSV-TK基因插入至CAR-T,使其对抗病毒药物GCV敏感,以此控制CAR-T的存活[35]。另一种是诱导型半胱氨酸蛋白酶9(inducible caspase 9, iCasp9)系统,iCasp9的诱导依赖于小分子二聚体药物AP1903,二聚能快速诱导转染细胞凋亡,优先杀死表达高水平转基因的活化细胞。Klopp等[36]观察到注射iC9二聚体后1~6 h,血液和脾脏中的CAR-T细胞减少了90%以上,肝脏中的CAR-T细胞减少了99%以上,从而限制了肝毒性并阻止了细胞因子的分泌。
4.2 提高CAR-T归巢在实体肿瘤中,肿瘤血管屏障、细胞外基质、肿瘤微环境的抑制因子等因素,共同阻碍了静注药物的疗效。CAR-T细胞在注射后往往不能有效到达肿瘤深处发挥作用,甚至过早衰竭,因此如何提高CAR-T的归巢是其发挥作用的前提。最直接的方法是将CAR-T细胞局部作用于肿瘤部位,比如在胸膜内注射靶向间皮素抗原的CAR-T[37]、颅内注射IL-13Rα2-CAR-T细胞等[38],都能够使患者的生存期显著延长。另一种想法是增强CAR-T趋化性,Wang等[39]设计了一种特异性针对肿瘤抗原间皮素(MSLN-CAR)的CAR与细胞趋化因子受体CCR2b或CCR4共表达,显著增强了其迁移和浸润到肿瘤组织中的地方。
4.3 CAR-T联合其他抗肿瘤方案联合疗法往往能产生协同作用,可能增加CAR-T功效。放化疗是最常见的临床肿瘤治疗方案,放疗可以促进肿瘤相关抗原和压力信号的释放,引发非放疗部位肿瘤的消退,这种效应被称为“远隔效应”。此外低剂量化疗可清除负性调节免疫细胞,重塑免疫微环境,提高CAR-T细胞的增殖和免疫活性。在一项报道中,42例复发或难治性(R/R)侵袭性B细胞淋巴瘤患者在经过大剂量化疗后的自体干细胞移植(HDT-ASCT)后,输注了CD19/22 CAR-T细胞,总体缓解率达到90.5%,持续完全缓解(CR)患者中,分别有97.1%和68.6%在3个月时持续检测到CD19和CD22CAR基因表达,说明CAR-T的持久性在化疗后得到了延长[40]。
新兴的光热疗法也有较好的前景[41],光热治疗肿瘤是将光热转换材料注射入生物体内部或肿瘤,在特定的外部光源照射下将光能转化为热能,达到“烧死”肿瘤的目的。肿瘤的轻度热疗可降低其致密结构和组织间液压力,增加血液灌注,释放抗原,促进内源性免疫细胞的招募。Chen等[42]运用了装载吲哚菁绿(ICG)的聚乳酸-乙醇酸(PLGA)纳米颗粒,通过红外照射造成局部升温,增加了血液灌注,改变了肿瘤局部微环境,能够提高CAR-T在肿瘤局部的浸润。
此外,由于程序性死亡受体(PD-1)介导的T细胞抑制作用是肿瘤细胞逃逸的关键机制之一,联合PD-1或PD-L1抗体或阻断剂能够有效避免免疫抑制。Zah联合了BCMA-CD319的双靶点CAR-T与PD-1阻断剂治疗,加速了体内肿瘤的初始清除率,获得治疗的持久性[43]。这种强强联合的策略,可能成为一种有效克服肿瘤进展和转移的策略。
5 结语与展望总之,CAR-T细胞治疗恶性肿瘤还有着广阔的研究空间,虽然在血液肿瘤中的应用较为成功,但仍需解决的问题是:如何提高CAR-T治疗效力,维持CAR-T在体内的有效增殖,减少耗竭,不仅在于CAR-T的自身设计,也与肿瘤类型和免疫微环境状态息息相关。从单靶点到多靶点的演变,逐渐克服CAR-T治疗的安全性、有效性和可行性等问题,在加强自身武器的同时,通过对肿瘤微环境的调节可促进CAR-T更有效地发挥功能。随着人们对肿瘤的逐渐认知,个性化、智能化地改造T细胞,使其具有更高的靶向杀伤功能,这无疑是攻克肿瘤的有力武器。
作者贡献:
蒋遥:撰写文章
温伟红:修改文章
杨发:资料总结
聂迪森:文献查阅
张武合:内容核查
秦卫军:立题构思
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Kiani J, Naderi M, Torabi-Rahvar M, et al. Generation of CD19-Targeted Chimeric Antigen Receptor T Cells[J]. Arch Iran Med, 2019, 22(1): 7-10. |
| [3] |
Grupp SA, Kalos M, Barrett D, et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia[J]. N Engl J Med, 2013, 368(16): 1509-1518. DOI:10.1056/NEJMoa1215134 |
| [4] |
黄河, 黄玥, 胡永仙, 等. 嵌合抗原受体T细胞治疗后急性淋巴细胞白血病复发的研究进展[J]. 浙江医学, 2020, 42(23): 2487-2494. [Huang H, Huang Y, Hu YX, et al. Advances in the study of acute lymphoblastic leukemia recurrence after chimeric antigen receptor T cell therapy[J]. Zhejiang Yi Xue, 2020, 42(23): 2487-2494. DOI:10.12056/j.issn.1006-2785.2020.42.23.2020-3420] |
| [5] |
Hou B, Tang Y, Li W, et al. Efficiency of CAR-T Therapy for Treatment of Solid Tumor in Clinical Trials: A Meta-Analysis[J]. Dis Markers, 2019, 2019: 3425291. |
| [6] |
Junghans RP, Ma Q, Rathore R, et al. PhaseⅠTrial of Anti-PSMA Designer CAR-T Cells in Prostate Cancer: Possible Role for Interacting Interleukin 2-T Cell Pharmacodynamics as a Determinant of Clinical Response[J]. Prostate, 2016, 76(14): 1257-1270. DOI:10.1002/pros.23214 |
| [7] |
Feng K, Guo Y, Dai H, et al. Chimeric antigen receptor-modified T cells for the immunotherapy of patients with EGFR-expressing advanced relapsed/refractory non-small cell lung cancer[J]. Sci China Life Sci, 2016, 59(5): 468-479. DOI:10.1007/s11427-016-5023-8 |
| [8] |
Neelapu SS, Locke FL, Bartlett NL, et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma[J]. N Engl J Med, 2017, 377(26): 2531-2544. DOI:10.1056/NEJMoa1707447 |
| [9] |
O'Rourke DM, Nasrallah MP, Desai A, et al. A single dose of peripherally infused EGFRvⅢ-directed CAR T cells mediates antigen loss and induces adaptive resistance in patients with recurrent glioblastoma[J]. Sci Transl Med, 2017, 9(399): eaaa0984. DOI:10.1126/scitranslmed.aaa0984 |
| [10] |
Ahmed N, Brawley V, Hegde M, et al. HER2-Specific Chimeric Antigen Receptor-Modified Virus-Specific T Cells for Progressive Glioblastoma: A Phase 1 Dose-Escalation Trial[J]. JAMA Oncol, 2017, 3(8): 1094-1101. DOI:10.1001/jamaoncol.2017.0184 |
| [11] |
Zhang C, Wang Z, Yang Z, et al. PhaseⅠ Escalating-Dose Trial of CAR-T Therapy Targeting CEA(+) Metastatic Colorectal Cancers[J]. Mol Ther, 2017, 25(5): 1248-1258. DOI:10.1016/j.ymthe.2017.03.010 |
| [12] |
Park JH, Rivière I, Gonen M, et al. Long-Term Follow-up of CD19 CAR Therapy in Acute Lymphoblastic Leukemia[J]. N Engl J Med, 2018, 378(5): 449-459. DOI:10.1056/NEJMoa1709919 |
| [13] |
Beatty GL, O'Hara MH, Lacey SF, et al. Activity of Mesothelin-Specific Chimeric Antigen Receptor T Cells Against Pancreatic Carcinoma Metastases in a PhaseⅠTrial[J]. Gastroenterology, 2018, 155(1): 29-32. DOI:10.1053/j.gastro.2018.03.029 |
| [14] |
Guo Y, Feng K, Liu Y, et al. PhaseⅠStudy of Chimeric Antigen Receptor-Modified T Cells in Patients with EGFR-Positive Advanced Biliary Tract Cancers[J]. Clin Cancer Res, 2018, 24(6): 1277-1286. DOI:10.1158/1078-0432.CCR-17-0432 |
| [15] |
Wang Y, Chen M, Wu Z, et al. CD133-directed CAR T cells for advanced metastasis malignancies: A phase I trial[J]. Oncoimmunology, 2018, 7(7): e1440169. DOI:10.1080/2162402X.2018.1440169 |
| [16] |
Xu J, Chen LJ, Yang SS, et al. Exploratory trial of a biepitopic CAR T-targeting B cell maturation antigen in relapsed/refractory multiple myeloma[J]. Proc Natl Acad Sci U S A, 2019, 116(19): 9543-9551. DOI:10.1073/pnas.1819745116 |
| [17] |
Wang M, Munoz J, Goy A, et al. KTE-X19 CAR T-Cell Therapy in Relapsed or Refractory Mantle-Cell Lymphoma[J]. N Engl J Med, 2020, 382(14): 1331-1342. DOI:10.1056/NEJMoa1914347 |
| [18] |
Liu Y, Guo Y, Wu Z, et al. Anti-EGFR chimeric antigen receptor-modified T cells in metastatic pancreatic carcinoma: A phase I clinical trial[J]. Cytotherapy, 2020, 22(10): 573-580. DOI:10.1016/j.jcyt.2020.04.088 |
| [19] |
Ruella M, Barrett DM, Kenderian SS, et al. Dual CD19 and CD123 targeting prevents antigen-loss relapses after CD19-directed immunotherapies[J]. J Clin Invest, 2016, 126(10): 3814-3826. DOI:10.1172/JCI87366 |
| [20] |
Wang N, Hu X, Cao W, et al. Efficacy and safety of CAR19/22 T-cell cocktail therapy in patients with refractory/relapsed B-cell malignancies[J]. Blood, 2020, 135(1): 17-27. DOI:10.1182/blood.2019000017 |
| [21] |
Han X, Wang Y, Wei J, et al. Multi-antigen-targeted chimeric antigen receptor T cells for cancer therapy[J]. J Hematol Oncol, 2019, 12(1): 128. DOI:10.1186/s13045-019-0813-7 |
| [22] |
Ko AH, Jordan AC, Tooker E, et al. Dual Targeting of Mesothelin and CD19 with Chimeric Antigen Receptor-Modified T Cells in Patients with Metastatic Pancreatic Cancer[J]. Mol Ther, 2020, 28(11): 2367-2378. DOI:10.1016/j.ymthe.2020.07.017 |
| [23] |
Feng KC, Guo YL, Liu Y, et al. Cocktail treatment with EGFR-specific and CD133-specific chimeric antigen receptor-modified T cells in a patient with advanced cholangiocarcinoma[J]. J Hematol Oncol, 2017, 10(1): 4. DOI:10.1186/s13045-016-0378-7 |
| [24] |
Kloss CC, Condomines M, Cartellieri M, et al. Combinatorial antigen recognition with balanced signaling promotes selective tumor eradication by engineered T cells[J]. Nat Biotechnol, 2013, 31(1): 71-75. DOI:10.1038/nbt.2459 |
| [25] |
Golubovskaya V, Zhou H, Li F, et al. Novel CD37, Humanized CD37 and Bi-Specific Humanized CD37-CD19 CAR-T Cells Specifically Target Lymphoma[J]. Cancers (Basel), 2021, 13(5): 981. DOI:10.3390/cancers13050981 |
| [26] |
Shah NN, Johnson BD, Schneider D, et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: a phase 1 dose escalation and expansion trial[J]. Nat Med, 2020, 26(10): 1569-1575. DOI:10.1038/s41591-020-1081-3 |
| [27] |
Zah E, Nam E, Bhuvan V, et al. Systematically optimized BCMA/CS1 bispecific CAR-T cells robustly control heterogeneous multiple myeloma[J]. Nat Commun, 2020, 11(1): 2283. DOI:10.1038/s41467-020-16160-5 |
| [28] |
Li T, Wang J. Therapeutic effect of dual CAR-T targeting PDL1 and MUC16 antigens on ovarian cancer cells in mice[J]. BMC Cancer, 2020, 20(1): 678. DOI:10.1186/s12885-020-07180-x |
| [29] |
Yuan X, Sun Z, Yuan Q, et al. Dual-function chimeric antigen receptor T cells targeting c-Met and PD-1 exhibit potent anti-tumor efficacy in solid tumors[J]. Invest New Drugs, 2021, 39(1): 34-51. DOI:10.1007/s10637-020-00978-3 |
| [30] |
Zhao W, Jia L, Zhang M, et al. The killing effect of novel bi-specific Trop2/PD-L1 CAR-T cell targeted gastric cancer[J]. Am J Cancer Res, 2019, 9(8): 1846-1856. |
| [31] |
Jiang W, Li T, Guo J, et al. Bispecific c-Met/PD-L1 CAR-T Cells Have Enhanced Therapeutic Effects on Hepatocellular Carcinoma[J]. Front Oncol, 2021, 11: 546586. DOI:10.3389/fonc.2021.546586 |
| [32] |
Fousek K, Watanabe J, Joseph SK, et al. CAR T-cells that target acute B-lineage leukemia irrespective of CD19 expression[J]. Leukemia, 2021, 35(1): 75-89. DOI:10.1038/s41375-020-0792-2 |
| [33] |
Bielamowicz K, Fousek K, Byrd TT, et al. Trivalent CAR T cells overcome interpatient antigenic variability in glioblastoma[J]. Neuro Oncol, 2018, 20(4): 506-518. DOI:10.1093/neuonc/nox182 |
| [34] |
Sukumaran S, Watanabe N, Bajgain P, et al. Enhancing the Potency and Specificity of Engineered T Cells for Cancer Treatment[J]. Cancer Discov, 2018, 8(8): 972-987. DOI:10.1158/2159-8290.CD-17-1298 |
| [35] |
Greco R, Oliveira G, Stanghellini MT, et al. Improving the safety of cell therapy with the TK-suicide gene[J]. Front Pharmacol, 2015, 6: 95. |
| [36] |
Klopp A, Schreiber S, Kosinska AD, et al. Depletion of T cells via Inducible Caspase 9 Increases Safety of Adoptive T-Cell Therapy Against Chronic Hepatitis B[J]. Front Immunol, 2021, 12: 734246. DOI:10.3389/fimmu.2021.734246 |
| [37] |
Adusumilli PS, Cherkassky L, Villena-Vargas J, et al. Regional delivery of mesothelin-targeted CAR T cell therapy generates potent and long-lasting CD4-dependent tumor immunity[J]. Sci Transl Med, 2014, 6(261): 261ra151. |
| [38] |
Brown CE, Alizadeh D, Starr R, et al. Regression of Glioblastoma after Chimeric Antigen Receptor T-Cell Therapy[J]. N Engl J Med, 2016, 375(26): 2561-2569. DOI:10.1056/NEJMoa1610497 |
| [39] |
Wang Y, Wang J, Yang X, et al. Chemokine Receptor CCR2b Enhanced Anti-tumor Function of Chimeric Antigen Receptor T Cells Targeting Mesothelin in a Non-small-cell Lung Carcinoma Model[J]. Front Immunol, 2021, 12: 628906. DOI:10.3389/fimmu.2021.628906 |
| [40] |
Cao Y, Xiao Y, Wang N, et al. CD19/CD22 Chimeric Antigen Receptor T Cell Cocktail Therapy following Autologous Transplantation in Patients with Relapsed/Refractory Aggressive B Cell Lymphomas[J]. Transplantat Cell Ther, 2021, 27(11): 910.e1-910.e11. DOI:10.1016/j.jtct.2021.08.012 |
| [41] |
韩佳轩, 赵云. 声动力联合热疗抗肿瘤机制及其在肿瘤中的应用[J]. 肿瘤防治研究, 2022, 49(1): 78-82. [Han JX, Zhao Y. Anti-tumor Mechanism of Sonodynamic Combined with Hyperthermia and Its Application in Tumor[J]. Zhong Liu Fang Zhi Yan Jiu, 2022, 49(1): 78-82.] |
| [42] |
Chen Q, Hu Q, Dukhovlinova E, et al. Photothermal Therapy Promotes Tumor Infiltration and Antitumor Activity of CAR T Cells[J]. Adv Mater, 2019, 31(23): e1900192. |
| [43] |
Zah E, Nam E, Bhuvan V, et al. Systematically optimized BCMA/CS1 bispecific CAR-T cells robustly control heterogeneous multiple myeloma[J]. Nat Commun, 2020, 11(1): 2283. |
 2022, Vol. 49
2022, Vol. 49