文章信息
- MAD2L1在肺腺癌中的表达及对免疫微环境的影响
- Expression of MAD2L1 in Lung Adenocarcinoma and Its Effect on Immune Microenvironment
- 肿瘤防治研究, 2022, 49(6): 586-592
- Cancer Research on Prevention and Treatment, 2022, 49(6): 586-592
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1222
- 收稿日期: 2021-11-01
- 修回日期: 2022-02-28
2. 030002 太原,山西医科大学第二医院呼吸与危重症医学科
2. Department of Respiratory and Critical Care Medicine, The Second Hospital of Shanxi Medical University, Taiyuan 030002, China
肺腺癌(lung adenocarcinoma, LUAD)作为肺癌最主要的病理类型,占所有肺癌的80%~85%[1],以密集淋巴细胞浸润为特征,具有恶性程度高、起病隐匿、早期缺乏典型临床症状等特点[2-4],患者预后相对较差,早期易发生局部浸润和转移[5]。因此需要探索新的生物标志物,可靠地评估肿瘤患者预后和生存情况,为肺腺癌个体化诊疗提供依据。
有丝分裂阻滞缺陷蛋白2(MAD2L1)位于人类4号染色体上,是有丝分裂检查点复合蛋白的重要组成部分。目前研究表明,在哺乳动物细胞中MAD2L1功能的破坏可影响有丝分裂检查点的功能,MAD2L1在有丝分裂检查点的异常表达可导致染色体不稳定和非整倍体性[6],进而导致肿瘤的发生,有研究表明MAD2L1的遗传变异可导致肺癌易感性[7]。
本研究拟探讨MAD2L1在肺腺癌中的表达和作用以及MAD2L1调控肺腺癌细胞增殖、迁移和侵袭的分子机制,我们的研究可能对肺腺癌进展的分子机制有更多的了解,并为肺腺癌的诊断和预后提供潜在的指标。
1 材料与方法 1.1 数据获取和预处理从TCGA数据库获取TCGA-LUAD的RNA队列数据,对所有数据进行归一化处理以去除丢失和重复的结果,并从GEO数据库中经过筛选后,选择包含肺腺癌组织和正常肺组织样本的GSE31210数据集作为验证。其中GSE31210数据集包含226个肺腺癌样本和20个正常肺组织样本。
1.2 MAD2L1在肺腺癌中的表达分析利用TCGA-肺腺癌数据来分析包括肺腺癌在内的泛癌谱中MAD2L1基因在肿瘤和邻近正常组织之间的差异表达。Wilcoxon检验比较差异表达情况,P < 0.05为差异有统计学意义。
使用GEO数据进一步验证MAD2L1在肺腺癌中的表达水平。t检验分析表达差异,R(4.03版本)软件的ggplot2包对结果进行可视化分析,P < 0.01为差异有统计学意义。此外,UALCAN数据库[8](http://ualcan.path.uab.edu/index.html)分析MAD2L1的表达在肺腺癌不同临床分期、淋巴结转移等中的差异及意义。
1.3 MAD2L1的预后分析根据MAD2L1 mRNA表达水平的中位数将样本分为高表达组和低表达组,Kaplan-Meier生存曲线评估了MAD2L1表达在肺腺癌患者中总生存期(OS)和无复发生存期(RFS)的预后价值。组间生存率比较采用Log rank检验,P < 0.05为差异有统计学意义。
1.4 MAD2L1上游miRNA的预测和分析为了确定MAD2L1是否受到一些非编码RNA的调控,使用StarBase数据库对调控MAD2L1的上游miRNA进行预测,对肺腺癌中miRNA-MAD2L1进行相关性分析,构建miRNA-mRNA调控网络。
1.5 免疫浸润相关分析TIMER数据库[9]评估肺腺癌患者中MAD2L1表达水平与免疫细胞浸润、免疫相关标志物、免疫检查点表达水平的相关性。采用Spearman检验,P < 0.05为差异有统计学意义。
1.6 免疫组织化学在HPA数据库(https://www.proteinatlas.org)中,利用该网站的免疫组织化学图像数据,从蛋白表达水平比较MAD2L1在正常肺组织和肺腺癌组织中的表达水平差异。
2 结果 2.1 MAD2L1表达分析使用TIMER数据库分析TCGA RNA-seq数据来评估人类不同肿瘤中的MAD2L1转录水平。与正常样本相比,MAD2L1在多种癌症类型中上调,其在肺腺癌组织中显著上调(P < 0.001),见图 1A。进一步验证MAD2L1在肺腺癌组织中的表达水平。在TCGA队列中,MAD2L1在肺腺癌中的表达显著增加(P < 0.01),见图 1B。在GSE31210队列中,MAD2L1在肺腺癌中的表达显著增加(P < 0.001),见图 1C,使用探针ID为:1554768_a_at。这些结果表明MAD2L1在多种肿瘤中异常表达,在肺腺癌组织中的表达明显高于正常组织。

|
| A: MAD2L1 expression in pan-cancer; B: MAD2L1 expression in TCGA; C: MAD2L1 expression in GSE31210. LUAD: lung adenocarcinoma. 图 1 MAD2L1在不同肿瘤中的表达差异 Figure 1 Difference of MAD2L1 expression in different tumor |
利用UALCAN数据库分析正常肺组织和肺腺癌组织中MAD2L1的表达在肺腺癌不同临床分期淋巴结转移中的差异,结果显示:与正常肺组织相比,MAD2L1在Stage 1组、Stage 2组、Stage 3组和Stage 4组的表达差异有统计学意义(P < 1E-12, P < 1E-12, P=1.631E-12, P=3.187E-07),见图 2A。
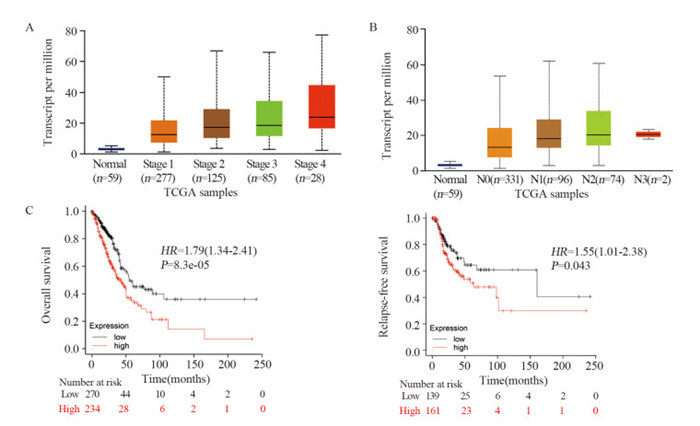
|
| A: individual cancer stages; B: nodal metastasis status; C: overall and relapse-free survival of MAD2L1. 图 2 MAD2L1表达与肺腺癌患者临床病理特征及预后的关系 Figure 2 Relation between MAD2L1 expression and clinicopathological characteristics and survival of LUAD patients |
与正常肺组织相比,MAD2L1在N0组、N1组和N2组的表达差异有统计学意义(P=1.624E-12, P < 1E-12, P=1.748E-12),而在N3组胃癌患者中的表达差异无统计学意义(P=9.635E-02),见图 2B。以上结果表明,肺腺癌组织中MAD2L1的高表达与肺腺癌组织不同临床病理分期、淋巴结转移有关。
2.3 MAD2L1预后分析与MAD2L1低表达组相比,MAD2L1高表达组肺腺癌患者(HR=1.79, P=8.3E-05)的总生存时间(OS)显著缩短(P < 0.05);MAD2L1的高表达(HR=1.55, P=0.043)与肺腺癌患者的无复发生存期(RFS)显著相关(P < 0.05),见图 2C。综合OS曲线和RFS曲线结果来看,MAD2L1可能成为肺腺癌患者不良预后的生物标志物。
2.4 MAD2L1与上游miRNA的预测与分析首先预测可能与MAD2L1结合的上游miRNA,最终发现了11个miRNA,Cytoscape软件对miRNA-MAD2L1调控网络进行可视化分析,见图 3A。根据miRNA调控靶基因表达的作用机制,miRNA与MAD2L1之间应该存在负相关关系。因此,进行了表达相关性分析后发现肺腺癌组织中MAD2L1与hsa-miR-139-5p、hsa-miR-101-3p呈显著负相关,与hsa-miR-28-5p、hsa-miR-493-3p、hsa-miR-708-5p、hsa-miR-873-5p呈正相关,MAD2L1与其他5个预测的miRNA之间差异无统计学意义,见表 1。
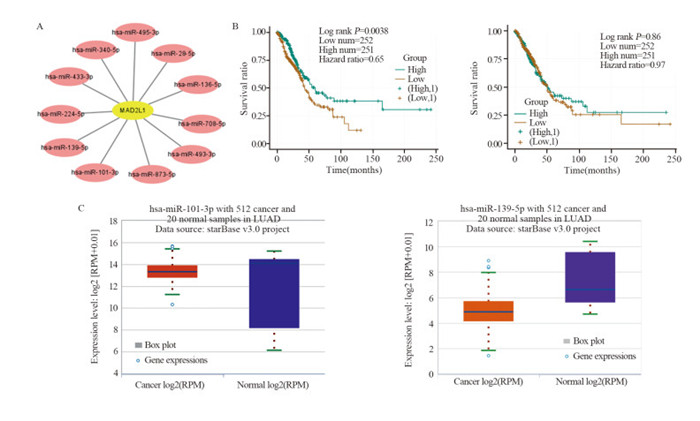
|
| A: miRNA-MAD2L1 regulatory network; B: prognostic value of hsa-miR-101-3p and hsa-miR-139-5p in lung adenocarcinoma; C: expression of hsamiR-101-3p and hsa-miR-139-5p in lung adenocarcinoma. 图 3 肺腺癌组织中MAD2L1上游miRNA基因hsa-miR-101-3p的鉴定 Figure 3 Identification of hsa-miR-101-3p as a potential upstream miRNA of MAD2L1 in LUAD |
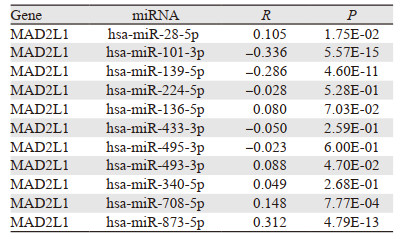
|
最后通过表达及预后分析,发现hsa-miR-101-3p在肺腺癌中表达下调,且其上调与患者预后呈正相关(P=0.0038),见图 3B、C。这表明hsa-miR-101-3p可能是MAD2L1在肺腺癌中最有潜力的调节miRNA。
2.5 MAD2L1表达水平与肺腺癌免疫细胞浸润水平的相关性MAD2L1的表达与B细胞(cor=-0.209, P=3.52E-06)、CD4+T细胞(cor=-0.196, P=1.43E-05)的浸润显著负相关,与CD8+T细胞(cor=-0.105, P=2.04E-02)、中性粒细胞(cor=0.134, P=3.28E-03)的浸润显著正相关,见图 4A。
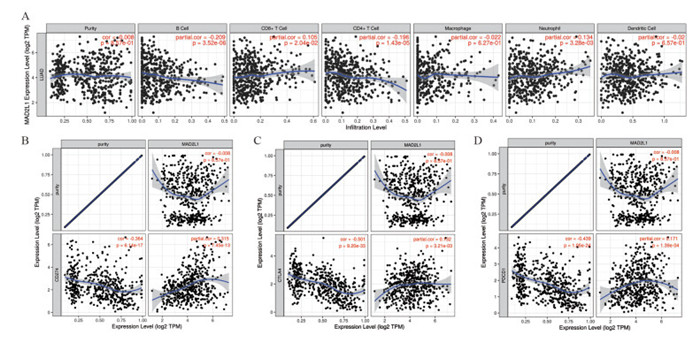
|
| A: immune cell infiltration; B: PD-L1; C: CTLA-4; D: PD-1. 图 4 肺腺癌组织中MAD2L1表达与免疫浸润和免疫检查点表达的相关性 Figure 4 Correlation of immune cell infiltration and immune checkpoint expression with MAD2L1 expression level in LUAD |
MAD2L1与CD8+T细胞的生物标志物(CD8A和CD8B)、M1型巨噬细胞的生物标志物(NOS2、IRF5和PTGS2)、M2型巨噬细胞的生物标志物(CD163、VSIG4和MS4A4A)显著正相关,与B细胞的生物标志物(CD19和CD79A)、CD4+T细胞的生物标志物(CD4)、中性粒细胞的生物标志物(ITGAM和CCR7)以及树突状细胞的生物标志物(HLA-DPB1、HLA-DQB1、HLA-DRA、HLA-DPA1、CD1C)显著负相关,见表 2。
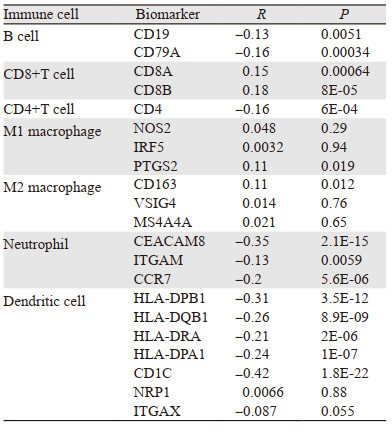
|
MAD2L1在肺腺癌的表达与PD1、PD-L1和CTLA-4呈显著正相关,表明肿瘤免疫逃逸可能参与了肺腺癌MAD2L1介导的致癌作用,见图 4B~D。
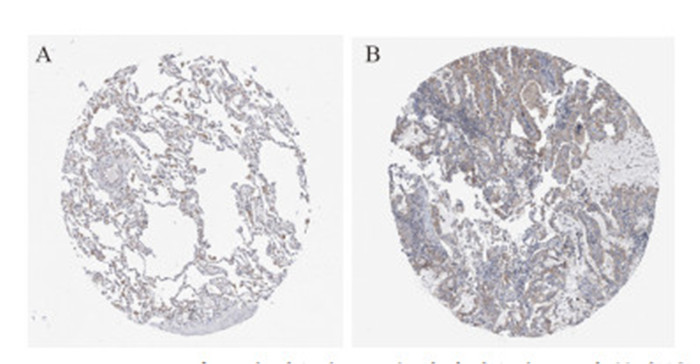
2.8 MAD2L1蛋白表达水平相较于正常肺组织,肿瘤组织的蛋白表达和抗体染色程度都是较高水平的,且阳性染色颗粒主要位于细胞质或细胞膜上,见图 5。
|
| 图 5 MAD2L1在正常肺组织(A)和肺腺癌组织(B)中的表达(HPA数据库) Figure 5 Immunohistochemical image of MAD2L1 protein expression in normal lung tissue(A) and lung adenocarcinoma tissue(B) (HPA database) |
细胞周期是哺乳动物生长发育必不可缺的关键步骤[10],细胞周期检查点异常被认为是多种肿瘤的重要致病原因,细胞周期检查点负责在细胞周期的关键节点上检查基因组异常,启动基因修复或凋亡信号[11],如果检查点被破坏,在不受控制的有丝分裂过程中染色体的丢失或错误分布将导致细胞非整倍体。非整倍体的发展可能导致肿瘤的发生,先前的研究在癌前病变和浸润性肺癌中可以检测到非整倍体,DNA含量异常的肺癌患者的生存期明显缩短[12]。这些发现强烈提示肺癌的发生可能与细胞周期检查点的功能障碍有关,细胞周期检查点相关蛋白也被认为是抗肿瘤治疗的关键靶点[13]。
MAD2L1基因集中在细胞周期通路,且MAD2L1作为有丝分裂检查点复合蛋白的一个组成部分,被认为是染色体控制途径的重要介体[14],在调控有丝分裂过程中的染色体分离方面起着至关重要的作用。MAD2L1水平失调的细胞表现出严重的有丝分裂异常,肿瘤内MAD2L1水平高与肿瘤患者预后不良和无复发生存率降低相关。MAD2L1在乳腺癌[15]、肺癌、肝癌[16]和胃癌[17]中都被发现过表达。
越来越多证据表明,MAD2L1在包括肺腺癌在内的多种人类癌症的发生和发展中起关键作用[18]。本研究通过对MAD2L1的表达分析、相关性分析和生存分析等,发现MAD2L1高表达的肺腺癌患者预后较差。Shi等[19]认为MAD2L1是肺腺癌的不良预后生物标志物,其表达增加可能使肺腺癌患者具有较高的癌症复发风险和较差的生存率,这和我们的分析结果一致表明了MAD2L1在肺腺癌中的致癌作用,并可能被用作肺腺癌治疗的潜在靶标。
此外,通过对MAD2L1的上游调控miRNA的预测,确定了miR-101-3p为有意义的MAD2L1的上游调控miRNA。此外通过相关表达分析和生存分析,发现miR-101-3p在肺腺癌组织中低表达,miR101-3p高表达的肺腺癌患者预后相对较好。这与Meng[20]、Liu等[21]的报道一致。因此,miR-101-3p通过靶向负调控MAD2L1的表达抑制肺腺癌细胞的增殖、迁移和侵袭,在肺腺癌中发挥了抗肿瘤作用。
大量研究证实,肿瘤免疫细胞浸润可影响肿瘤患者化疗、放疗或免疫治疗的疗效和预后[22-24]。本研究表明,MAD2L1与肺腺癌中的各种免疫细胞,与B细胞、CD4+T细胞呈显著负相关,与CD8+T细胞、中性粒细胞呈显著正相关。此外,MAD2L1还与这些浸润的免疫细胞生物标志物显著相关,提示肿瘤免疫浸润可能是MAD2L1介导的肺腺癌致癌作用的部分原因。此外,免疫治疗的效果不仅需要足够的免疫细胞在肿瘤微环境中浸润,还依赖于免疫检查点的充分表达[25]。因此,我们还评估了MAD2L1与免疫检查点的关系。结果表明,肺腺癌组织中MAD2L1的高表达与PD1、PD-L1或CTLA-4密切相关,提示靶向MAD2L1可提高肺腺癌的免疫治疗效果。
综上所述,本研究阐明了MAD2L1在肺腺癌中的高表达,并与肺腺癌的不良预后呈正相关,确定了MAD2L1在肺腺癌中的上游调控机制,即miR-101-3p/MAD2L1轴。MAD2L1可能通过增加肿瘤免疫细胞浸润和免疫检查点表达而发挥其致癌作用。然而,这些结果还需要在未来进行更多的基础实验和更大规模的临床试验来验证。
作者贡献:
刘迎博:课题思路设计、数据分析及文章撰写
刘晓红:数据分析、课题思路设计
茹美华:数据筛选和分析
李建强:审阅及指导修改
| [1] |
Torre LA, Siegel RL, Jemal A. Lung Cancer Statistics[J]. Adv Exp Med Biol, 2016, 893: 1-19. |
| [2] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [3] |
Eanes WF. New views on the selection acting on genetic polymorphism in central metabolic genes[J]. Ann N Y Acad Sci, 2017, 1389(1): 108-123. DOI:10.1111/nyas.13285 |
| [4] |
Xu XH, Kou LC, Wang HM, et al. Genetic polymorphisms of melatonin receptors 1A and 1B may result in disordered lipid metabolism in obese patients with polycystic ovary syndrome[J]. Mol Med Rep, 2019, 19(3): 2220-2230. |
| [5] |
Luo C, Lei M, Zhang Y, et al. Systematic construction and validation of an immune prognostic model for lung adenocarcinoma[J]. J Cell Mol Med, 2020, 24(2): 1233-1244. DOI:10.1111/jcmm.14719 |
| [6] |
Foijer F, Albacker LA, Bakker B, et al. Deletion of the MAD2L1 spindle assembly checkpoint gene is tolerated in mouse models of acute T-cell lymphoma and hepatocellular carcinoma[J]. Elife, 2017, 6: e20873. DOI:10.7554/eLife.20873 |
| [7] |
Kim Y, Choi JW, Lee JH, et al. Spindle assembly checkpoint MAD2 and CDC20 overexpressions and cell-in-cell formation in gastric cancer and its precursor lesions[J]. Hum Pathol, 2019, 85: 174-183. DOI:10.1016/j.humpath.2018.10.029 |
| [8] |
Chandrashekar DS, Bashel B, Balasubramanya AH, et al. UALCAN: A Portal for Facilitating Tumor Subgroup Gene Expression and Survival Analyses[J]. Neoplasia, 2017, 19(8): 649-658. DOI:10.1016/j.neo.2017.05.002 |
| [9] |
Li T, Fan J, Wang B, et al. TIMER: A Web Server for Comprehensive Analysis of Tumor-Infiltrating Immune Cells[J]. Cancer Res, 2017, 77(21): e108-e110. DOI:10.1158/0008-5472.CAN-17-0307 |
| [10] |
Leal-esteban LC, Fajas L. Cell cycle regulators in cancer cell metabolism[J]. Biochim Biophys Acta Mol Basis Dis, 2020, 1866(5): 165715. DOI:10.1016/j.bbadis.2020.165715 |
| [11] |
Niwa M. A cell cycle checkpoint for the endoplasmic reticulum[J]. Biochim Biophys Acta Mol Cell Res, 2020, 1867(12): 118825. DOI:10.1016/j.bbamcr.2020.118825 |
| [12] |
Alikhanyan K, Chen Y, Somogyi K, et al. Mad2 Induced Aneuploidy Contributes to Eml4-Alk Driven Lung Cancer by Generating an Immunosuppressive Environment[J]. Cancers(Basel), 2021, 13(23): 6027. |
| [13] |
Wenzel ES, Singh TK. Cell-cycle Checkpoints and Aneuploidy on the Path to Cancer[J]. In vivo, 2018, 32(1): 1-5. |
| [14] |
Gay S. A novel function for the mitotic checkpoint protein Mad2p in translation[J]. Mol Cell Oncol, 2018, 5(4): e1494949. DOI:10.1080/23723556.2018.1494949 |
| [15] |
Zhu XF, Yi M, He J, et al. Pathological significance of MAD2L1 in breast cancer: an immunohistochemical study and meta analysis[J]. Int J Clin Exp Pathol, 2017, 10(9): 9190-9201. |
| [16] |
Li Y, Bai W, Zhang J. MiR-200c-5p suppresses proliferation and metastasis of human hepatocellular carcinoma (HCC) via suppressing MAD2L1[J]. Biomed Pharmacother, 2017, 92: 1038-1044. DOI:10.1016/j.biopha.2017.05.092 |
| [17] |
Wang Y, Wang F, He J, et al. miR-30a-3p Targets MAD2L1 and Regulates Proliferation of Gastric Cancer Cells[J]. Onco Targets Ther, 2019, 12: 11313-11324. DOI:10.2147/OTT.S222854 |
| [18] |
Lin X, Zhou M, Xu Z, et al. Bioinformatics study on genes related to a high-risk postoperative recurrence of lung adenocarcinoma[J]. Sci Prog, 2021, 104(3): 368504211018053. |
| [19] |
Shi YX, Zhu T, Zou T, et al. Prognostic and predictive values of CDK1 and MAD2L1 in lung adenocarcinoma[J]. Oncotarget, 2016, 7(51): 85235-85243. DOI:10.18632/oncotarget.13252 |
| [20] |
Meng X, Sun Y, Liu S, et al. miR-101-3p sensitizes lung adenocarcinoma cells to irradiation via targeting BIRC5[J]. Oncol Lett, 2021, 21(4): 282. DOI:10.3892/ol.2021.12543 |
| [21] |
Liu SH, Hsu KW, Lai YL, et al. Systematic identification of clinically relevant miRNAs for potential miRNA-based therapy in lung adenocarcinoma[J]. Mol Ther Nucleic Acid, 2021, 25: 1-10. DOI:10.1016/j.omtn.2021.04.020 |
| [22] |
Waniczek D, Lorenc Z, Śnietura M, et al. Tumor-Associated Macrophages and Regulatory T Cells Infiltration and the Clinical Outcome in Colorectal Cancer[J]. Arch Immunol Ther Exp(Warsz), 2017, 65(5): 445-454. DOI:10.1007/s00005-017-0463-9 |
| [23] |
Zhang H, Liu H, Shen Z, et al. Tumor-infiltrating Neutrophils is Prognostic and Predictive for Postoperative Adjuvant Chemotherapy Benefit in Patients With Gastric Cancer[J]. Ann Surgery, 2018, 267(2): 311-318. DOI:10.1097/SLA.0000000000002058 |
| [24] |
Lyu L, Yao J, Wang M, et al. Overexpressed Pseudogene HLA-DPB2 Promotes Tumor Immune Infiltrates by Regulating HLA-DPB1 and Indicates a Better Prognosis in Breast Cancer[J]. Front Oncol, 2020, 10: 1245. DOI:10.3389/fonc.2020.01245 |
| [25] |
Chae YK, Arya A, Iams W, et al. Current landscape and future of dual anti-CTLA4 and PD-1/PD-L1 blockade immunotherapy in cancer; lessons learned from clinical trials with melanoma and non-small cell lung cancer (NSCLC)[J]. J Immunother Cancer, 2018, 6(1): 39. DOI:10.1186/s40425-018-0349-3 |
 2022, Vol. 49
2022, Vol. 49


