文章信息
- PTBP1与肿瘤发展和治疗关系的研究进展
- Research Progress on Relation Between BTBP1 and Tumor Progression and Treatment
- 肿瘤防治研究, 2022, 49(7): 715-720
- Cancer Research on Prevention and Treatment, 2022, 49(7): 715-720
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1179
- 收稿日期: 2021-10-18
- 修回日期: 2022-02-14
RNA结合蛋白(polyrimidine tract binding protein 1, PTBP1),作为一种转录后基因表达调节因子,参与调节mRNA的剪接、翻译、稳定性和定位,在多个细胞周期发挥作用。PTBP1可以通过影响肿瘤组织能量代谢即Warburg效应来影响肿瘤进展,也可以通过调节肿瘤的自噬、凋亡、上皮间充质转化、肿瘤免疫来影响肿瘤进展。随着人们对肿瘤分子机制与生物学特性认识的深入,越来越多的化疗药物和肿瘤靶向药物被应用于临床,如何减少肿瘤的耐药性以及提高靶向药治疗效果便成了肿瘤治疗的关键问题。越来越多的证据证明PTBP1与肿瘤关系密切,它可能是改善肿瘤治疗效果的关键因子之一。
1 PTBP1概述RNA结合蛋白PTBP1属于不均一核糖核蛋白(heterogeneous nuclear ribonucleoproteins, hnRNPs)家族成员,其基因位于人类的19p13.3号染色体上,在除神经元和心肌细胞外的几乎所有细胞中都有表达[1]。PTBP1含有四个RRM型的RNA结合域(RBD),RBDs由90个碱基组成,拥有βαββαβ二级结构和一个α/β三级折叠,由三个连接区连接。
PTBP1是多聚嘧啶区结合蛋白(polypyrimidine tract-binding protein, PTB)的一种,此类蛋白的主要结合序列是前体mRNA上富含嘧啶的序列,故称之为多聚嘧啶区结合蛋白。该家族还包括PTBP2和PTBP3(也称为ROD1)两个成员,三者都发挥着剪接调控因子的作用,且三者之间也存在相互调节,共同参与mRNA的剪接。与广泛分布的PTBP1不同的是,PTBP2只在神经元、睾丸和某些其他细胞中表达,PTBP3主要在造血细胞中表达[2]。
PTBP1既可以作为剪接增强子,也可以作为调控外显子的抑制子。PTBP1结合在受调控的外显子的上游或内部会促进外显子的跳跃,而招募到下游元件则会促进外显子的保留。PTBP1在肿瘤细胞中除了调节某些外显子或内含子的选择性剪接来发挥生物学功能,还可以作为内部核糖体进入位点(internal ribosome entry site, IRES)反式作用因子(ITAF)促进某些mRNA IRES的活性来调控某些因子的表达[3-4]。除此之外,PTBP1可以通过与某些mRNA的3’UTR或5’UTR结合,调节mRNA的稳定性。PTBP1是一种穿梭蛋白,在其N端蛋白上包含两个独立的区域——出核信号和能被输入蛋白α识别的核定位信号,当细胞受到某些外界条件影响时,PTBP1会由细胞核向细胞质中转移[5]。
PTBP1在乳腺癌、胶质瘤、结直肠癌等癌症中都起到了促癌的作用,参与了肿瘤组织的能量代谢、自噬、凋亡、上皮间充质转化以及肿瘤免疫等过程,与肿瘤发生和进展关系密切[6-7]。作为一个在细胞周期大部分时间都发挥作用的蛋白,PTBP1也参与肿瘤治疗中相关通路活性的改变,在不同肿瘤微环境中可能发挥着不同的作用。
2 PTBP1在细胞中的作用方式 2.1 PTBP1的选择性剪切作用作为一种剪接因子,大多数情况下PTBP1都是通过调节前体mRNA的选择性剪接来发挥作用,如在肝癌细胞中,PTBP1可以影响AXL外显子10的选择性剪接而影响肝癌细胞的侵袭和转移[8]。在乳腺癌、肾细胞癌、膀胱癌等癌细胞中,PTBP1也可通过调节丙酮酸激酶M亚型(pyruvate kinase M, PKM)的选择性剪切来促进癌细胞的增殖转移[9-11]。在胰腺导管腺癌中,PTBP1导致的PKM剪接的改变是产生耐药的原因之一[12]。
2.2 PTBP1影响mRNA的稳定性在非癌组织中,PTBP1与mRNA的3’UTR结合,使mRNA稳定性增加。在胰岛素的生成过程中,葡萄糖被证实通过促使PTBP1与胰岛素mRNA的3’UTR结合,增加了胰岛素mRNA的稳定性[13]。活化的T淋巴细胞表达的CD154在细胞免疫和体液免疫中起重要作用,有实验表明PTBP1与CD154的mRNA结合促进其mRNA的稳定性[14]。而在肿瘤组织中,PTBP1与5’UTR结合使mRNA稳定性下降。在肺腺癌中,CL1细胞是从一例低分化腺癌患者的组织中分离培养的腺癌细胞,经过传代培养后,CL1细胞发生异质性改变,并产生具有更强侵袭性的亚系CL1-5,研究发现CL1-5细胞比CL1细胞表达更多的低氧诱导因子-1(hypoxia inducible factor-1, HIF-1)mRNA和蛋白,而实验证明PTBP1与HIF-1 mRNA 5’UTR的结合使其稳定性下降是两种亚系HIF-1产生区别的原因[15]。同样是在肺癌中,有实验表明PTBP1与跨膜受体酪氨酸激酶AXL的mRNA5’UTR结合使其稳定性下降,从而影响肿瘤进展[16]。以上研究结果证实PTBP1通过与mRNA的3’UTR或5’UTR结合从而影响mRNA的稳定性。
2.3 PTBP1促进mRNA的翻译PTBP1作为反式作用因子结合mRNA的5’UTR上调mRNA IRES的活性使IRES依赖的翻译水平上调。有实验表明在HeLa细胞中,敲除PTBP1降低了P27 mRNA IRES的活性,使其翻译水平下降[17]。节律调节基因PER1水平也受到PTBP1的调节,PTBP1与PER1的mRNA 5’UTR上的IRES结合正向调节IRES介导的PER1的翻译,而不影响PER 1mRNA水平[3]。
除了通过调节IRES的活性来影响蛋白的转录后水平,PTBP1还可以通过直接结合mRNA 3’UTR来影响蛋白的转录后水平。在HeLa细胞中,PTBP1结合HIF-1α mRNA的3’UTR可以促进HIF-1α的翻译[18]。
2.4 PTBP1改变mRNA的分布在肿瘤细胞中,PTBP1的敲除除了增加MCL1 mRNA水平外,还使得MCL1 mRNA在细胞质中聚集,上调了细胞质/核比值,但细胞核中mRNA数量并未减少[19]。而在CD4+的T细胞中,下调PTBP1会增加CD40L mRNA的质/核比,使细胞核中的CD40L mRNA水平减少而细胞质中水平增加[20]。
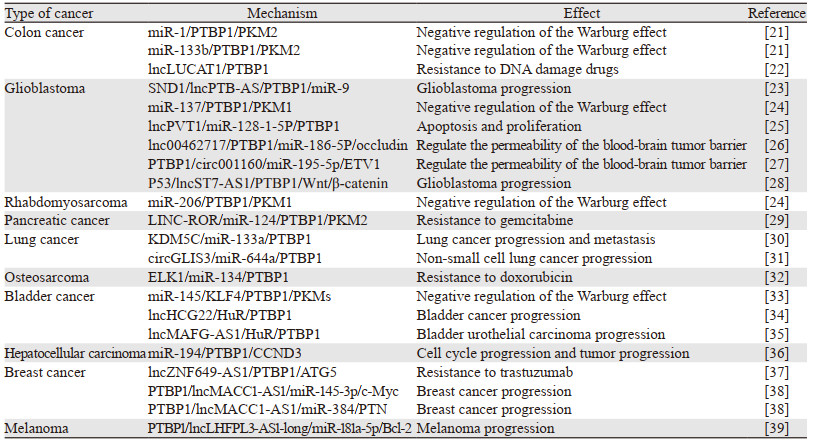
3 PTBP1及相关非编码RNA对肿瘤的调控作用非编码RNA(non-coding RNA, ncRNA)是一类不编码蛋白质的在RNA水平上发挥生物学功能的RNA,与PTBP1共同参与转录过程的调控,研究较多的ncRNA有长链RNA(lncRNA)、微小RNA(miRNA)和环状RNA(circRNA)。越来越多的研究证明非编码RNA在肿瘤中发挥作用,有研究表明PTBP1与非编码RNA结合在肿瘤中会起到调控作用。本文汇总了PTBP1与几种常见的非编码RNA相互作用在不同肿瘤中发挥的生物学功能,见表 1。
|
很多非编码RNA可以与PTBP1结合影响Warburg效应来影响肿瘤能量代谢。在结肠癌中miR-1与miR-133b表达下调,过表达的miR-1与miR-133b会结合PTBP1 mRNA减少PTBP1表达,抑制Warburg效应[21]。大脑特异的miR-137和肌肉特异的miR-206分别在胶质母细胞瘤和横纹肌肉瘤中通过直接结合PTBP1 mRNA调节PKM的表达,抑制Warburg效应[24]。在膀胱癌中,miR-145通过抑制膀胱癌细胞中的KLF4/PTBP1/PKMs通路来干扰Warburg效应,抑制肿瘤生长[33]。
3.2 影响肿瘤耐药某些非编码RNA通过直接结合PTBP1产生耐药的作用。在大肠癌细胞中,缺氧诱导的lncRNA LUCAT1与PTBP1相互作用,促进一系列DNA损伤相关基因与PTBP1的结合,导致这些基因选择性剪接的改变,造成大肠癌细胞的化疗耐药[22]。在胰腺癌细胞中,linc-ROR调节miR-124/PTBP1/PKM2作用轴使胰腺癌细胞产生了吉西他滨耐药[29]。在骨肉瘤细胞中,ELK1/miR-134/PTBP1作用轴促进了骨肉瘤细胞对阿霉素的耐药[32]。在乳腺癌中,lncRNA ZNF649-AS1通过结合PTBP1增强ATG5 mRNA的稳定性来提高ATG5的表达水平,从而诱导曲妥珠单抗耐药[37]。
3.3 调节血脑肿瘤屏障的通透性血脑肿瘤屏障(BTB)的存在限制了化疗药物向脑肿瘤组织的转运,是肿瘤治疗特别是胶质瘤治疗的重要障碍。有研究证明lnc00462717与PTBP1的相互作用抑制了miR-186-5p/occludin通路,降低了血脑肿瘤屏障的通透性[26]。PTBP1还可以通过PTBP1/circRNA_001160/miR-195-5p/ETV1作用轴来影响血脑肿瘤屏障的通透性[27]。
3.4 影响肿瘤的细胞周期和凋亡在胶质瘤中lncRNA PVT1与miR-128-1-5p特异性结合,影响miR-128-1-5p靶基因PTBP1的表达,促进胶质瘤细胞的凋亡,并抑制其增殖[25]。在肝细胞癌中,miR-194通过与PTBP1 mRNA的3’-UTR结合抑制PTBP1的表达,导致细胞周期蛋白D3(CCND3)蛋白水平下降,影响细胞周期和肿瘤进展[36]。在黑色素瘤中,PTBP1介导的lncRNA LHFPL3-AS1前体剪接产生的lncRNA LHFPL3-AS1-long通过作用于miR-181抑制其靶基因Bcl-2 mRNA的降解,上调Bcl-2表达,从而抑制黑色素瘤干细胞的凋亡,促进了黑色素瘤的发生[39]。
3.5 通过其他方式影响肿瘤进展还有一些非编码RNA与PTBP1结合通过其他方式影响肿瘤进展。在胶质瘤中,lncRNA ST7-AS1作为P53的靶基因,通过与PTBP1相互作用抑制Wnt/β-catenin信号通路发挥肿瘤抑制作用[28]。lncRNA PTB-AS与PTBP1的3’UTR结合并稳定其mRNA,增加PTBP1的表达,促进胶质瘤进展。此外PTB-AS还可以屏蔽PTBP1的3’UTR中miR-9的结合位点,减少miR-9对PTBP1的负调控[23]。在肺癌细胞中,miR-133a通过与PTBP1结合抑制肺癌的生长和转移[30]。在非小细胞肺癌中,环状RNA circGLIS3作为miR-644a的分子海绵,结合miR-644a来上调PTBP1的表达,同时PTBP1能与circGLIS3的侧翼内含子结合,促进circGLIS3的环化,形成circGLIS3/miR-644a/PTBP1正反馈环,促进非小细胞肺癌的进展[31]。在膀胱癌中,lncHCG22和lncMAFG-AS1都可以通过HuR/PTBP1轴影响肿瘤进展。HuR又称ELAVL1,是一种RNA结合蛋白,其中lncHCG22通过破坏HuR蛋白的稳定性来调控PTBP1水平,抑制膀胱癌进展。而lncMAFG-AS1则通过减少HuR的泛素化降解增加PTBP1的表达,促进膀胱尿路上皮癌的进展[34-35]。在乳腺癌细胞中,lncRNA MACC1-AS1与PTBP1的结合减少了其自身的降解,增加了它对多个抑癌miRNAs(miR-145-3p、miR-384或miR-342-5p)的海绵效应,促进细胞增殖和乳腺肿瘤的进展。此外MACC1-AS1还会与PTBP1的靶基因竞争PTBP1,减少PTBP1与下游靶基因(如MCL-1和PKM1)的结合[38]。
4 PTBP1影响靶向药物靶点靶向治疗已经成为肿瘤治疗中十分重要的治疗手段,药物特异地结合靶点从而发挥作用,研究发现PTBP1与许多流行靶向药物的靶点有关。表皮生长因子受体(EGFR)是一个明确与肿瘤增殖相关的靶点,吉非替尼、厄洛替尼等药物就作用于该靶点。研究发现在胶质母细胞瘤中,PTBP1可以通过ANXA7的剪接来增强EGFR信号通路[40]。
STAT3在许多癌症中高度活跃,是一个新兴的治疗靶点,并有许多靶向药即将进入临床,如STAT3抑制剂TTI-101、Napabucasin、DSP-0337等。有研究证明在间变性大细胞淋巴瘤(ALCL)细胞中,PTBP1与PKM2在细胞核内相互作用,调节STAT3的磷酸化和活化来促进ALCL的肿瘤发生[41]。
PTEN/PI3K/AKT信号通路是经典的生长信号通路,在多种肿瘤中被激活。它可以调节细胞周期、细胞凋亡,参与细胞增殖、迁移和侵袭。目前大量靶向于PI3K信号通路的药物正不断进入临床,如Copanlisib、Taselisib等。有研究证明在乳腺癌中,PTBP1通过激活该信号通路促进了乳腺癌的增殖,同时该研究还发现PTBP1与HER2的表达有关[42]。
血管内皮生长因子(vascular endothelial growth factor, VEGF)是一种特异性的促血管内皮细胞生长因子,具有促进血管通透性增加、细胞外基质变性、血管内皮细胞迁移、增殖和血管形成等作用,靶向药物有贝伐珠单抗等。有研究指出PTBP1与冷休克结构域(CSD)结合后会影响VEGF mRNA的稳定性[43]。综上所述PTBP1可能是影响很多靶向药物治疗效果的重要因素之一。
5 PTBP1影响肿瘤耐药性文献报道很多肿瘤耐药性的产生与PTBP1存在一定的关系。在胰腺癌临床治疗中,长期暴露于吉西他滨会导致胰腺导管腺癌(PDAC)细胞中PTBP1表达上调和产生PKM选择性剪切[12]。有研究指出linc-ROR/miR-124/PTBP1/PKM2轴参与调节胰腺癌细胞吉西他滨耐药性的产生[25]。在结直肠癌的临床治疗中,PTBP1基因敲除将PKM亚型表达从PKM2转换为PKM1,参与调节糖酵解从而逆转结肠癌细胞对长春新碱和奥沙利铂的耐药性[44]。大肠癌细胞利用缺氧诱导条件下的lncRNA-LUCAT1与PTBP1相互作用,调节DNA损伤相关基因的选择性剪接从而产生对DNA损伤药物的耐药性[22]。
还有一些影响与PTBP1调节mRNA的稳定和翻译水平有关。在乳腺癌的临床治疗中,H3K27ac修饰诱导的lncRNA ZNF649-AS1基因上调可能通过与PTBP1结合并促进ATG5转录而导致自噬和曲妥珠单抗耐药[39]。在骨肉瘤的临床治疗中,PTBP1可通过与铜转运蛋白SLC31A1的mRNA结合而影响SLC31A1的表达水平,从而影响顺铂耐药型骨肉瘤(CISR骨肉瘤细胞)对顺铂的摄取,调节CISR骨肉瘤细胞对顺铂的敏感度[45]。在肺癌的临床治疗中,PTBP1与AXL的mRNA5’UTR结合使其稳定性下降,从而影响肿瘤进展,对于因AXL表达水平改变而产生厄洛替尼或吉非替尼耐药的肺癌细胞,PTBP1的上调极有可能恢复其药物敏感度[16]。
另有文献报道肿瘤细胞耐药性产生与microRNA/PTBP1作用轴相关。转录因子ELK1通过下调miR-134和上调PTBP1促进有氧糖酵解来提高骨肉瘤细胞的存活率和增殖能力,从而促进骨肉瘤细胞对阿霉素(DXR)的化疗耐药性,提示ELK1/miR-134/PTBP1作用轴可能是骨肉瘤产生耐药的一种新的分子机制[32]。在胶质瘤的临床治疗中,PTBP1与miR155HG结合,调节与miR155HG相关的替莫唑胺耐药机制。miR155HG的敲除通过有效下调PTBP1而抑制Wnt/β-catenin通路的激活,可增加胶质瘤细胞对曲美他嗪的敏感度。此外,miR155HG通过上调PTBP1来促进Wnt/β-catenin通路激活,促进胶质瘤对替马西林耐药性的产生[46]。
另外,有证据证明,自噬活性的调节可以增强许多抗肿瘤药物的作用,包括奥沙利铂、顺铂、阿霉素和5-氟尿嘧啶(5-Fu)等。因此,自噬被认为是逆转耐药性的潜在药物靶点。作为自噬调节的影响因素之一,PTBP1在逆转耐药性方面有着很大潜力。综上所述,PTBP1与肿瘤耐药性的产生关系密切。
6 结语PTBP1作为一种RNA结合蛋白,参与调控mRNA的剪接、翻译、稳定性和定位等多种细胞内生物过程,与肿瘤关系极为密切。在肿瘤细胞中PTBP1与多种非编码RNA相互作用影响肿瘤的进展和治疗,这提示PTBP1可能是协调非编码RNA发挥作用的关键因子之一。但当前PTBP1与各类非编码RNA的作用背景还未明确,研究影响PTBP1与非编码RNA作用的生理基础,可能是破译非编码RNA在癌症中如何发挥作用的关键。PTBP1不仅与肿瘤的进展关系密切,还参与肿瘤治疗中相关通路活性的改变,这其中包括很多已经广泛应用的临床药物的靶点。但是在临床治疗中拮抗PTBP1能否提高药物治疗效果以及针对PTBP1的药物研发能否改善患者预后还未可知,若能明确PTBP1在不同肿瘤药物治疗中所带来的影响,将能大大改善肿瘤的治疗效果。综上所述,PTBP1与肿瘤进展和治疗关系密切,具有作为肿瘤诊断标志物和改善肿瘤治疗效果的潜力,并有可能为癌症治疗提供新的策略。
作者贡献:
辛彤:文献查阅、撰写论文
孙悦:论文修改
胡晶:论文选题和基金支持、论文审核
| [1] |
Ontiveros RJ, Hernandez L, Nguyen H, et al. Identification and Characterization of a Minimal Functional Splicing Regulatory Protein, PTBP1[J]. Biochemistry, 2020, 59(50): 4766-4774. DOI:10.1021/acs.biochem.0c00664 |
| [2] |
Spellman R, Llorian M, Smith CW. Crossregulation and functional redundancy between the splicing regulator PTB and its paralogs nPTB and ROD1[J]. Mol Cell, 2007, 27(3): 420-434. DOI:10.1016/j.molcel.2007.06.016 |
| [3] |
Kim W, Shin JC, Lee KH, et al. PTBP1 Positively Regulates the Translation of Circadian Clock Gene, Period1[J]. Int J Mol Sci, 2020, 21(18): 6921. DOI:10.3390/ijms21186921 |
| [4] |
Mitchell SA, Brown EC, Coldwell MJ, et al. Protein factor requirements of the Apaf-1 internal ribosome entry segment: roles of polypyrimidine tract binding protein and upstream of N-ras[J]. Mol Cell Biol, 2001, 21(10): 3364-3374. DOI:10.1128/MCB.21.10.3364-3374.2001 |
| [5] |
Li B, Yen TS. Characterization of the nuclear export signal of polypyrimidine tract-binding protein[J]. J Biol Chem, 2002, 277(12): 10306-10314. DOI:10.1074/jbc.M109686200 |
| [6] |
Zhu W, Zhou BL, Rong LJ, et al. Roles of PTBP1 in alternative splicing, glycolysis, and oncogensis[J]. J Zhejiang Univ Sci B, 2020, 21(2): 122-136. DOI:10.1631/jzus.B1900422 |
| [7] |
沈良华, 吴璐华, 张仙丽, 等. PTBP1通过EMT途径促进肝癌细胞的迁移与侵袭[J]. 中国病理生理杂志, 2019, 35(10): 1819-1825. [Shen LH, Wu LH, Zhang XL, et al. PTBP1 promotes migration and invasion of liver cancer cells through EMT pathway[J]. Zhongguo Bing Li Sheng Li Za Zhi, 2019, 35(10): 1819-1825.] |
| [8] |
Shen L, Lei S, Zhang B, et al. Skipping of exon 10 in Axl pre-mRNA regulated by PTBP1 mediates invasion and metastasis process of liver cancer cells[J]. Theranostics, 2020, 10(13): 5719-5735. DOI:10.7150/thno.42010 |
| [9] |
He X, Arslan AD, Ho TT, et al. Involvement of polypyrimidine tract-binding protein (PTBP1) in maintaining breast cancer cell growth and malignant properties[J]. Oncogenesis, 2014, 3(1): e84. DOI:10.1038/oncsis.2013.47 |
| [10] |
Jiang J, Chen X, Liu H, et al. Polypyrimidine Tract-Binding Protein 1 promotes proliferation, migration and invasion in clear-cell renal cell carcinoma by regulating alternative splicing of PKM[J]. Am J Cancer Res, 2017, 7(2): 245-259. |
| [11] |
Xie R, Chen X, Chen Z, et al. Polypyrimidine tract binding protein 1 promotes lymphatic metastasis and proliferation of bladder cancer via alternative splicing of MEIS2 and PKM[J]. Cancer Lett, 2019, 449: 31-44. DOI:10.1016/j.canlet.2019.01.041 |
| [12] |
Calabretta S, Bielli P, Passacantilli I, et al. Modulation of PKM alternative splicing by PTBP1 promotes gemcitabine resistance in pancreatic cancer cells[J]. Oncogene, 2016, 35(16): 2031-2039. DOI:10.1038/onc.2015.270 |
| [13] |
Tillmar L, Carlsson C, Welsh N. Control of insulin mRNA stability in rat pancreatic islets. Regulatory role of a 3'-untranslated region pyrimidine-rich sequence[J]. J Biol Chem, 2002, 277(2): 1099-1106. DOI:10.1074/jbc.M108340200 |
| [14] |
Hamilton BJ, Genin A, Cron RQ, et al. Delineation of a novel pathway that regulates CD154 (CD40 ligand) expression[J]. Mol Cell Biol, 2003, 23(2): 510-525. DOI:10.1128/MCB.23.2.510-525.2003 |
| [15] |
Wang MJ, Lin S. A region within the 5'-untranslated region of hypoxia-inducible factor-1alpha mRNA mediates its turnover in lung adenocarcinoma cells[J]. J Biol Chem, 2009, 284(52): 36500-36510. DOI:10.1074/jbc.M109.008904 |
| [16] |
Cho CY, Chung SY, Lin S, et al. PTBP1-mediated regulation of AXL mRNA stability plays a role in lung tumorigenesis[J]. Sci Rep, 2019, 9(1): 16922. DOI:10.1038/s41598-019-53097-2 |
| [17] |
Cho S, Kim JH, Back SH, et al. Polypyrimidine tract-binding protein enhances the internal ribosomal entry site-dependent translation of p27Kip1 mRNA and modulates transition from G1 to S phase[J]. Mol Cell Biol, 2005, 25(4): 1283-1297. DOI:10.1128/MCB.25.4.1283-1297.2005 |
| [18] |
Galbán S, Kuwano Y, Pullmann JR, et al. RNA-binding proteins HuR and PTB promote the translation of hypoxia-inducible factor 1alpha[J]. Mol Cell Biol, 2008, 28(1): 93-107. DOI:10.1128/MCB.00973-07 |
| [19] |
Cui J, Placzek WJ. PTBP1 modulation of MCL1 expression regulates cellular apoptosis induced by antitubulin chemotherapeutics[J]. Cell Death Differ, 2016, 23(10): 1681-1690. DOI:10.1038/cdd.2016.60 |
| [20] |
Matus-nicodemos R, Vavassori S, Castro-faix M, et al. Polypyrimidine tract-binding protein is critical for the turnover and subcellular distribution of CD40 ligand mRNA in CD4+ T cells[J]. J Immunol, 2011, 186(4): 2164-2171. DOI:10.4049/jimmunol.1003236 |
| [21] |
Taniguchi K, Sakai M, Sugito N, et al. PTBP1-associated microRNA-1 and -133b suppress the Warburg effect in colorectal tumors[J]. Oncotarget, 2016, 7(14): 18940-18952. DOI:10.18632/oncotarget.8005 |
| [22] |
Huan L, Guo T, Wu Y, et al. Hypoxia induced LUCAT1/PTBP1 axis modulates cancer cell viability and chemotherapy response[J]. Mol Cancer, 2020, 19(1): 11. DOI:10.1186/s12943-019-1122-z |
| [23] |
Zhu L, Wei Q, Qi Y, et al. PTB-AS, a Novel Natural Antisense Transcript, Promotes Glioma Progression by Improving PTBP1 mRNA Stability with SND1[J]. Mol Ther, 2019, 27(9): 1621-1637. DOI:10.1016/j.ymthe.2019.05.023 |
| [24] |
Taniguchi K, Sugito N, Shinohara H, et al. Organ-Specific MicroRNAs (MIR122, 137, and 206) Contribute to Tissue Characteristics and Carcinogenesis by Regulating Pyruvate Kinase M1/2 (PKM) Expression[J]. Int J Mol Sci, 2018, 19(5): 1276. DOI:10.3390/ijms19051276 |
| [25] |
Dahai Z, Daliang C, Famu L, et al. Lowly expressed lncRNA PVT1 suppresses proliferation and advances apoptosis of glioma cells through up-regulating microRNA-128-1-5p and inhibiting PTBP1[J]. Brain Res Bull, 2020, 163: 1-13. DOI:10.1016/j.brainresbull.2020.06.006 |
| [26] |
Zhang C, Zhang X, Wang J, et al. Lnc00462717 regulates the permeability of the blood-brain tumor barrier through interaction with PTBP1 to inhibit the miR-186-5p/Occludin signaling pathway[J]. FASEB J, 2020, 34(8): 9941-9958. DOI:10.1096/fj.202000045R |
| [27] |
Li H, Shen S, Ruan X, et al. Biosynthetic CircRNA_001160 induced by PTBP1 regulates the permeability of BTB via the CircRNA_001160/miR-195-5p/ETV1 axis[J]. Cell Death Dis, 2019, 10(12): 960. DOI:10.1038/s41419-019-2191-z |
| [28] |
Sheng J, He X, Yu W, et al. p53-targeted lncRNA ST7-AS1 acts as a tumour suppressor by interacting with PTBP1 to suppress the Wnt/β-catenin signalling pathway in glioma[J]. Cancer Lett, 2021, 503: 54-68. DOI:10.1016/j.canlet.2020.12.039 |
| [29] |
Li C, Zhao Z, Zhou Z, et al. Linc-ROR confers gemcitabine resistance to pancreatic cancer cells via inducing autophagy and modulating the miR-124/PTBP1/PKM2 axis[J]. Cancer Chemother Pharmacol, 2016, 78(6): 1199-1207. DOI:10.1007/s00280-016-3178-4 |
| [30] |
Zhang Q, Xu L, Wang J, et al. KDM5C Expedites Lung Cancer Growth and Metastasis Through Epigenetic Regulation of MicroRNA-133a[J]. Onco Targets Ther, 2021, 14: 1187-1204. DOI:10.2147/OTT.S288799 |
| [31] |
Wu Z, Jiang H, Fu H, et al. A circGLIS3/miR-644a/PTBP1 positive feedback loop promotes the malignant biological progressions of non-small cell lung cancer[J]. Am J Cancer Res, 2021, 11(1): 108-122. |
| [32] |
Zhang Q, Wu J, Zhang X, et al. Transcription factor ELK1 accelerates aerobic glycolysis to enhance osteosarcoma chemoresistance through miR-134/PTBP1 signaling cascade[J]. Aging (Albany NY), 2021, 13(5): 6804-6819. |
| [33] |
Minami K, Taniguchi K, Sugito N, et al. MiR-145 negatively regulates Warburg effect by silencing KLF4 and PTBP1 in bladder cancer cells[J]. Oncotarget, 2017, 8(20): 33064-33077. DOI:10.18632/oncotarget.16524 |
| [34] |
Jiang D, Zhang Y, Yang L, et al. Long noncoding RNA HCG22 suppresses proliferation and metastasis of bladder cancer cells by regulation of PTBP1[J]. J Cell Physiol, 2020, 235(2): 1711-1722. DOI:10.1002/jcp.29090 |
| [35] |
Xiao M, Liu J, Xiang L, et al. MAFG-AS1 promotes tumor progression via regulation of the HuR/PTBP1 axis in bladder urothelial carcinoma[J]. Clin Transl Med, 2020, 10(8): e241. |
| [36] |
Kang H, Heo S, Shin JJ, et al. A miR-194/PTBP1/CCND3 axis regulates tumor growth in human hepatocellular carcinoma[J]. J Pathol, 2019, 249(3): 395-408. DOI:10.1002/path.5325 |
| [37] |
Han M, Qian X, Cao H, et al. lncRNA ZNF649-AS1 Induces Trastuzumab Resistance by Promoting ATG5 Expression and Autophagy[J]. Mol Ther, 2020, 28(11): 2488-2502. DOI:10.1016/j.ymthe.2020.07.019 |
| [38] |
Zhang X, Zhou Y, Chen S, et al. LncRNA MACC1-AS1 sponges multiple miRNAs and RNA-binding protein PTBP1[J]. Oncogenesis, 2019, 8(12): 73. |
| [39] |
Zhang S, Wan H, Zhang X. LncRNA LHFPL3-AS1 contributes to tumorigenesis of melanoma stem cells via the miR-181a-5p/BCL2 pathway[J]. Cell Death Dis, 2020, 11(11): 950. |
| [40] |
Ferraese R, Harshg RT, Yadva AK, et al. Lineage-specific splicing of a brain-enriched alternative exon promotes glioblastoma progression[J]. J Clin Invest, 2014, 124(7): 2861-2876. |
| [41] |
Hwang SR, Murga-zamalloa C, Brown N, et al. Pyrimidine tract-binding protein 1 mediates pyruvate kinase M2-dependent phosphorylation of signal transducer and activator of transcription 3 and oncogenesis in anaplastic large cell lymphoma[J]. Lab Invest, 2017, 97(8): 962-970. |
| [42] |
Wang X, Li Y, Fan Y, et al. PTBP1 promotes the growth of breast cancer cells through the PTEN/Akt pathway and autophagy[J]. J Cell Physiol, 2018, 233(11): 8930-8939. |
| [43] |
Coles LS, Bartley MA, Bert A, et al. A multi-protein complex containing cold shock domain (Y-box) and polypyrimidine tract binding proteins forms on the vascular endothelial growth factor mRNA. Potential role in mRNA stabilization[J]. Eur J Biochem, 2004, 271(3): 648-660. |
| [44] |
Cheng C, Xie Z, Li Y, et al. PTBP1 knockdown overcomes the resistance to vincristine and oxaliplatin in drug-resistant colon cancer cells through regulation of glycolysis[J]. Biomed Pharmacother, 2018, 108: 194-200. |
| [45] |
Cheng C, Ding Q, Zhang Z, et al. PTBP1 modulates osteosarcoma chemoresistance to cisplatin by regulating the expression of the copper transporter SLC31A1[J]. J Cell Mol Med, 2020, 24(9): 5274-5289. |
| [46] |
He X, Sheng J, Yu W, et al. LncRNA MIR155HG Promotes Temozolomide Resistance by Activating the Wnt/β-Catenin Pathway Via Binding to PTBP1 in Glioma[J]. Cell Mol Neurobiol, 2021, 41(6): 1271-1284. |
 2022, Vol. 49
2022, Vol. 49


