文章信息
- STK11基因突变与非小细胞肺癌免疫治疗相关性研究进展
- Correlation Between STK11 Gene Mutation and Immunotherapy of Non-small Cell Lung Cancer
- 肿瘤防治研究, 2022, 49(8): 850-854
- Cancer Research on Prevention and Treatment, 2022, 49(8): 850-854
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1133
- 收稿日期: 2021-10-09
- 修回日期: 2021-12-05
肺癌是对人群健康和生命威胁最大的恶性肿瘤之一,全球范围内肺癌致死率极高。男女性的肺癌发病率占比分别是12%和13%。死亡率占比均为22%[1],远超其他癌症类型,位居癌症死亡人数第一位。其中非小细胞肺癌(non-small cell lung cancer, NSCLC)占所有肺癌类型的85%[2],大多数患者在晚期确诊,预后仍待改善。近年来,非小细胞肺癌的治疗取得了很大的进展,患者死亡率大幅降低,除了对致癌驱动基因阳性的患者进行靶向治疗,免疫检查点抑制剂在非小细胞肺癌中的使用极大的改善了患者的预后。丝氨酸-苏氨酸11(STK11)的体细胞突变,经常发生在非小细胞肺癌中。STK11突变为肺腺癌患者定义了一个特殊的亚型[3]。研究发现肺癌基因突变与PD-1/PD-L1信号异常激活之间有相互作用[4]。对于驱动基因阳性(EGFR突变、ALK融合和ROS1融合等)的肺癌患者,免疫检查点抑制剂疗效不佳。越来越多的证据表明,非小细胞肺癌存在显著的临床异质性,目前单一致癌驱动因素对此解释不完全。因此本文综述了STK11单基因突变和共突变对NSCLC患者免疫治疗疗效及其预后的影响。
1 STK11概述STK11编码丝氨酸/苏氨酸蛋白激酶是一种位于人类染色体19p13.3上的抑癌基因,其可通过激活腺苷一磷酸(adenosine monophosphate, AMP)激活的蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)来调节细胞代谢、增殖和极性,该蛋白激酶能够抑制哺乳动物雷帕霉素(mammalian target of rapamycin, mTOR)信号的靶点,通过此途径控制所有真核生物的细胞生长[5]。mTOR是细胞存活、蛋白合成和转录的中心调控因子[6],mTOR通过控制mRNA的翻译、核糖体的生成和代谢,在调控细胞生长中发挥核心作用,因此抑制mTOR可以抑制肿瘤生长,导致耐药肿瘤细胞死亡。STK11做为AMPK的主要上游激酶[7],在细胞ATP水平下降和ADP/AMP相对水平升高的情况下激活AMPK(如葡萄糖缺乏、缺氧、组织缺血或肌肉切除引起的应激状态)[8],进而促进上游激酶磷酸化AMPK激活环中的Thr172[9]。除了调节AMPK磷酸化,STK11也被证明可以有效磷酸化其他12种与AMPK相关的激酶[10-11]。结节性硬化症蛋白1(TSC1)和结节性硬化症蛋白2(TSC2)基因产物hamartin和tuberin分别是负调控mTOR信号复合体的组成部分,相应地,结节TSC1或TSC2的失活与mTOR活性升高有关[12],最近的研究表明,TSC2肿瘤抑制蛋白tuberin是AMPK的直接靶点,也是AMPK依赖的抑制mTOR信号转导的关键介质[13]。S6K1是哺乳动物细胞生长的重要调节因子,mTOR介导的信号增强了S6K1的表达,进而促进其下游靶点rpS6表达增加,从而促进细胞的生长和增殖,见图 1。此外,PI3K/AKT/mTOR信号通路是人类恶性肿瘤中最常见的解除控制的信号通路之一,Akt蛋白激酶在许多肿瘤中由于PI3K的功能获得突变或PTEN的功能缺失突变而过度激活,Akt是AMPK的负调控因子和mTOR的正调控因子。这两种途径都涉及TSC2在不同位点的直接磷酸化,AMPK激活TSC2, Akt抑制TSC2[14]。因此,STK11对细胞的损伤修复、能量代谢、肿瘤的免疫应答等具有重要调控作用。
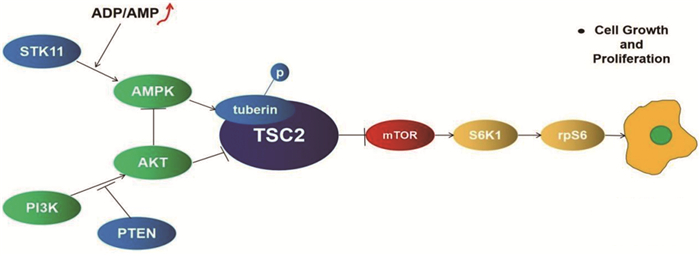
|
| AMPK: adenosine monophosphate-activated protein kinase; AMP: adenosine monophosphate; ADP: adenosine diphosphate; mTOR: mammalian target of rapamycin; PI3K: phosphatidylinositol 3-kinase; AKT(PKB): protein kinase B; PTEN: phosphatase and tensin homolog deleted on chromosome ten; TSC2: tuberous sclerosis 2; rpS6: ribosomal protein S6. 图 1 mTOR信号通路中各蛋白之间的关系 Figure 1 Relation between proteins in mTOR signaling pathway |
肿瘤细胞PD-L1目前是抗PD-1/PD-L1治疗的优势人群选择的最常用标志物,肿瘤细胞PD-L1表达水平与其疗效及预后相关,部分PD-L1阳性表达的NSCLC患者,免疫治疗显著改善患者的OS[15],但仍有很多NSCLC患者不能从免疫治疗中获益。此前通过对非小细胞肺癌中高突变率基因对免疫检查点抑制剂(ICB)耐药因素的评估,发现丝氨酸/苏氨酸激酶11(STK11)的体细胞突变被认为是非鳞状细胞(NSQ)非小细胞肺癌对ICB耐药的潜在机制[16-18]。鉴于STK11基因组改变与肿瘤细胞PD-L1表达缺失之间的密切联系,Skoulidis等将66例接受PD-1/PD-L1抑制剂治疗的非小细胞肺癌患者组成独特队列研究,在一组PD-L1阳性的NSCLC中,用PD-1/PD-L1抑制剂治疗STK11突变型肿瘤时,会出现较差的客观缓解率(ORR)、较短的无进展生存期(PFS)和总生存时间(OS)[18]。Rizvi等报告称,在接受PD-1/PD-L1单药治疗的晚期非小细胞肺癌患者中,STK11突变在非持久获益组中显著高于持久临床获益组(19% vs. 27%)[19],这可能是由于STK11通过突变或非突变机制失活导致了惰性肿瘤免疫微环境的产生和较低的PD-L1表达[20-21],在用ICIs治疗的KRAS/STK11突变型非小细胞肺癌患者的PD-L1阳性亚组中,证实STK11突变患者具有更差的临床疗效[16],这些数据说明STK11突变是免疫逃逸的主要驱动因素,STK11突变与抗PD-1/PD- L1治疗的非小细胞肺癌患者的不良预后相关。
2.2 STK11突变与肿瘤突变负荷肿瘤突变负荷(tumor mutation burden, TMB)定义为每百万碱基中被检测出的体细胞基因编码错误、碱基替换、基因插入或缺失错误的总数[22]。TMB是肿瘤基因组中去除胚系突变后的体细胞突变的数目,基因水平变异可能导致蛋白表达发生变化,产生新抗原从而激发机体的免疫系统,并且TMB一直是预测免疫治疗疗效的研究热点[17]。免疫检查点抑制剂已在多种肿瘤治疗中获得显著的临床效果。肿瘤突变负荷(TMB)作为抗PD-1治疗效果评估的最新标志物,其效果在用PD-1抗体治疗有错配修复缺陷的肿瘤中得到证实[23],在抗PD-1/PD-L1药物治疗肺癌的部分研究表明突变负荷高低与免疫治疗疗效密切相关,因为在回顾性研究中,低TMB与PD-1轴抑制剂的反应受损相关,可能是由于肿瘤免疫原性差[24],在Skoulidis等的一项研究中,通过排除低TMB(TMBL) 肿瘤,只关注中度和高度TMB(TMBI/H)肿瘤,发现STK11/LKB1突变在TMBI最为显著,STK11/LKB1在TMBI/H肿瘤中与PD-L1低表达相关,并且通过对肺腺癌患者手术切除标本中的肿瘤免疫微环境的组成进行分析,发现STK11/ LKB1突变的肿瘤表现出较低密度CD3(+)T淋巴细胞(P=0.0019)和CD8(+)T淋巴细胞(P=0.0072)浸润以及较低的PD-L1表达[18]。因此STK11突变患者的TMB水平更高,可能是由于在TME中肿瘤细胞或免疫细胞上的PD-L1与肿瘤浸润淋巴细胞上的PD-1相互作用,从而减弱效应性T淋巴细胞反应,使肿瘤产生免疫逃逸。
2.3 STK11突变和免疫细胞浸润肿瘤免疫微环境(tumor immune microenvironment, TIME)评估已成为肿瘤防治的重要靶标,因为已有大量数据支持肿瘤浸润淋巴细胞在多种不同类型肿瘤中的预后和潜在的预测意义[25]。迄今为止,在PD-L1阳性患者中,肿瘤浸润淋巴细胞已被证明是ICI治疗的指标[26]。在非小细胞肺癌中最强有力的肿瘤浸润淋巴细胞预后标志物是CD8(+)T淋巴细胞[27],细胞毒性CD8(+)T淋巴细胞能够直接杀死癌细胞,而CD4(+)T淋巴细胞参与CD8(+)T淋巴细胞的激活和抑制[28]。STK11突变肿瘤的免疫微环境主要表现为中性粒细胞密度较高,而间质中CD8(+)T淋巴细胞密度较低,Hiraoka等证明CD8(+)T淋巴细胞和CD4(+)T淋巴细胞的高水平是评估非小细胞肺癌患者预后的重要指标,这些细胞群体之间的合作可能比任何一个单独群体产生更有效的抗肿瘤反应[29]。Wang等通过TIMER和TISIDB数据库发现在STK11突变患者中,包括B细胞、CD8(+)T淋巴细胞、CD4(+)T淋巴细胞、巨噬细胞、树突状细胞在内的浸润性免疫细胞均显著减少。结果表明,携带STK11突变的患者可能具有冷肿瘤免疫微环境或免疫沙漠型,从而不能从免疫治疗中获益[30]。
3 STK11突变和肺癌相关突变与ICIs关系 3.1 STK11突变与KRAS突变在肺癌患者中,KRAS突变是最常见的突变,27%的肺腺癌患者存在这种突变[31],在肺腺癌KRAS突变组中,患者存活率低似乎与伴随的TP53或STK11突变有关,而与KRAS突变状态无关。一项研究确定STK11的突变是KRAS突变肺腺癌对PD-1阻断产生耐药性的主要驱动因素[18]。这些KRAS突变经常伴随着抑癌基因TP53和STK11的突变,具有KRAS单突变的患者总体存活率与野生型组相似,而同时存在TP53或STK11突变的患者总体存活率比野生型组更差[32]。肺腺癌中的基因表达分析表明,STK11突变增强了由KRAS突变诱导的基因表达并抑制了免疫相关信号[33],最近的另一项研究表明,与STK11单突变的患者相比,KRAS/STK11共突变的非小细胞肺癌患者用ICIs作为二线或三线治疗,经历了更差的PFS和OS[34],此外,一项关于纳入具有KRAS p.G12C突变的局部或转移性NSCLC的CodeBreak100实验研究,发现靶向KRAS p.G12C的索托拉西布(Sotorasib)在临床Ⅱ期研究中显著延长了患者的生存期,但在STK11共突变的亚组分析中发现索托拉西布对患者缓解率并无明显影响[35]。因此KRAS/STK11共突变可能是ICIs及靶向治疗在晚期非小细胞肺癌中临床获益减少的重要原因。
3.2 STK11突变与KEAP1突变STK11突变与KELCH样ECH相关蛋白1(KEAP1)的突变往往同时发生,这与治疗的耐药性有关[34]。KEAP1的缺失增加了肿瘤负荷和高级别病变的百分比,表明其在肿瘤发生和发展中的重要作用[36]。Papillon-Cavanagh等通过研究发现30%的肿瘤患者携带STK11和(或)KEAP1突变(STK11-KEAP1),且为男性患者、诊断晚期的年轻患者、有吸烟史的患者居多,研究者通过在多变量模型中测试STK11和KEAP1突变对肺癌患者预后的不良结果,包括两个基因突变之间的相互作用,结果显示两个基因都与较低的rwPFS相关,仅KEAP1突变的患者比仅STK11突变的患者表现更差,而双突变状态的患者预后最差,表明STK11和KEAP1突变具有累加效应[37]。通过对非小细胞肺癌中STK11和KEAP1突变的综合分析表明,无论治疗类别如何,这些突变往往会导致不良预后。Gadgeel等对STK11和KEAP1突变与KEYNOTE-189疗效结局相关性的探索性分析结果表明在突变可评估人群(n=289)中STK11和KEAP1突变的发生率分别为18.7%和23.5%,受试者同时具有两种突变的发生率为10%。具有STK11或KEAP1突变的受试者的中位PD-L1肿瘤比例评分(TPS)往往低于没有这些突变的受试者。与没有STK11和KEAP1突变的受试者相比,具有这些突变的受试者TMB评分有升高的趋势,不论STK11/KEAP1突变状态如何,与安慰剂加化疗组相比,帕博利珠单抗加化疗组的OS得到改善[38]。在KEYNOTE-042研究中MOT等也得到了相似的结果,在突变可评估人群(n=429)中,STK11和KEAP1突变的发生率分别为7.7%和14.9%,STK11-KEAP1共突变率为2.8%。具有STK11突变的受试者PD-L1表达降低,STK11/KEAP1突变的受试者具有更高的TMB,且不论有无STK11/KEAP1突变,帕博利珠单抗单药治疗PD-L1阳性(TPS≥1%)局部晚期/转移性NSCLC患者相比铂类为基础的化疗改善了OS[39]。表明STK11基因突变不能作为预测免疫疗效的指标。
回顾性的研究表明,对比STK11突变型和野生型的差异,STK11突变共存于更多突变的KRAS和KEAP1和更少突变的TP53中。STK11突变的患者PD-L1的表达较低、免疫细胞浸润较少,但是携带STK11突变的患者具有更高的TMB评分。对于接受免疫检查点抑制剂治疗的患者,STK11突变组的预后更差,接受免疫检查点抑制剂治疗的STK11突变患者中位生存期较短,阐明了STK11突变患者不能受益于免疫检查点抑制剂[30]。
4 总结与展望STK11基因突变的患者在接受免疫检查点抑制剂治疗后往往效果不佳,研究表明,在局部晚期/转移性NSCLC中STK11突变与免疫细胞浸润减少、PD-L1低表达有关。同时STK11突变是免疫检查点抑制剂治疗耐药性的主要预测因素,部分独立于PD-L1表达和TMB,KRAS和STK11的共突变导致肺腺癌患者存活率低,而当STK11、TP53及KRAS基因一同突变时,患者又有着很显著的疗效及预后优势。对于其他少见共突变,STK11与SMARCA4共突变缩短了患者的总生存期疾病的无进展生存期[40]。KEAP1和STK11具有相似的突变频率,与单突变和野生型患者相比,共突变肿瘤的存活率较低。因此,多基因组合检测在临床工作中有重要意义,有必要探索更多基因突变/共突变对患者疗效和预后的影响,以更好的指导临床实践。
随着对非小细胞肺癌基因组的理解加深,致癌驱动基因状态改变已经成为治疗非小细胞肺癌的重要标志。基于目前研究结果,驱动基因阳性的非小细胞肺癌患者较阴性患者从免疫治疗中获益小,基因突变状态在免疫治疗中的疗效以及预测价值有着无限的可能性,未来的挑战应是对非小细胞肺癌中所有基因并存突变的治疗效用进行分类、功能化和系统化评估,对于基因突变的NSCLC患者,未来以免疫治疗为基础的联合治疗应该得到更广泛的研究,从而为非小细胞肺癌患者带来更好的临床疗效。
作者贡献:
夏思雨:文章设计与撰写
赵梓彤:数据收集归纳
李里:提供文章思路、文章审核
| [1] |
Siegel RL, Miller KD, Fuchs HE, et al. Cancer Statistics, 2021[J]. CA Cancer J Cin, 2021, 71(1): 7-33. DOI:10.3322/caac.21654 |
| [2] |
王莉新, 吴文斌, 朱诗国. 非小细胞肺癌免疫治疗的策略与展望[J]. 现代免疫学, 2018, 38(3): 247-251. [Wang LX, Wu WB, Zhu SG. Strategies and prospects of immunotherapy for non-small cell lung cancer[J]. Xian Dai Mian Yi Xue, 2018, 38(3): 247-251.] |
| [3] |
Gibert J, Clavé S, Hardy-Werbin M, et al. Concomitant genomic alterations in KRAS mutant advanced lung adenocarcinoma[J]. Lung Cancer, 2020, 140: 42-45. DOI:10.1016/j.lungcan.2019.12.003 |
| [4] |
陈捷, 姜达, 黄芳. 非小细胞肺癌中驱动基因状态与免疫治疗相关性的研究进展[J]. 中国肺癌杂志, 2019, 22(4): 233-238. [Chen J, Jiang D, Huang F. Advances of the Correlation between Driver Gene Status and Immunotherapy in Non-small Cell Lung Cancer[J]. Zhongguo Fei Ai Za Zhi, 2019, 22(4): 233-238.] |
| [5] |
Zhao N, Wilkerson MD, Shah U, et al. Alterations of LKB1 and KRAS and risk of brain metastasis: comprehensive characterization by mutation analysis, copy number, and gene expression in non-small-cell lung carcinoma[J]. Lung Cancer, 2014, 86(2): 255-261. DOI:10.1016/j.lungcan.2014.08.013 |
| [6] |
Guertin DA, Sabatini DM. Defining the role of mTOR in cancer[J]. Cancer Cell, 2007, 12(1): 9-22. DOI:10.1016/j.ccr.2007.05.008 |
| [7] |
Hawley SA, Boudeau J, Reid JL, et al. Complexes between the LKB1 tumor suppressor, STRAD alpha/beta and MO25 alpha/beta are upstream kinases in the AMP-activated protein kinase cascade[J]. J Biol, 2003, 2(4): 28. DOI:10.1186/1475-4924-2-28 |
| [8] |
Shirwany NA, Zou MH. AMPK: a cellular metabolic and redox sensor. A minireview[J]. Front Biosci (Landmark Ed), 2014, 19(3): 447-474. DOI:10.2741/4218 |
| [9] |
Stein SC, Woods A, Jones NA, et al. The regulation of AMP-activated protein kinase by phosphorylation[J]. Biochem J, 2000, 345 Pt 3(Pt 3): 437-443. |
| [10] |
Hardie DG. AMPK: a target for drugs and natural products with effects on both diabetes and cancer[J]. Diabetes, 2013, 62(7): 2164-2172. DOI:10.2337/db13-0368 |
| [11] |
Lizcano JM, Göransson O, Toth R, et al. LKB1 is a master kinase that activates 13 kinases of the AMPK subfamily, including MARK/PAR-1[J]. EMBO J, 2004, 23(4): 833-843. DOI:10.1038/sj.emboj.7600110 |
| [12] |
Manning BD, Cantley LC. United at last: the tuberous sclerosis complex gene products connect the phosphoinositide 3-kinase/Akt pathway to mammalian target of rapamycin (mTOR) signalling[J]. Biochem Soc Trans, 2003, 31((Pt 3): 573-578. |
| [13] |
Inoki K, Zhu T, Guan KL. TSC2 mediates cellular energy response to control cell growth and survival[J]. Cell, 2003, 115(5): 577-590. DOI:10.1016/S0092-8674(03)00929-2 |
| [14] |
Wang Z, Wang N, Liu P, et al. AMPK and Cancer[J]. Exp Suppl, 2016, 107: 203-226. |
| [15] |
江美林, 彭文颖, 李佳, 等. 非小细胞肺癌免疫治疗生物标志物研究进展[J]. 肿瘤防治研究, 2018, 45(10): 805-810. [Jiang ML, Peng WY, Li J, et al. Research progress in non-small cell lung cancer immunotherapy biomarkers[J]. Zhong Liu Fang Zhi Yan Jiu, 2018, 45(10): 805-810. DOI:10.3971/j.issn.1000-8578.2018.17.1514] |
| [16] |
Aggarwal C, Thompson JC, Chien AL, et al. Baseline Plasma Tumor Mutation Burden Predicts Response to Pembrolizumab-based Therapy in Patients with Metastatic Non-Small Cell Lung Cancer[J]. Clin Cancer Res, 2020, 26(10): 2354-2361. DOI:10.1158/1078-0432.CCR-19-3663 |
| [17] |
Biton J, Mansuet-Lupo A, Pécuchet N, et al. TP53, STK11, and EGFR Mutations Predict Tumor Immune Profile and the Response to Anti-PD-1 in Lung Adenocarcinoma[J]. Clin Cancer Res, 2018, 24(22): 5710-5723. DOI:10.1158/1078-0432.CCR-18-0163 |
| [18] |
Skoulidis F, Goldberg ME, Greenawalt DM, et al. STK11/LKB1 Mutations and PD-1 Inhibitor Resistance in KRAS-Mutant Lung Adenocarcinoma[J]. Cancer Discov, 2018, 8(7): 822-835. DOI:10.1158/2159-8290.CD-18-0099 |
| [19] |
Rizvi H, Sanchez-Vega F, La K, et al. Molecular Determinants of Response to Anti-Programmed Cell Death (PD)-1 and Anti-Programmed Death-Ligand 1 (PD-L1) Blockade in Patients With Non-Small-Cell Lung Cancer Profiled With Targeted Next-Generation Sequencing[J]. J Clin Oncol, 2018, 36(7): 633-641. DOI:10.1200/JCO.2017.75.3384 |
| [20] |
Skoulidis F, Byers LA, Diao L, et al. Co-occurring genomic alterations define major subsets of KRAS-mutant lung adenocarcinoma with distinct biology, immune profiles, and therapeutic vulnerabilities[J]. Cancer Discov, 2015, 5(8): 860-877. DOI:10.1158/2159-8290.CD-14-1236 |
| [21] |
Skoulidis F, Heymach JV. Co-occurring genomic alterations in non-small-cell lung cancer biology and therapy[J]. Nat Rev Cancer, 2019, 19(9): 495-509. DOI:10.1038/s41568-019-0179-8 |
| [22] |
Yarchoan M, Hopkins A, Jaffee EM. Tumor Mutational Burden and Response Rate to PD-1 Inhibition[J]. N Engl J Med, 2017, 377(25): 2500-2501. DOI:10.1056/NEJMc1713444 |
| [23] |
Le DT, Durham JN, Smith KN, et al. Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade[J]. Science, 2017, 357(6349): 409-413. DOI:10.1126/science.aan6733 |
| [24] |
Carbone DP, Reck M, Paz-Ares L, et al. First-Line Nivolumab in Stage Ⅳ or Recurrent Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2017, 376(25): 2415-2426. DOI:10.1056/NEJMoa1613493 |
| [25] |
Binnewies M, Roberts EW, Kersten K, et al. Understanding the tumor immune microenvironment (TIME) for effective therapy[J]. Nat Med, 2018, 24(5): 541-550. DOI:10.1038/s41591-018-0014-x |
| [26] |
Topalian SL, Taube JM, Anders RA, et al. Mechanism-driven biomarkers to guide immune checkpoint blockade in cancer therapy[J]. Nat Rev Cancer, 2016, 16(5): 275-287. DOI:10.1038/nrc.2016.36 |
| [27] |
Donnem T, Kilvaer TK, Andersen S, et al. Strategies for clinical implementation of TNM-Immunoscore in resected nonsmall-cell lung cancer[J]. Ann Oncol, 2016, 27(2): 225-232. DOI:10.1093/annonc/mdv560 |
| [28] |
Kim HJ, Cantor H. CD4 T-cell subsets and tumor immunity: the helpful and the not-so-helpful[J]. Cancer Immunol Res, 2014, 2(2): 91-98. DOI:10.1158/2326-6066.CIR-13-0216 |
| [29] |
Hiraoka K, Miyamoto M, Cho Y, et al. Concurrent infiltration by CD8+ T cells and CD4+ T cells is a favourable prognostic factor in non-small-cell lung carcinoma[J]. Br J Cancer, 2006, 94(2): 275-280. DOI:10.1038/sj.bjc.6602934 |
| [30] |
Wang H, Guo J, Shang X, et al. Less immune cell infiltration and worse prognosis after immunotherapy for patients with lung adenocarcinoma who harbored STK11 mutation[J]. Int Immunopharmacol, 2020, 84: 106574. DOI:10.1016/j.intimp.2020.106574 |
| [31] |
El Osta B, Behera M, Kim S, et al. Characteristics and Outcomes of Patients With Metastatic KRAS-Mutant Lung Adenocarcinomas: The Lung Cancer Mutation Consortium Experience[J]. J Thorac Oncol, 2019, 14(5): 876-889. DOI:10.1016/j.jtho.2019.01.020 |
| [32] |
La Fleur L, Falk-Sörqvist E, Smeds P, et al. Mutation patterns in a population-based non-small cell lung cancer cohort and prognostic impact of concomitant mutations in KRAS and TP53 or STK11[J]. Lung Cancer, 2019, 130: 50-58. DOI:10.1016/j.lungcan.2019.01.003 |
| [33] |
Schabath MB, Welsh EA, Fulp WJ, et al. Differential association of STK11 and TP53 with KRAS mutation-associated gene expression, proliferation and immune surveillance in lung adenocarcinoma[J]. Oncogene, 2016, 35(24): 3209-3216. DOI:10.1038/onc.2015.375 |
| [34] |
Bange E, Marmarelis ME, Hwang WT, et al. Impact of KRAS and TP53 Co-Mutations on Outcomes After First-Line Systemic Therapy Among Patients With STK11-Mutated Advanced Non-Small-Cell Lung Cancer[J]. JCO Precis Oncol, 2019, 3: PO.18.00326. |
| [35] |
Skoulidis F, Li BT, Dy GK, et al. Sotorasib for Lung Cancers with KRAS p.G12C Mutation[J]. N Engl J Med, 2021, 384(25): 2371-2381. DOI:10.1056/NEJMoa2103695 |
| [36] |
Romero R, Sayin VI, Davidson SM, et al. Keap1 loss promotes Kras-driven lung cancer and results in dependence on glutaminolysis[J]. Nat Med, 2017, 23(11): 1362-1368. DOI:10.1038/nm.4407 |
| [37] |
Papillon-Cavanagh S, Doshi P, Dobrin R, et al. STK11 and KEAP1 mutations as prognostic biomarkers in an observational real-world lung adenocarcinoma cohort[J]. ESMO Open, 2020, 5(2): e000706. DOI:10.1136/esmoopen-2020-000706 |
| [38] |
Gadgeel S, Rodríguez-Abreu D, Speranza G, et al. Updated Analysis From KEYNOTE-189: Pembrolizumab or Placebo Plus Pemetrexed and Platinum for Previously Untreated Metastatic Nonsquamous Non-Small-Cell Lung Cancer[J]. J Clin Oncol, 2020, 38(14): 1505-1517. DOI:10.1200/JCO.19.03136 |
| [39] |
Mok TSK, Wu YL, Kudaba I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial[J]. Lancet,, 2019, 393(10183): 1819-1830. DOI:10.1016/S0140-6736(18)32409-7 |
| [40] |
Armon S, Hofman P, Ilié M. Perspectives and Issues in the Assessment of SMARCA4 Deficiency in the Management of Lung Cancer Patients[J]. Cells, 2021, 10(8): 1920. DOI:10.3390/cells10081920 |
 2022, Vol. 49
2022, Vol. 49


